El carcinoma adenoide quístico (CAQ) primario de piel es un tumor extremadamente raro y hay publicados pocos casos. Aparece frecuentemente en las glándulas salivares, pero también puede presentarse en la glándula lagrimal, donde constituye el tercer tumor más frecuente (20-30%), tracto respiratorio (35% en glándulas mucosas de los senos paranasales, 25%-30% en laringe y tráquea y 25% en las glándulas submucosas de los bronquios), glándula de Bartholino (15%), cuello uterino y vagina (<1%) y mama (0,1%).
El CAQ de piel previo al diagnóstico se presenta como un tumor de varios años de evolución, con un promedio de 6 meses a 14 años. Desde el punto de vista macroscópico se puede observar como nódulos en dermis o en forma difusa engrosando la dermis con o sin infiltración del tejido celular subcutáneo. La localización más frecuente es en cuero cabelludo (50%), miembros superiores (20%), región axilar (10%), tórax y abdomen (10%)1,2. Las metástasis son raras, pero un 50% de los casos recidivan, no obstante cuando lo hacen las localizaciones más frecuentes son los ganglios regionales y el pulmón3.
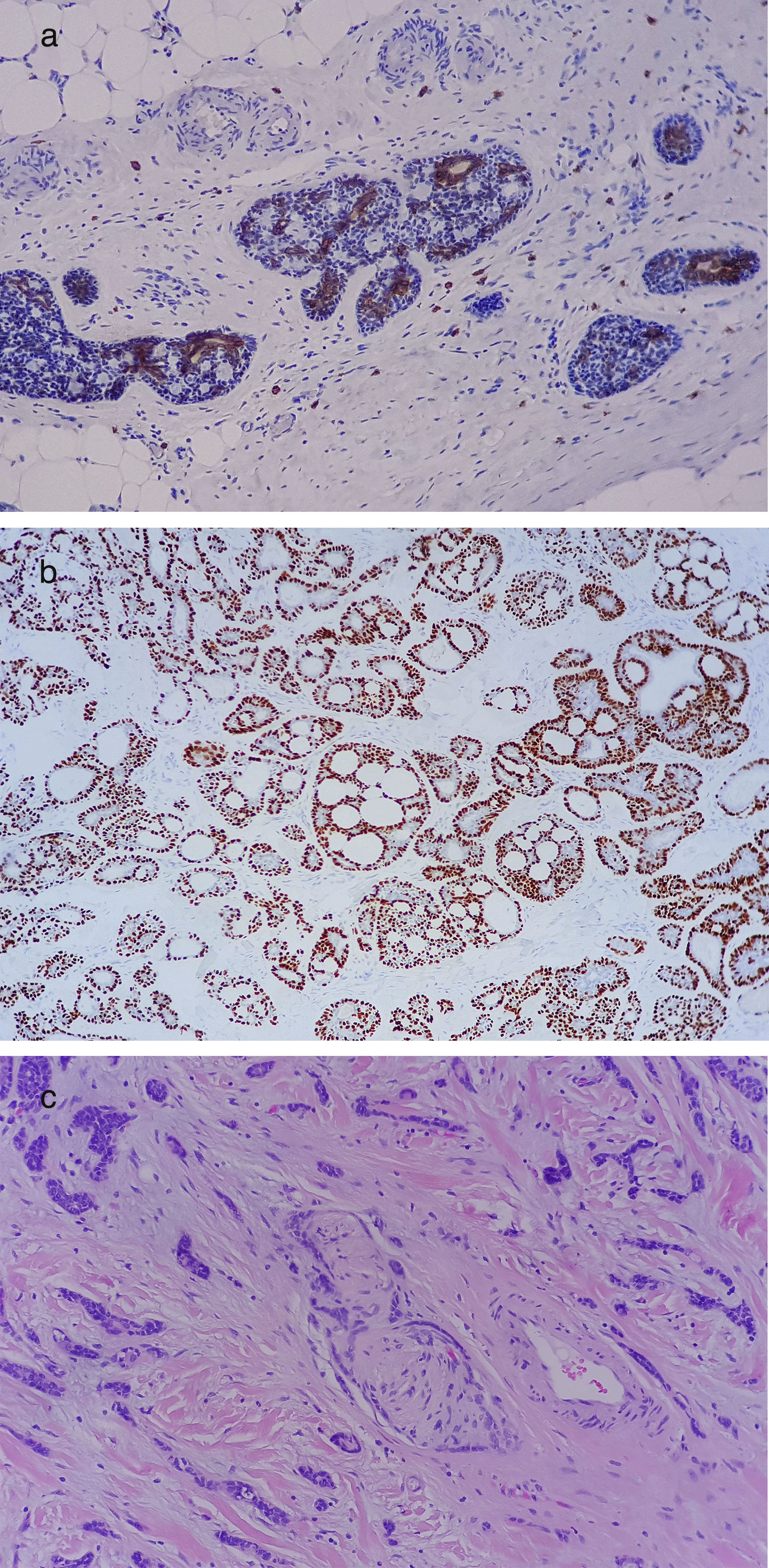
Presentamos el caso de un CAQ primario de piel, en una mujer de 74 años que consulta por un nódulo localizado entre línea intermamaria y cuadrante supero interno de mama izquierda de 10 años de evolución. Observándose una lesión nodular de 4cm, indolora, blanda, móvil, sin cambios en la piel, diagnosticado como quiste sebáceo se realiza escisión quirúrgica del mismo. Informado como CAQ con márgenes afectos e invasión perineural, se planteó el caso como un CAQ de mama. Ampliando el estudio con mamografías no se hallaron signos de patología mamaria. Posteriormente se ampliaron los márgenes, resultando libres de enfermedad. Completado el estudio histológico se observó una neoplasia epitelial que asentaba en dermis e infiltraba tejido celular subcutáneo, constituida por células de tipo basaloides de escasos citoplasmas eosinófilos y núcleos regulares hipercromáticos. Se agrupan en nidos de tamaños variables, sin empalizada periférica, conformando espacios quísticos/seudoluces glandulares con material hialino en la luz. Existe invasión perineural, pero no se identifica invasión linfovascular. La actividad mitótica es muy baja (1 mitosis×10 campos de gran aumento), con inmunofenotipo: p63 (+), CKIT (CD117) (+ focal), CEA (+ focal), RE (−), RP (−) y un índice de proliferación tumoral (Ki-67) del 1%(figs. 1a-c).
Ante las diversas localizaciones del CAQ se ha sugerido que su origen no es a partir de un tipo celular específico, sino que el tumor en sí es un patrón histológico específico de carcinoma. El CAQ cutáneo es indistinguible de sus homólogos en otras localizaciones. La invasión perineural, característica muy frecuente en las glándulas salivales, ha sido poco observada4. Ante la proximidad a la glándula mamaria, nos planteamos el diagnóstico diferencial con un CAQ de mama.
Ni la morfología celular, ni las técnicas de histoquímica e inmunohistoquímica, permitieron diferenciar un CAQ de mama de uno cutáneo, siendo necesaria la correlación clínico-patológica para el diagnóstico definitivo.
El CAQ de mama también es infrecuente. Su tratamiento no se realiza según los parámetros determinantes en otros cánceres mamarios y posee una evolución y pronóstico más favorables5.
La anatomía patológica nos permite hacer el diagnóstico diferencial con otras neoplasias mamarias, pero difícilmente con otros CAQ.
El tratamiento del CAQ no está estandarizado, recomendándose la exéresis. La linfadenectomía no está indicada de primera elección, ya que el riesgo de metástasis ganglionares es bajo y la radioterapia no previene las recurrencias4–8.
Se están desarrollando nuevos tratamientos basados en el genoma tumoral recientemente secuenciado. Con los avances en caracterización molecular, se ha observado que los CAQ tienen una translocación cromosómica característica. La investigación está limitada por la rareza y el lento crecimiento de CAQ, pero se están revisando varios ensayos con agentes que inhiben la señalización del receptor del factor de crecimiento de fibroblastos u otras vías de señalización para retrasar la progresión tumoral, pero las respuestas tumorales siguen siendo raras9.
En nuestro caso el seguimiento clínico se realiza de forma anual con exploración física exhaustiva, asociando TC toracoabdominal y mamografías bilaterales. Actualmente la paciente evoluciona de forma satisfactoria sin recurrencia o evidencia de enfermedad local o metástasis al año tras la cirugía.