INTRODUCCION
El carcinoma ductal hipersecretor de mama (CHDC) representa una variante inusual del carcinoma ductal, la cual fue descrita por primera vez por Rosen y Scott en 19841 y ha sido considerada como un precursor del carcinoma micropapilar2. La edad de presentación es amplia (34-79 años) siendo la media de 56 años2. Suele presentarse como masa o zona irregular palpable en mama. Macroscópicamente son lesiones firmes aunque no duras y suelen medir entre 1-10 cm de diámetro.
Este tipo de neoplasia presenta numerosas formaciones quísticas de tamaño variable conteniendo abundante material de secreción en su luz. El epitelio de revestimiento puede ser aplanado o mostrar focos de atipia micropapilar. La denominada hiperplasia hipersecretora quística (CHH) es similar desde el punto de vista histológico salvo la ausencia de atipia citológica.
Pocos casos de CHDC han sido descritos, los últimos por Guerry (1988)2 en total 19 casos, cuatro de los cuales fueron microinvasores. Varios casos aislados adicionales han sido recogidos3-5, aunque esta entidad tumoral continua siendo casi desconocida para una gran mayoría de patólogos.
Nosotros presentamos un nuevo caso of CHDC con microinvasión en una mujer de 37 años sin historia previa de patología mamaria.
CASO CLINICO
Mujer de 37 años, con toma de anovulatorios desde hace dos años. La paciente tuvo dos niños con corto período de lactancia. Entre los antecedentes familiares consta una tía con carcinoma de mama.
Desde hace 10 años, los controles periódicos tanto mamográficos como ecográficos son anodinos, dado el antecedente familiar de carcinoma de mama. El último control demostró calcificaciones multiples en el cuadrante superointerno de mama izquierda. Tras biopsia intraoperatoria y con diagnóstico de carcinoma por la invasión tumoral estromal y la presencia de material coloide extracelular, se procedió a una cuadrantectomía con disección axilar.
Tras 2 años de seguimiento la paciente está libre de enfermedad.
MATERIAL Y MÉTODOS
Múltiples secciones tanto de la pieza quirúrgica como de los ganglios extirpados fueron fijados en formol tamponado e incluidos en parafina para posteriormente teñirse en hematoxilina-eosina. Algunas secciones fueron seleccionadas para estudio inmunohistoquímico complementario. Los anticuerpos usados para inmunohistoquímica fueron p53 (dilución 1/50, DAKO), MIB1(Ki67) (dilución 1/50, BIOMEDA), EMA (dilución 1/200, DAKO) y CAM 5.2 (dilución 1/50, MEDAC). El método empleado fue el de avidina biotina peroxidasa.
Muestras para microscopia electrónica fueron fijadas en gluteraldehído diluido en tampón fosfato (2,5 %) (pH 6,9, a 4 °C) durante dos horas y posteriormente refijadas en tetraóxido de osmio (1 %) durante una hora, deshidratadas en soluciones graduales de acetona e incluidas en Epon. Las muestras fueron cortadas en secciones de una micra de espesor, teñidas con azul de toluidina y examinadas en el microscopio óptico, para seleccionar campos representativos del tumor. La microscopia electrónica (Jeol, Jem 1010, Tokyo) de los campos seleccionados se realizó tras tinción con citrato de plomo y acetato de uranilo.
HALLAZGOS PATOLOGICOS
Estudio macroscópico
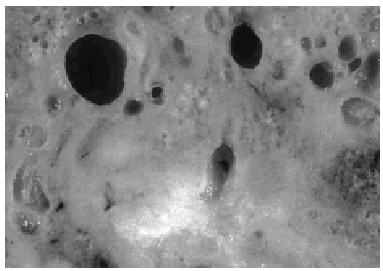
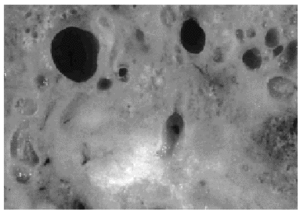
Se recibió una pieza de lumpectomía de 12x10x3 cm en el seno de la cual se apreciaba una tumoración mal delimitada, de consistencia aumentada, mostrando numerosos quistes pequeños rellenos de material coloide entre 0,1 y 1,2 cm de tamaño (fig. 1). De la grasa axilar se aislaron 12 ganglios.
Fig. 1. Macroscópicamente la tumoración presenta numerosos quistes pequeños rellenos de material coloide.
Histología
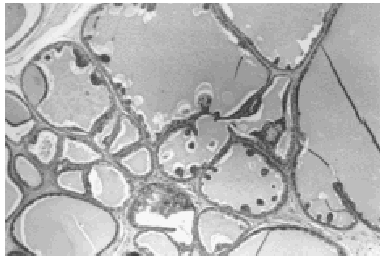
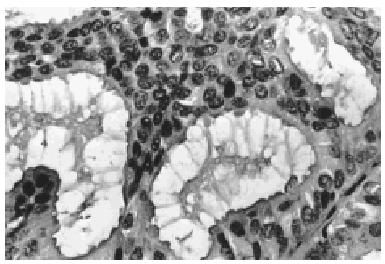
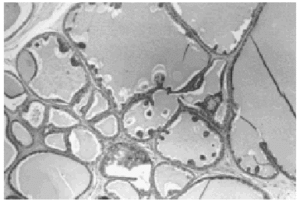
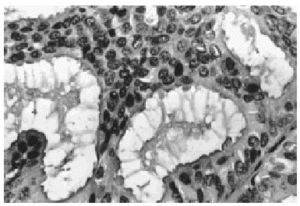
A bajo aumento el tumor mostraba numerosos microquistes de tamaño variable conteniendo material de secreción tipo coloide con tendencia a la retracción central (fig. 2). Este material era denso, homogéneo y eosinófilo con ocasionales microcalcificaciones. El epitelio de revestimiento de los quistes era mono o pluriestratificado con tendencia a formar micropapilas que protruían hacia la luz. Aunque se observaron puentes y arcos romanos las células ductales mostraban escasa atipia y limitado número de mitosis (fig. 3).
Fig. 2. Histológicamente el tumor muestra múltiples quistes conteniendo material de aspecto coloide (HE, x 4).
Fig. 3. El epitelio de revestimiento es mono o pluriestratificado con tendencia a formar micropapilas (HE, x 40).
Frecuentemente se observaron grupos aislados de células tumorales inmersas en el material coloide.
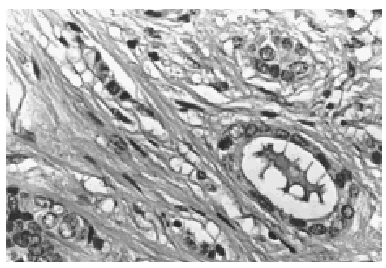
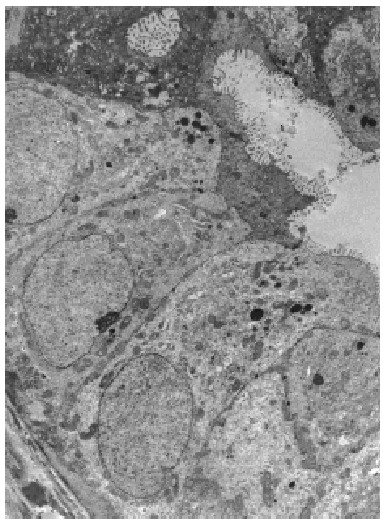
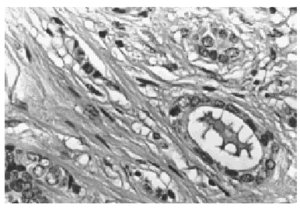
Al menos en dos focos diferentes se observó una clara invasión estromal (fig. 4). Un material colágeno denso rodeaba los espacios periductales. Sin embargo algunos quistes distendidos estaban rotos y el material coloide infiltraba el estroma. También fue observada una invasión estromal periductular por focos neoplásicos pobremente diferenciados sin secreción. De los doce ganglios aislados, uno de ellos presentaba una invasión parcial por células tumorales
Fig. 4. A gran aumento se observa el componente epitelial invadiendo el estroma (HE, x 40).
Microscopia electrónica
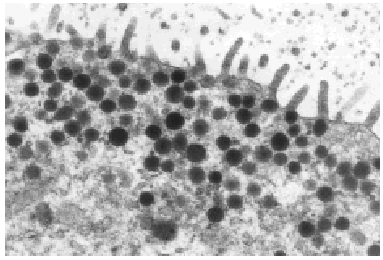
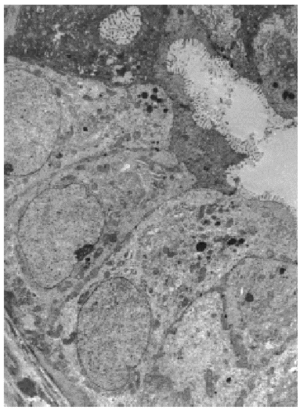
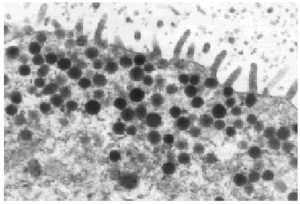
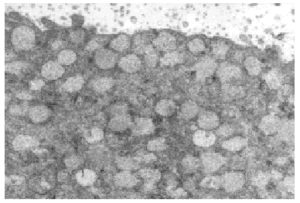
Varios pequeños fragmentos de tumor fueron revisados por microscopia electrónica. El epitelio de revestimiento de los ductos mostraba dos o mas capas de células epiteliales columnares rodeadas por una capa de de células mioepiteliales las cuales las separan de las membranas basales (fig. 5). Las células epiteliales eran cilíndricas, estaban íntimamente agrupadas y con numerosas microvellosidades cubriendo la superficie. Estas se encontraban unidas por desmosomas y uniones estrechas yuxtaluminales. Las células columnares presentaban una función secretora muy activa con numerosas vesículas aisladas o confluyentes sin membrana, y se distribuían al azar en el área apical del citoplasma (fig. 7). Las vesículas secretoras contenían material floculento granular, similar al observado en la luz de los ductos (fig. 6). Las células mioepiteliales mantenían la morfología usual al microscopio electrónico, con contornos estrellados o fusocelulares y presencia de haces de filamentos en el interior del citoplasma.
Fig. 5. Células epiteliales con microvellosidades y complejos de unión rodeadas por células mioepiteliales y membrana basal.
Fig. 6. Gránulos secretores y microvellosidades (x 13.000).
Fig. 7. Vesículas esféricas conteniendo material de secreción (x 5.500).
Estudio inmunohistoquímico
Las células neoplásicas expresaban inmunomarcadores epiteliales, tales como citoqueratinas tipo CAM 5.2 y EMA. La expresión de receptores de estrógenos y progesterona se encontró en aproximadamente el 75 % de los núcleos; no se observó expresión de p53 y el índice proliferativo, expresado por la positividad nuclear frente al ki67, se observó en menos del 10 % de las células.
DISCUSION
Presentamos un nuevo caso de esta rara entidad, la cual no ha sido recogida en la clasificación WHO de los tumores de mama. El diagnóstico diferencial debería establecerse con su contrapartida benigna llamada "Hiperplasia Hipersecretora Quística" (CHH). En esta entidad, los ductos y los quistes están histológicamente cubiertos por una única capa celular sin atipia, pero muestra una actividad hipersecretora alta, como la observada en su contrapartida maligna; esta lesión podría ser considerada un predecesor del CHDC, aunque puede persistir como tal durante muchos años6.
El curso clínico y la manifestación del CHDC es similar al de otros carcinomas ductales no invasores o microinvasores4,5. Por tanto, el tratamiento terapéutico debería ser similar a a los carcinomas intraductales con invasión.
Respecto a la evolución clínica, la presencia de metástasis axilares ha sido descrita en 2 pacientes de los cuatro casos publicados de CHDC invasor2. En este caso la microinvasión fue seguida por metástasis en un ganglio axilar.
Un punto que merece la atención es el patrón seudoinvasivo producido por la presencia de material coloide de los ductos disperso en el estroma. Este tipo de seudoinvasión debería ser diferenciada de una real infiltración de células de al menos 0.5 mm de diámetro máximo7 como ocurre en este caso.
A nivel ultraestructural nuestros resultados contrastan con los publicados por Guerry en 19882, ya que en nuestra experiencia el cúmulo de gránulos electrodensos al igual que los de baja densidad se producen en las áreas adluminales, siendo muy numerosos tanto en las áreas quísticas como las de predominio ductal.
El hallazgo de células mioepiteliales, muy numerosas en nuestras observaciones contradicen los hallazgos de Tavassoli-Norris8.