En los últimos años se ha identificado un pequeño número de células en los tumores con características de células madre que se han observado en distintos tipos de tumor, incluido el cáncer de mama. Estas células, las células madre tumorales, resultan de gran interés, ya que se les atribuye la capacidad de originar, mantener y expandir los tumores, así como de dar lugar a las metástasis y recidivas. Por otro lado, estas células han demostrado ser más resistentes a tratamientos convencionales utilizados en oncología, como la quimioterapia o la radioterapia; por tanto, suponen un candidato claro para la generación de recidivas. La caracterización molecular de estas células se ha convertido en uno de los campos más activos en la investigación oncológica, ya que los tratamientos dirigidos contra estas células podrían dar lugar a una eliminación completa del tumor y, por lo tanto, a la curación de la enfermedad.
In recent years, a small population of cells with stem cell properties, and named cancer stem cells (CSC), has been identified in a wide variety of tumours, including breast cancer. The increasing interest in CSCs resides in the ability of this cell population to originate, maintain and expand the tumour, thus being responsible for tumour initiation, metastasis and relapses. As these cells have shown to be more resistant to conventional cancer treatments, such as chemotherapy or radiotherapy, it has been suggested that they may be responsible for relapses. The molecular characterization of these cells is one of the most active research areas in oncology, as targeting this cell population may become necessary for a complete elimination of the tumour and possibly a definitive cure of the disease.
Según los datos publicados por el Instituto Nacional del Cáncer de Estados Unidos, la incidencia de muerte por cáncer se ha mantenido constante en los últimos 60 años, a diferencia de la incidencia de muerte por otras enfermedades prevalentes, como las enfermedades cardiovasculares o las enfermedades de origen infeccioso, cuya mortalidad ha disminuido hasta en un 50% en este período. El tratamiento de enfermedades como la leucemia infantil, la enfermedad de Hodgkin y el cáncer testicular han obtenido grandes mejoras1. En el caso del cáncer de mama, la mortalidad ha aumentado de forma significativa en los últimos años (425.000 mujeres en el año 2010)2, a pesar de que se ha producido una mejora importante en el diagnóstico temprano y en el desarrollo de tratamientos más efectivos en adyuvancia3. Además de esto, el desarrollo de tratamientos a medida para cada subtipo molecular de cáncer de mama ofrece una esperanza a pacientes con enfermedad metastásica. Estos tratamientos incluyen agentes cuya diana es el receptor del factor de crecimiento epidérmico 2 (Her2) para los tumores que sobreexpresan Her2; inhibidores de la aromatasa, tratamientos hormonales de tercera generación para tumores positivos para el receptor de estrógeno (RE), e inhibidores de poly(ADP-ribosa) polimerasa (PARP) para los tumores deficientes en BRCA1 y los triple negativos4. A pesar de estos grandes avances y de la administración de tratamiento adyuvante, muchas mujeres experimentan recidivas, y el cáncer de mama metastásico sigue siendo una enfermedad larga e incurable.
Recientemente, ha retomado fuerza una antigua idea sobre cómo se originan y mantienen los tumores5 y sobre cómo éstos evaden los tratamientos, dando lugar a recidivas o metástasis: la hipótesis de las células madre tumorales (CMT). Esta hipótesis lleva consigo importantes implicaciones terapéuticas que deberían provocar un cambio en el diseño de los tratamientos antitumorales. Conocer mejor cómo se produce la transformación en CMT permitirá diseñar abordajes de tratamiento celular más seguros y nuevos tratamientos específicos contra estas células6.
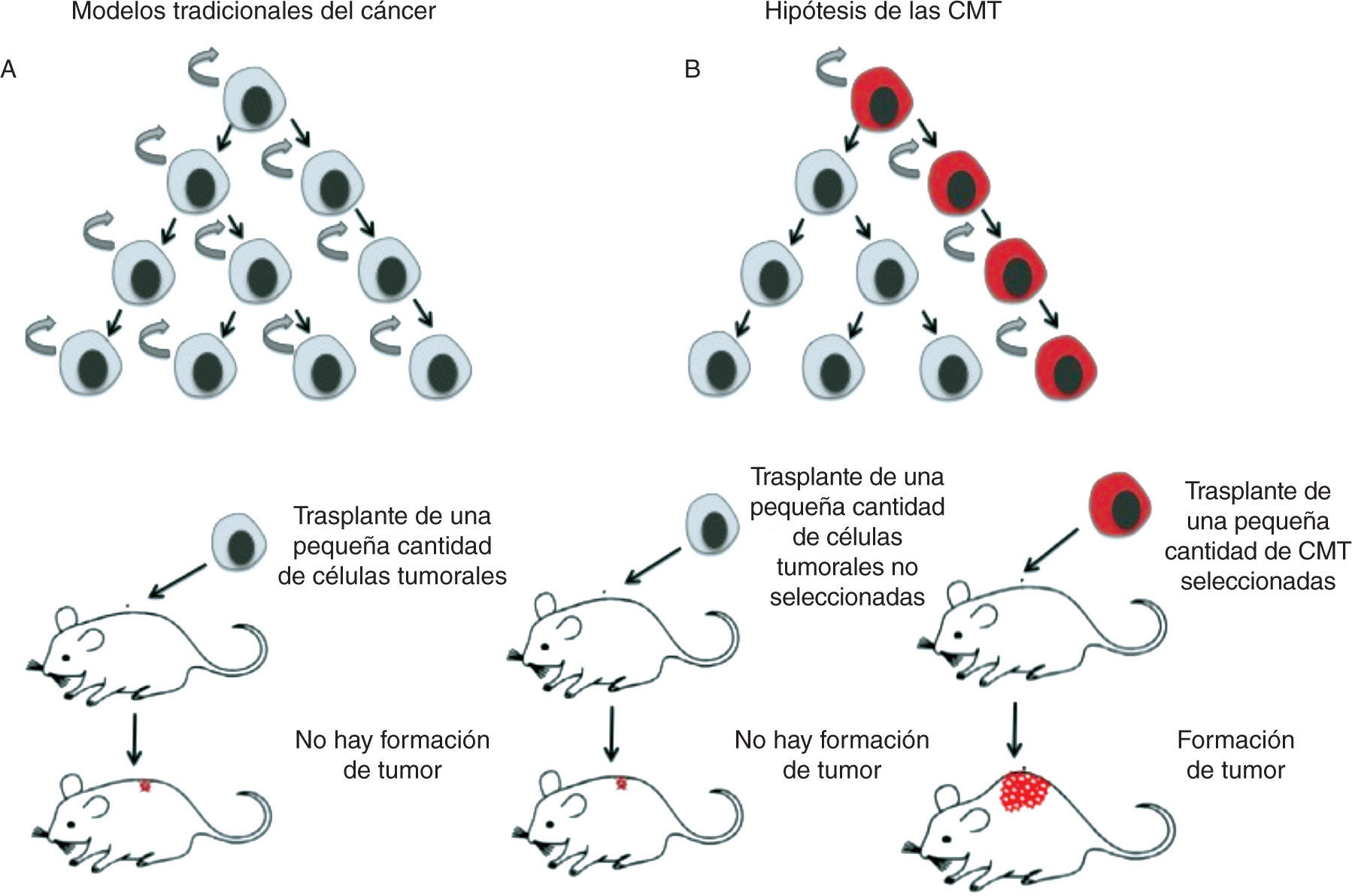
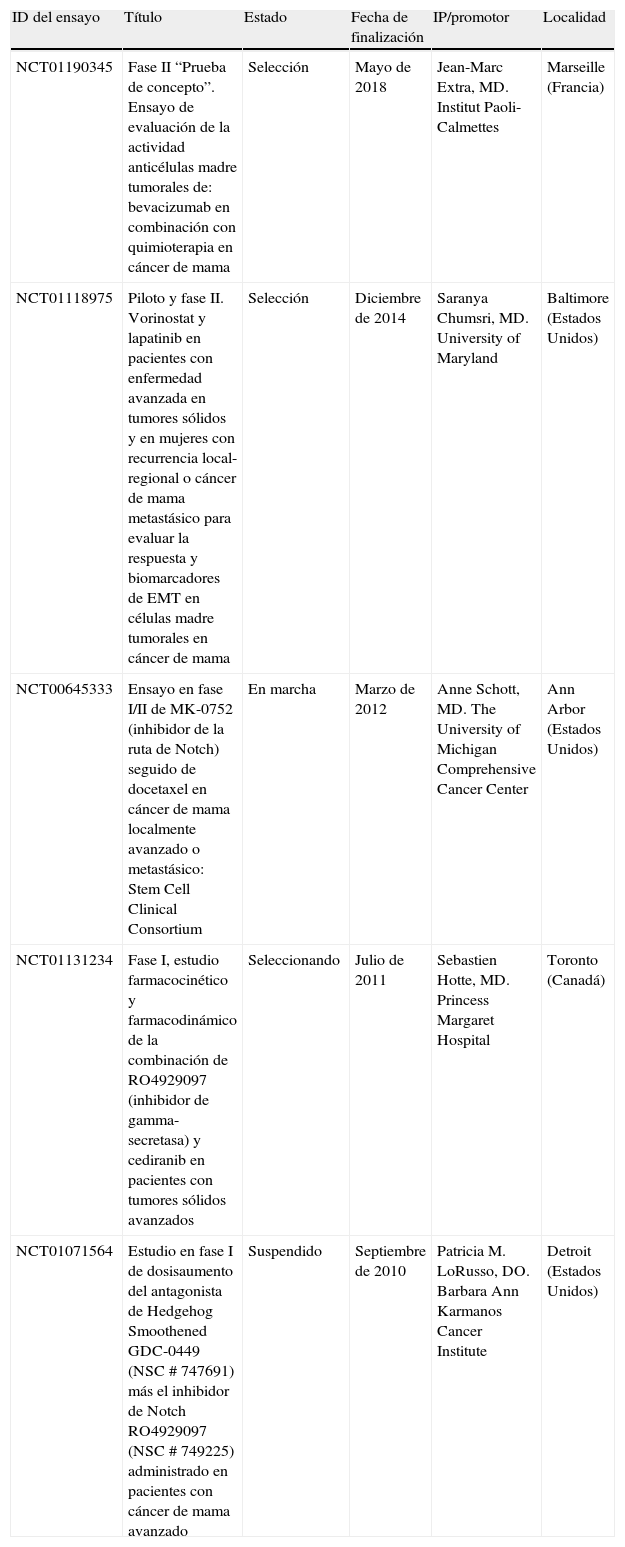
Modelo jerárquico de las células madre tumoralesEl modelo estocástico o tradicional del cáncer postula que una o varias células del tejido adquieren una mutación y que, a partir de ésta y a través de un proceso de división no controlado, van acumulándose nuevas alteraciones genéticas que, mediante la selección de los clones más aptos, alcanzan el estado de célula tumoral, dando finalmente lugar al tumor. Según este modelo, cualquier célula del tumor resultante sería capaz de mantener y expandir el tumor, así como de dar lugar a nuevos tumores. Por el contrario, el modelo jerárquico de las CMT implica la existencia de una célula de origen en el tumor con propiedades de célula madre, capaz de proliferar y mantenerse en el tumor de forma indefinida gracias a su capacidad autorrenovadora6. En este modelo, tan sólo la población de CMT tiene la capacidad de generar y mantener el tumor, a diferencia del resto de células que lo forman que no tienen esa habilidad (fig. 1).
Representación gráfica de los modelos de cáncer. A. El modelo tradicional o estocástico mantiene que todas las células del tumor tienen las mismas capacidades de mantener y expandir el tumor. B. El modelo jerárquico de las células madre tumorales (CMT) sostiene que tan sólo una subpoblación celular del tumor es capaz de generar nuevos tumores.
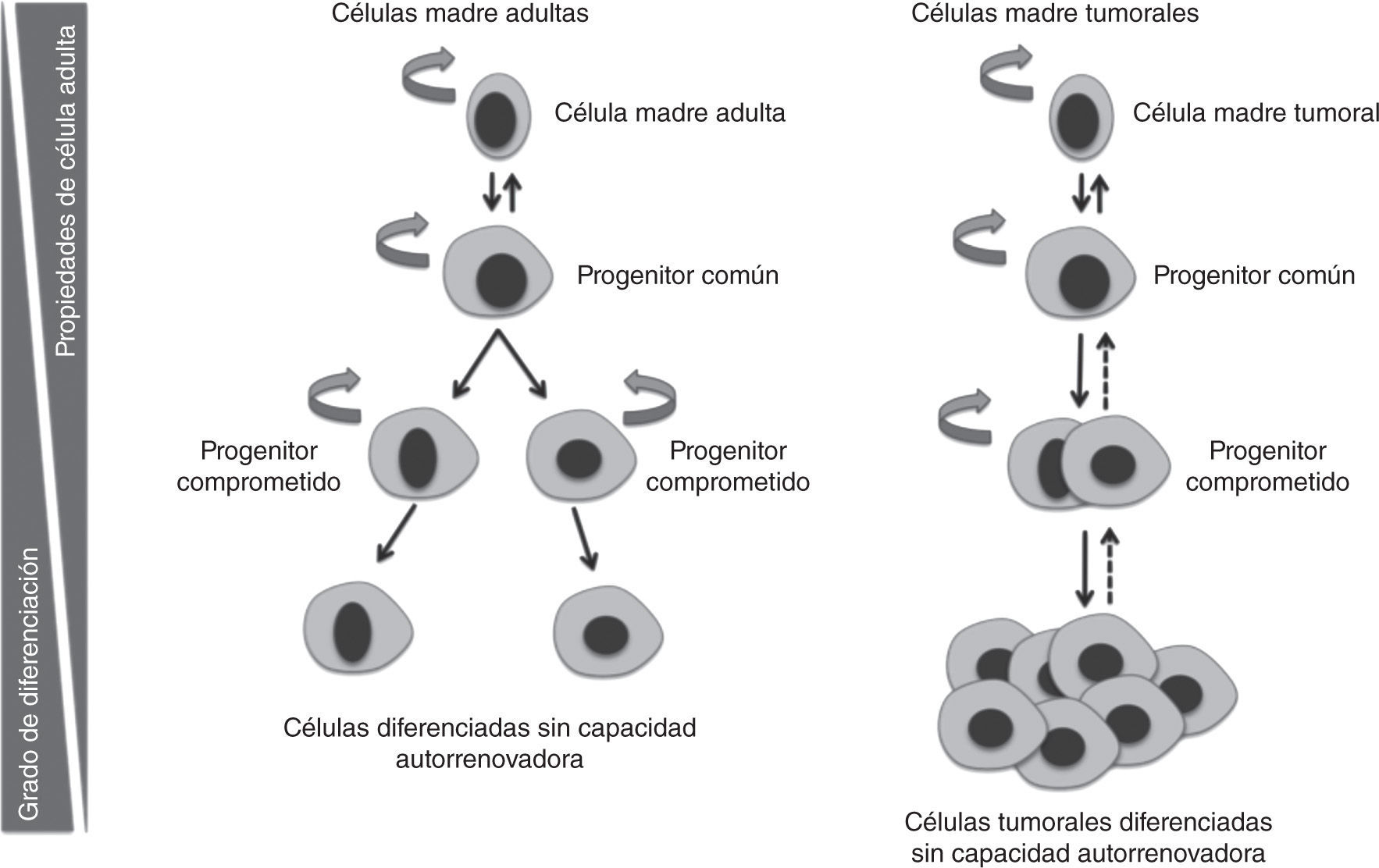
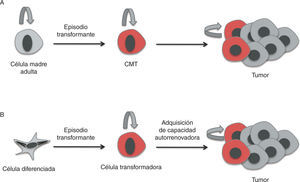
Al igual que ocurre en los tejidos sanos, los tumores están compuestos por poblaciones heterogéneas de células en diferentes estados de diferenciación7. Según el modelo de las CMT, dentro de los tumores hay una población celular capaz de autorrenovarse y de generar toda la variabilidad celular que compone un tumor. Las CMT dentro del tumor presentan la capacidad de dividirse tanto de forma simétrica, generando células del mismo tipo, como asimétrica, originando progenitores de amplificación rápida, pero transitoria. Estos progenitores darán lugar a precursores comprometidos con un linaje que formarán células tumorales diferenciadas y sin capacidad tumorogénica, que compondrán el grueso del tumor8,9.
Es importante señalar las evidencias que avalan al modelo jerárquico de las CMT:
- —
La gran heterogeneidad existente entre las células tumorales a la hora de dar lugar a colonias in vitro, así como de generar tumores in vivo mediante xenotrasplante en ratones inmunodeficientes10, demuestra que no todas las células del tumor tienen las mismas capacidades.
- —
Según el modelo estocástico del cáncer, cualquier célula del tumor sería capaz de generar un nuevo tumor, suponiendo que todas las células del tumor fueran iguales. Por tanto, resulta lógico creer que un número bajo de células sería suficiente para dar lugar a un tumor10; sin embargo, es necesario trasplantar millones de células tumorales para prender un tumor11. El modelo jerárquico de las CMT explica este hecho argumentando que al incrementarse el número de células inyectadas, aumenta la probabilidad de inyectar CMT10–12. No obstante, en un trabajo reciente sobre melanoma se ha cuestionado el uso de modelos de roedores inmunodeprimidos para cuantificar la frecuencia de CMT. Utilizando para los xenotrasplantes ratones NOD/SCID (diabéticos no obesos con inmunodeficiencia grave combinada, deficientes en células B y T) tan sólo 1 de cada millón de células trasplantadas era capaz de dar lugar a un tumor; pero si se utilizaban ratones NOD/ SCID deficientes para la cadena g del receptor de la interleucina 2 (no presentan células B, T, ni natural killers), 1 de cada 4 células inyectadas fue capaz de dar lugar a un tumor. Ello indica que la frecuencia de células con capacidad tumorogénica depende del ensayo y, por tanto, debe reevaluarse utilizando ensayos estandarizados13. No obstante, parece que se trata de una característica asociada a melanoma y no se ha reproducido en otros tipos de tumores.
- —
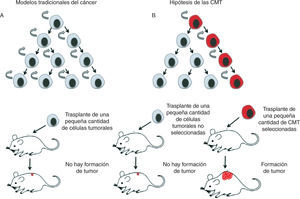
La heterogeneidad celular existente a nivel histológico en los tumores es muy similar a la del tejido de origen, lo cual indica una relación jerárquica en la que existen células indiferenciadas que dan lugar a células maduras diferenciadas12. Esto respalda el modelo jerárquico de las CMT e indica una relación jerárquica en la que existen células indiferenciadas que dan lugar a células maduras diferenciadas12. En algunos tipos de tumores, estas células conservan la capacidad de diferenciarse a células terminales similares a las del tejido de origen (figs. 2 y 3).
- —
También pone de manifiesto la existencia de las CMT, el hecho de que el desarrollo de un carcinoma ocurra por mutaciones que se dan a lo largo de los años, las CMT se dividen lentamente, se mantienen con vida en el tiempo y tienen una tasa proliferativa baja, por lo que representan la población celular adecuada para acumular mutaciones. A lo largo de su vida se exponen a agentes dañinos y propagan entre las células hijas las mutaciones inducidas por agentes genotóxicos14. Las mujeres víctimas de la bomba atómica de Hiroshima y Nagasaki presentaron una elevada incidencia de cáncer de mama, pero 30 años después de la exposición a la radiación, lo cual demuestra que las dianas de la trasformación son células de larga vida15. Las mutaciones encontradas en estas mujeres coincidieron con las conocidas como resultado de la exposición a la radiación. Además, las mujeres que fueron expuestas a esta radiación durante su adolescencia presentaron la mayor susceptibilidad a desarrollar cáncer de mama, por lo que se considera que este período de la vida es el que presenta más actividad de células madre mamarias16.
El modelo tradicional y el modelo jerárquico no son excluyentes entre sí, ya que las propias CMT están sujetas a evolución clonal, tal como se demostró en el caso de las CMT de algunas leucemias17. De este modo, ambos paradigmas podrían existir en cáncer, aunque tan sólo el modelo de las CMT es jerárquico18.
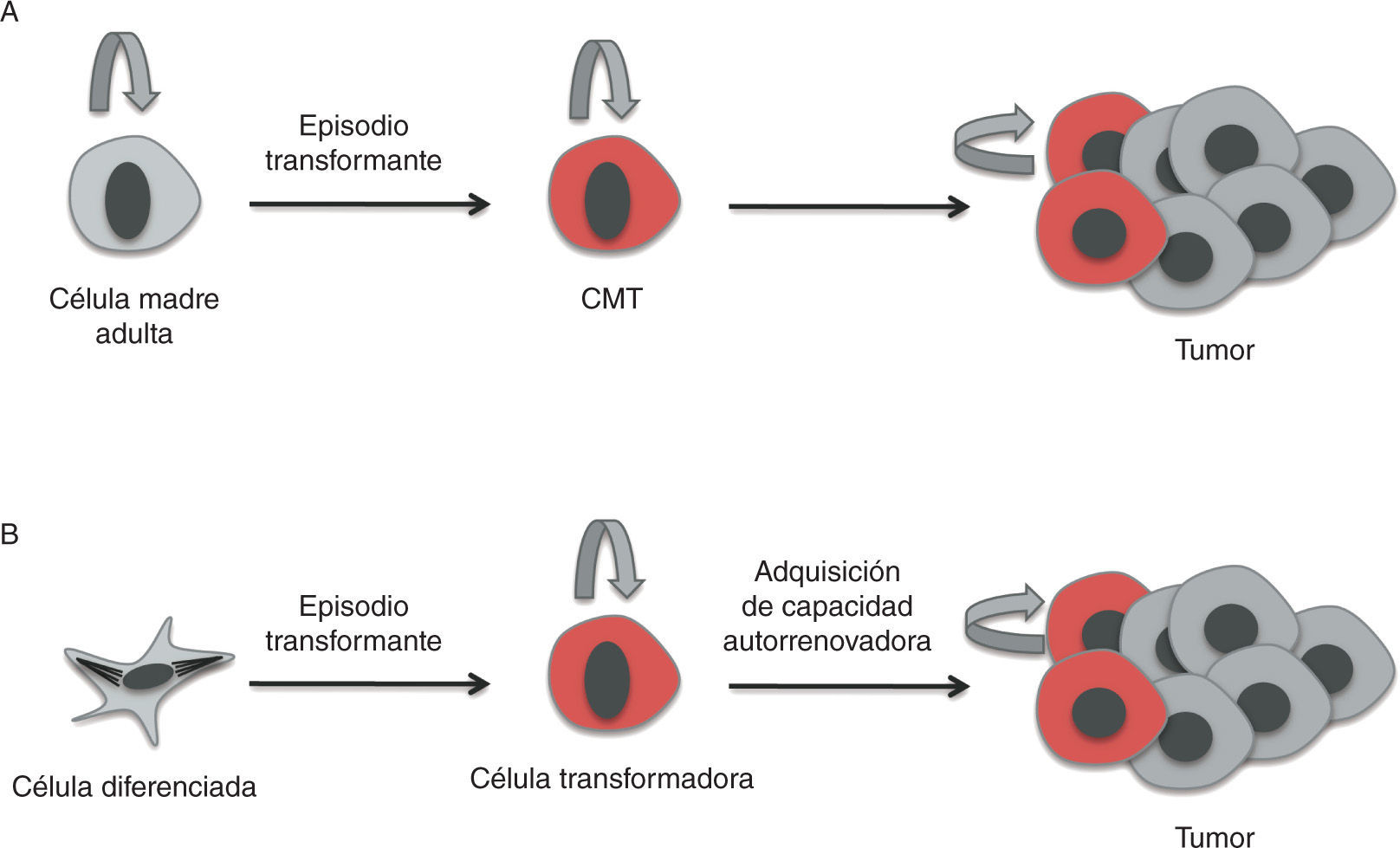
Poco se sabe hasta el momento sobre cuál es la célula diana de la trasformación que da lugar a las CMT, es decir, sobre la célula de origen del cáncer. Es importante tener en cuenta que la célula de origen —la que recibe las primeras mutaciones que la convierten en célula tumoral— no es necesariamente la célula madre adulta19, sino que podría derivarse de un precursor más comprometido, o incluso de una célula diferenciada que haya adquirido las propiedades de célula madre18,20.
Células madre de la glándula mamariaPara conocer el origen y la biología del cáncer de mama es necesario conocer el tejido donde se origina. La glándula mamaria, cuya principal función es la producción de leche, se desarrolla después del nacimiento y a partir de un pequeño número de células invasoras derivadas del ectodermo21. Su epitelio es un tejido muy dinámico que experimenta grandes cambios morfogenéticos en la pubertad, el embarazo, la lactancia, la involución y la menopausia22.
La glándula mamaria se sustenta gracias a la existencia de una jerarquía celular. El parénquima mamario está compuesto por tres tipos principales de células epiteliales diferenciadas: a) las células ductales luminales que delinean los ductos; b) las células luminales alveolares que producen la leche durante la lactancia, y c) las células contráctiles mioepiteliales situadas entre las células luminales y la membrana basal23. Estas poblaciones de células epiteliales, bajo la regulación de hormonas sistémicas y señales locales del estroma, experimentan constantes procesos de proliferación, diferenciación y apoptosis, con lo que al llegar al estado más diferenciado pierden su capacidad de proliferación. Existen progenitores más primitivos que remplazan estas células, a los que a su vez remplaza una jerarquía de progenitores con niveles de “indiferenciación” crecientes, según se alcanza lo más alto de la jerarquía mamaria, hasta llegar a la célula madre mamaria “indiferenciada”24.
Los primeros datos que indicaron la existencia de células madre mamarias son del año 1996 y se basan en la observación de alteraciones cromosómicas idénticas en regiones contiguas del epitelio mamario25–27. La existencia de una cé lula de larga vida en este epitelio es consistente con el incremento en el riesgo de presentar cáncer de mama asociado a la exposición a radiación en mujeres adolescentes28. Además de esto, ensayos de clonogenicidad realizados in vitro con células epiteliales de la mama han demostrado la heterogeneidad existente en este tejido29. La caracterización de estas células en humanos es algo en lo que se ha empezado a trabajar en los últimos 5 años, por lo que aún no están correctamente caracterizadas. Por un lado, en el año 2007, Ginestier et al30 demostraron que las células del epitelio mamario con características de células madre o progenitoras eran aquellas con mayor actividad para la enzima aldehído deshidrogenasa 1 (ALDH1) mediante el ensayo de Aldefluor®. Por otro lado, a nivel de marcadores de membrana, se ha identificado la población CD49fhiEpCAM– como enriquecida en progenitores bipotentes31,32. Este modelo ha sido recientemente cuestionado por el grupo de Cedric Blanpain (Universidad Libre de Bruselas [Bélgica]), el cual ha demostrado en una serie de elegantes experimentos de trazado de linaje en ratón que el mantenimiento de la homeostasis normal en la glándula mamaria posnatal se debe a células madre unipotentes33. Es únicamente durante el desarrollo embrionario y durante el embarazo cuando aparecen células madre bipotentes. Estos datos apuntan a la existencia de una jerarquía compleja de células madre que incluye células multipotentes, así como células madre de capacidades más restringidas19.
Al igual que en la glándula mamaria sana, la diferenciación de las células madre genera un linaje celular compuesto por tres tipos mayoritarios de células funcionales diferenciadas. En los tumores de mama también hay una diferenciación celular aberrante que se traduce en los distintos subtipos moleculares de cáncer de mama34, aunque distintos trabajos indican que tumores de fenotipo basal indiferenciado provienen de progenitores luminales32,35, por lo que la célula de origen que presenta la trasformación que la convierte en CMT podría ser cualquier célula del linaje celular de la glándula mamaria, siempre y cuando hubiera adquirido los cambios adecuados.
Células madre tumorales en cáncer de mamaLa existencia de CMT en cáncer de mama se demostró por primera vez según la presencia de los marcadores de membrana EpCAM y CD44 y la ausencia o baja presencia del marcador CD2436. En este trabajo se demostró que tan sólo 200 células con este fenotipo eran capaces de formar tumores en ratones NOD/SCID, a diferencia del resto de células del mismo tumor que, inyectadas en cantidades hasta 100 veces mayores, no dieron lugar a tumores. Además, esta población celular dio lugar a toda la heterogeneidad del tumor inicial36. Aunque el fenotipo CD44+/CD24– ha sido propuesto como fenotipo de células iniciadoras de tumores con características invasoras, no está claro si este patrón de marcadores tiene relevancia clínica en tumores37,38.
A pesar de los avances que se están realizando en el campo de las CMT en cáncer de mama, es importante conocer las características específicas que definen a estas células, así como los mecanismos moleculares implicados en su generación, para poder utilizar las CMT en la práctica habitual del diagnóstico del cáncer de mama, y así poder determinar un diagnóstico más temprano de la enfermedad y de su capacidad para generar metástasis.
La caracterización de las CMT supone un paso clave en la investigación del cáncer, en general, y del cáncer de mama, en particular; por un lado, en la mejora de la eficacia de los tratamientos y, por el otro, para poder actuar de forma selectiva contra estas células, para así conseguir la desaparición completa del tumor y la curación de la enfermedad.
Aislamiento de células madre tumorales en cáncer de mamaUno de los retos más importantes en el campo de las CMT de cáncer de mama es su definición fenotípica. Para ello se han descrito varios ensayos que permiten identificar a poblaciones celulares con características funcionales de CMT:
- —
A partir del modelo de neuroesferas descrito por Reynolds y Weiss39 en el año 1992 para detectar células precursoras en cerebro adulto, se demostró que las células con capacidad de sobrevivir en suspensión formando colonias flotantes, denominadas mamosferas, estaban enriquecidas en CMT40.
- —
Más adelante, el grupo de Max Wicha (University of Michigan, Michigan, Ann Arbor [Estados Unidos]) descubrió que las células con más actividad para la ALDH1 presentaban las características que definen a las CMT, por lo que el ensayo del Aldefluor®, acoplado a separación mediante citometría de flujo, puede utilizarse para enriquecer los cultivos en este tipo celular30.
- —
Al igual que se ha demostrado la presencia de CMT en tumores primarios de mama, las líneas celulares de carcinoma de mama establecidas contienen jerarquías celulares dirigidas por una población celular que expresa marcadores descritos en CMT41. Por primera vez, en el año 2005, se asoció la población conocida como SP (del inglés Side Population) con la línea celular de carcinoma de mama MCF7. se observó que esta población representaba un 2% del total de la línea celular y que contenía la única fracción tumorogénica de la línea celular, como se demostró en experimentos de xenotrasplante realizados en ratones NOD/SCID. Además, esta pequeña fracción fue capaz de reconstituir la heterogeneidad completa de la línea parental en los xenotrasplantes42.
Debido a que ninguno de estos ensayos es determinante para identificar y aislar la población de CMT en los tumores de mama, en la comunidad científica hay un gran interés en estudiar su relevancia clínica. Diversos estudios han utilizado cultivos celulares de los tumores y modelos animales para demostrar que las CMT son más resistentes a tratamientos tradicionales contra el cáncer, situándolas como la causa de las recidivas y las metástasis.
Células madre tumorales y pluripotenciaDesde hace unos años, es posible generar células pluripotentes en cultivo, con las mismas capacidades que las células madre embrionarias. Para ello, es necesario únicamente la expresión de 4 factores de transcripción43. Distintos grupos han demostrado que p53 es una barrera para este proceso de inducción de pluripotencia44–48, lo que hace pensar que el proceso por el cual se generan las células iPS in vitro presenta grandes paralelismos con la generación de los tumores. Las mutaciones por las cuales se inactiva el gen supresor de tumores p53 se producen en la mayoría de los tumores naturales humanos; por este motivo, hay una gran similitud entre los procesos genéticos y epigenéticos encargados de la generación del cáncer y la adquisición de un fenotipo menos diferenciado y con capacidad de autorrenovación en pluripotencia inducida. En el sistema hematopoyético, la pérdida de p53 confiere propiedades de célula madre a progenitores comprometidos49. Además, en el sistema mamario se ha demostrado que p53 regula la polaridad de las divisiones de las células madre adultas y favorece la división simétrica de las CMT, con lo que contribuye al crecimiento tumoral50. Por lo tanto, es posible que la adquisición de la capacidad autorrenovadora de las CMT surja como consecuencia de un mecanismo paralelo de reprogramación, junto con la inactivación de p53.
En el año 2011, en un artículo publicado por nuestro grupo51, demostramos que, a nivel inmunohistoquímico, a diferencia de lo que ocurre con los genes de pluripotencia Oct4 y Nanog, el 16% de los tumores primarios de mama expresa el gen de pluripotencia Sox2 y que la expresión de Sox2 es inducida en los cultivos celulares de esferas derivados de tumores primarios de mama, así como en las esferas derivadas de líneas celulares de carcinoma mamario. Además de esto, los tumores Sox2 positivos se estratificaron en los estadios más tempranos de la progresión tumoral acorde a la estadificación TNM, presentando mayor prevalencia de células Sox2 positivas en el componente in situ que en el infiltrante. De esta forma, demostramos que la expresión de Sox2 correlaciona con los estadios iniciales de la progresión tumoral. Funcionalmente, el bloqueo transitorio de la expresión de Sox2 redujo la formación de tumores en animales inmunodeprimidos, con lo que se demostró su participación en la iniciación tumoral. Este hecho nos indicó que el gen Sox2 desempeña un papel importante en el inicio de la tumorogénesis, aunque posiblemente no sea necesario en los estadios más avanzados del tumor.
La reactivación de la expresión del gen de pluripotencia Sox2 en una célula con las mutaciones adecuadas (como la inactivación de la ruta de p53) podría ser la causa de la generación de las CMT. El lugar de esta célula en la jerarquía mamaria sería el determinante del fenotipo del tumor.
Implicaciones clínicas de las células madre tumoralesLos tratamientos antitumorales clásicos no generan una respuesta de eliminación total de las células tumorales, por lo que en muchos casos no se da la curación completa de la enfermedad. Los tratamientos antitumorales se basan en el modelo tradicional o estocástico, ya que usan como parámetro la disminución de la masa del tumor a corto plazo. A las CMT se les atribuye la capacidad de evadir este tipo de tratamientos, lo que da lugar a las recidivas y a las metástasis, ya que estas células son de índice mitótico bajo, las que se dividen lentamente y a las que en menor medida les afectan este tipo de fármacos.
Se ha descrito que la quimioterapia convencional incrementa la población de células CD44+CD24– y la capacidad de formar mamosferas in vitro en tumores de mama avanzados52, y que la quimioterapia basada en paclitaxel y epirubicina aumenta la población de células ALDH1 positivas en tumores de mama53. Por otro lado, con el objetivo de asociar el contenido de CMT de los tumores de mama y el pronóstico de la enfermedad, se examinó la presencia de la población CD44+CD24– en tumores de mama y se observó que no había asociación con los casos de pronóstico peor54. Este resultado indica la necesidad de definir correctamente las CMT para su futuro uso en la clínica.
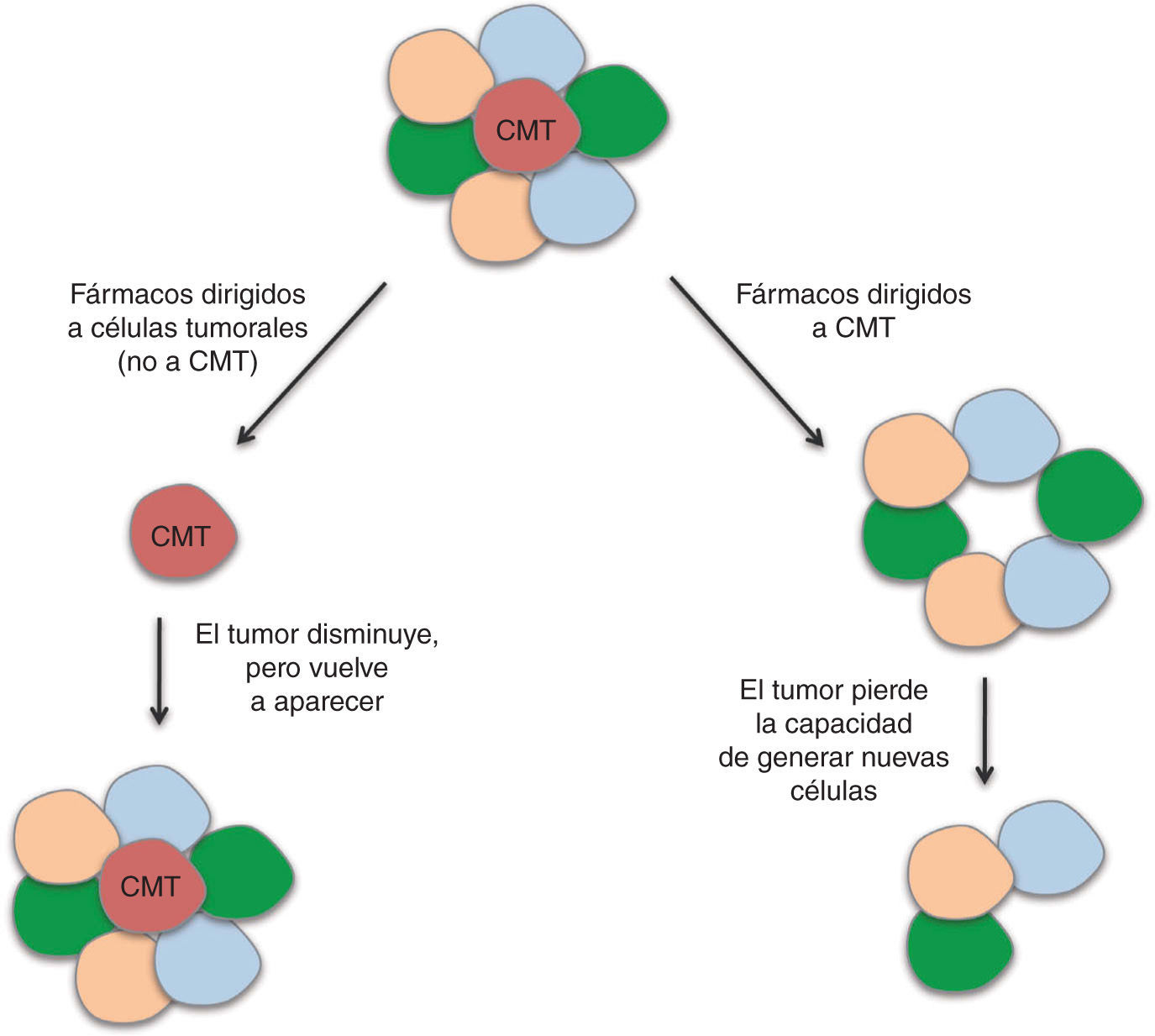
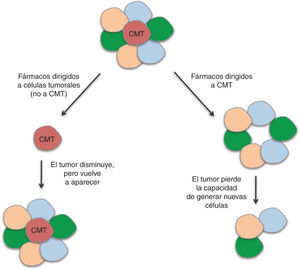
En las CMT se encuentran alteradas diversas vías de señalización que regulan los procesos de división, diferenciación y apoptosis. Entre ellas se encuentran las vías de WNT, b-catenina, PTEN, TGF-b, Hedgehog, Notch y Bmi-155. Algunos agentes dirigidos a bloquear estas rutas y, por tanto, las CMT, que han mostrado eficacia en ensayos preclínicos, están siendo incluidos en ensayos clínicos. Sin embargo, se requieren diseños novedosos en los que pueda evaluarse la eficacia biológica y clínica de estos fármacos. La eficacia de los agentes antitumorales se mide siguiendo las reglas RECIST (del inglés, Response Evaluation Criteria In Solid Tumors), que definen cuando los pacientes responden al tratamiento, se mantienen estables ante éste o empeoran, a partir del tamaño del tumor. Este criterio no evalúa la disminución de las CMT, ya que el grueso del tumor no está compuesto por estas células. Debido a esta falta de precisión en la evaluación de la respuesta a quimioterapéuticos, se están abriendo paso otros criterios en esta valoración, como los establecidos por Ogston et al56, que utiliza el sistema de gradación de regresión histológica del tumor. La identificación de biomarcadores específicos de CMT en cáncer de mama nos dará la posibilidad de evaluar el efecto de los agentes utilizados en los ensayos clínicos sobre estas células; por lo tanto, en vez de utilizar la medida del tamaño del tumor como criterio, se utilizará el criterio de respuesta completa cuando se produzca una reducción de la recidiva. Un agente dirigido a CMT no dará lugar a una gran disminución de la masa tumoral, pero tendrá un efecto importante en la recurrencia de la enfermedad; por otro lado, un agente dirigido a las células tumorales en general, pero no a la capacidad autorrenovadora de las CMT, dará lugar a una reducción importante del tamaño del tumor, pero no a una reducción en la recidiva (fig. 4). Por tanto, entendemos que resulta necesaria la inclusión de la recidiva como criterio de evaluación en los ensayos clínicos dirigidos a las CMT57. En estudios recientes se ha demostrado que las células tumorales diferenciadas pueden adquirir propiedades de CMT mediante el proceso de EMT (del inglés Epithelial Mesenchymal Transition)58, y así dar lugar a la necesidad de realizar tratamientos dirigidos tanto contra las CMT, como contra el resto de las células del tumor, para obtener resultados eficaces. La combinación de tratamientos dirigidos a CMT con quimioterapia y/o radioterapia convencional llevarán a la destrucción de ambas poblaciones.
Actualmente hay distintos ensayos clínicos basados en tratamientos dirigidos contra la población CMT, que se resumen en la tabla 1.
Ensayos clínicos dirigidos a células madre tumorales en la actualidad
| ID del ensayo | Título | Estado | Fecha de finalización | IP/promotor | Localidad |
| NCT01190345 | Fase II “Prueba de concepto”. Ensayo de evaluación de la actividad anticélulas madre tumorales de: bevacizumab en combinación con quimioterapia en cáncer de mama | Selección | Mayo de 2018 | Jean-Marc Extra, MD. Institut Paoli-Calmettes | Marseille (Francia) |
| NCT01118975 | Piloto y fase II. Vorinostat y lapatinib en pacientes con enfermedad avanzada en tumores sólidos y en mujeres con recurrencia local-regional o cáncer de mama metastásico para evaluar la respuesta y biomarcadores de EMT en células madre tumorales en cáncer de mama | Selección | Diciembre de 2014 | Saranya Chumsri, MD. University of Maryland | Baltimore (Estados Unidos) |
| NCT00645333 | Ensayo en fase I/II de MK-0752 (inhibidor de la ruta de Notch) seguido de docetaxel en cáncer de mama localmente avanzado o metastásico: Stem Cell Clinical Consortium | En marcha | Marzo de 2012 | Anne Schott, MD. The University of Michigan Comprehensive Cancer Center | Ann Arbor (Estados Unidos) |
| NCT01131234 | Fase I, estudio farmacocinético y farmacodinámico de la combinación de RO4929097 (inhibidor de gamma-secretasa) y cediranib en pacientes con tumores sólidos avanzados | Seleccionando | Julio de 2011 | Sebastien Hotte, MD. Princess Margaret Hospital | Toronto (Canadá) |
| NCT01071564 | Estudio en fase I de dosisaumento del antagonista de Hedgehog Smoothened GDC-0449 (NSC # 747691) más el inhibidor de Notch RO4929097 (NSC # 749225) administrado en pacientes con cáncer de mama avanzado | Suspendido | Septiembre de 2010 | Patricia M. LoRusso, DO. Barbara Ann Karmanos Cancer Institute | Detroit (Estados Unidos) |
Las CMT son la causa del mantenimiento y la expansión de los tumores. La célula de origen que da lugar a las CMT podría ser cualquier célula del linaje celular de la glándula mamaria, siempre y cuando adquiera la capacidad autorrenovadora y diferenciadora que caracteriza a las células madre adultas. La identificación de los mecanismos moleculares que regulan la autorrenovación y la diferenciación de las CMT nos conducirá al diseño de tratamientos dirigidos que puedan eliminar la plasticidad de estas células.
Los autores declaran no tener ningún conflicto de intereses.