El pronóstico de las pacientes con cáncer de mama mestastásico ha mejorado significativamente en los últimos 30 años, gracias a la adición de nuevos tratamientos, especialmente en el subgrupo de pacientes HER2 positivo. Sin embargo, la mayoría de pacientes con cáncer de mama metastásico pertenecen al subgrupo de receptores hormonales positivos, HER2 negativo, por lo que este subgupo supone un desafío oncológico1.
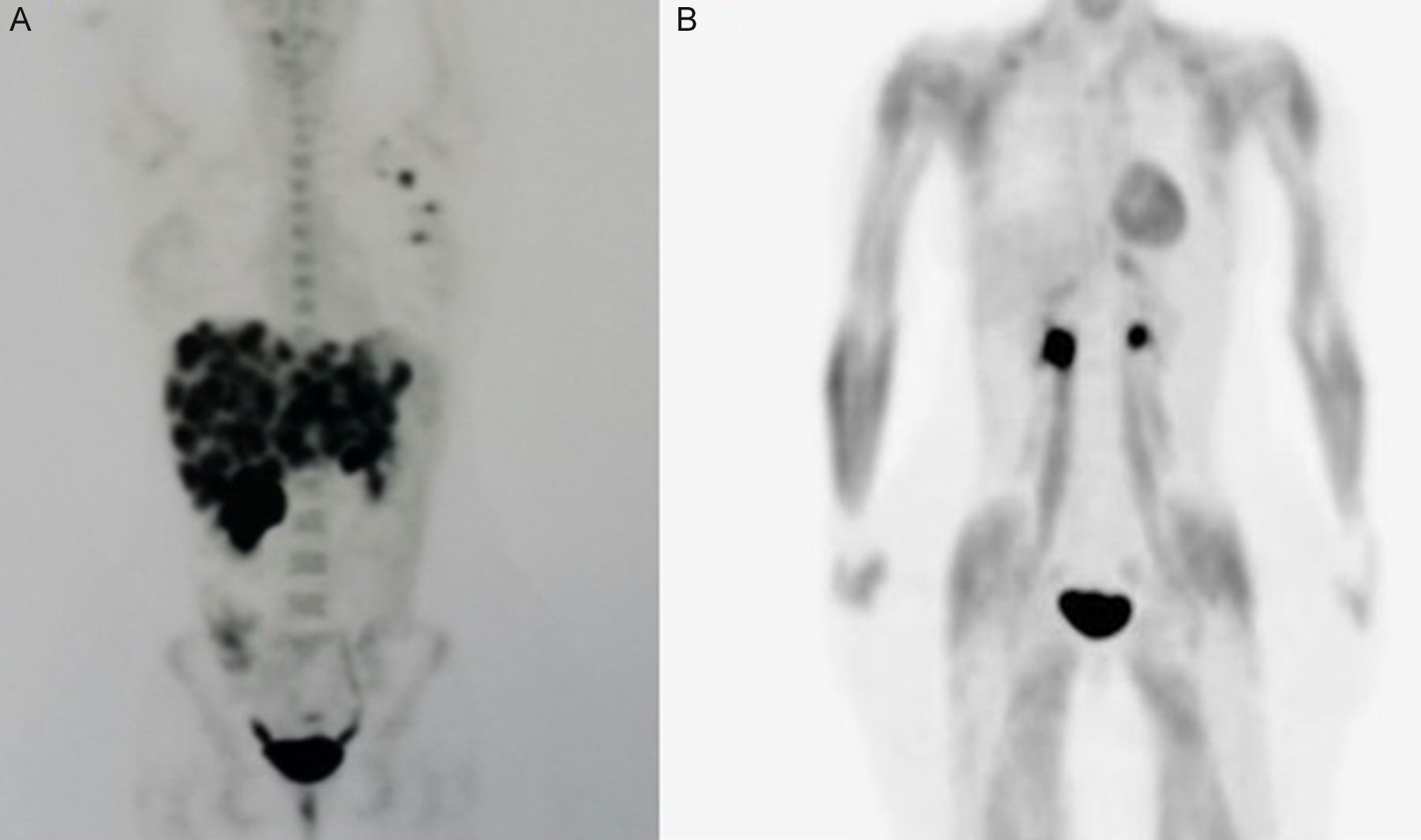
Presentamos el caso de una paciente de 39 años, diagnosticada en mayo de 2013 de un carcinoma tubulolobulillar infiltrante de mama cT1N1M1, con afectación masiva hepática (fig. 1A) receptores hormonales positivos, HER2 negativo. Se propone tratamiento sistémico de primera línea según esquema paclitaxel 90mg/m2, días 1-8-15/21 días+bevacizumab 10mg/kg/15 días. Recibe 3 ciclos de febrero a mayo de 2013 consiguiendo una respuesta clínica, parcial radiológica y negativización del marcador. Como complicaciones a día +10 del 3.er ciclo una insuficiencia cardiaca grado 4 (FEVI Simpson biplano 31%). Se pauta tratamiento con un β-bloqueantes, IECA y diuréticos, presentando mejoría clínica, y a los 3 meses ecocardiograma de control FEVI 63%. Por la toxicidad presentada, se da por finalizada la quimioterapia, en junio de 2013, la paciente sigue tratamiento con tamoxifeno 10mg/día y se somete a una castración física, consiguiendo una mejoría de las lesiones hepáticas metastásicas quedando mínima enfermedad hepática milimétrica y resto tumoral en mama y axila (fig. 1B). En la última revisión en septiembre de 2015 se encuentra asintomática.
A) PET basal: multitud de focos hipermetabólicos hepáticos (SUV 13,1g/ml), foco hipermetabólico en mama izquierda CSI (4,4g/ml), adenopatía hipermetabólica e axila ixquierda (SUV 6,2g/ml), y en región subpectoral izquierda (SUV 2,7gml). B) Último PET: mejoría de las lesiones hepáticas metastásicas, quedando mínima enfermedad hepática milimétrica y resto tumoral en mama axila.
El cáncer de mama metastásico es una enfermedad en la que la mayoría de casos permanecen incurables, siendo los objetivos principales de tratamiento mejorar la supervivencia, paliar síntomas y optimizar la calidad de vida1. Como sabemos por 2 revisiones sistemáticas2,3 se recomienda la hormonoterapia, a menos que la enfermedad represente un riesgo para la vida de la paciente, la quimioterapia por necesidad de una respuesta rápida.
Aún no se ha determinado el tratamiento óptimo de primera línea4, pero según los estudios de Belfiglio et al.5 y Xu et al.6 los taxanos en combinación demostraban ser superiores a los taxanos en monoterapia, en términos de tiempo a la progresión, supervivencia libre de progresión (SLP) y tasa de respuestas (TR), pero sin diferencias en supervivencia global (SG). En cuanto a la forma de administración de los taxanos, según el metaanálisis de Mauri et al.7 cuando se comparaba el régimen de paclitaxel semanal cada 3 semanas, se demostró una mayor SG, así como un menor número de eventos adversos como fiebres neutropénicas y neuropatía periférica con la administración semanal.
Por otro lado, según el metaanalisis de Petrelli y Barni8, Cuppone et al.9 y Valachis et al.10, la adición de bevacizumab a la quimioterapia ha demostrado un aumento de la TR y de SLE, pero no de la duración de respuesta ni de SG, a expensas de mayor tasa de hipertensión arterial. En el ensayo clínico AVF3694g destacar como efectos secundarios de bevacizumab, la ICC sintomática grado 3-4 en el 1,4% de los pacientes.
Desde nuestro punto de vista, el caso presenta un especial interés por la marcada respuesta a la quimioterapia y bevacizumab en primera línea, en una paciente con masiva enfermedad visceral. Tras detener la quimioterapia por la aparición de toxicidad cardíaca por bevacizumab y taxanos inesperada, pero reversible, se ha conseguido ampliar la respuesta con la hormonoterapia. Actualmente destacar que la paciente está viva con mínima enfermedad, y asintomática después de 28 meses del diagnóstico.