INTRODUCCION
El oncogén HER2 fue descrito por primera vez en 1984 en tumores cerebrales inducidos por carcinógeno en ratas. Este oncogén se llamó neu y tenía la característica de presentar una mutación en la zona que correspondía al dominio de transmembrana de la proteína. En 1985 se identificó el mismo gen en células de cáncer humanas. El gen se llamó erbB-2 y pronto se hizo evidente que la alteración genética predominante en tumores humanos era la amplificación del gen (y no mutaciones puntuales). El oncogén HER2 (erbB-2/neu) codifica una proteína de 185 kDa que se localiza en la membrana de las células y que tiene estructura de receptor de factores de crecimiento, presentando un dominio extracelular y un dominio intracelular con actividad tirosina-quinasa. La amplificación de erbB-2 produce una sobreexpresión de la oncoproteína, que pasa de los niveles normales de 30.000 receptores por célula hasta niveles de 1 millón de receptores por célula. La transmisión de señales de la oncoproteína HER2 se produce mediante la formación de dímeros entre HER2 y otros receptores de factores de crecimiento, sobre todo HER31, pero también HER4 y, en menor medida, HER1: los factores de crecimiento, sobre todo la Heregulina y el factor de diferenciación de neu2, al unirse a HER3, inducen la formación de un dímero HER3/HER2, iniciándose la cascada de transmisión de señales al núcleo a partir del dominio tirosina-quinasa1. A continuación, se activan los genes específicos y se estimula la división celular.
El oncogén HER2 se encuentra amplificado (y sobreexpresado a niveles muy altos) en aproximadamente el 20 % de los carcinomas de mama1. También está amplificado en un porcentaje similar de otros adenocarcinomas humanos, como los cánceres de ovario, páncreas, vejiga o pulmón. La amplificación del oncogén HER2 puede analizarse mediante Southern blot o FISH. La sobreexpresión de la oncoproteína HER2 puede determinarse utilizando técnicas de inmunohistoquímica, Western blot o ELISA. Además, el dominio extracelular de HER2 puede hallarse en el suero de los pacientes con metástasis mediante ELISA.
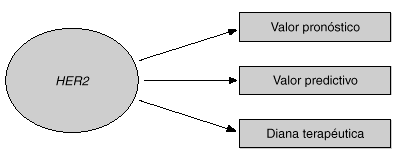
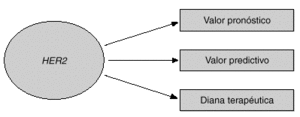
Dos de las aplicaciones clínicas de HER2 son su valor pronóstico y su valor predictivo. En este artículo se revisarán las evidencias de que HER2 puede utilizarse como factor pronóstico y como factor predictivo en cáncer de mama (fig. 1). Una tercera aplicación de HER2 es su papel como diana terapéutica para los nuevos tratamientos que están dirigidos contra la proteína o el propio gen HER21,3. En la última parte del artículo se discutirá el papel de HER2 como diana terapéutica y se mostrará la utilidad del anticuerpo monoclonal dirigido contra HER2 llamado trastuzumab (Herceptin), junto con otros fármacos nuevos para el cáncer de mama.
Fig. 1. Utilidad clínica de HER2.
HER2 COMO FACTOR PRONOSTICO
Un factor pronóstico es aquel que, independientemente del tratamiento que se utilice, indica una evolución clínica mejor o peor. Un ejemplo tradicional de factor pronóstico en cáncer de mama primario es la afectación ganglionar axilar. Tras la operación quirúrgica, las pacientes con afectación ganglionar tienen un pronóstico peor que las pacientes sin afectación ganglionar. La afectación ganglionar tiene valor pronóstico en las pacientes que no reciben tratamiento adyuvante, y sigue teniéndolo en las pacientes que se tratan con quimioterapia u hormonoterapia adyuvantes. En el cáncer metastásico de mama se utilizan diversos indicadores pronósticos, entre ellos el lugar de afectación metastásica inicial (visceral frente a partes blandas) o el número de localizaciones metastásicas.
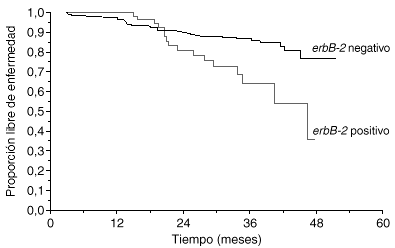
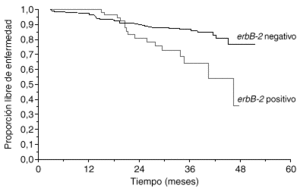
La primera utilidad clínica descrita del oncogén HER2 fue su valor pronóstico. Muy poco tiempo después de la descripción inicial del oncogén, Slamon halló que, en 189 casos de cáncer de mama primario en los que se determinó la amplificación del gen HER2 mediante Southern blot, las pacientes con más de 3 copias del HER2 tenían un tiempo a la recaída y una supervivencia global peores que las pacientes sin amplificación3. En una revisión reciente se han analizado 47 estudios clínicos en los que se evaluó la expresión de HER2 en más de 15.000 pacientes1. En 41 de los estudios se confirmó que HER2 se asociaba a un valor pronóstico adverso. El método de estudio y el año de publicación tuvieron importancia en los resultados. Mientras que los estudios de Southern blot, los más antiguos, hallaron valor pronóstico a HER2 en el 80 % de los casos, los estudios de FISH, más modernos, han hallado una asociación pronóstica en el 100 % de los casos (tabla 1). En una serie propia de 412 pacientes con cáncer de mama en las que HER2 se evaluó con ELISA, observamos también que la sobreexpresión de HER2 tenía valor pronóstico adverso (fig. 2).
Fig. 2. Valor pronóstico de HER2 (serie Hospital Universitario 12 de Octubre).
Los resultados de los diversos estudios no son uniformes debido a que existen variaciones importantes en los métodos de determinación analítica y en los métodos de la evaluación clínica de las pacientes. En la detección de HER2 mediante inmunohistoquímica, la técnica más frecuentemente empleada, se han utilizado multitud de anticuerpos monoclonales de reactividad diversa con HER25, y muestras de tumores de mama con diferentes procedimientos de fijación y conservación. Por otro lado, muchos de los estudios publicados tienen períodos de seguimiento relativamente cortos, o emplean grupos de pacientes en las que el número de eventos es pequeño para hallar diferencias (como en muchos de los estudios en pacientes sin afectación ganglionar).
En la actualidad existe el consenso de que la expresión de HER2 en carcinomas de mama tiene un valor pronóstico adverso, que en general es de menor importancia que el valor pronóstico que confieren indicadores clásicos como el tamaño tumoral o el número de ganglios axilares afectados. Una de los posibles motivos por los que HER2 tiene valor pronóstico es que tenga relación con una resistencia a los tratamientos que se administran. En el siguiente apartado se discutirá el papel de HER2 como factor predictivo.
HER2 COMO FACTOR PREDICTIVO
La predicción de la eficacia de los tratamientos actuales contra el cáncer, como la quimioterapia o la hormonoterapia, es otra de las posibles aplicaciones de HER2. Varios estudios han investigado la relación entre la expresión de HER2 y la respuesta al tratamiento en cáncer de mama. Algunos de estos estudios han evaluado la eficacia del tratamiento adyuvante y otros la eficacia del tratamiento en la enfermedad metastásica. Los estudios adyuvantes emplean, como parámetros de estudio, variables dependientes del tiempo (como la supervivencia libre de enfermedad o la supervivencia global), mientras que los estudios en enfermedad avanzada pueden además evaluar directamente la respuesta clínica objetiva (lo cual también ocurre con los tratamientos preoperatorios, en los que se valora la respuesta en el cáncer primario de mama). En los estudios adyuvantes se puede realizar solamente una estimación indirecta de la relación entre la eficacia del tratamiento y la expresión de HER2, mientras que los estudios en cáncer metastásico permiten estudiar directamente esta asociación y, por tanto, son metodológicamente más apropiados.
Se ha estudiado por separado la relación entre HER2 y la eficacia de los tratamientos de hormonoterapia y de quimioterapia.
HER2 y tratamiento hormonal
Se ha descrito que, en cáncer de mama, existe una regulación cruzada entre los sistemas de crecimiento relacionados con el receptor de estrógeno y HER26. La Heregulina, el factor de crecimiento relacionado con HER2, induce una disminución de los niveles de receptor estrogénico, y modula su actividad en células de cáncer de mama7,8. La transfección del oncogén HER2 en células de cáncer de mama dependientes de estradiol hace que adquieran la independencia hormonal in vitro e in vivo9,10. Por otra parte, el estradiol reduce la expresión de HER2 in vitro, mientras que el tamoxifeno la induce11. Por tanto, parece que los tratamientos dirigidos contra el receptor de estrógeno (como el tamoxifeno) estimularían el sistema de HER2. Los tratamientos contra HER2 (como el anticuerpo monoclonal Herceptin), por su parte, estimulan el sistema de crecimiento relacionado con el receptor de estrógeno.
Algunos estudios han mostrado que la eficacia del tamoxifeno adyuvante en el cáncer de mama operado se ve comprometida en las pacientes con expresión de HER212,13. Otros estudios no han observado esta asociación14, aunque en un contexto metodológico cuestionable.
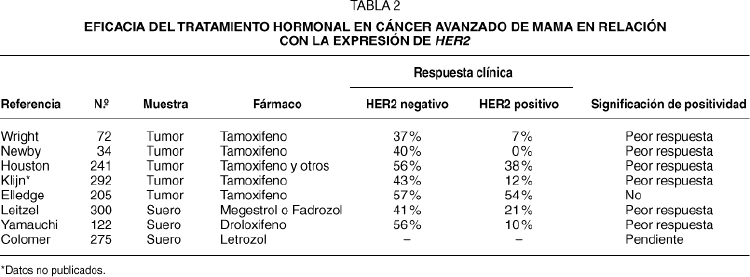
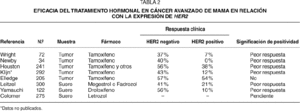
Se han publicado 7 estudios en cáncer avanzado de mama que correlacionan la eficacia del tratamiento hormonal con la expresión de HER2. Cinco de estos estudios han evaluado HER2 mediante inmunohistoquímica en muestras tumorales, y 2 estudios han estudiado los niveles de HER2 en el suero mediante ELISA. En la tabla 2 se muestran de manera resumida15-21. Aunque algunas de estas investigaciones se han realizado en el marco de estudios prospectivos de tratamiento, ninguno de los estudios ha realizado las determinaciones de HER2 de manera prospectiva, y por lo tanto la interpretación está sujeta al influjo de posibles sesgos. Es destacable que todos los estudios clínicos, salvo uno, han mostrado que existe una asociación entre la expresión de HER2 y la eficacia de los tratamientos hormonales. La diferencia entre la respuesta clínica al tamoxifeno es, en general, dramática, y en varios de los estudios clínicos la eficacia de la hormonoterapia en las pacientes con sobreexpresión de HER2 es de la mitad o menos de la mitad que en las pacientes sin sobreexpresión de HER2. Recientemente, un grupo cooperativo español en el que han participado 40 centros, ha finalizado el reclutamiento de más de 275 pacientes en un estudio prospectivo de cohortes que definirá el valor de HER2 en las pacientes tratadas con letrozol.
HER2 y quimioterapia
Los primeros estudios publicados sobre la relación entre HER2 y la resistencia a la quimioterapia se realizaron en muestras de pacientes tratadas de manera adyuvante con quimioterapia tipo CMF13,22-24. Estos estudios demostraron que el CMF es menos eficaz en las pacientes que tienen sobreexpresión de HER2 respecto a las pacientes sin sobreexpresión. Una publicación reciente ha mostrado que la expresión de HER2 indica un peor pronóstico en todas las pacientes, se traten con quimioterapia o no. En este estudio, en el que se aleatorizaron 274 pacientes tras la cirugía a recibir CMF o no, la supervivencia mediana de las pacientes tratadas con CMF fue de 6,1 años en las pacientes HER2 positivo frente a 21,7 años en las HER2 negativo. En el grupo control, la supervivencia mediana fue de 4,4 años en las HER2 positivo y de 7,3 años en las HER2 negativo25. Estas diferencias fueron muy significativas. Otra interpretación de estos mismos datos muestra que el CMF produjo un beneficio terapéutico en todas las pacientes, aunque fue más marcado en las pacientes HER2 negativo. Por tanto, parece que el tratamiento con CMF no debe dejar de emplearse en el contexto del tratamiento adyuvante del cáncer de mama en función de HER2.
Un estudio adyuvante del grupo cooperativo americano CALGB sugirió la posible relación entre la expresión de HER2 y la sensibilidad a la adriamicina26. Esta investigación se realizó en 397 pacientes de las 1.572 que participaron en un estudio que comparaba tres dosis de FAC (estándar, dosis bajas y dosis muy bajas). Los resultados de esta evaluación parcial de los casos sugirieron que en las pacientes HER2 positivo, el tratamiento con dosis muy bajas de FAC era inferior al tratamiento con dosis estándar. Esta diferencia no se observó en los casos HER2 negativo. El mismo grupo de investigación, sin embargo, no ha validado estos resultados en una muestra independiente de 595 pacientes extraídas del mismo estudio clínico, aunque aparentemente esto se debió a un desajuste de factores pronósticos27. La interpretación de los resultados se complica aún más debido a que 1.012 pacientes recibieron tamoxifeno de una manera no reglada. Otro estudio de quimioterapia adyuvante con adriamicina ha sugerido también que puede existir una relación entre la sensibilidad a la adriamicina y la expresión de HER228. Sin embargo, no puede afirmarse con estos datos sobre CMF y CAF, que la expresión de HER2 pueda ni deba ser un factor de selección de los fármacos de quimioterapia en el tratamiento adyuvante del cáncer de mama.
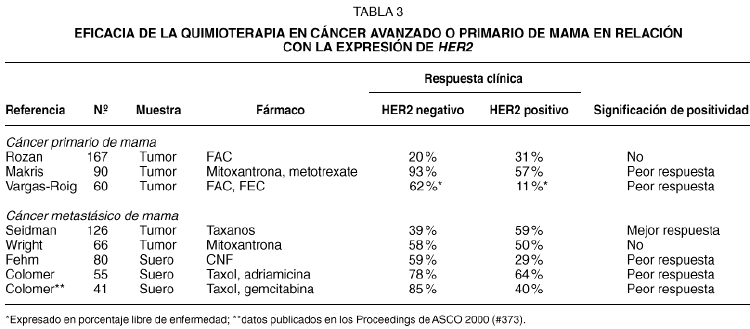
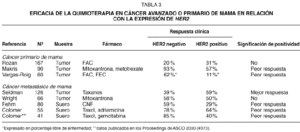
Las investigaciones realizadas en cáncer de mama primario o metastásico sugieren que HER2 puede tener valor predictivo de resistencia a la quimioterapia. En la tabla 3 se resumen los resultados de diversos estudios clínicos29-37. En general, las investigaciones muestran que la expresión de HER2 se asocia con la resistencia al tratamiento de quimioterapia. Solamente un estudio retrospectivo que se realizó en pacientes tratadas con taxanos sugiere lo contrario. La asociación de HER2 con la resistencia a la quimioterapia es especialmente notable en tres estudios que se han realizado en pacientes con cáncer avanzado de mama, en las que se ha evaluado la expresión del dominio extracelular de HER2 (HER2 ECD), y que han mostrado que la eficacia de la quimioterapia puede verse reducida a menos de la mitad en los casos con HER2 ECD positivo. En nuestros ensayos clínicos, la relación entre HER2 ECD y la eficacia del tratamiento era uno de los objetivos de los estudios descritos en el texto original del protocolo, y la extracción de sangre para determinar HER2 ECD se realizó de manera prospectiva. Además de mostrar la reducción significativa en el porcentaje de respuestas objetivas, también hemos observado que, en las pacientes que responden, la duración de la respuesta es significativamente inferior en los casos HER2 positivos (7,5 meses frente a 11 meses, p = 0,03)37.
La especificidad de la relación entre HER2 y la quimiorresistencia, sin embargo, puede no ser una relación causa-efecto. Se ha descrito que la resistencia a la quimioterapia asociada a la sobreexpresión de HER2 es independiente del gen de multirresistencia farmacológica mdr-138. Además, estudios en animales empleando células transfectadas con HER2 han sugerido que la falta de respuesta a la quimioterapia de los tumores HER2 positivo está relacionada con la rápida proliferación de las células tumorales que sobreviven a la quimioterapia, y no con una resistencia intrínseca a la quimioterapia39. Confirmando estas observaciones, una investigación reciente, en la que se midieron los índices apoptóticos en carcinomas de mama primarios antes y 24 horas después de recibir un régimen de quimioterapia con adriamicina, ha demostrado que los tumores HER2 positivo tienen una respuesta apoptótica reducida a la quimioterapia. Por tanto, la expresión de HER2 puede no indicar una resistencia pleiotrópica a la quimioterapia, sino más bien representar una ventaja para el crecimiento celular, al permitir el recrecimiento de las células tumorales tras el tratamiento40.
HER2 COMO DIANA TERAPÉUTICA
De una serie de más de 100 anticuerpos monoclonales que se generaron contra HER2 mediante la inmunización de ratones con células NIH3T3 que expresaban niveles elevados del producto del oncogén HER29, uno de ellos se seleccionó para su caracterización posterior. Este anticuerpo se llamó 4D5, y reaccionaba con el dominio estracelular de la proteína HER2. El anticuerpo 4D5 reconocía específicamente HER2 y no reaccionaba de manera cruzada con el receptor de EGF o con otras proteínas.
El anticuerpo de origen murino 4D5 producía una inhibición del crecimiento de tipo citostático en las células SK-BR-3 y otras células de adenocarcinoma humano que sobreexpresaban HER242. Resultados parecidos se vieron en ensayos a agar43. El anticuerpo 4D5 sensibilizó a células de cáncer de mama con sobreexpresión de HER2 a los efectos citotóxicos del TNF-a42. La combinación del agente quimioterápico cisplatino con 4D544,45, así como la combinación del antiestrógeno tamoxifeno con 4D546 resultaron en una potenciación del efecto inhibidor del crecimiento del 4D5 en células de cáncer de mama.
En estudios preclínicos, el anticuerpo 4D5 inhibió el crecimiento de células de cáncer de mama con sobreexpresión de HER2 en ratones desnudos45. Se observó un aumento sinérgico en su eficacia cuando el 4D5 se administraba conjuntamente con cisplatino45, lo cual era consistente con los estudios in vitro. En otro estudio, el anticuerpo 4D5 inhibió el crecimiento de células de cáncer gástrico que sobreexpresaban HER2 implantadas en ratones SCID. El anticuerpo 4D5 también inhibió la aparición de metástasis pulmonares y aumentó la supervivencia en estos ratones SCID47.
Mecanismo de acción del anticuerpo 4D5
El anticuerpo 4D5 regula negativamente los niveles de la proteína HER242 y también inhibe el crecimiento de las células de cáncer de mama que sobreexpresan HER2. Además de estos efectos antagonistas, el 4D5 tiene también algunos efectos agonistas48,49. El tratamiento de células con el anticuerpo resulta en la internalización de HER2 y del anticuerpo y la estimulación de la fosforilación de HER248. También se fosforila en tirosina una proteína de 56 kDa49. La exposición a corto plazo a 4D5 produce muchos efectos celulares, entre los que se encuentran la estimulación de la hidrólisis de los lípidos inositol como se demuestra por los niveles intracelulares aumentados de polifosfatos inositol (InsP) y diacilglicerol48. También ocurren el aumento de actividad de fosfatidil inositol 4-quinasa y de inositol 1,4,5-trifosfato 3'-quinasa49. También se han observado la inducción del RNAm de c-fos49, y de RAR-a50. La exposición más larga al anticuerpo produce una disminución de la fosforilación de HER251 y la regulación negativa de la señalización de HER248, así como una inducción de la transcripción de las moléculas de adhesión cadherina-E y la subunidad B2 de la integrina, bloqueando además la interacción de HER2 con la proteína GRB2/Sem552. El tratamiento de células con sobreexpresión de HER2 con 4D5 resulta en una reducción dosis-dependiente de la producción de la proteína VEGF53, lo cual sugiere que el 4D5 puede inhibir la angiogénesis.
Humanización del anticuerpo murino 4D5
Al inhibir el anticuerpo 4D5 específicamente el crecimiento de las líneas tumorales que sobreexpresaban HER2 in vitro e in vivo en ratones desnudos, se pensó que el 4D5 era potencialmente útil para ser empleado en la clínica en carcinomas que tuvieran sobreexpresión de HER2.
Un problema importante para el uso clínico de los anticuerpos monoclonales murinos es la respuesta inmunitaria que produce anticuerpos humanos anti-ratón. Para disminuir la respuesta inmune humana a los anticuerpos de ratón, y para potenciar la actividad citotóxica mediada por el anticuerpo, una posible solución es construir anticuerpos quiméricos mediante el acoplamiento de los dominios variables murinos de unión al antígeno (V) a los dominios humanos constantes (C)23-25. Los isotipos de los dominios humanos C pueden variarse para dirigir al anticuerpo quimérico en la actividad citotóxica mediada por el anticuerpo (ADCC) y la citotoxicidad dependiente del complemento (CDC). Sin embargo, un 30 % de las moléculas quiméricas siguen siendo secuencias murinas, por lo que en la actualidad, la humanización de los anticuerpos monoclonales murinos, con la retención de la mayor parte de su actividad de unión al antígeno es un procedimiento de rutina26. Los anticuerpos monoclonales murinos recombinantes humanizados se construyen habitualmente mediante el trasplante de la región determinante complementaria (CDR), la cual comprende las partes hipervariables implicadas en la unión al antígeno, del anticuerpo murino a los dominios humanos V47,48,50.
El anticuerpo humanizado anti-HER2, rhuMAb HER2 (Herceptin) tiene una afinidad mayor por el dominio extracelular de HER2 que el anticuerpo murino original 4D5 (Kd = 0,1 nM), y es más potente que el 4D5 en el bloqueo de la proliferación de células de cáncer de mama con sobreexpresión de HER254-55. Tanto el anticuerpo quimérico 4D5 como el 4D5 "humanizado", en combinación con células mononucleares humanas, han mostrado respuestas citotóxicas dependientes de anticuerpo (ADCC), que siguen a los niveles de expresión de HER243.
Estudios preclínicos con 4D5 humanizado
Una manera para optimizar la eficacia de los anticuerpos anti-HER2 es administrándolos en combinación con citoquinas, radioterapia, quimioterapia o tratamientos hormonales. Estudios con citoquinas como el interferón alfa, interferón gamma y TNF-a han demostrado un aumento de los efectos inhibidores del crecimiento de los anticuerpos anti-HER256. Un estudio reciente ha empleado la combinación del anticuerpo anti-HER2 con un inhibidor de la proteasa lisosómica y ha mostrado una inhibición del crecimiento mayor que el anticuerpo solo en la línea celular SK-Br-3, que sobreexpresa HER2, pero no en la línea MCF-7, que expresa niveles bajos de HER256. Otros estudios con rhuMAb HER2 han mostrado un aumento en la actividad anti-tumoral del cisplatino en xenotrasplantes de cáncer humano57. El paclitaxel y la adriamicina son dos de los agentes quimioterápicos más activos para el tratamiento del cáncer de mama. El rhuMAb HER2 aumenta los efectos citotóxicos del paclitaxel de una manera dosis-dependiente en cultivos de células de cáncer que sobreexpresan HER2, y en xenotrasplantes de cáncer de mama en ratones desnudos. El rhuMAb HER2 también aumenta, aunque en un grado menor, la actividad antitumoral in vivo de la adriamicina58.
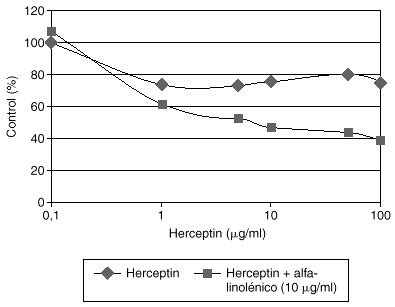
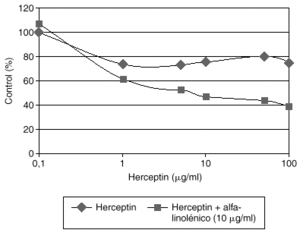
El Herceptin normalmente no aumenta su eficacia en modelos celulares al incrementar su concentración en el medio de cultivo por encima de 10 mg/ml. Estudios preliminares de nuestro laboratorio demuestran que la adición de algunos ácidos grasos como el alfa-linolénico al medio de cultivo produce una potenciación de la eficacia del Herceptin, que es dependiente de la dosis de Herceptin (fig. 3). La asociación de Herceptin y ácido alfa-linolénico posiblemente afecta a los mecanismos fisiológicos de internalización del complejo anticuerpo-HER2, y merecerá un desarrollo más amplio en el futuro.
Fig. 3. Potenciación del efecto inhibidor del crecimiento del Herceptin por el ácido alfa-linolénico en células de cáncer de mama con sobreexpresión de HER2.
Herceptin. Estudios clínicos
El Herceptin (Trastuzumab) fue aprobado por la FDA norteamericana en septiembre de 1998. Es un anticuerpo monoclonal humanizado, dirigido contra el dominio extracelular de la oncoproteína HER2 (HER2). El Trastuzumab es una IgG1, que contiene las regiones de determinación antigénica del anticuerpo murino 4D5, que son las que se unen a HER2, y el resto es componente humano.
El Herceptin está indicado para su uso como agente único en el tratamiento de pacientes con cáncer de mama metastásico cuyos tumores sobreexpresan la proteína HER2, y que han recibido uno o más regímenes de quimioterapia para la enfermedad avanzada. El Herceptin también se aprobó, en combinación con taxol, para el tratamiento de pacientes con cáncer metastásico de mama cuyos tumores sobreexpresan la proteína HER2 y que no han recibido quimioterapia para la enfermedad avanzada.
El Herceptin ejerce su acción antineoplásica mediante una citotoxicidad celular dependiente del anticuerpo (ADCC), que se ejerce con preferencia en las células que sobreexpresan HER2. Además, tiene un efecto citostático directo, que ocurre en las células que sobreexpresan HER2.
Herceptin como tratamiento de segunda línea
El Herceptin es un tratamiento útil en el cáncer avanzado de mama que sobreexpresa HER2. Un estudio clínico multicéntrico en 222 pacientes que habían recibido uno o dos regímenes previos, ha demostrado que la respuesta objetiva, evaluada por observadores independientes, fue del 15 %62. La duración de las respuestas fue de 8 meses. Solamente 2 pacientes abandonaron el tratamiento debido a efectos secundarios. Se detectó una reducción asintomática de la fracción de eyección en 6 pacientes, y sintomática en tres.
Herceptin como tratamiento de primera línea
Se ha realizado un ensayo clínico de Herceptin en primera línea de cáncer metastásico de mama. En este estudio multicéntrico de fase II se trataron 114 pacientes con cáncer de mama avanzado y sobreexpresión de HER2. La mayoría de las pacientes habían recibido quimioterapia adyuvante y tenían enfermedad visceral63.
Las pacientes se randomizaron a recibir bien la dosis estándar de Herceptin (2 mg/kg/semana, precedido de una dosis de 4 mg/kg), o bien una dosis mayor (4 mg/ kg/semana, precedido de una dosis de 8 mg/kg). El tratamiento con las dosis más altas se asoció a una mayor incidencia de efectos secundarios, aunque la mayoría fueron leves. Dos pacientes desarrollaron cardiotoxicidad. La incidencia de leucopenia, trombopenia o estomatitis fue menor del 1 %. El índice de respuestas con Herceptin en primera línea fue de 26 %, y un 10 % adicional de pacientes presentó una estabilización de más de 6 meses. No hubo diferencias de eficacia entre la dos dosis de Herceptin.
Este estudio ha demostrado que que el Herceptin en primera línea de tratamiento tiene una eficacia mayor que en segunda línea, y que la toxicidad es leve y manejable.
Herceptin en combinación con quimioterapia
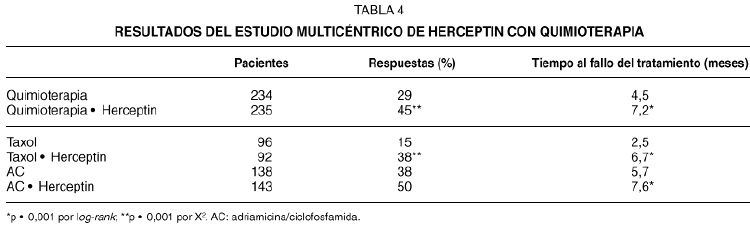
Un estudio multicéntrico randomizado65 evaluó Herceptin en combinación con quimioterapia en el tratamiento de primera línea del cáncer metastásico de mama. Las pacientes recibieron adriamicina (o epirrubicina) más ciclofosfamida (AC) si no habían recibido previamente antraciclinas en el tratamiento postoperatorio (aproximadamente el 60 % de las pacientes), o bien taxol (175 mg/m2). Las pacientes se randomizaron a recibir Herceptin (2 mg/kg/semana, precedido por una dosis de 4 mg/kg), o no tratamiento con Herceptin. Un comité independiente evaluó la eficacia del tratamiento. Se observaron unos índices de respuesta más altos con la combinación de Herceptin y quimioterapia (tabla 4). La diferencia en la eficacia con la combinación fue más marcada en el caso del taxol. El uso de Herceptin más taxol produjo un índice de respuestas del 38 %, frente al 15 % obtenido con taxol solo, mientras que la combinación de Herceptin más AC produjo un 50 % de respuestas, frente al 38 % de AC solo. Estos hallazgos sugieren una interacción entre el Herceptin y la quimioterapia, especialmente el taxol. El tiempo al fallo del tratamiento fue más largo en las pacientes tratadas com Herceptin más quimioterapia que con quimioterapia sola. Se observó un aumento en la toxicidad cardíaca en las pacientes que se trataron con Herceptin más AC, como se mostrará más adelante.
Por tanto, la administración simultánea de Herceptin más quimioterapia es más activa que la quimioterapia sola en el cáncer de mama avanzado.
Predictores de respuesta
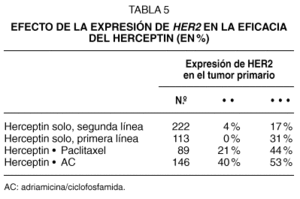
El índice de respuestas al Herceptin fue mayor en las pacientes con expresión 3 + , que eran aproximadamente el 75 % de los casos, que en las 2 + . En los ensayos de Herceptin como agente único en primera y segunda línea, la eficacia fue del 31 % y del 17 % en las pacientes 3 + , mientras que fue del 0 % y del 4 % en las pacientes 2 + , respectivamente. Esto indica que una selección más restrictiva de los casos puede optimizar la eficacia del Herceptin (tabla 5).
Toxicidad
Los efectos secundarios más frecuentes del Herceptin son las reacciones en la infusión, que consisten en fiebre y escalofríos y ocurren en el 30 % de las pacientes, sobre todo en el primer ciclo. Estas reacciones son generalmente leves o moderadas y se tratan con paracetamol o difenhidramina. El 25 % de las pacientes tratadas con Herceptin como agente único tuvieron diarrea. La toxicidad hematológica es rara (1 %). El uso de Herceptin solo no ha producido toxicidades grado 4.
La incidencia de disfunción cardíaca en pacientes tratadas con Herceptin como agente único fue del 4,7 %. La mayoría de estas pacientes tenían factores de riesgo, como tratamiento previo con antraciclinas o irradiación de la pared torácica. Cuando el Herceptin se administró con antraciclinas, la incidencia de cardiotoxicidad fue del 27 %.
Recientemente, se ha presentado una evaluación de la toxicidad cardíaca del Herceptin67, realizado por un Comité de Evaluación y Revisión Cardíaca (CREC). En total, se analizaron 1.024 pacientes que recibieron Herceptin en distintos ensayos. Se observó algún grado de disfunción cardíaca en 97 pacientes (9,5 %). La disfunción cardíaca fue más frecuente cuando se combinó Herceptin con quimioterapia. La asociación de Herceptin con AC fue especialmente cardiotóxica, y fue también más cardiotóxica que AC solo. La mayoría de pacientes respondieron al tratamiento médico estándar.
Se realizó un análisis multivariante para identificar los factores de riesgo de desarrollar cardiotoxicidad. Los factores de riesgo que se identificaron fueron edad mayor de 60 años, y uso concomitante de quimioterapia con antraciclinas. Ni el tratamiento previo con antraciclinas ni la dosis acumulada de antraciclinas previas fueron factores de riesgo independientes.
En las pacientes que recibieron Herceptin como agente único, la incidencia de disfunción cardíaca evaluada por el CREC fue del 4 %. La toxicidad cardíaca de Herceptin en las pacientes del estudio de primera línea, sin embargo, fue de menos del 2 %, lo cual puede reflejar una exposición menor a antraciclinas previas.
CONCLUSION
La expresión del oncogén HER2 en cáncer de mama operado se asocia con un peor pronóstico de las pacientes. Esto se debe en parte a que las pacientes que sobreexpresan HER2 tienen una resistencia a los tratamientos hormonales y quizá también a la quimioterapia. Aunque en este momento no se pueden efectuar recomendaciones terapéuticas definitivas basadas en los datos de los que se disponen, sí debe recomendarse la participación de las pacientes con sobreexpresión de HER2 en ensayos clínicos que investiguen el uso de los tratamientos estándar con o sin la adición de tratamientos adyuvantes dirigidos contra HER2, como el anticuerpo monoclonal Herceptin.
El Herceptin es un tratamiento nuevo y extremadamente prometedor para el tratamiento del cáncer metastásico de mama, solo o en combinación con quimioterapia, que pronto se estudiará además en el tratamiento adyuvante del cáncer de mama operado y en combinación con otros tratamientos en el cáncer metastásico de mama, como fármacos de tipo hormonal. Es el primer tratamiento contra en cáncer de mama que llega a la clínica desde el laboratorio, en un plazo de tiempo relativamente breve, y supone la primera demostración de que la inversión en biología molecular y ciencias básicas que se realizaron en los años ochenta ha valido la pena.