El método One step nucleic acid amplification (OSNA) se ha incorporado para el estudio del ganglio centinela (GC) en cáncer de mama como alternativa al estudio convencional histológico (MC).
El propósito de nuestro estudio fue comparar la estadificación por ganglio centinela (EGC) obtenida por el método OSNA con la obtenida mediante MC.
Material y métodosSe seleccionaron pacientes con cáncer de mama y EGC recogidas durante los años 2009-2010 y 2012-2013, estudiadas con MC y método OSNA. Se analizaron diferentes parámetros clínico-patológicos.
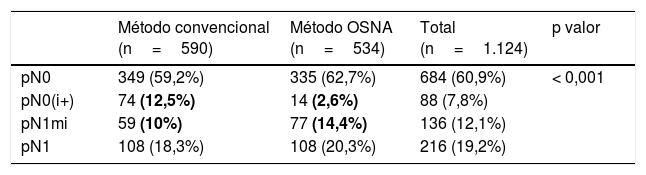
ResultadosSe incluyó a 1.124 pacientes, 590 estudiadas por MC y 534 por método OSNA. La EGC inicial fue: pN0: MC 349 (59,2%) y OSNA 335 (62,7%); pN0(i+): MC 74 (12,5%) y OSNA 14 (2,6%); pN1mi: MC 59 (10%) y OSNA 77 (14,4%); pN1: MC 108 (18,3%) y OSNA 108 (20,3%). Se encontraron diferencias estadísticamente significativas entre la EGC por método OSNA y MC (p<0,001), a expensas de las tasas de pN1mi y pN0(i+).
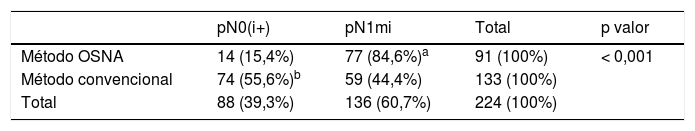
Se seleccionó a 224 pacientes con EGC pN1mi y pN0(i+) para determinar si las diferencias encontradas podrían atribuirse a distintas características clínico-patológicas. El método OSNA detecta el doble de micrometástasis (84,6%).
ConclusionesEn nuestra casuística, por el método OSNA se observa un incremento significativo de pN1mi (84,6% vs. 44,4%) y una disminución de pN0(i+) respecto al estudio convencional, diferencias que no están condicionadas por los parámetros clínico-patológicos. El 75% de casos con pN1mi por OSNA muestra un número de copias inferior a 1.000.
The “One Step Nucleic Acid Amplification” (OSNA) method has been incorporated in the study of the sentinel lymph node (SLN) in breast cancer as an alternative to conventional histological study.
The aim of our study was to compare sentinel lymph node staging (SLNS) obtained by the OSNA method with that obtained by the conventional method (CM).
Material and methodsWe identified patients with breast cancer and SLN study during the periods 2009-2010 and 2012-2013, who underwent the CM and by OSNA. We analysed different clinicopathological parameters.
ResultsA total of 1124 patients were studied, 590 by CM and 534 by OSNA. SLNS was: pN0: CM 349 (59.2%) and OSNA 335 (62.7%); pN0(i+): CM 74 (12.5%) and OSNA 14 (2.6%); pN1mi: CM 59 (10%) and OSNA 77 (14.4%); pN1: CM 108 (18.3%) and OSNA 108 (20.3%). Statistically significant differences were found between the SLNS by OSNA and CM (p <0.001), due to the rates of pN1mi and pN0(i+).
To determine whether this statistical significance could be attributed to different clinicopathological features, 224 patients were selected from the initial series with SLN pN1mi and pN0(i+). In this subgroup, the OSNA method detected twice as many micrometastases (pN1mi) (84.6%).
ConclusionsIn our series, the OSNA method resulted in a significant increase in pN1mi (84.6% vs 44.4%) and a decrease in pN0(i+) compared with the conventional method. Those differences were not affected by clinicopathological parameters. Most cases (75%) with pN1mi by OSNA showed less than 1000 copies.
El estado del ganglio centinela es el factor pronóstico más importante en las pacientes con cáncer de mama en estadios iniciales (axila clínicamente negativa)1,2 y su estudio conlleva además una disminución de la morbilidad asociada a la linfadenectomía axilar3,4.
Las técnicas convencionales de estudio del ganglio centinela (citología, hematoxilina-eosina [H&E] e inmunohistoquímica) tienen limitaciones en la medición del volumen metastásico total puesto que no evalúan la totalidad del ganglio5. El estudio intraoperatorio convencional del ganglio centinela puede tener falsos negativos con respecto al estudio histológico definitivo6,7.
Recientemente, se ha incorporado la utilización de técnicas de biología molecular para la detección de metástasis del ganglio centinela en cáncer de mama, utilizando citoqueratina 19 como marcador. El método One step nucleic acid amplification (OSNA) detecta y amplifica mediante la reacción en cadena de la polimerasa la presencia de ARNm de citoqueratina 19 en todo el ganglio. Este método ha sido validado y estandarizado en diversos estudios8-10. El OSNA tiene numerosas ventajas: es un método rápido, semiautomatizado y estandarizado, que evalúa todo el ganglio y permite cuantificar el número de copias de ARNm11. El estudio intraoperatorio mediante OSNA permite realizar la linfadenectomía si fuera precisa en el mismo acto quirúrgico, lo cual evita una segunda cirugía y permite iniciar antes el tratamiento adyuvante12. Además, permite analizar más de un ganglio a la vez13 y reduce la carga laboral del patólogo7.
Actualmente, se considera que el método OSNA es una técnica con elevada sensibilidad, especificidad y reproducibilidad, que permite la estandarización del proceso diagnóstico del ganglio centinela, por lo que se considera la técnica de elección en dicho estudio14.
Pero se debe tener en cuenta que hay tumores de mama que no expresan citoqueratina 19 o son heterogéneos; en estos casos, algunos autores recomiendan estudio del ganglio centinela mediante métodos convencionales13.
Desde 2011 en nuestro centro utilizamos el método OSNA en el estudio del ganglio centinela, ya sea de forma intraoperatoria o en diferido, excepto en los tumores CK19 negativos o heterogéneos, considerándose como expresión heterogénea a aquellos tumores cuya expresión de CK19 es menor del 100% y especificándose el porcentaje de positividad.
El propósito de nuestro estudio es comparar la estadificación del ganglio centinela (EGC) obtenido por el método OSNA con el obtenido mediante el método convencional (MC) (citología, H&E e inmunohistoquímica), así como la evaluación de la carga tumoral (número de copias de ARNm de citoqueratina 19) de los ganglios centinela metastásicos.
Material y métodosPacientesSe estudió a pacientes con cáncer de mama tratadas en el Hospital de Bellvitge, recogidas entre los años 2009-2010 y 2012-2013, con estudio de ganglio centinela axilar. Se distribuyeron en 2 cohortes históricas según el método empleado para el estudio de ganglio centinela. Por un lado, pacientes con estudio por MC (citología, H&E e inmunohistoquímica) y, por otro lado, con estudio mediante método OSNA.
Los distintos parámetros clínico-patológicos analizados en los subgrupos pN1mi y pN0(i+) fueron: tipo de cirugía (mastectomía, tumorectomía, otros), subtipo histológico (ductal, lobulillar, mucinoso, papilar, metaplásico, intraductal, otros), grado histológico (grado 1, 2 y 3), invasión vascular, receptores de estrógeno y receptores de progesterona, índice de proliferación Ki67, estado de HER2, estadio pT, estado del estudio genético, estado menopáusico (premenopáusica, perimenopáusica, posmenopáusica) y tratamientos complementarios (no tratamiento, quimioterapia, hormonoterapia, quimioterapia+hormonoterapia).
Los receptores de estrógenos y progesterona se consideraron positivos si la expresión inmunohistoquímica era en ≥ 10% de las células tumorales y negativos si era menor del 10%. HER2 se consideró positivo en los casos con expresión inmunohistoquímica 3+ o en los casos con expresión inmunohistoquímica 2+ y amplificación del oncogén por hibridación fluorescente in situ15. En otro orden, el punto de corte del índice de proliferación de Ki67 se estableció en<20% o ≥ 20%.
Estudio de ganglio centinela por método One step nucleic acid amplificationEn todos los casos se había evaluado inmunohistoquímicamente en la core biopsia la positividad para CK19 en el 100% de células neoplásicas. Se disecó el tejido adiposo periganglionar y se incluyó en su totalidad en parafina para estudio histológico. Los ganglios centinela fueron pesados y procesados en su totalidad mediante método OSNA. Dicho método consiste en la detección de mRNA de la CK19, mediante la tecnología RT-LAMP y la amplificación isotérmica. Las muestras se homogeneizaron usando un tampón de lisis LYNORHAG y se introdujeron en el sistema automatizado de detección en tiempo real RD-100i (Sysmex Corp., Hyogo, Japón). El número de copias de ARNm de CK19 se estimó a partir del tiempo en que la curva de amplificación de la muestra exhibe un crecimiento exponencial y se calcula a partir de una recta patrón.
Los resultados se visualizan en 4 categorías diferentes: macrometástasis (> 5.000 copias de ARNm de CK19) (++), micrometástasis (250-5.000 copias) (+), células aisladas (100-250 copias) y negativo (< 99 copias) (–), según las recomendaciones del fabricante8.
Para estudios comparativos, todas las pacientes fueron clasificadas según sus respectivas estadificaciones axilares, según la clasificación TNM16.
Estudio de ganglio centinela por método convencionalPara la evaluación intraoperatoria del ganglio centinela por MC, se separó el tejido adiposo y en un primer tiempo los ganglios fueron seccionados de manera seriada a lo largo de su eje menor a intervalos de 1-2mm. Se realizaron 2 improntas citológicas, quedando representadas las dos caras de cada sección ganglionar. Las primeras improntas se secaron al aire y se tiñeron con tinción de Diff Quick. Las segundas improntas se fijaron inmediatamente 3 min en etanol al 95% y fueron teñidas con H&E. Las improntas fueron revisadas por un patólogo especialista en patología mamaria, un citotécnico certificado o un citopatólogo, en los casos dificultosos. Las categorías diagnósticas incluían si el ganglio centinela fue positivo o negativo, o bien si había presencia de celularidad atípica. El resultado del estudio peroperatorio se notificó con celeridad al equipo quirúrgico.
Después de concluir el diagnóstico peroperatorio, el ganglio centinela y el tejido adiposo residual fueron fijados con formol al 10%, procesados de forma habitual y finalmente incluidos en parafina en su totalidad. Se aplicó el protocolo de ganglio centinela vigente en aquel periodo (3 cortes teñidos con H&E cortados a intervalos de 150μm, intercalados con 3 cortes teñidos con técnicas de inmunohistoquímica para citoqueratina AE1/AE3 [DAKO IR053/IS053]).
Después del análisis histológico se reportó el tamaño de la metástasis en su diámetro mayor y la estadificación pN según la clasificación TNM16. Según dicha clasificación, una medida de metástasis<0,2mm o<200 células aisladas en secciones histológicas se corresponde con la categoría de células tumorales aisladas (pN0[i+]), si 0,2-2mm o>200 células con micrometástasis (pN1mi) y macrometástasis (pN1) si la metástasis es>2mm.
Análisis estadísticoEl cálculo del tamaño muestral correspondió a todas las pacientes tratadas en el Hospital Universitari de Bellvitge entre los años 2009-2010 y 2012-2013.
La descripción de las variables categóricas o dicotómicas se realizó con el cálculo de las frecuencias absolutas y relativas. Las variables continuas se describieron mediante el cálculo de un valor central, media o mediana, y el rango de valores o intervalo de confianza del 95% correspondiente. Para las comparaciones entre las variables cualitativas utilizamos la prueba de la chi al cuadrado y para las comparaciones de variables continuas, el test t de Student. Todas las comparaciones entre grupos se realizaron mediante test a 2 colas y con nivel de significación del 5% (valor de p<0,05). Todo el análisis estadístico se realizó con el programa SPSS.
ResultadosPrimer análisis estadísticoA partir de las 1.124 pacientes iniciales se realizó un análisis descriptivo de los diferentes estadios pN (pN0, pN0[i+], pN1mi, pN1a) comparando la cohorte OSNA (534 pacientes) con la cohorte convencional (590 pacientes).
Los resultados se recogen en la tabla 1. Se encontraron diferencias estadísticamente significativas (p<0,001) entre la EGC por método OSNA y MC, a expensas de las tasas de los subgrupos pN1mi y pN0(i+).
Análisis descriptivo inicial por métodos
| Método convencional (n=590) | Método OSNA (n=534) | Total (n=1.124) | p valor | |
|---|---|---|---|---|
| pN0 | 349 (59,2%) | 335 (62,7%) | 684 (60,9%) | < 0,001 |
| pN0(i+) | 74 (12,5%) | 14 (2,6%) | 88 (7,8%) | |
| pN1mi | 59 (10%) | 77 (14,4%) | 136 (12,1%) | |
| pN1 | 108 (18,3%) | 108 (20,3%) | 216 (19,2%) |
Diferencias en la EGC según el método, a expensas de las tasas de pN1mi y pN0(i+).
Los valores resaltados en negrita ponen de manifiesto las diferencias entre ambos métodos, a expensas de los resultados del análisis estadístico en los subgrupos pN0(i+) y pN1mi.
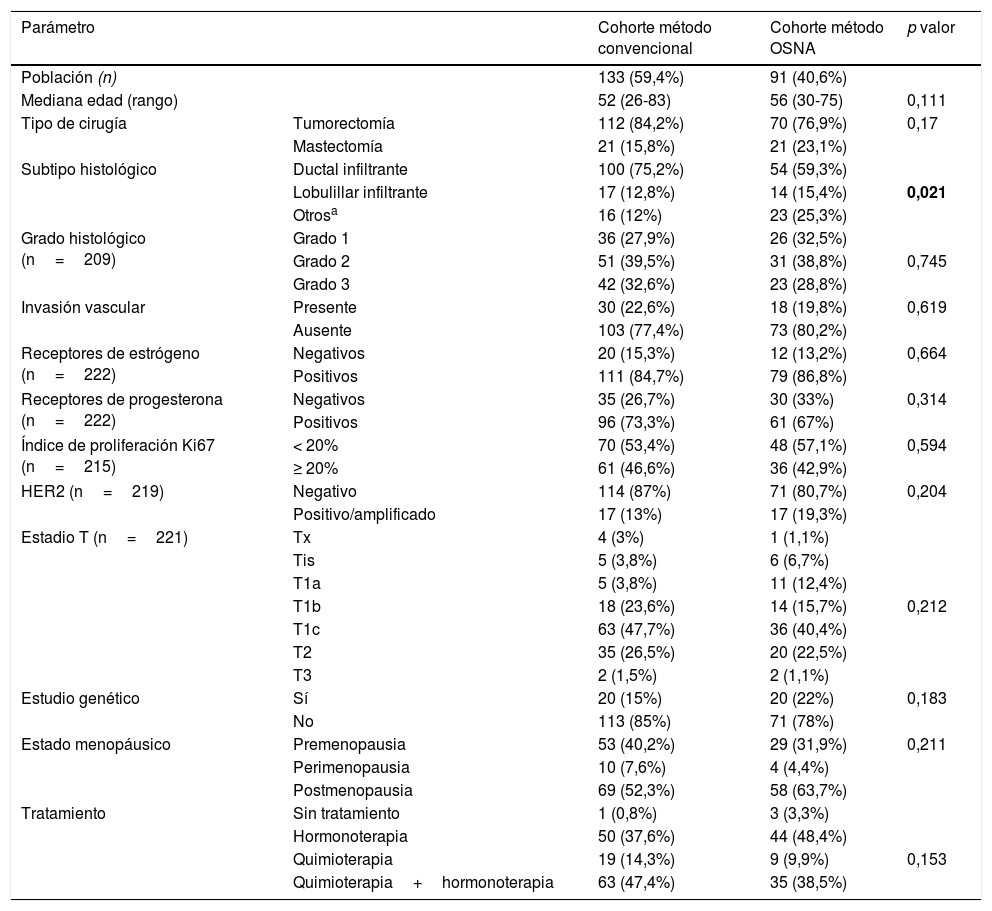
Para determinar si esta significación estadística podría atribuirse a las distintas características clínico-patológicas, se seleccionó, a partir de la serie inicial, a las 224 pacientes con EGC pN1mi y pN0(i+), 133 estudiadas por MC y 91 por OSNA. En dichos subgrupos se analizaron los parámetros clínico-patológicos, recogidos en la tabla 2.
Parámetros clínico-patológicos analizados en los subgrupos pN1mi y pN0(i+)
| Parámetro | Cohorte método convencional | Cohorte método OSNA | p valor | |
|---|---|---|---|---|
| Población (n) | 133 (59,4%) | 91 (40,6%) | ||
| Mediana edad (rango) | 52 (26-83) | 56 (30-75) | 0,111 | |
| Tipo de cirugía | Tumorectomía | 112 (84,2%) | 70 (76,9%) | 0,17 |
| Mastectomía | 21 (15,8%) | 21 (23,1%) | ||
| Subtipo histológico | Ductal infiltrante | 100 (75,2%) | 54 (59,3%) | |
| Lobulillar infiltrante | 17 (12,8%) | 14 (15,4%) | 0,021 | |
| Otrosa | 16 (12%) | 23 (25,3%) | ||
| Grado histológico (n=209) | Grado 1 | 36 (27,9%) | 26 (32,5%) | |
| Grado 2 | 51 (39,5%) | 31 (38,8%) | 0,745 | |
| Grado 3 | 42 (32,6%) | 23 (28,8%) | ||
| Invasión vascular | Presente | 30 (22,6%) | 18 (19,8%) | 0,619 |
| Ausente | 103 (77,4%) | 73 (80,2%) | ||
| Receptores de estrógeno (n=222) | Negativos | 20 (15,3%) | 12 (13,2%) | 0,664 |
| Positivos | 111 (84,7%) | 79 (86,8%) | ||
| Receptores de progesterona (n=222) | Negativos | 35 (26,7%) | 30 (33%) | 0,314 |
| Positivos | 96 (73,3%) | 61 (67%) | ||
| Índice de proliferación Ki67 (n=215) | < 20% | 70 (53,4%) | 48 (57,1%) | 0,594 |
| ≥ 20% | 61 (46,6%) | 36 (42,9%) | ||
| HER2 (n=219) | Negativo | 114 (87%) | 71 (80,7%) | 0,204 |
| Positivo/amplificado | 17 (13%) | 17 (19,3%) | ||
| Estadio T (n=221) | Tx | 4 (3%) | 1 (1,1%) | |
| Tis | 5 (3,8%) | 6 (6,7%) | ||
| T1a | 5 (3,8%) | 11 (12,4%) | ||
| T1b | 18 (23,6%) | 14 (15,7%) | 0,212 | |
| T1c | 63 (47,7%) | 36 (40,4%) | ||
| T2 | 35 (26,5%) | 20 (22,5%) | ||
| T3 | 2 (1,5%) | 2 (1,1%) | ||
| Estudio genético | Sí | 20 (15%) | 20 (22%) | 0,183 |
| No | 113 (85%) | 71 (78%) | ||
| Estado menopáusico | Premenopausia | 53 (40,2%) | 29 (31,9%) | 0,211 |
| Perimenopausia | 10 (7,6%) | 4 (4,4%) | ||
| Postmenopausia | 69 (52,3%) | 58 (63,7%) | ||
| Tratamiento | Sin tratamiento | 1 (0,8%) | 3 (3,3%) | |
| Hormonoterapia | 50 (37,6%) | 44 (48,4%) | ||
| Quimioterapia | 19 (14,3%) | 9 (9,9%) | 0,153 | |
| Quimioterapia+hormonoterapia | 63 (47,4%) | 35 (38,5%) |
En negrita, el único parámetro clínico-patológico que muestra diferencias entre ambos subgrupos.
En este segundo análisis estadístico, el método OSNA detectaba el doble de micrometástasis (pN1mi) (84,6%), respecto al estudio convencional (44,4%). Mientras que el MC detectaba 3 veces más células tumorales aisladas (pN0[i+]) que el método OSNA (55,6% vs. 15,4%, respectivamente) (tabla 3).
Mediante análisis estadístico se demostró que las diferencias estadísticamente significativas halladas entre ambos métodos (p < 0,001) eran independientes de todas las variables clínico-patológicas, a excepción de la variable de subtipo histológico.
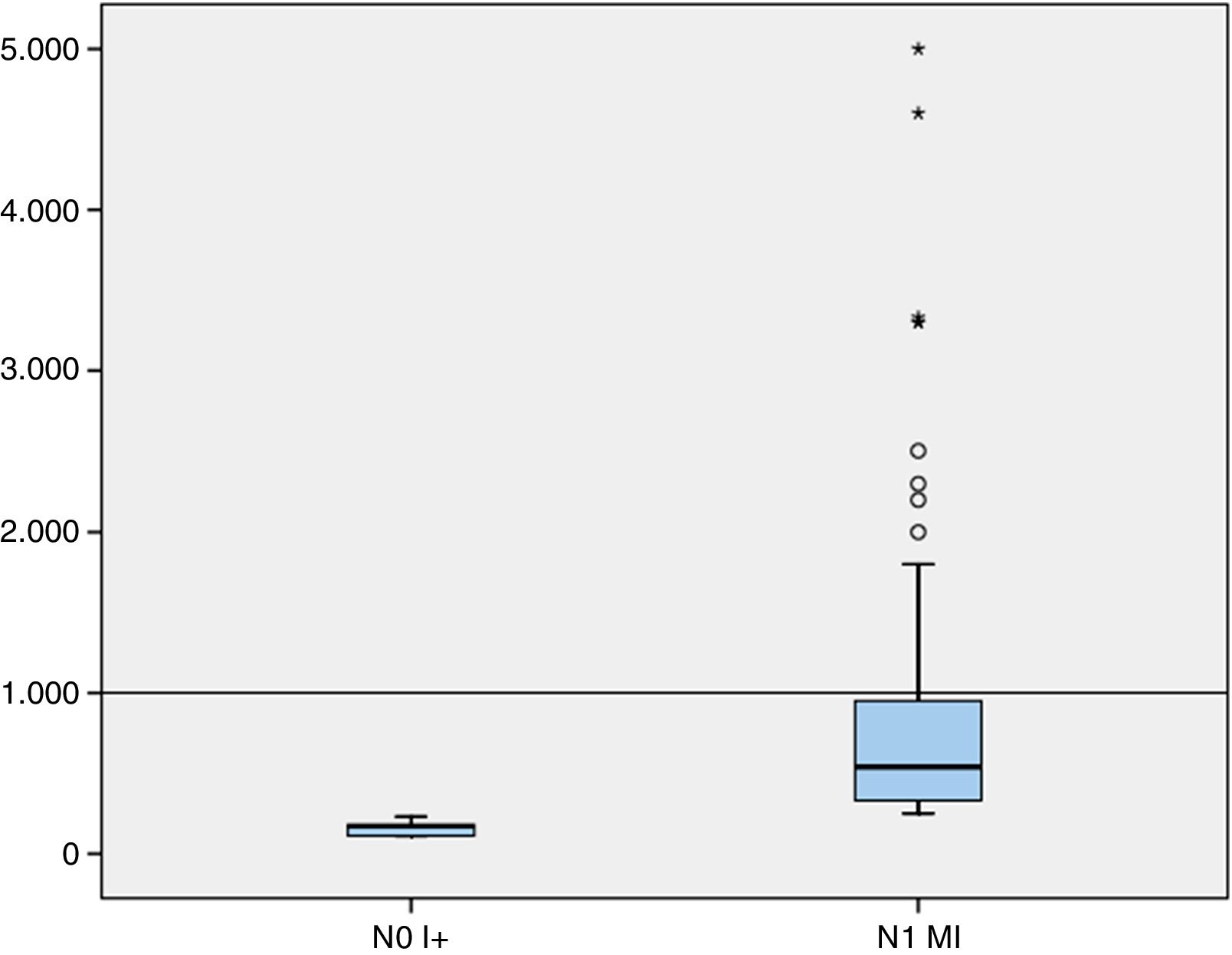
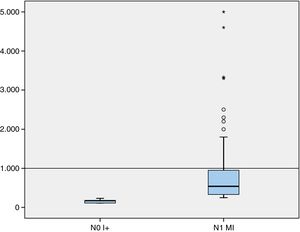
Así mismo, de la serie estudiada por OSNA también se valoraron la media y la mediana de la carga tumoral mayor y total de los ganglios centinela (número de copias de ARNm de citoqueratina 19) (tabla 4). En nuestra casuística, en el 75% de los casos con estadificación de ganglio centinela pN1mi, la carga tumoral mayor se encontraba por debajo de las 952,5 copias (fig. 1)
Diversos estudios de comparación entre ambos métodos muestran que el MC infraestima la estadificación ganglionar7,17,18, siendo el método OSNA más preciso para la detección de metástasis ganglionares6.
Según estudios recientes, el método OSNA tiene mayor sensibilidad para la detección de micrometástasis, siendo similar la proporción de macrometástasis entre ambos métodos7,17. En un estudio español reciente de metodología similar al nuestro, se concluye que el método OSNA es más preciso para la detección de metástasis del ganglio centinela que el MC, encontrando una mayor incidencia global de metástasis en el grupo estudiado con método OSNA, pero sin hallar diferencias significativas entre macro y micrometástasis6.
No obstante, en un estudio en el que se evalúa el mismo ganglio mediante ambos métodos, se observa que el método OSNA detecta peor las células tumorales aisladas y las micrometástasis en comparación con el MC11. Así mismo, otro estudio reporta que el método OSNA puede tener falsos negativos en cuanto a la detección de células aisladas tumorales19.
En nuestro estudio se observa un aumento significativo de casos diagnosticados de micrometástasis y una disminución de casos de células tumorales aisladas en el grupo de método OSNA con respecto al grupo de MC. Creemos que esto puede deberse a que el método OSNA evalúa el ganglio en su totalidad a diferencia del MC. De manera que una posible hipótesis sería que algunos casos diagnosticados como células tumorales aisladas por el MC pudieran ser clasificados como micrometástasis si se hubiese realizado el estudio por el método OSNA.
A pesar de estas diferencias, hay controversia en la relevancia clínica de la EGC. Se han publicado estudios a favor y en contra de linfadenectomía en células tumorales aisladas y micrometástasis del ganglio centinela20,21. En un estudio realizado en nuestro centro (por Pernas et al.) se concluyó que las pacientes con micrometástasis (N1mi) tratadas con quimioterapia sistémica y sin linfadenectomía no tenían recurrencia axilar, por lo que la linfadenectomía podría evitarse en estos casos22.
Las recomendaciones actuales de la 14th St. Gallen Breast Cancer Conference 2015 establecen que la presencia de micrometástasis en el ganglio centinela ya no se considera una indicación de vaciamiento ganglionar. Incluso, la linfadenectomía podría evitarse en casos de macrometástasis en pacientes con solo uno o 2 ganglios centinela positivos, a quienes se les haya practicado cirugía de mama conservadora y hayan recibido posterior radioterapia y quimioterapia adyuvante23. Por ello, algunos estudios concluyen que el estudio del ganglio centinela mediante OSNA proporciona un mejor indicador de la necesidad de linfadenectomía en el mismo acto quirúrgico ya que permite la evaluación intraoperatoria de todo el ganglio, pero no modifica el manejo terapéutico de las pacientes con cáncer de mama6.
En cuanto a la evaluación de la carga tumoral de las metástasis de los ganglios centinela, un estudio reciente demuestra que la carga tumoral total (definida como el sumatorio de la cantidad de copias de ARNm de CK19/μl de todos los ganglios centinela estudiados) es la mejor herramienta para predecir la probabilidad de tener más ganglios axilares metastásicos. A partir de 15.000 copias, aumenta la probabilidad de metástasis en otros ganglios axilares no centinela, siendo necesaria la linfadenectomía24.
En el consenso de la SESPM se establece que el valor «carga tumoral» es más predictivo de afectación axilar que los grupos pronósticos definidos en el TNM (células tumorales aisladas, micrometástasis y macrometástasis)25. Sobre la base de los estudios publicados, una carga tumoral total de 10.000-15.000 copias corresponde a una probabilidad de axila no afectada (libre de metástasis) de un 85%, mientras que el riesgo de enfermedad axilar residual para pacientes de bajo riesgo (según criterio histológico) es del 27%25.
Dicho consenso recomienda el uso del criterio «carga tumoral» para la toma de decisiones quirúrgicas sobre la axila en los centros en que se utilice el sistema diagnóstico OSNA25.
En nuestro estudio, la carga tumoral mayor del 75% de los casos con micrometástasis corresponde a < 1.000 copias (siendo el rango de micrometástasis de 250-5.000 copias de ARNm CK19/μl). Un número bajo de copias en las micrometástasis es un hallazgo relevante que no se encuentra reportado en la literatura. Creemos que sería conveniente contrastar estos resultados con los de otros centros, así como estudiar su significado clínico-patológico.
En cuanto al subtipo histológico de cáncer de mama, se han hallado diferencias estadísticamente significativas (p = 0,021) entre ambos subgrupos (pN0(i+) y pN1mi) debido a un aumento de la categoría «otros» en la cohorte método OSNA (tabla 2). Creemos que estas diferencias podrían atribuirse a la implementación de la clasificación de la OMS de los tumores de mama del 201226 y a una subtipificación más exhaustiva en los diagnósticos de cáncer de mama de la cohorte método OSNA (realizados entre 2012 y 2013). A pesar de estas diferencias, y pese al sesgo inherente debido a comparar 2 series distintas de pacientes y no el mismo ganglio centinela, ambos grupos son homogéneos en cuanto al resto de variables clínico-patológicas.
En conclusión, en nuestra casuística, por el método OSNA se observa un incremento significativo de pN1mi (84,6% vs. 44,4%) y una disminución de pN0(i+) respecto al estudio convencional, diferencias que no están condicionadas por los parámetros clínico-patológicos. La mayoría de casos (75%) con pN1mi por OSNA muestra una carga tumoral baja con un número de copias inferior a 1.000.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
FinanciaciónLa realización del análisis estadístico ha sido financiada económicamente por Sysmex Corp.
AutoríaMaría López-Zambrano y Nuria Ruiz contribuyeron igualmente en este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.