Presentamos los resultados de tolerancia de la adición de sobreimpresión hipofraccionada después de irradiación global hipofraccionada de la mama.
Material y métodoSe incluyeron pacientes con cirugía conservadora y tratadas mediante hipofraccionamiento de 2,67Gy/día hasta 40Gy sobre la mama. La sobreimpresión del lecho tumoral se realizó a dosis de 16 o 8Gy según los criterios de riesgo para recaída local: tamaño tumoral, grado, márgenes o presencia de carcinoma ductal in situ, o nada en ausencia de dichos factores.
ResultadosSe trataron 110 pacientes. Los grupos de riesgo se distribuyeron en alto, medio o bajo, con 51, 54 y 5 pacientes, respectivamente. Un 4,5% no presentaron toxicidad aguda. Las pacientes presentaron dermitis grado i o ii en el 38,2 y 47,3% de los casos, respectivamente. No se observaron diferencias en la toxicidad aguda dependiendo de la dosis de sobreimpresión. Tras un seguimiento medio de 2 años, en 79 casos (71,8%) no hubo cambios cutáneos crónicos. Apareció fibrosis leve en 24 pacientes (21,8%) y de grado ii en 7 pacientes.
ConclusionesLa sobreimpresión hipofraccionada parece bien tolerada y las toxicidades aguda y crónica son leves. No parece haber impacto de la dosis total acumulada en la incidencia de fibrosis.
We present the results of adding a hypofractionated boost after whole-breast hypofractionated radiotherapy and report patient tolerance of this procedure.
Material and methodPatients were included after conservative surgery and underwent adjuvant therapy. The whole breast was treated at 2.67Gy per fraction up to 40Gy. The boost was performed at different dose levels (16 or 8Gy) according to the presence of risk factors for local recurrence (tumor size, histologic grade, margin status or the presence of carcinoma in situ) or nothing in case of their absence.
ResultsA total of 110 patients were treated. The distribution into high-, middle- and low-risk groups was 51, 54 and 5 patients, respectively. There was no toxicity in 4.5% of the patients. Grade i or ii dermatitis was found in 38.2 and 47.3%, respectively. No differences were observed in acute dermatitis depending on boost doses. After a follow-up of 2 years, there were no chronic skin or subcutaneous changes in 79 patients (71.8%). Mild fibrosis occurred in 24 patients (21.8%) and grade ii fibrosis occurred in 7 patients.
ConclusionsHypofractionated boost seems to be well tolerated. Acute and chronic toxicities are mild. The cumulative dose does not seem to increase the incidence of fibrosis at the boost area compared with the whole breast.
El tratamiento establecido del cáncer de mama en estadios precoces es la cirugía conservadora seguida de radioterapia. La experiencia acumulada en el tiempo demuestra una equivalencia al tratamiento radical con mastectomía1,2. Durante mucho tiempo la irradiación se ha realizado administrando una dosis de 45-50Gy a todo el volumen mamario seguido o no de complemento sobre lecho tumoral3,4.
La duración del tratamiento ha supuesto un importante esfuerzo para las pacientes y para los Servicios de Radioterapia, por lo que se han ensayado esquemas de tratamiento más cortos5,6. Tras los ensayos aleatorizados que comparan la irradiación normofraccionada respecto a la irradiación hipofraccionada con dosis por fracción superior a 2Gy al día, se ha demostrado una efectividad equivalente en términos de control local, efectos secundarios y resultado cosmético7–9, incluso en aquellas pacientes con tumores de alto grado10. Los efectos a largo plazo de los principales estudios confirman los buenos resultados sin aumento de la toxicidad crónica, por lo que se piensa que en estadios precoces debe considerarse tratamiento estándar11. Este hecho fue estimado por ASCO como uno de los mayores avances de 201012, y ASTRO en el mismo año13 anunciaba un incremento del uso de este tipo de fraccionamientos en pacientes con cáncer de mama, y en 2011 publicó las guías14 de consenso para la práctica clínica.
A pesar de los buenos resultados quedan todavía algunas preguntas por responder15. En estos estudios, no se contempló la posibilidad de realizar la sobreimpresión de forma hipofraccionada, en algunas ocasiones se administró una dosis adicional al fraccionamiento normal, basado en los resultados aportados por el estudio de la EORTC3, y en otras no se administró. El principal temor al uso de la sobreimpresión es la preocupación por el riesgo de toxicidad incrementada a largo plazo. Por ello, continúa siendo tema de debate la forma de administrar esta sobreimpresión, tras irradiación hipofraccionada16.
En este estudio se analizan los resultados de tolerancia y toxicidad aguda y crónica de una serie consecutiva de pacientes en las que se ha realizado una irradiación hipofraccionada de toda la mama, seguida de forma secuencial por un complemento sobre el lecho tumoral adaptado a los factores de riesgo de recaída local usando el mismo aumento de la fracción empleada.
Material y métodosSe ha incluido una serie consecutiva de 110 pacientes diagnosticadas de neoplasia de mama sometidas a tratamiento conservador, que cumplían los criterios de inclusión enumerados en la tabla 1. La edad media de las pacientes fue de 64,2 años (45-85). En 101 (91,8%) casos las pacientes eran posmenopáusicas, y el resto, premenopáusicas.
Todas las pacientes fueron tratadas con cirugía conservadora consistente en tumorectomía (98 casos; 89%) o cuadrantectomía (12 casos; 11%). Asimismo las pacientes fueron sometidas a un abordaje axilar consistente en biopsia selectiva del ganglio centinela con linfadenectomía en los casos en que este fue positivo. La mayor parte de la serie presentó ganglios negativos (83,6%), y el 16,4% siempre tuvo menos de 4 ganglios afectos. Se incluyeron pacientes con ganglios positivos en los que no se consideró indicada la irradiación de áreas ganglionares. La presencia o no de carcinoma intraductal se distribuyó por partes iguales a lo largo de toda la serie. En ningún caso se incluyeron pacientes con carcinoma intraductal puro.
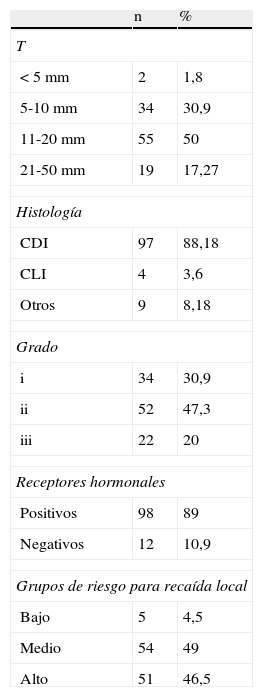
De forma habitual se realizó marcaje del lecho tumoral mediante el uso de 4-5 marcas radioopacas situadas en cada una de las caras de la cavidad quirúrgica. El estado de los márgenes fue el siguiente: positivos en 8 pacientes (7,2%), cercano inferior a 3mm en 24 pacientes (21,8%) y negativo en 78 pacientes (71%). En los casos con afectación focal o margen próximo, dado que en nuestra experiencia el rendimiento de la ampliación es muy baja y que se retrasa el tratamiento complementario, compensamos el riesgo ajustando las dosis sobre lecho tumoral. Las características patológicas de los tumores tratados se muestran en la tabla 2.
Características de los tumores
| n | % | |
| T | ||
| <5mm | 2 | 1,8 |
| 5-10mm | 34 | 30,9 |
| 11-20mm | 55 | 50 |
| 21-50mm | 19 | 17,27 |
| Histología | ||
| CDI | 97 | 88,18 |
| CLI | 4 | 3,6 |
| Otros | 9 | 8,18 |
| Grado | ||
| i | 34 | 30,9 |
| ii | 52 | 47,3 |
| iii | 22 | 20 |
| Receptores hormonales | ||
| Positivos | 98 | 89 |
| Negativos | 12 | 10,9 |
| Grupos de riesgo para recaída local | ||
| Bajo | 5 | 4,5 |
| Medio | 54 | 49 |
| Alto | 51 | 46,5 |
CDI: carcinoma ductal infiltrante; CLI: carcinoma lobulillar infiltrante.
Tras la cirugía conservadora las pacientes recibieron tratamiento sistémico según el protocolo asistencial. Así, se indicó tratamiento sistémico con hormonoterapia (58,2%), quimioterapia (10%) o ambas (31,8%). Para intentar evitar la toxicidad cardiaca, las pacientes con tumores localizados en mama izquierda y tributarias de tratamiento con trastuzumab fueron excluidas, al no existir suficiente experiencia en los grandes estudios de la combinación de hipofraccionamiento y trastuzumab. Sin embargo, se incluyeron 3 pacientes con tumores en la mama derecha y sobreexpresión de HER2 en las células tumorales y que recibieron tratamiento con trastuzumab.
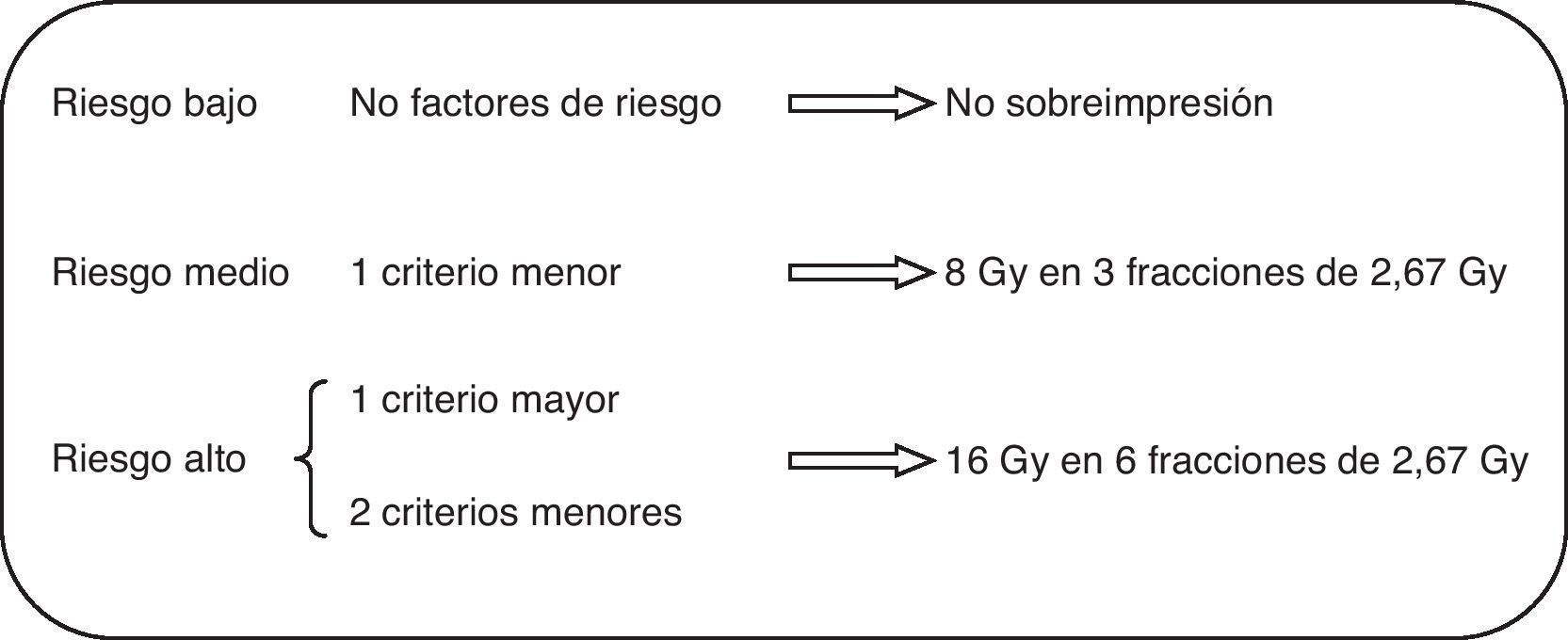
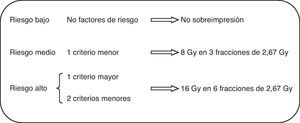
Tras valoración clínica y firma del correspondiente consentimiento, la delimitación de los volúmenes a irradiar se realizó en imágenes tomográficas, la delimitación del lecho tumoral se realizó mediante la guía de marcas radioopacas y los cambios posquirúrgicos, añadiéndose un margen de al menos 10mm. La técnica de irradiación empleada consistió en campos tangenciales y opuestos, optimizando la dosimetría mediante segmentación de campos para obtener una mayor homogeneidad de la dosis a administrar. Se excluyeron las pacientes que, por presentar mama voluminosa, tenían un diámetro transversal máximo (desde las entradas medial y lateral de los tangenciales) superior a 25cm, dado que se considera un factor asociado a previsible mayor toxicidad. Para la sobreimpresión se utilizaron fotones, electrones o ambos, atendiendo a la idoneidad dosimétrica individualizada de cada caso. La dosis por fracción administrada a lo largo de todo el tratamiento fue de 2,67Gy en 15 fracciones a toda la mama, 5 días a la semana. La dosis total al lecho quirúrgico se ajustó en función de los criterios de riesgo de recaída local. Se consideraron factores mayores la presencia de carcinoma intraductal extenso o márgenes afectos o inferiores a 3mm; se consideraron criterios menores el tamaño mayor de 10mm, grado iii o márgenes de 3 a 5mm. En presencia de un criterio mayor o 2 menores se administró dosis alta de sobreimpresión, y en presencia de un criterio menor se administró dosis baja de sobreimpresión (fig. 1). En ausencia de criterios de riesgo de recaída local la sobreimpresión no se administró. El tratamiento fue realizado mediante acelerador lineal en todos los casos y la energía utilizada para el tratamiento de la mama fue de fotones de 6MV. En 29 pacientes (26,4%) se utilizó un campo directo de electrones de 6 a 12MeV para la sobreimpresión del lecho tumoral, y el resto, campos oblicuos de fotones de 6MV. Ninguna de las pacientes recibió irradiación de áreas ganglionares, ya que las que la precisaron se trataron mediante fraccionamiento clásico.
Todas las pacientes fueron evaluadas semanalmente mediante control clínico con estrecha vigilancia de la toxicidad aguda. Tras el tratamiento las pacientes mantuvieron un programa de seguimiento, por lo que fueron evaluadas al mes, 3 y 6 meses, y sucesivamente una vez al año. Se evaluó la toxicidad crónica mediante la escala de la RTOG.
ResultadosTras una mediana de seguimiento de 24 meses no se han observado recidivas locales; han acaecido 2 muertes, una relacionada con metástasis pulmonares y otra por enfermedad no oncológica.
Como ha sido mencionado, la administración de la sobreimpresión se decidió en función de los criterios de riesgo (fig. 1). Así, en 5 pacientes no se administró, las 54 del grupo de riesgo intermedio recibieron 3 sesiones de 2,67Gy y dosis total de 48Gy, y las 51 del grupo de mayor riesgo recibieron 6 sesiones y una dosis total de 56Gy.
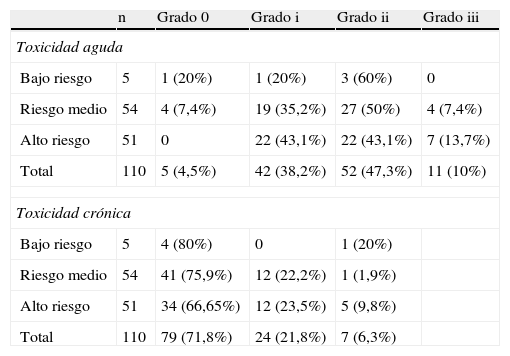
La toxicidad cutánea aguda que presentaron las pacientes se muestra en la tabla 3 A y B. La mayoría de las pacientes presentaron una dermitis grado i o ii, en el 85,5% de los casos. En 5 pacientes no hubo toxicidad aguda alguna. No hubo diferencias significativas en la incidencia de dermitis leve o moderada en los diferentes grupos de dosis, por lo que dosis mayores de sobreimpresión no se correlacionaron con una toxicidad mayor. En ningún caso se ha tenido que interrumpir el tratamiento por toxicidad aguda y únicamente se observó una dermitis grado iii en 4 (7,4%) pacientes del grupo de riesgo intermedio y en 7 (13,7%) del de alto riesgo. En cuanto a la toxicidad crónica, no hemos detectado ningún caso de neumonitis, ni toxicidad cardiaca. En 82 pacientes (75,5%) tampoco se detectó toxicidad cutánea tardía. En 12 casos (22%) del grupo de riesgo intermedio y en otros 12 (23,5%) del grupo de alto riesgo se detectó una fibrosis grado i, y en una (1,9%) y en 5 (9,8%) pacientes, una fibrosis grado ii.
Toxicidades aguda y crónica
| n | Grado 0 | Grado i | Grado ii | Grado iii | |
| Toxicidad aguda | |||||
| Bajo riesgo | 5 | 1 (20%) | 1 (20%) | 3 (60%) | 0 |
| Riesgo medio | 54 | 4 (7,4%) | 19 (35,2%) | 27 (50%) | 4 (7,4%) |
| Alto riesgo | 51 | 0 | 22 (43,1%) | 22 (43,1%) | 7 (13,7%) |
| Total | 110 | 5 (4,5%) | 42 (38,2%) | 52 (47,3%) | 11 (10%) |
| Toxicidad crónica | |||||
| Bajo riesgo | 5 | 4 (80%) | 0 | 1 (20%) | |
| Riesgo medio | 54 | 41 (75,9%) | 12 (22,2%) | 1 (1,9%) | |
| Alto riesgo | 51 | 34 (66,65%) | 12 (23,5%) | 5 (9,8%) | |
| Total | 110 | 79 (71,8%) | 24 (21,8%) | 7 (6,3%) | |
El tratamiento del cáncer de mama, y en concreto la radioterapia, están presentando mejoras continuas en cuanto a indicaciones de tratamiento y esquemas utilizados17. En nuestro estudio hemos obtenido unos resultados de control de la enfermedad y una tolerancia superponible a la amplia experiencia publicada. Los estudios aleatorizados de Whelan9 y de los británicos START7,8 demuestran que el hipofraccionamiento es equivalente a la irradiación estándar en términos de control local, supervivencia y toxicidad. Posteriormente, han aparecido otros artículos que describen la experiencia con pautas hipofraccionadas incluso con quimioterapia concomitante18 o en el carcinoma in situ19. En la mayor parte de ellos se utiliza el hipofraccionamiento en la irradiación de toda la mama y diversos tipos de fraccionamiento a la hora de realizar la sobreimpresión, ya que, como hemos mencionado, en los estudios aleatorizados la sobreimpresión, cuando se realizó, se hizo de forma normofraccionada. Así, nos encontramos ante una situación en la que se está estandarizando el hipofraccionamiento en la irradiación de toda la mama, pero no existe una homogeneidad en los esquemas de irradiación de la sobreimpresión. El motivo de la no utilización generalizada de la sobreimpresión hipofraccionada es el miedo a la toxicidad, especialmente la tardía, por ello muchos autores se preguntan cómo debe administrarse la sobreimpresión tras una irradiación hipofraccionada de toda la mama20.
Los principales estudios que han añadido sobreimpresión tras la irradiación hipofraccionada de toda la mama son los del Hospital Royal Marsden, donde administraban 14Gy a fraccionamiento de 2Gy por sesión21, y los estudios START A y B6,7, que añadían 10Gy, siempre a criterio del médico responsable. En todos estos casos la técnica utilizada para la administración de la sobreimpresión fue un campo directo de electrones.
Existen autores que proponen la utilización de la sobreimpresión concomitante. Teh et al.22 describen los resultados en un estudio prospectivo de una cohorte de 15 pacientes, en las que se administró una concomitante de 10,08Gy durante las 16 fracciones del tratamiento, administrando una dosis total por fracción de 3,28Gy. Los autores realizaron 2 dosimetrías, una con el tratamiento descrito y otra con el estándar, y compararon los histogramas conseguidos con ambas planificaciones; las dosis en pulmón y corazón fueron inferiores en las dosimetrías con sobreimpresión hipofraccionada. En cuanto a la toxicidad, únicamente el 27% de las pacientes presentó toxicidad aguda grado ii, y una paciente, grado iii; por el momento no han encontrado toxicidades crónicas grado iii/iv tras un año de seguimiento.
Guenzi et al.23 proponen una sobreimpresión concomitante administrada de forma semanal. Estos autores, en una serie de 65 pacientes a las que les administraron 39Gy en fracciones de 3Gy, añaden de forma concomitante una fracción de 3Gy sobre la cavidad de tumorectomía una vez a la semana. Tras un seguimiento de 24 meses, únicamente describen una toxicidad aguda grado ii en el 9% de los casos y una fibrosis grado ii del 3%. En ningún momento utilizaron técnicas complejas (IMRT) para administrar la sobreimpresión.
Pinnarò et al.24 utilizan una única fracción de 8Gy con electrones como sobreimpresión, tras un esquema hipofraccionado de 34Gy en 10 fracciones y una semana de reposo. Tras un seguimiento medio de 43 meses, las 39 pacientes incluidas se hallan libres de enfermedad y ninguna presentó toxicidad relevante a nivel cardiaco o pulmonar. Una discreta fibrosis cutánea se describe en 9 pacientes.
Deantonio et al.25 utilizan un esquema similar al propuesto por nosotros; en una serie de 85 pacientes, tras una pauta hipofraccionada de 45Gy en 20 fracciones de 2,25Gy, administran una dosis de 9Gy en 3 fracciones. Para comparar los resultados seleccionan un grupo de 70 pacientes tratadas de forma clásica. Las toxicidades aguda y crónica fueron menores en el grupo hipofraccionado. Los autores encuentran una relación entre el volumen mamario y la toxicidad en ambos grupos de tratamiento, por lo que recomiendan ajustar los análisis al volumen mamario en los estudios de toxicidad.
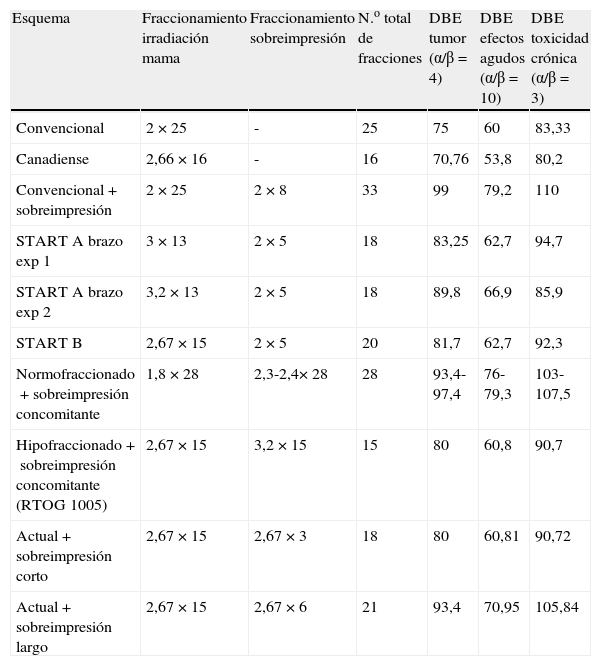
Al considerar el impacto de las alteraciones del fraccionamiento se deben tener en cuenta los aspectos radiobiológicos implicados tanto a nivel de la respuesta tumoral como de la tolerancia de los tejidos sanos. En los últimos años ha habido importantes discusiones acerca de los valores de α/β que se deben considerar para establecer equivalencias de los diferentes esquemas. La hipótesis más difundida es la de que el α/β para el cáncer de mama es relativamente bajo26, estimado en unos valores que oscilan entre 2,8 y 6, si bien algunos autores consideran que dicho rango podría ser más amplio. Asumiendo estos valores bajos, es comprensible el atractivo que puede tener el hipofraccionamiento diario en el tratamiento del cáncer de mama al conseguir un mismo control tumoral con un menor tiempo de tratamiento. Los principales estudios de hipofraccionamiento diario con un número importante de pacientes y seguimiento adecuado han permitido estimar que el valor de α/β a considerar para no ver aumentada la toxicidad crónica se sitúa en 3,1Gy (tabla 4). En el estudio de Qi et al.27 se realiza una modelización estadística que permite establecer las equivalencias de los diferentes hipofraccionamientos diarios entre 3 y 20 sesiones y esquema bifraccionado de 10 sesiones en una semana, en comparación con el esquema estándar de 25 sesiones a fraccionamiento de 2Gy. En dicho estudio se concluye que a dosis biológicamente equivalentes para el tumor, un número inferior de sesiones obtiene unos valores de dosis biológicamente equivalente para órganos de riesgo inferior a la obtenida con fraccionamiento normal o con el esquema bifraccionado, concluyendo que el valor de α/β que debería considerarse para el diseño de esquemas hipofraccionados se halla en torno a 4 en comparación con el fraccionamiento normal.
Comparación de las dosis biológicamente equivalentes de los diversos fraccionamientos
| Esquema | Fraccionamiento irradiación mama | Fraccionamiento sobreimpresión | N.o total de fracciones | DBE tumor (α/β=4) | DBE efectos agudos (α/β=10) | DBE toxicidad crónica (α/β=3) |
| Convencional | 2×25 | - | 25 | 75 | 60 | 83,33 |
| Canadiense | 2,66×16 | - | 16 | 70,76 | 53,8 | 80,2 |
| Convencional+sobreimpresión | 2×25 | 2×8 | 33 | 99 | 79,2 | 110 |
| START A brazo exp 1 | 3×13 | 2×5 | 18 | 83,25 | 62,7 | 94,7 |
| START A brazo exp 2 | 3,2×13 | 2×5 | 18 | 89,8 | 66,9 | 85,9 |
| START B | 2,67×15 | 2×5 | 20 | 81,7 | 62,7 | 92,3 |
| Normofraccionado+sobreimpresión concomitante | 1,8×28 | 2,3-2,4×28 | 28 | 93,4-97,4 | 76-79,3 | 103-107,5 |
| Hipofraccionado+sobreimpresión concomitante (RTOG 1005) | 2,67×15 | 3,2×15 | 15 | 80 | 60,8 | 90,7 |
| Actual+sobreimpresión corto | 2,67×15 | 2,67×3 | 18 | 80 | 60,81 | 90,72 |
| Actual+sobreimpresión largo | 2,67×15 | 2,67×6 | 21 | 93,4 | 70,95 | 105,84 |
Otro aspecto relacionado con las dosis equivalentes a tener en cuenta para la valoración de la tasa de complicaciones es la relación de las dosis y fraccionamientos con los volúmenes irradiados, de forma que, tal y como se propone en una revisión sobre el efecto volumen, se concluye acerca de cómo una pequeña reducción en la dosis total sobre la irradiación completa de la mama tiene un impacto positivo en la reducción de las complicaciones a largo plazo en la zona de la sobreimpresión28,29.
También uno de los aspectos radiobiológicos que destaca en los estudios de hipofraccionamiento es la reducción del tamaño de la fracción para la realización de la sobreimpresión en el momento de mayor probabilidad de repoblación, lo que justificaría nuestra opción por mantener la misma dosis de 2,67Gy. Un ejemplo similar a nuestra propuesta lo constituye el estudio aleatorizado de Clark et al.30, en el que tras la irradiación global de la mama tratada con 40Gy en 16 fracciones de 2,5Gy se compara la adición o no de una sobreimpresión de 12,5Gy al mismo fraccionamiento, obteniendo una reducción marcada de la recaída local.
Nosotros propusimos utilizar un esquema hipofraccionado en la sobreimpresión utilizando unos criterios de selección de dosis (fig. 1), 3 sesiones para las pacientes de riesgo intermedio, 6 para las de alto riesgo y no sobreimpresión para las de bajo riesgo. La técnica de irradiación para la sobreimpresión siempre fue basada en dosimetría tridimensional con fotones, electrones o ambos en función de la anatomía de las pacientes y localización del tumor. No hemos observado toxicidad aguda (tabla 3A) ni crónica (tabla 3B) relevante.
A pesar de estos buenos resultados, el grupo sueco31 revisa la plexopatía del nervio braquial que motivó indemnización y que estaba relacionada con el hipofraccionamiento en la irradiación mamaria. Desde el año 1964 hasta 1970 describen 222 casos, y concluyen que el hipofraccionamiento puede causar lesiones graves, si la determinación del volumen a tratar no es precisa o la dosis total no se está ajustada a las dosis de tolerancia conocidas. Por ello la mayoría de autores32–34 afirman que en este tipo de tratamientos hipofraccionados, las dosimetrías se deben optimizar al máximo, utilizando técnicas de IMRT si es preciso, semiautomáticas de IMRT directa35 o la denominada field in field intensity-modulated radiotherapy36.
Ante esta igualdad de eficacia y de toxicidad, el hipofraccionamiento mejora la eficiencia de los Servicios de Radioterapia al disminuir el tiempo total de tratamiento. La irradiación clásica consistente en 50Gy+16 de sobreimpresión administrados en 33 fracciones3 equivale a unas 11-21 fracciones (según la secuencia y fracción utilizada), lo que representa una disminución del 45% de la carga de trabajo en las unidades de tratamiento; con la sobreimpresión concomitante administrada durante las 13-16 fracciones, el tiempo total del tratamiento disminuye un poco más, llegando hasta el 51%. A pesar de que la disminución del tiempo de tratamiento es superior en la sobreimpresión concomitante, probablemente el aumento de la complejidad del tratamiento no lo compense. Esta reducción del tiempo total es especialmente útil ya que las pacientes susceptibles de recibir este tratamiento son más de la mitad de las pacientes afectas de cáncer de mama, y representan aproximadamente el 15% de los enfermos tratados en un Servicio de Radioterapia37. El beneficio para las pacientes y el aumento de la eficiencia en la utilización de los recursos es muy importante, pudiendo disminuir los costes en un 24%38, por lo que el hipofraccionamiento en el cáncer de mama debe ser considerado tan estándar como el fraccionamiento clásico.
Además, supone una mejora significativa en la calidad de vida de las pacientes39 y puede constituir la opción preferida en la mayoría de los casos40. Existe discrepancia en la extensión de estos esquemas hipofraccionados a las pacientes con indicación de irradiación ganglionar o tras mastectomía; así, el grupo francés41 opina que el hipofraccionamiento debe reservarse únicamente para las pacientes candidatas a irradiación mamaria exclusiva, sin áreas ganglionares. Por el contrario, el grupo inglés, liderado por Yarnold et al.42, opina que un hipofraccionamiento moderado debe ser considerado estándar en estas pacientes y que puede utilizarse tras mastectomía o para la irradiación ganglionar, probablemente con aumentos ligeros de la fracción a administrar sin que ello vaya a tener impacto en las tasas de efectos secundarios a largo plazo. El futuro y el desarrollo tecnológico probablemente llevarán a poder hipofraccionar más la dosis tanto con esquemas de irradiación parcial acelerada de la mama como de irradiación completa de la mama43, tal como propone el grupo inglés con 5 fracciones diarias de 5Gy en una semana en el FAST Trial44.
En conclusión, la irradiación hipofraccionada en el cáncer de mama se considera estándar en buena parte de las pacientes sometidas a cirugía conservadora. La sobreimpresión administrada de forma hipofraccionada es factible y no aumenta de forma significativa la toxicidad cutánea, aunque se requiere mayor seguimiento para valorar adecuadamente la toxicidad crónica. La sobreimpresión hipofraccionada permite conseguir una reducción adicional del número total de las sesiones administradas a las pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.