El objetivo de esta revisión es exponer los conceptos más actualizados sobre el linfoma anaplásico de células grandes asociado a implantes mamarios, debido a que es una condición poco conocida, descrita recientemente, en 1997, y apenas reconocida en 2016 por la Organización Mundial de la Salud como una nueva entidad patológica. Se realizó una búsqueda en Pubmed y Medline de todos los artículos en inglés y español entre los años 2009 y 2019 que incluyeran las palabras clave.
Hasta el 6 de junio del 2019 la FDA había recibido 573 reportes de casos con linfoma anaplásico de células grandes asociado a implantes mamarios (LACG-AIM). En 2016 la Organización Mundial de la Salud reconoció el LACG-AIM como una forma única de linfoma anaplásico de células grandes. El LACG-AIM se caracteriza por presentar un crecimiento anormal de las células T (linfocitos T), así como la expresión del receptor de membrana CD30.
El desarrollo del LACG-AIM es un proceso complejo que involucra muchos factores de riesgo, incluyendo crecimiento de biofilm bacteriano, la superficie de implantes texturizados, la respuesta inmune y aspectos genéticos del paciente. La presentación clínica más frecuente es un seroma periprotésico tardío. Lo importante en el tratamiento del LACG-AIM es el diagnóstico oportuno y la exéresis quirúrgica completa de las lesiones, lo cual se relaciona con un excelente pronóstico y supervivencia a largo plazo.
The aim of this review is to describe the most up-to-date concepts regarding breast implant-associated anaplastic large cell lymphoma, because it is a rare condition, recently described in 1997 and barely recognised in 2016 by the World Health Organisation (WHO) as a new pathological entity. A search was conducted in Pubmed and Medline, including all articles in English and Spanish between 2009 and 2019 that included the keywords. Until June 6, 2019, the Food and Drug Administration (FDA) had received 573 case reports of breast implant-associated anaplastic large cell lymphoma (BIA-ALCL). In 2016, the WHO recognised BIA-ALCL as a unique form of anaplastic large cell lymphoma. BIA-ALCL is characterised by abnormal growth of T cells (T lymphocytes), as well as expression of the CD30 membrane receptor. The development of BIA-ALCL is a complex process that involves many risk factors, including the growth of bacterial biofilm, the surface of textured implants, the immune response and the patient's genetic characteristics. The most frequent clinical presentation is a late periprothetic seroma. The most important aspect in the treatment of BIA-ALCL is early diagnosis and complete surgical excision of the lesions, which is related to excellent prognosis and long-term survival.
El objetivo de esta revisión es exponer los conceptos más actualizados sobre el linfoma anaplásico de células grandes asociado a implantes mamarios, debido a que es una condición poco conocida, descrita recientemente en 1997 y apenas reconocida en 2016 por la Organización Mundial de la Salud (OMS) como una nueva entidad patológica, además de poder establecer con la ayuda de un caso clínico una guía para la sospecha, diagnóstico y manejo de las pacientes con esta afección.
Material y métodoSe realizó una búsqueda en Pubmed y Medline de todos los artículos en inglés y español entre los años 2009 y 2019 que incluyeran las palabras clave linfoma, implantes de mama, cáncer, mama, encontrando un total de 271 estudios en Pubmed y 116 en Medline.
IntroducciónEl uso de implantes mamarios se ha vuelto una práctica bastante común en estos tiempos, ya sea con fines estéticos o para fines reconstructivos en pacientes tratadas con cáncer de mama o como reductoras de riesgo. El primer implante de silicona fue colocado en el año 1962; actualmente, cerca de 1,5 millones de mujeres alrededor del mundo se colocan implantes mamarios anualmente1. Hasta la fecha no se ha logrado relacionar los implantes mamarios con un aumento en el riesgo de padecer cáncer de mama; sin embargo, se ha relacionado con otras complicaciones como la contractura capsular, las infecciones, las hemorragias, los seromas, los fenómenos autoinmunes, etc.2.
Durante las últimas 2 a 3 décadas se ha observado una importante relación entre los implantes mamarios y un tipo muy poco frecuente de linfoma: el linfoma anaplásico de células grandes. Esta entidad consta de ciertas peculiaridades las cuales han permitido nombrar a esta enfermedad en concreto como linfoma anaplásico de células grandes asociado a implantes mamarios (LACG-AIM).
Definición y epidemiologíaEn 2016 la OMS reconoció el LACG-AIM como una forma única de linfoma anaplásico de células grandes (LACG) que puede desarrollarse después de la colocación de implantes mamarios3. El LACG es un tipo de linfoma no Hodgkin que fue descrito por primera vez en 1985 y se caracteriza por la presencia de células linfoides grandes anaplásicas, las cuales expresan la proteína de superficie celular CD30. El LACG-AIM se debe distinguir del linfoma mamario primario, en el que predominan las células B que involucran el parénquima mamario y representan el 0,04-0,5% de todos los casos de cáncer de mama. El LACG-AIM es únicamente un linfoma de células T que proviene en su totalidad del líquido o la cápsula que se encuentra alrededor del implante4.
Se han reportado casos de LACG de la mama en mujeres con y sin implantes, y en un estudio de casos y controles realizado por de Jong, et al. se ha estimado que los implantes incrementan el riesgo de padecer un LACG alrededor de 18 veces. En 1997 se estableció la primera relación del LACG con los implantes mamarios en una serie de 46 casos5. En 2011 la Food and Drug Administration de los EE. UU. informó sobre la probabilidad de presentar un tipo de linfoma no Hodgkin asociado al uso de implantes mamarios, y desde entonces se han descrito diferentes casos y series de casos en la literatura en relación con este proceso patológico6.
Hasta el 6 de junio del 2019 la Food and Drug Administration había recibido 573 reportes de casos con LACG-AIM, casos no solo de los EE. UU., sino de todo el mundo, y se han reportado 33 casos fatales. Debido a lo raro de esta enfermedad se ha dificultado determinar la incidencia y prevalencia. Se reporta una incidencia de hasta 1 en 2.832 mujeres con implantes mamarios por año, dependiendo el tipo de implante y de sus características. La edad promedio de presentación en el momento del diagnóstico es de 53,2±12,3 años. El intervalo promedio desde la colocación de los implantes y el momento del diagnóstico del LACG-AIM es de 10,7±4,6 años. La mayoría de los casos se presentan con implantes texturizados y existen pocos casos relacionados con implantes lisos; sin embargo, existe controversia sobre la veracidad de estos casos debido a que las pacientes tienen historial de múltiples cambios de implantes. Se estima una prevalencia en mujeres con implantes texturizados de presentar LACG-AIM del 3,3% en mujeres de los 20 a los 70 años7,8.
FisiopatologíaEl LACG-AIM se caracteriza por presentar un crecimiento anormal de las células T (linfocitos T), así como la expresión del receptor de membrana CD30. La histología no se presenta siempre de la misma manera. Además de la expresión del CD30, existen variantes en cuanto a la expresión de la proteína quinasa de linfoma anaplásico (ALK por sus siglas en inglés). Entre el 60-80% de los casos con LACG son ALK+, el resto son ALK–, haciendo notar que la mayoría de los casos del LACG-AIM son ALK–. La importancia de la expresión o no de esta proteína se basa en el pronóstico y comportamiento de la enfermedad. En los casos con ALK+ el comportamiento es menos agresivo y el pronóstico es más favorable9.
El desarrollo del LACG-AIM es un proceso complejo que involucra muchos factores, incluyendo crecimiento de biofilm bacteriano, la superficie de implantes texturizados, la respuesta inmune y aspectos genéticos de la paciente10.
El LACG-AIM se ha relacionado con un proceso inflamatorio posiblemente secundario a un proceso reactivo al implante mamario. Está bien establecido en la literatura que la inflamación crónica puede desencadenar en un linfoma. Se piensa que el tejido que crece dentro de los poros de los implantes texturizados puede prolongar la inflamación crónica. Además, estudios recientes demuestran asociación de algunas mutaciones genéticas como JAK/STAT, SOCS1 TP53 y DNMT3A. El tiempo en el cual se desarrolló la enfermedad es consistente con el periodo requerido para que un biofilm produzca inflamación crónica y activación autoinmune. Los implantes texturizados desarrollan una carga significativamente mayor de biofilm bacteriano en comparación con los implantes lisos. En un estudio se realizó un análisis de la mama contralateral sin LACG-AIM, en donde se mostró microbiota similar pero significativamente con menos bacterias8.
Presentación clínicaEl LACG-AIM puede tener varios tipos de presentación, pero el principal síntoma es el aumento de volumen de la mama. La presentación clínica más frecuente es un seroma periprotésico tardío (posterior a un año desde la colocación del implante) recidivante con un aumento repentino del volumen mamario, en el 66% de los casos. El seroma tardío se puede desarrollar tras 7 a 10 años de la colocación del implante, con un rango de 2,2meses y 28 años11. La segunda es la presencia de una masa o tumoración en la cápsula periprotésica en el 8% de los casos. En el 7% de los casos la presentación es combinada con una masa y un seroma. Otras formas de presentación menos frecuentes, el 18% de los casos, son las adenopatías axilares palpables, la contractura capsular, las lesiones en la piel y la presencia de síntomas B (fiebre, adenopatías, sudoraciones nocturnas y fatiga). Entre un 10-14,9% de los casos reportan como presentación clínica inicial la presencia de linfadenopatía axilar12.
Las pacientes que presentan una colección de fluido importante alrededor del implante se pueden mal diagnosticar de una rotura del implante, pero como regla general las roturas de implante no incrementan el volumen de la mama. Otra causa común de un seroma tardío es la infección o un traumatismo reciente de la pared torácica13.
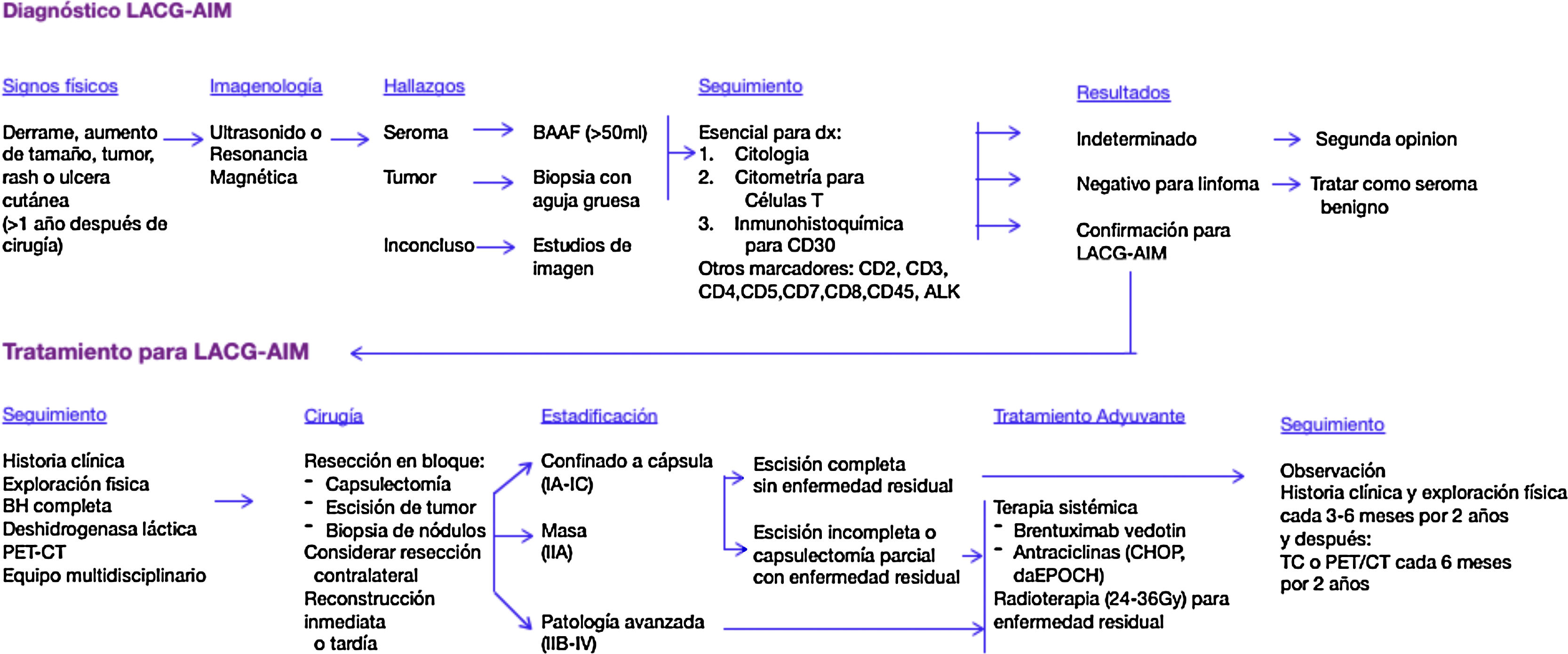
Evaluación y diagnósticoLa evaluación inicial al presentar un aumento en el tamaño de la mama debe incluir un estudio de ultrasonografía para valorar la presencia de líquido periprotésico, tumoraciones capsulares y ganglios regionales aumentados de tamaño. Los ganglios axilares comprometidos son los más comunes, hasta en un 93% de los casos, seguidos de los ganglios mamarios internos y supraclaviculares. La presencia de otros ganglios comprometidos es poco frecuente. Para el LACG-AIM se ha reportado una sensibilidad y especificidad del ultrasonido para la detección de colecciones de líquido de un 84% y 75% respectivamente, y para la detección de tumoraciones del 46% y 100% respectivamente. En caso de ser necesario o que el ultrasonido otorgue información insuficiente se sugiere realizar una resonancia magnética14.
Con el ultrasonido se puede dirigir la punción y aspiración del líquido periprotésico para su análisis. Este líquido suele tener un aspecto turbio en los casos de LACG-AIM debido a su celularidad aumentada, con células grandes pleomórficas, linfocitos epiteloides con citoplasma abundante y con un núcleo excéntrico en forma de riñón con nucléolo prominente. El análisis de citología de líquido extraído ayuda a orientar el diagnóstico, el cual se confirmará por medio de un estudio inmunohistoquímico (obtener como mínimo 50ml)15, por lo que es importante que el cirujano tenga la sospecha de esta enfermedad para que solicite el estudio de inmunohistoquímica, ya que como se había comentado anteriormente las células del LACG-AIM son CD30+ y suelen ser ALK–. No está indicado realizar una biopsia de la cápsula en todas las pacientes que presenten algún derrame periprotésico; sin embargo, la cápsula se debe enviar para estudio histológico cuando se realiza una cirugía de exéresis de la misma.
Debido a que la expresión del CD30 no es patognomónico del LACG-AIM, y se puede encontrar en células inflamatorias benignas, el diagnóstico se deberá correlacionar con el estado clínico de la paciente. Recientemente se ha realizado una revisión a fondo de las etapas de LACG-AIM y se enfatiza en la importancia de excluir afecciones benignas y malignas que puedan imitar al LACG-AIM. Se ha estudiado la importancia de realizar biomarcadores para llevar a cabo un diagnóstico correcto y excluir otras enfermedades malignas como son el CD2, CD3, CD4, CD5, CD7, CD8 y CD4516.
Una vez confirmado el diagnóstico de LACG-AIM se recomienda ampliamente consultar el caso en un grupo multidisciplinario que incluya oncólogos, patólogos, cirujanos oncólogos y cirujanos plásticos. También se sugiere realizar pruebas de laboratorio a la paciente, como son biometría hemática, química sanguínea, pruebas de función hepática y pruebas de hepatitis B (en caso de considerar quimioterapia adyuvante). Se sugiere biopsia de m,dula ósea para pacientes en los que exista alta sospecha de LACG sistémico como a los pacientes con una invasión local agresiva o con presencia de metástasis ganglionar.
Para la estadificación la modalidad de imagen preferida es una PET/CT en enfermedad sistémica para demostrar la presencia de tumoraciones asociadas a la cápsula y compromiso de la pared torácica, utilizando las imágenes como guía durante el tratamiento quirúrgico. Generalmente el estudio se repite después de haber realizado el tratamiento quirúrgico, dando un tiempo adecuado para permitir una correcta cicatrización de las heridas y disminuir el riesgo de falsos positivos (2 a 3 meses después de la cirugía)17.
EstadificaciónEl LACG (no asociado a implantes mamarios) es un linfoma infrecuente y agresivo, con un pronóstico desafortunado, que requiere tratamiento sistémico intensivo y que se estadifica generalmente mediante la clasificación de Ann Arbor para linfomas no Hodgkin. Esta clasificación podría no ser adecuada para el LACG-AIM, ya que sobreestadificaría y, por lo tanto, se sobretrataría a estas pacientes, que en general tienen mucho mejor pronóstico, además de que esta clasificación no tiene en cuenta la penetración o invasión capsular18.
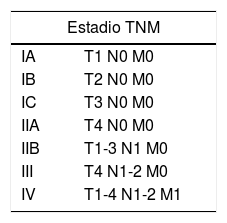
Las guías de la National Comprehensive Cancer Network ahora incluyen una propuesta reciente para clasificar el LACG-AIM utilizando la clasificación TNM (tablas 1 y 2).
Clasificación de TNM
| Clasificación TNM | |
|---|---|
| T: extensión del tumor | |
| T1 | Confinado al seroma o a la porción interna de la cápsula |
| T2 | Infiltración temprana de la cápsula |
| T3 | Conglomerados celulares o adherencias infiltrando la cápsula |
| T4 | Linfoma infiltra más allá de la cápsula |
| N: ganglios linfáticos | |
| N0 | Sin ganglios involucrados |
| N1 | Un ganglio regional positivo |
| N2 | Múltiples ganglios regionales positivos |
| M: metástasis | |
| M0 | Sin actividad tumoral a distancia |
| M1 | Evidencia de actividad tumoral a distancia |
Adaptado de las guías de NCCN, actualizadas en 2019.
El porcentaje de casos de acuerdo a esta clasificación se presenta en la etapa IA 35-70%, IB 3-11%, IC 8-13%, IIA 8-25%, IIB 3,5%, ii 3-9% y etapa iv 1,2%. Hay que tomar en cuenta que en todas las etapas el LACG-AIM se considera como una entidad maligna y en ningún caso se considera como una afección benigna.
Se ha reportado una supervivencia promedio del 94% y 91% a 3 y 5 años, respectivamente, encontrando una mejor predicción de supervivencia y recurrencia con la clasificación TNM en comparación con la clasificación de Ann Arbor19.
TratamientoLo importante en el tratamiento del LACG-AIM es el diagnóstico oportuno y la exéresis quirúrgica completa de las lesiones, lo cual se relaciona con un excelente pronóstico y supervivencia a largo plazo. El objetivo de la cirugía debe de ser extraer el implante junto con la cápsula fibrosa que lo rodea y cualquier tumoración que pueda estar alrededor de la cápsula. La exéresis quirúrgica completa prolonga el promedio de supervivencia y el periodo libre de enfermedad comparado con otras intervenciones de tratamiento. Hasta el momento no existe evidencia de la utilidad de la mastectomía radical o la técnica de ganglio centinela. La disección axilar completa solo se ha utilizado en algunos casos en los que hay un compromiso ganglionar importante. Se estima que de un 2% a un 4% de las pacientes presentan una enfermedad bilateral, por lo que el cirujano debe considerar retirar el implante y la cápsula contralateral12.
La afección confinada a la cápsula (etapa IA-IIA) puede ser tratada solamente con cirugía en caso de lograr una exéresis completa. La tasa de recurrencia es 2,6 veces mayor en la etapa ii y 2,7 mayor en la etapa iii comparados con pacientes en etapa i. La tasa de recurrencia posterior a una exéresis quirúrgica completa en pacientes T4 es de un 14,3%, comparados con un 0% en pacientes T1-T3. El marcaje de las lesiones previo al tratamiento quirúrgico puede facilitar la resección quirúrgica completa y disminuir la tasa de recurrencias, mejorando el pronóstico20.
No existe un estudio prospectivo que proporcione una guía en relación con el manejo de pacientes con enfermedad diseminada. El tratamiento en estos casos generalmente se ha extrapolado del manejo de pacientes con LACG cutáneo o sistémico. En pacientes con enfermedad residual localizada, márgenes positivos o enfermedad irresecable con invasión a la pared torácica se sugiere manejo con radioterapia. La terapia sistémica está justificada en pacientes en etapa IIB-IV. Los oncólogos pueden considerar un manejo similar al que se sugiere para el LACG sistémico con ciclofosfamida, hidroxi daunorrubicina, vincristina y prednisona (CHOP), en combinación con antraciclinas o como alternativa una combinación con brentuximab vedotin. Estas combinaciones de quimioterapia con brentuximab vedotin ha demostrado un promedio de supervivencia mayor en comparación con la quimioterapia CHOP por sí sola, en pacientes con linfomas de células T con expresión del CD3021.
Vigilancia y seguimientoPacientes con respuesta completa al tratamiento pueden ser monitorizadas con interrogatorio y exploración física cada 3 a 6 meses por 2 años. El papel del seguimiento con estudios de imagen aún no está claro, pero la tomografía torácica, abdominal y pélvica con contraste o la PET/TC se pueden considerar cada 6 meses por un periodo de 2 años. Transcurridos los 2 años el seguimiento dependerá de las manifestaciones clínicas de cada paciente21,22.
ConclusionesEs importante reconocer que esta enfermedad no se trata de un verdadero cáncer de mama, sino de un trastorno linfoproliferativo relacionado con la cápsula del implante, ya que esta no forma parte de la glándula mamaria; sin embargo, debido a la relevancia clínica que representa se debe considerar como una enfermedad maligna.
Ha sido ya descrita como una entidad patológica y reconocida por la OMS recientemente desde el año 2016, pero es de suma importancia que sea una enfermedad sospechada en pacientes que tengan las manifestaciones clínicas que han sido descritas anteriormente, por la importancia y relevancia clínica que presenta, tomando en cuenta que ha ido en incremento la población que cuenta con implantes mamarios en la actualidad.
El LACG-AIM se ha relacionado con un proceso inflamatorio posiblemente secundario a un proceso reactivo al implante mamario. La presentación clínica más frecuente es el aumento del volumen en la mama afectada, y con el ultrasonido se puede observar líquido periprotésico que debe diferenciarse de la rotura del implante. El estudio del líquido periprotésico debe ser valorado mediante inmunohistoquímica, y es importante sospechar esta enfermedad en el momento de obtener la muestra del líquido, ya que debe tomarse al menos 50ml para su correcto estudio.
Recientemente se propuso un algoritmo por las guías de la National Comprehensive Cancer Network para el abordaje, diagnóstico y tratamiento (fig. 1) de esta enfermedad.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y han obtenido los permisos correspondientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.