Sr. Director:
Las metástasis son el tumor hepático maligno que se presenta más frecuentemente. Los carcinomas de tubo digestivo, de la mama y del pulmón tienen tendencia a la diseminación hepática. La presencia de metástasis hepáticas modifica de forma importante las opciones terapéuticas y el pronóstico de los pacientes.
Actualmente la resección de las metástasis hepáticas es la mejor estrategia terapéutica en pacientes seleccionadas con cáncer primario de mama1. Este hecho se objetiva en algunas series de pacientes con metástasis hepáticas por cáncer de mama potencialmente resecables en tratamiento con quimioterápicos con una esperanza de vida media de 24 meses y sin supervivencia a los 4 años2, frente a las pacientes con metástasis hepáticas resecables, que tras ser operadas tienen una esperanza de vida media de 50 meses y su supervivencia es del 50% a los 5 años3,4.
Presentamos el caso de una paciente mujer de 59 años intervenida en 1998 con mastectomía radical modificada por carcinoma ductal infiltrante de mama derecha T3N1(1/24) M0, que precisó tratamiento posterior con 6 ciclos de FAC (5-fluorouracilo, adriamicina y ciclofosfamida) y radioterapia junto con tratamiento hormonal sustitutivo (tamoxifeno hasta el año 2004).
En diciembre de 2010, se la estudió por cuadro de estreñimiento de varios meses de evolución que, tras colonoscopia y polipectomía, se diagnosticó de adenocarcinoma pobremente diferenciado de sigma pT1 (adenocarcinoma pobremente diferenciado originado en lesión polipoide que infiltraba hasta un nivel 3 de Haggitt; sin invasión vascular ni linfática; se observa tumor budding extenso, con glándulas tumorales muy cerca del margen de sección profundo), con receptores estrogénicos negativos y CDX2 positivos. En el estudio de extensión, se realizó una tomografía computarizada (TC) toracoabdominopelviana, en la que se objetivaron 3 lesiones focales hepáticas, 2 de ellas hipervasculares en segmentos 4a y 7, probablemente lesiones benignas (adenomas frente a hemangiomas) y una tercera lesión de 2,2cm hipodensa en segmento 6 sospechosa de malignidad. Se solicitó resonancia magnética, en la que se identificaron 2 lesiones, una en el segmento 4 hepático de 1,2cm y otra en la cúpula hepática de 1,5cm, marcadamente hiperintensas, que presentaban una captación inicial nodular periférica con tendencia a la captación centrípeta y homogeneización tardía con el resto del parénquima hepático. El comportamiento por imagen de estas dos lesiones indicaba hemangiomas hepáticos. En el segmento 6 hepático se identificó otra lesión hipointensa en secuencias T1 y con una señal tenue en secuencias T2, con un comportamiento hipovascular con presencia de anillo periférico hipointenso en fases tardías, sospechosa de metástasis. La gammagrafía ósea y la mamografía de la paciente, realizada de acuerdo con el estudio de seguimiento habitual, no mostraron alteraciones patológicas.
Dados los antecedentes de la paciente, se decidió realizar biopsia ecodirigida de lesión en segmento 6, con resultado anatomopatológico de metástasis de carcinoma ductal infiltrante con receptores estrogénicos positivos, receptores de progesterona débiles y c-erb B2 dudosamente positivo, por lo que se realizó SISH, con resultado de no amplificación y Ki 67 50%.
Se decidió cirugía electiva, y se practicó sigmoidectomía laparoscópica con anastomosis terminoterminal circular mecánica. A continuación, durante el mismo acto quirúrgico, por laparotomía subcostal, se realizó ecografía intraoperatoria y se objetivó una lesión de 2×1,8cm en segmento 6 que apuntaba a metástasis. Asimismo, se verificaron los hemangiomas en segmento 4 y 7, y no se encontraron otras lesiones, por lo que se realizó resección limitada de la metástasis en segmento 6. La duración de la cirugía fue de 290 min.
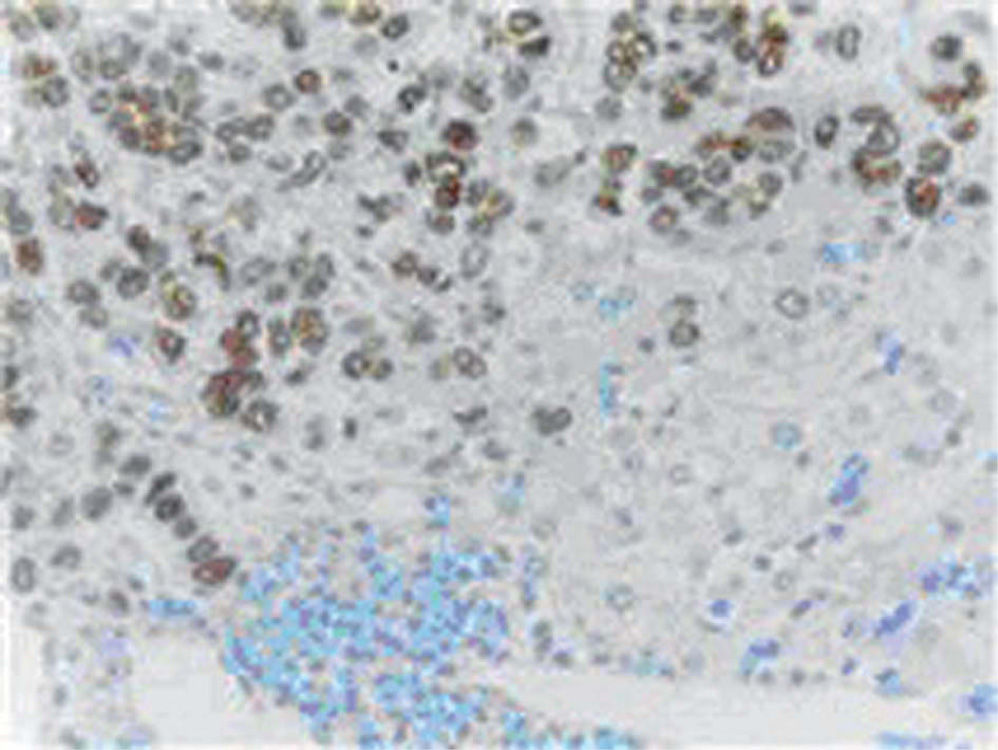
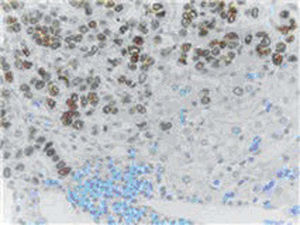
En el resultado anatomopatológico definitivo, no se objetivó tumor de colon, se identificó la zona de cicatriz de polipectomía con fibrosis y proliferación vascular de carácter reactivo con estadio pT1N0(0/14). La metástasis hepática se confirmó para carcinoma de origen mamario (fig. 1) con márgenes de resección libres, receptores estrogénicos y progesterona positivos, C-erB-2 negativo (no amplifica en estudio SISH), Ki 67 40%.
El postoperatorio cursó sin complicaciones, con una estancia postoperatoria de 7 días; 4 semanas tras la cirugía, la paciente inició tratamiento con exemestano 25mg/24h.
Las metástasis hepáticas aparecen en aproximadamente la mitad de las pacientes con cáncer de mama metastático. Típicamente se asocian con metástasis en otras localizaciones, lo que indica su mal pronóstico5. Las metástasis hepáticas aparecen según algunas series en un 1,5–20% de las pacientes con cáncer de mama, incidencia que varía en función del tipo de paciente6.
La resección quirúrgica de las metástasis hepáticas por cáncer de mama debe ofrecerse siempre a todas las pacientes que cumplan los siguientes requisitos: buena situación funcional (ECOG 0–2), posibilidad de realizar una resección hepática completa (R0), que no presente enfermedad extrahepática (excepto metástasis óseas que sean fácilmente controlables con radioterapia)7 y en las que el intervalo libre de enfermedad sea largo8. Sin embargo, ser mujer mayor de 70 años con receptores hormonales negativos se considera contraindicación relativa para la hepatectomía9.
La controversia sobre realizar una colectomía y hepatectomía en el mismo acto quirúrgico se ha debatido en algunas series, con pacientes seleccionados (menos de 4 metástasis unilobulares), ya que resulta en tasas de morbilidad y mortalidad similares, incluso con una estancia hospitalaria más corta que en las operaciones en etapas10–17. Por otra parte, la elección de qué lesión resecar primero y por qué vía de abordaje también sigue siendo aún motivo de debate. Algunos grupos, como el grupo francés de Tranchart18, recomiendan la resección hepática primero, ya que el paciente se encuentra más estable y resulta más sencillo mantener las presiones venosas centrales deseables (necesario en hepatectomías mayores) al inicio de la cirugía. Otros grupos, como el de Weber, prefieren realizar la cirugía colónica primero, sin proceder a realizar la cirugía hepática si se producen complicaciones durante la cirugía del colon (p. ej., perforación) y además evita el edema de asas producido por el pinzamiento portal. Tanto el grupo de Tranchart como el de Hayashi19 realizan actualmente ambos procedimientos por vía laparóscopica con buenos resultados. En nuestro caso, dado que por el momento no disponemos de la infraestructura necesaria para hepatectomías laparoscópicas y que no se trataba de una hepatectomía mayor, decidimos iniciar el abordaje laparoscópico del colon, continuando con una laparotomía subcostal para la ecografía intraoperatoria y la resección hepática limitada.
En el caso que presentamos, la lesión hepática no presentaba el comportamiento hipervascular habitual de las metástasis de origen mamario20,21. Por otra parte, la baja estadificación del tumor colónico tampoco impresionaba de ser el origen primario de la metástasis. Actualmente, el desarrollo de las técnicas de imagen ha limitado la utilización de la biopsia de las metástasis hepáticas a casos muy seleccionados, como en el caso que presentamos, donde el hecho de filiar el origen metastático de la lesión ha condicionado la elección del tratamiento quirúrgico de entrada y el tratamiento adyuvante posterior. Respecto al tratamiento adyuvante posterior, se indicó únicamente hormonoterapia, ya que el intervalo libre de enfermedad era superior a 10 años y los receptores hormonales eran positivos.
En conclusión, conocer el origen primario de la metástasis hepática en pacientes con tumores de distinta etiología influye en la estrategia terapéutica. Por otra parte, tanto la resección de las metástasis hepáticas de cáncer de mama como la realización de cirugía simultánea de las metástasis hepáticas y del colon son posibles, siempre en pacientes seleccionados con una situación funcional que lo permita.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.