INTRODUCCION
En las últimas décadas, con los avances de la genética poblacional y molecular, el cáncer hereditario ha sido objeto de estudio de varios grupos en Europa y en los Estados Unidos. Estudios familiares demostraron la existencia de neoplasias con un patrón definido de transmisión en las diferentes generaciones. Generalmente, los síndromes de cáncer hereditario se caracterizan por su edad de presentación precoz, alta penetrancia, afectación bilateral de los órganos, transmisión vertical de susceptibilidad, así como asociación de diversos tipos de neoplasia en un mismo individuo1,2.
El cáncer de mama representa la neoplasia más frecuente en las mujeres del mundo occidental y la segunda causa de muerte por cáncer en este grupo. A pesar de los avances en los métodos de detección precoz y en las técnicas terapéuticas, el número de casos viene aumentando progresivamente y la mortalidad ha permanecido estable en las últimas décadas.
Estudios epidemiológicos definieron varios factores de riesgo para el desarrollo de esta neoplasia, incluyendo la historia familiar como uno de los más importante. Estudios caso-control demostraron un aumento del riesgo relativo de 2 a 4 veces en las mujeres con uno o más parientes en primer grado con cáncer de mama3; este riesgo aumenta progresivamente con el número de familiares afectados, con la edad en la que se presenta la neoplasia y con la proximidad del parentesco4,5. Cuanto más joven es la enferma en el momento del diagnóstico, más probable es su relación con uno de los síndromes del cáncer de mama hereditario.
En todas las mujeres que desarrollan precozmente un cáncer de mama, debemos plantearnos la hipótesis de un patrón genético de predisposición, el cual generalmente se presenta con más probabilidad en las enfermas con afectación bilateral, asociación con otras neoplasias, incluyendo ovario y colon, con un patrón hereditario sugestivo de transmisión autosómica dominante (tabla 1)1,2. Debemos señalar que casos de cáncer de mama y próstata en enfermos de sexo masculino también son características del grupo de los síndromes de los carcinomas de mama hereditarios.
SINDROME DEL CANCER DE MAMA HEREDITARIO
Estudios epidemiológicos muestran que el 5-10 % de los casos de cáncer de mama presentan una transmisión autosómica dominante. Los síndromes más frecuentemente asociados a esta neoplasia son el de cáncer de mama de localización específica y el de cáncer de mama y ovario hereditarios, síndrome de Li-Fraumeni, síndrome de Cowden, ataxia-telangiectasia, síndrome de Muir-Torre, síndrome de Peutz-Jeghers y el síndrome de Reifenstein (tabla 2)6. De todos estos, centraremos la discusión en el síndrome de cáncer de mama y ovario.
SINDROME DEL CANCER DE MAMA Y OVARIO
Varios genes asociados al cáncer de mama hereditario fueron clonados en los últimos años. En 1990, Hall et al7, a través de estudios de ligamiento genético, describieron una asociación de casos de cáncer de mama hereditarios con una mutación en células germinales de un gen en el locus 17q12-21, que recibió el nombre de BRCA1. Estudios posteriores demostraron una asociación de cáncer de mama y ovario hereditarios asociados a mutaciones de este gen8. Easton et al8, en 1993, analizaron 214 casos con asociación de cáncer de mama y ovario hereditarios llegando a la conclusión de que mutaciones del BRCA1 en células germinales ocurrían en un 45 % de las neoplasias de mama hereditarias y en un 90 % de los casos que pertenecían a cánceres familiares de mama y ovario.
En 1994 se describió un segundo gen susceptible, localizado en el brazo largo del cromosoma 13, siendo designado como BRCA29; familias con mutación de este gen presentaban casos de cáncer de mama en enfermos varones9,10.
CARACTERISTICAS CLINICAS
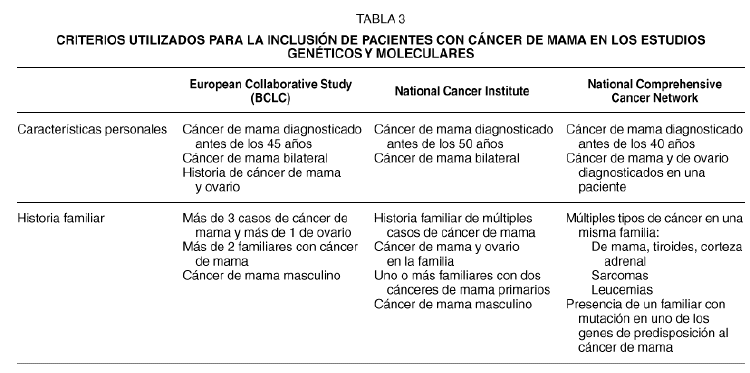
Las enfermas con mutaciones del BRCA1 y BRCA2 presentan características clínicas y familiares distintas, las cuales pueden ser utilizadas para una selección de los individuos que deben de ser sometidos a tests moleculares para identificar las mutaciones de estos genes. Los criterios utilizados por el European Collaborative Study (BCLC), por el National Cancer Institute y por el National Comprehensive Cancer Network para la detección inicial de estas pacientes están resumidas en la tabla 3. En general, el desarrollo de un carcinoma antes de la quinta década de vida, la bilateralidad, la presencia de casos de cáncer de mama en familiares de primer y segundo grado, así como casos de cáncer de ovario, o bien de mama y próstata en familiares de sexo masculino, constituyen criterios para un posible análisis genético.
GENÉTICA MOLECULAR
BRCA1
El gen supresor tumoral BRCA1 se localiza en el brazo largo del cromosoma 17, estando constituido por más de 81 kb, distribuidos en 24 exones11. De estos, el exón 11 abarca casi el 60 % del gen, siendo uno de los principales lugares de detección de mutaciones a través de los métodos moleculares. Este gen codifica una proteína de 1.863 aminoácidos, con un peso molecular de 220 kDa, que normalmente se localiza en el núcleo en forma fosforilada; presentando dos dominios: un dominio en anillo próximo al N-terminal12 y dos dominios BRCT próximo al C-terminal13.El dominio en anillo consiste en varios residuos de cisteína que coordinan la unión de dos iones cinc, permitiendo las interacciones proteína-proteína y proteína DNA. El dominio BRCT se presenta filogenéticamente conservado y se encuentra en diversas proteínas que participan en la regulación del ciclo celular y en la reparación de defectos del DNA13. El BRCA1 se expresa en varios tejidos analizados,iniciándose su transcripción en la fase G1 tardía y manteniéndose durante toda la fase S, lo que sugiere su papel en la síntesis del DNA14. Este hecho es corroborado por la interacción de esta proteína con la proteína RAD5115,16, un componente fundamental de reparación de roturas de la doble-hélice y en la recombinación homóloga. Con todo, la proteína BRCA1 actúa también como factor de transcripción, induciendo la expresión de la proteína p21, un inhibidor de las cinasas dependientes de las ciclinas, la cual actúa como supresor del ciclo celular por interrumpir el paso G1-S.
De esta forma, el BRCA1 es un gen supresor tumoral que actúa tanto como un vigilante como un portero, ya que corrige los errores de la replicación del DNA y también regula la progresión del ciclo celular.
Se han descrito mas de 600 mutaciones del BRCA1, siendo la mayoría de ellas del tipo estructural (frameshift) dando como resultado una proteína truncada o inactiva. La mayor parte de las mutaciones parecen estar restringidas a pocas familias, con todo se puede observar un efecto fundador en familias judías de Ashkenazi, en las que hay una prevalencia de las mutaciones 185delAG y 5382insC16,17.
Las enfermas con mutaciones del BRCA1 presentan un 87 % de posibilidades de desarrollar un carcinoma mamario y un 40-60 % de desarrollar un carcinoma de ovario durante la vida, así como un 65 % de desarrollar un segundo carcinoma mamario cuando viven hasta los 70 años3,6,16,17.
BRCA2
Es un gen supresor tumoral localizado en el locus 13q129, constituido por 70 kb dispuestos en 27 exones, estos exones codifican una proteína de 3418 aminoácidos, que se encuentran en el núcleo de la célula en una forma fosforilada18. No han sido identificados los dominios proteicos específicos del BRCA2, no obstante, Siddique et al19 en 1998 describieron la actividad histona acetil transferasa de la proteína del BRCA2, que puede estar implicada en la capacidad de transcripción del RNA y de reparación del DNA presentados por esta proteína. A pesar de no presentar similitudes bioquímicas o estructurales con la proteína del gen BRCA1, se pueden observar varias semejanzas a nivel funcional: la proteína del BRCA2 se expresa en un gran número de tejidos; como el BRCA1, esta proteína es transcrita en la fase G1 tardía y durante la fase S, bien como interacción con el BRCA1 y con el RAD51 en la reparación de los errores del DNA. Estudios realizados utilizando células procedentes de embriones a las que se les inactiva el BRCA220 presentan defectos en la reparación del DNA, provocando una hipersensibilidad a las radiaciones y a efectos de agentes radiomiméticos.
Hasta el momento se han descrito cerca de 450 mutaciones del BRCA2, siendo las más frecuentes las de tipo estructural (frameshift) y de tipo mutación sin sentido (nonsense), que llevan a la producción de proteínas truncadas o inactivas. Entre las familias de judías Ashkenazi, la mutación 6174delT parece haber aparecido en un ancestro común21.
Las mujeres con mutación del BRCA2 presentan cerca de un 85 % de posibilidades de desarrollar un carcinoma de mama durante la vida y de un 10-27 % de posibilidades de desarrollar un carcinoma de ovario3,6,16,17.
DETECCION DE LAS MUTACIONES DEL BRCA1 Y BRCA2
Existen varios métodos para la identificación de las mutaciones BRCA1 y BRCA2. El método utilizado depende de los recursos del laboratorio, así como de la existencia de una mutación ya conocida en la familia y del grupo étnico al cual pertenece la enferma. La tabla 4 resume los principales métodos de identificación de las mutaciones, así como sus mayores limitaciones.
PATOLOGIA: ¿QUÉ PUEDE HACER EL PATOLOGO PARA CONTRIBUIR EN EL DIAGNOSTICO DEL CANCER DE MAMA HEREDITARIO?
Varias características histológicas recientemente descritas indican patrones distintos entre los carcinomas hereditarios ligados a mutaciones del BRCA1 y del BRCA2, cuando se comparan a carcinomas hereditarios ligados a otros síndromes y a tumores esporádicos.
Como en los carcinomas de mama esporádicos, el tipo histológico más común de carcinoma de mama hereditario es el ductal invasivo; no obstante, varios estudios demostraron una alta prevalencia de carcinomas medulares típicos y atípicos en enfermas con mutaciones del BRCA1 o BRCA222-27. Las portadoras de estas mutaciones presentan un riesgo relativo de 2,47 de desarrollar un carcinoma medular típico o atípico comparadas con el grupo control25. Armes et al, relatan una frecuencia de 60 % de carcinomas medulares en pacientes australianas con mutaciones del BRCA1 contra un 5 % entre pacientes del grupo control22. En el mayor estudio correlacionando las características anatomopatológicas de los carcinomas hereditarios, publicado por el Breast Cancer Linkage Consortium23, en 1997, se observó una prevalencia del 13 % de carcinomas medulares en enfermas con mutaciones del BRCA1, 3 % de las enfermas con mutaciones del BRCA2 y en 2 % del grupo control. De acuerdo con este estudio23, pueden ser observados dos perfiles histológicos distintos en las enfermas portadoras de mutaciones del BRCA1 y del BRCA2 cuando son comparadas con enfermas con tumores esporádicos: las mutaciones en el BRCA1 le confieren un mayor grado nuclear, menor formación de túbulos, actividad mitótica más elevada, infiltrado linfoide exuberante, y márgenes expansivos; las mutaciones del BRCA2 están asociadas raramente a márgenes expansivos, asociadas a una menor formación de túbulos y a una actividad mitótica menos llamativa. En las enfermas australianas, hubo una mayor prevalencia de carcinomas lobulillares pleomórficos en las enfermas con carcinomas hereditarios ligados al BRCA2, de la misma forma, Marcus et al25 demostraron un exceso de carcinomas tubulolobulares en pacientes con carcinoma de mama hereditario. Estos dos hallazgos no fueron corroborados por otros estudios.
La presencia de un componente in situ ductal o lobulillar en enfermas con mutaciones del BRCA1 es controvertido; no obstante, Eisinger et al24, así como los estudios del BCLC23 demostraron una menor frecuencia de carcinoma ductal o lobulillar in situ en enfermas con carcinomas de mama hereditarios.
De esta forma, cuando un patólogo quirúrgico se encuentra con una mujer joven (menor de 45 años), que presenta un carcinoma mamario con alto grado nuclear, escasa formación de túbulos, márgenes expansivos, infiltrado linfoide prominente y componente intraductal o lobulillar in situ escaso o ausente, debe de pensar en la posibilidad de un carcinoma hereditario asociado a mutaciones del BRCA.
En relación con los receptores hormonales, los carcinomas mamarios asociados a mutaciones del BRCA1 son más frecuentemente negativos para receptores de estrógenos (RE) y de progesterona (RP), con una negatividad para ambos receptores que varía entre 60 y 95 %28-32. Mientras en nuestra serie, el 72 % de los carcinomas hereditarios con mutaciones del BRCA1 presentan positividad para RE, no habiendo diferencia estadísticamente significativa cuando los comparamos con el grupo control27. Sin embargo, los carcinomas asociados a mutaciones del BRCA2, a pesar de ser estudiados en menor escala, presentan una positividad para receptores hormonales igual o superior a la de los carcinomas esporádicos22,33.
Un análisis de otros factores pronósticos usualmente estudiados en los carcinomas de mama por los patólogos, como el índice proliferativo, la expresión inmunohistoquímica de p53 y la sobreexpresión del c-erb-B2 presenta características diferentes entre los carcinomas hereditarios y los esporádicos.
El análisis del índice proliferativo de los carcinomas mamarios asociados a mutaciones del BRCA1 estudiado por inmunohistoquímica para el marcador de proliferación celular M1B1/Ki-67 presenta diferencias significativas cuando se comparan con los índices proliferativos de los carcinomas con mutaciones del BRCA2 y los esporádicos, con un índice proliferativo más elevado en los carcinomas asociados a las mutaciones del BRCA127,28,30.
Varios estudios demostraron tanto una mayor frecuencia de expresión nuclear del p53 detectada por inmunohistoquímica, como una mayor tasa de mutaciones de este gen, en casos de CM hereditario asociado a mutación del BRCA1, cuando es comparado con grupos control22,27,28. En nuestra casuística, el 54 % de los carcinomas hereditarios ligados a mutaciones del BRCA1 presentan mutaciones del gen TP53 contra el 38 % de los carcinomas esporádicos27. En los casos asociados al BRCA2, se observó una mayor prevalencia de mutaciones del TP53, no obstante no hubo una mayor expresión nuclear de proteína por el método inmunohistoquímico34.
Armes et al22, Robson et al30, y el estudio del BCLC23 demostraron una menor tasa de expresión inmunohistoquímica del c-erb-B2 en los carcinomas asociados a mutaciones del BRCA1 cuando se compararon con los carcinomas esporádicos; no obstante, ni el estudio de Lynch et al28 ni los datos provenientes de nuestra casuística27 corroboran tales hallazgos, no habiendo diferencias estadísticamente significativas entre los dos grupos.
No hay comprobación de que otros marcadores inmunohistoquímicos usualmente analizados en los carcinomas mamarios, incluyendo la catepsina D, bcl-2, p27 o la ciclina D1, de que presenten diferencias estadísticamente significativas entre los carcinomas de mama hereditarios y los esporádicos30.
En nuestra casuística, otros dos factores demostraron diferencias estadísticamente significativas cuando se comparan los carcinomas hereditarios con mutaciones del BRCA1 y los carcinomas esporádicos: el estudio semicuantitativo de la angiogénesis demostró una mayor densidad de microvasos en los primeros, así como que estos presentaron una mayor tasa de aneuploidía determinada por citometría estática27. La tabla 5 presenta un sumario de las principales características histológicas y de los marcadores biológicos de los carcinomas mamarios hereditarios.
Debido a que los tests de genética molecular tienen muchas dificultades y de que a veces la historia familiar presenta limitaciones en la identificación de casos de carcinomas hereditarios, la asociación de características clínicas y anatomopatológicas de los carcinomas de mama puede ser mucho más eficaz para identificar individualmente portadores de mutaciones en los genes de susceptibilidad al cáncer de mama. Recientemente, Lidereau et al35, demostraron que la asociación entre la edad precoz al diagnóstico (35 años), asociada a casos con grado histológico III y RE negativos aumentaba la eficacia en la detección de mutaciones del BRCA1 en un 66 % con reducción de hasta un 30 % de los costos.
En conclusión, el estudio de las características anatomopatológicas del cáncer de mama hereditario contribuye a la detección de nuevos casos y nos informa sobre las posibles funciones de los genes, a la vez que tiene implicaciones en el desarrollo de las estrategias de prevención. Así, dado que la mayor parte de los casos BRCA1 positivos son RE negativos, el uso de tamoxifeno como prevención de estos tipos de cáncer podría estar limitado.