múltiples estudios han evaluado la utilidad de la 18F-FDG-PET/TC en la estadificación inicial del cáncer de mama, demostrando un importante impacto clínico con cambio en el manejo terapéutico; sin embargo, su papel en la práctica clínica actual es controvertido y su uso sigue siendo opcional para las principales guías. Nuestro objetivo es valorar la utilidad de la PET/TC en este contexto.
Material y métodose han analizado los resultados de la PET/TC en pacientes recientemente diagnosticadas de cáncer de mama (2021–2022) de manera visual y semicuantitativa mediante SUVmax. Los hallazgos positivos se confirmaron mediante procedimientos de imagen específicos.
Resultadosevaluamos prospectivamente 166 pacientes (59,8 ± 12,08 años). El tumor primario fue detectado por PET/TC en todos los casos. En el diagnóstico 58 pacientes presentaban afectación ganglionar axilar por PET/TC. La ecografía axilar detectó la afectación ganglionar en el 79% (46/58). Además, en las 46 pacientes con afectación ganglionar detectada por ambas pruebas, la PET/TC incrementó el número de lesiones ganglionares modificando así el estadio. Se diagnosticaron metástasis a distancia no sospechadas mediante PET/TC en 12 pacientes, 10 tenían afectación ganglionar axilar. Las variables significativamente asociadas con mayor probabilidad de metástasis axilares o a distancia en PET/TC fueron: grado histológico 2–3 (p = 0,03), Ki67 elevado (p = 0,002) y superior SUVmax de lesión primaria (p = 0,02).
Conclusionesnuestros resultados sugieren una utilidad potencial del PET/TC en la estadificación inicial de pacientes con cáncer de mama, particularmente en aquellas con afectación axilar para la detección de metástasis a distancia no sospechadas.
Multiple studies have evaluated the usefulness of 18F-FDG-PET/CT in the initial staging of breast cancer, demonstrating an important clinical impact with a change in therapeutic management. However, its role in current clinical practice is controversial and its use remains optional for major guidelines. Our objective is to assess the usefulness of PET/CT in this context.
Material and methodThe results of PET/CT in patients recently diagnosed with breast cancer (2021–2022) have been analyzed visually and semiquantitatively using SUVmax. Positive findings were confirmed by specific imaging procedures.
ResultsWe prospectively evaluated 166 patients (59.8 ± 12.08 years). The primary tumor was detected by PET/CT in all cases. At diagnosis, 58 patients had axillary lymph node involvement by PET/CT. Axillary ultrasound detected lymph node involvement in 79% (46/58). Furthermore, in the 46 patients with lymph node involvement detected by both tests, PET/CT increased the number of lymph node lesions, thus modifying the stage. Unsuspected distant metastases were diagnosed by PET/CT in 12 patients, 10 had axillary lymph node involvement. The variables significantly associated with a higher probability of axillary or distant metastases in PET/CT were: histological grade 2–3 (p = 0.03), elevated Ki67 (p = 0.002) and higher SUVmax of the primary lesion (p = 0.02).
ConclusionsOur results suggest a potential usefulness of PET/CT in the initial staging of patients with breast cancer, particularly in those with axillary involvement, for the detection of unsuspected distant metastases.
El cáncer de mama fue el tumor maligno más frecuentemente diagnosticado en el mundo en el año 2020, con una estimación de más de 2,2 millones de nuevos casos. Los cánceres más frecuentemente diagnosticados en España en 2023 serán los de colon y recto, seguidos por los cánceres de mama, con una estimación de 35.001 nuevos casos1. El diagnóstico precoz y una precisa estadificación inicial son esenciales para un adecuado manejo de las pacientes con cáncer de mama.
En los últimos años, la 18F-FDG PET/TC (PET/TC) está asumiendo un rol de mayor importancia en la estadificación inicial del cáncer de mama2,3, si bien no se recomienda de manera rutinaria.
De acuerdo con las principales guías de cáncer de mama, como la National Comprehensive Cancer Network (NCCN), la Sociedad Europea de Oncología Médica (ESMO), la Sociedad Española de Oncología Médica (SEOM) y el National Institute for Care Excellence (NICE), la PET/TC no está indicada en mujeres con enfermedad en estadios precoces (I o II) o, incluso, en aquellas con estadio III operable4–9, considerándose opcional en aquellos casos de hallazgos sospechosos y/o equívocos en las imágenes de TC o RM y en casos de cáncer localmente avanzado, especialmente en caso de afectación ganglionar axilar avanzada, por el mayor riesgo que presentan de afectación metastásica a distancia al diagnóstico que determinarían un cambio en la estrategia terapéutica. Sin embargo, los niveles de evidencia y las recomendaciones para el uso del PET/TC varían según las guías, existiendo al día de hoy controversia. Nuestro estudio pretende evaluar el valor añadido de la realización de un estudio PET/TC en pacientes recientemente diagnosticadas de cáncer de mama, así como el impacto en la estadificación y por tanto en el manejo de las mismas.
MétodosSe ha realizado un estudio longitudinal prospectivo, entre noviembre de 2021 y julio de 2022, en el que se incluyeron pacientes con diagnóstico anatomopatológico de cáncer de mama (estadios IA-IIIA) a las que se les realizó estadificación inicial mediante PET/TC. Este estudio ha recibido la aprobación por parte del comité de ética del hospital. Todas las pacientes fueron informadas verbalmente y por escrito de la prueba y firmaron el consentimiento informado en el momento de la realización de la misma.
Las pacientes candidatas a la realización de PET/TC de estadificación inicial fueron seleccionadas en el comité multidisciplinar de cáncer de mama del Hospital Virgen de las Nieves de Granada, España. La prueba se realizó en el servicio de Medicina Nuclear del mismo centro, que dispone de un equipo PET/TC (Siemens Biograph 600) y consiste en un rastreo corporal que incluye desde la base de cráneo hasta el tercio proximal de los fémures. Para la realización de la exploración, las pacientes siguieron una preparación previa consistente en ayuno de al menos 6 horas. Entre el momento de la inyección intravenosa de 18F-fluorodesoxiglucosa (18F-FDG) y la exploración se estableció un tiempo de reposo entre 45 y 60 minutos. Los hallazgos resultantes en los estudios PET/TC fueron valorados de manera visual (considerando positivo una actividad superior al fondo, adyacente a las lesiones) y semicuantitativa mediante el cálculo del SUVmax (standardized uptake value) por 2 médicos especialistas en medicina nuclear. El análisis semicuantitativo se realizó mediante volúmenes de interés (VOI) en los hallazgos patológicos encontrados.
Se recogieron las siguientes variables: edad, tipo histológico, inmunofenotipo, grado tumoral, tamaño del tumor, estadio clínico (cTNM), estadio patológico (pTNM), hallazgos de la mamografía, ecografía mamaria y axilar y hallazgos del PET/TC (localización del tumor primario, actividad metabólica mediante SUVmax y localización de las metástasis).
En el análisis descriptivo se emplearon medidas de tendencia central (media) y dispersión (desviación estándar) para las variables numéricas, y la distribución de frecuencias absolutas y relativas para las variables categóricas. La asociación entre las variables categóricas se evaluó por medio de tablas de contingencia aplicando la prueba de chi cuadrado para comparaciones individuales o la prueba exacta de Fisher para comparaciones múltiples. Para estudiar la asociación entre las distintas variables independientes se utilizó el análisis de regresión logística binaria univariante. Finalmente, se ajustó un modelo multivariante a partir de aquellas variables que mostraron asociación significativa en el análisis univariante. Los datos se procesaron para su análisis mediante el software IBM SPSS Versión 25.0 (IBM Corp, Armonk, Nueva York). Un valor de p < 0,05 se consideró estadísticamente significativo.
ResultadosSe han incluido un total de 166 pacientes con diagnóstico anatomopatológico de cáncer de mama a las que se realizó un estudio PET/TC de estadificación inicial.
La edad media fue de 59,8 años (desviación estándar de 12,08 años). El tipo histológico más frecuente fue el carcinoma ductal, en 81% de los casos, moderadamente diferenciado (grado II) en el 54%, con subtipo luminal en el 76% de las pacientes. Las características clínicas de las pacientes están recogidas en la tabla 1.
Características de las pacientes
| n (%) | |
|---|---|
| Pacientes | 166 |
| Edad media ± DE | 59,8 ± 12,08 |
| Estadio clínico antes del PET/TC | |
| IA | 61 (37,9) |
| IIA | 56 (34,8) |
| IIB | 26 (16,1) |
| IIIA | 14 (8,7) |
| IIIC | 4 (2,5) |
| Histología del tumor | |
| Ductal infiltrante | 135 (81,3) |
| Lobulillar infiltrante | 22 (13,3) |
| Otros | 8 (4,8) |
| Grado | |
| Grado 1 | 39 (23,9) |
| Grado 2 | 90 (55,2) |
| Grado 3 | 34 (20,9) |
| Subtipo molecularLuminal | |
| 127 (77) | |
| HER2 | 22 (13,3) |
| Triple Negativo | 16 (9,7) |
| Media diámetro tumor ± DE (mm) | 26,3 ± 15,8 |
PET/TC: tomografía por emisión de positrones/tomografía computarizada.
El tumor primario fue detectado por PET/TC en todos los casos, la media del SUVmax de la lesión primaria fue 9,6. El estudio PET/TC identificó afectación ganglionar metastásica en 58 pacientes (35%). La afectación ganglionar se detectó previamente mediante ecografía axilar en el 79% (46/58). En aquellos casos de PET/TC negativo, todas las pacientes se realizaron biopsia selectiva de ganglio centinela; en caso de que el PET/TC fuera positivo, se hizo ecografía de segunda mirada; y en todos los casos en las que esta mostró resultado negativo, se llevó a cabo una biopsia selectiva de ganglio centinela. Por tanto, el PET/TC aumentó el estadio en 12 pacientes, pasando de N0 a N1.
Además, en las 46 pacientes en las que la afectación ganglionar fue detectada por ambas pruebas, la PET/TC incrementó el número de lesiones ganglionares, modificando así el estadio (N1 a N2 en 13 pacientes, N1 a N3 en 1, N2 a N3 en 4 pacientes) (tabla 2).
Cambios en el estadio clínico tras la tomografía por emisión de positrones/tomografía computarizada
| n | |
|---|---|
| De N0 a N+ | |
| T1N0 (E. IA) → T1N1 (E. IIA) | 4 |
| T2N0 (E. IIA) → T2N1 (E. IIB) | 3 |
| T3N0 (E. IIB) → T3N1 (E. IIIA) | 1 |
| T1N0 (E. IA) → T1N2 (E. IIIA) | 1 |
| T3N0 (E. IIB) → T3N2 (E. IIIC) | 1 |
| T2N0 (E. IIA) → T2N3 (E. IIIC) | 2 |
| Incremento de N | 2 |
| T1N1 (E. IIA) → T1N2 (E. IIIA) | |
| T2N1 (E. IIB) → T2N2 (E. IIIA) | 7 |
| T3N1 (E. IIIA) → T3N2 (E. IIIC) | 4 |
| T2N1 (E. IIB) → T2N3 (E. IIIC) | 1 |
| T2N2 (E. IIIA) → T2N3 (E. IIIC) | 3 |
| T3N2 (E. IIIC) → T3N3 (E. IIIC) | 1 |
| A distancia | |
| Hueso | 6 |
| Pulmón | 2 |
| Hígado | 1 |
| Ganglionares + hueso | 2 |
| Ganglionares + pulmón | 1 |
E.: estadio clínico.
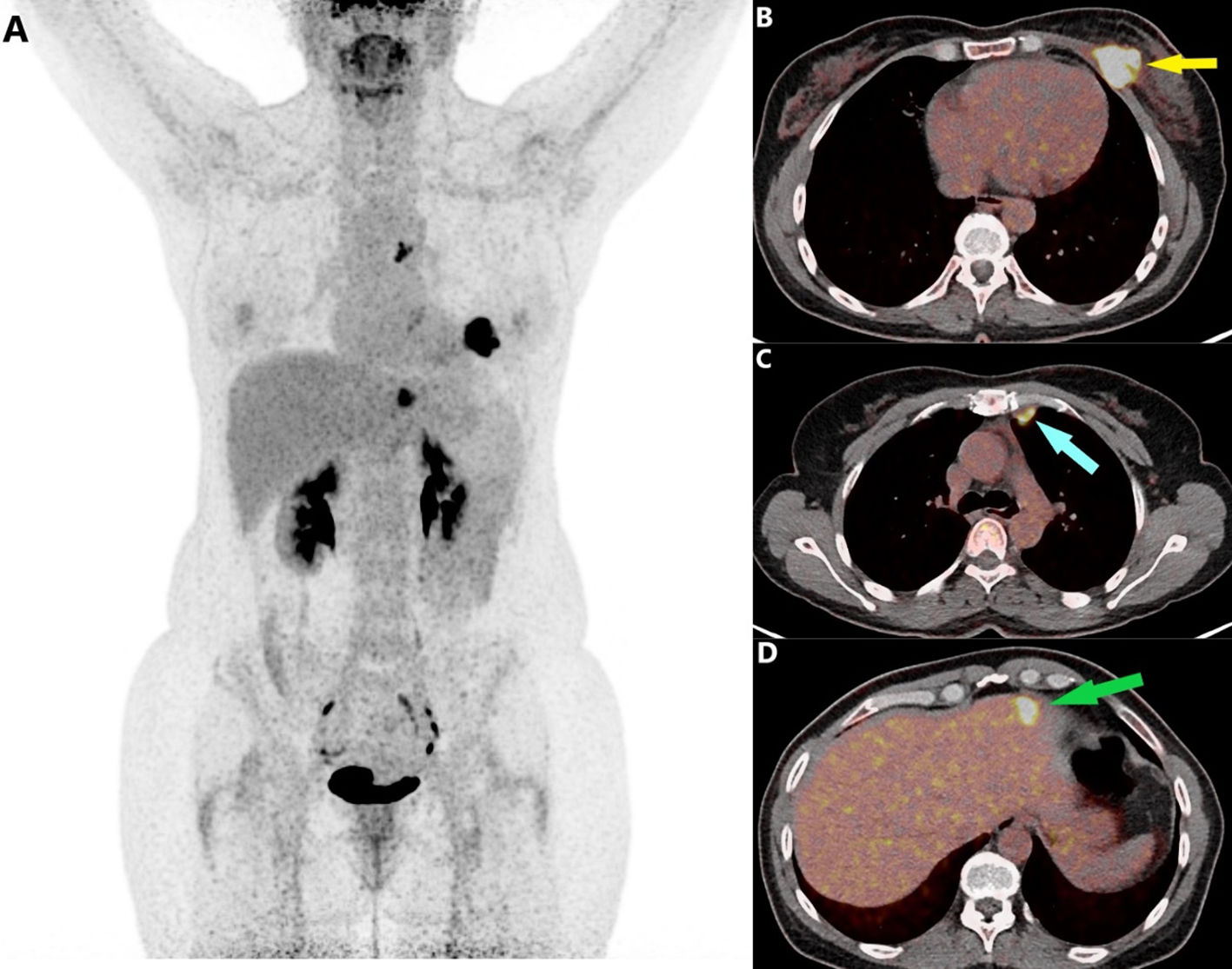
Se diagnosticaron metástasis a distancia no sospechadas mediante PET/TC en 12 pacientes (7%), 10 de ellas tenían afectación ganglionar axilar (17%). La localización más frecuente de las metástasis a distancia detectadas fue el hueso (n = 8), seguido de los ganglios a nivel supraclavicular, laterocervical, mediastínico, hiliar pulmonar o retroperitoneal (n = 3), pulmón (n = 3) e hígado (n = 1) (fig. 1).
A) Imagen de estudio 18F-FDG PET/TC en proyección de máxima intensidad de una paciente con diagnóstico de cáncer de mama localmente avanzado (T4N3), en la que se observan 3 focos hipermetabólicos que se corresponden con B) una lesión mamaria izquierda con extensión a músculo pectoral (flecha amarilla), C) afectación ganglionar en mama interna izquierda (flecha azul) y D) lesión hepática (flecha verde). Tras el cual el estadio de la paciente cambió de IIIC a IV.
Las variables significativamente asociadas con una mayor probabilidad de metástasis axilares o a distancia en PET/TC fueron: grado histológico alto (2–3) (p = 0,03), niveles elevados de Ki67 (p = 0,002) y superior SUVmax de lesión primaria (p = 0,02).
DiscusiónLa estadificación inicial en pacientes con cáncer de mama es crucial, ya que la detección de afectación ganglionar y de metástasis a distancia va a ser determinante en la elección de la estrategia terapéutica más adecuada y un condicionante del pronóstico.
Estudios previos han demostrado una mayor sensibilidad del 18F-FDG PET/TC en la detección de metástasis regionales y a distancia cuando se compara con la TC de cuerpo completo, así como una mayor precisión en la detección de metástasis óseas cuando se compara con la gammagrafía ósea10–12. Esto ocurre mayoritariamente en aquellos casos en los que se trate de lesiones metastásicas óseas de tipo lítico y/o mixto y en casos de infiltración de médula ósea. En el caso de las blásticas es más variable y puede ser superior la gammagrafía ósea, no obstante, las lesiones blásticas muestran cambios osteocondensantes identificables en las imágenes de la TC13 por lo que en un estudio PET/TC serían detectables.
Nuestro estudio muestra una mayor sensibilidad del PET/TC en la detección de afectación ganglionar axilar al compararlo con la gold standard, la ecografía axilar. Doce pacientes mostraron afectación ganglionar axilar, únicamente detectada en el estudio PET/TC que fue confirmada posteriormente mediante biopsia. Este cambio en el estadio implicó una modificación de la estrategia terapéutica, al considerar a las pacientes candidatas a tratamiento sistémico primario previo a la cirugía. Pero, además, en el resto de pacientes que mostraron afectación ganglionar axilar metastásica por ambas pruebas (ecografía y PET/TC), el estudio PET/TC mostró un mayor número de lesiones ganglionares en un total de 18 pacientes.
En las pacientes con afectación ganglionar que van a recibir tratamiento sistémico primario previo a la cirugía, la realización de la biopsia selectiva del ganglio centinela tiene una aplicación controvertida. Por este motivo, y partiendo de la idea bastante lógica e intuitiva de que el mejor ganglio axilar para valorar la respuesta a la quimioterapia neoadyuvante es aquel en el que se ha confirmado la presencia de metástasis antes del tratamiento, es decir, el ganglio positivo biopsiado, se han propuesto diferentes procedimientos para el marcaje de dicho ganglio que garanticen su identificación intraoperatoria y la extirpación en la cirugía axilar: semillas radiactivas de yodo-125 (125I), arpones/guías metálicas, tatuaje con una suspensión de partículas de carbón, ecografía intraoperatoria, reflectores electromagnéticos, identificación por radiofrecuencia y semillas magnéticas14–16. En el reciente escenario del marcaje de las lesiones ganglionares axilares metastásicas en pacientes que van a recibir tratamiento sistémico primario previo a la cirugía, una mayor precisión en la detección del número de ganglios axilares es fundamental, por lo que el PET/TC podría ser de utilidad a la hora de seleccionar a pacientes candidatas a dicho marcaje.
Las pacientes con afectación ganglionar tienen un mayor riesgo de afectación metastásica a distancia, lo que justificaría la realización de un estudio PET/TC en este grupo de pacientes. El porcentaje de pacientes metastásicas en nuestro estudio tras la estadificación PET/TC es del 7%, pero este porcentaje se incrementa de manera significativa si atendemos a pacientes con afectación ganglionar donde aumenta al 17%. En relación a la detección de metástasis a distancia, estudios como el de Niikura17 et al. muestran una mayor sensibilidad y especificidad de la PET/TC (97,4 y 91,4%, respectivamente) en la detección de dichas metástasis frente a los métodos de diagnóstico convencional (85,9 y 67,3%). Igualmente, un estudio reciente de Dayes et al.18, en el que comparan de manera aleatoria (es el primer y único ensayo controlado aleatorizado sobre este tema) la estadificación con PET/TC frente a MDC en pacientes con cáncer de mama estadios IIb/III, concluyen que el estudio PET/TC detecta más metástasis a distancia que los métodos de diagnóstico convencionales (23% vs. 11%).
Si consideramos esta mayor precisión en la estadificación por parte del PET/TC podemos asumir también que se trata de una prueba costo-eficiente, ya que podría sustituir otras pruebas que se han venido realizando para la estadificación inicial y evitaría tratamientos costosos que no estarían indicados por no ser eficaces. Así mismo, los pacientes se realizarían una única prueba (rastreo corporal total) que redundaría en su comodidad (una única cita hospitalaria), posibilidad de disminuir la dosis de radiación recibida, sobre todo al disminuir la necesidad de pruebas radiológicas adicionales en caso de resultados discordantes entre las distintas pruebas y evitar retrasos innecesarios en el inicio del tratamiento, además de que no recibirían tratamientos ineficaces que llevan asociadas una alta morbilidad.
Entre las limitaciones de nuestro estudio se encuentra el escaso número de pacientes con afectación ganglionar axilar, junto con la inclusión de pacientes con cáncer de mama en estadios iniciales, que podría justificar una menor tasa de detección de metástasis a distancia si comparamos nuestros resultados con los de otros estudios17,18.
ConclusiónNuestros resultados sugieren una utilidad potencial del 18F-FDG PET/TC en la estadificación inicial de pacientes con cáncer de mama, particularmente en aquellas pacientes con afectación ganglionar axilar metastásica para la detección de metástasis a distancia no sospechadas.
Responsabilidades éticasEl presente estudio ha recibido la aprobación por parte del comité ético del hospital donde se ha realizado.
Consentimiento informadoLos autores declaran que todas las pacientes fueron informadas y firmaron el consentimiento para la realización del estudio.
FinanciaciónLos autores declaran que no han tenido financiación para la realización de este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.