REV. SENOLOGÍA Y PATOL. MAM., 12, 1 (40-43), 1999
CASOS CLÍNICOS
Sarcoma de mama contralateral en paciente sometida a cirugía conservadora y radioterapia por cáncer de mama
Contralateral breast sarcoma in a patient after undergoing conservative surgery and radiotherapy for breast cancer
J. C. Jordán Balanzá, J. A. Pallas Regueira, E. Buch Villa, M. D. Ruiz Carmona, J. V. Roig Vila
Servicio de Cirugía General y Digestiva.
Hospital de Sagunto. Valencia.
Correspondencia:
J. C. Jordán Balanzá.
Periodista Azzati, 2, pta. 1.
46520 Puerto de Sagunto
(Valencia).
SUMMARY
Purpose: Sarcoma of the breast represents less than 1% of malignant tumors of the breast. As a result of increasing use of conservative surgery for the treatment of breast cancer, the number of cases of radiotherapy induced breast sarcoma has increased (BSIRT).
Patient and method: A 58-year-old patient had a malignant tumor of the contralateral breast 3 years after conservative surgery and radiotherapy for infiltrating ductal carcinoma of the left breast. Modified radical mastectomy was performed and the tumor was identified as a mammary sarcoma with epulis type giant cells.
Result: The patient underwent postoperative radiotherapy. The tumor progressed postoperatively and the patient died 16 months after surgery.
Conclusions: When faced with a breast tumor after conservative surgery and radiotherapy, radiotherapy-induced breast sarcoma should be excluded. We emphasize the low frequency of this type of tumor and the poor response to adjuvant treatment of this sarcoma variant.
Palabras clave
Sarcoma de mama, Sarcoma inducido por radioterapia, Cirugía conservadora del cáncer de mama, Cáncer de mama.
Key words
Breast sarcoma, Radiotherapy-induced sarcoma. Conservative surgery for breast cancer, Breast cancer.
INTRODUCCIÓN
El tratamiento conservador del cáncer de mama mediante tumorectomía y vaciamiento axilar ha demostrado tener las mismas tasas de control de la enfermedad que la mastectomía radical modificada con mejor resultado cosmético, pero es preciso añadir la radioterapia (RT) para evitar una incidencia elevada de recidivas locorregionales..1, 2
La radioterapia presenta el riesgo de efectos adversos sistémicos y locorregionales sobre la mama tratada y la contralateral, entre los cuales se encuentra la aparición de sarcomas de mama como segunda neoplasia..3-6
Los sarcomas de mama son tumores poco frecuentes que implican a menos del 1% de las pacientes con cáncer de mama y menos del 5% del total de los sarcomas de partes blandas..7
La incidencia de sarcoma de mama inducido por radioterapia (SMIRT) oscila entre el 0,03 y 0,8% de pacientes irradiados por cáncer de mama, apareciendo con un intervalo de latencia entre 7 y 17 años tras la radioterapia..4, 7-10
Los SMIRT se observan, según Kurtz et al (1988), en dos de cada 1.000 supervivientes más de 5 años si el seguimiento se extiende durante una década..10
Se ha calculado que la mama contralateral recibe en el curso de la radioterapia que sigue a cirugía conservadora por cáncer de mama una dosis que oscila entre 1 y 3 Gy; sin embargo, en series amplias no existe acuerdo acerca del riesgo de carcinoma de la mama contralateral en las pacientes sometidas a radioterapia a dosis habituales..4
Presentamos un caso único de sarcoma mamario de células gigantes tras irradiación de la mama contralateral por un carcinoma ductal.
CASO CLÍNICO
Paciente de 58 años de edad, postmenopáusica, con antecedentes de biopsia mamaria derecha en 1984 por una lesión benigna, tratada en 1991 por un carcinoma ductal infiltrante de mama izquierda con quimioterapia neoadyuvante, cirugía conservadora y posteriormente quimioterapia y radioterapia adyuvantes (esta última iniciada en septiembre de 1994 con telecobaltoterapia sobre la pared torácica mediante dos campos tangenciales paralelos y opuestos con dosis de 60 Gy a razón de 2,5 Gy por día durante 29 días).
Durante el control postoperatorio en el año 1994, 3 años después del tratamiento con radioterapia, se constata a la exploración una tumoración en cuadrante superoexterno de mama derecha de 2,5 cm de diámetro bien delimitada y no adherida a planos profundos que mamográfica y ecográficamente se confirma su carácter sólido y de límites bien definidos de 2,5 * 3 cm. No se detectaron adenopatías palpables.
La citología y la punción con trócar son informadas como sarcoma de alto grado de malignidad con células de tipo osteoclástico sin que sea posible descartar carcinoma metaplásico. El hemograma y la bioquímica fueron normales y las cifras de antígeno carcinoembrionario y CA 15.3 eran normales.
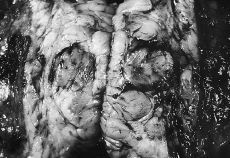
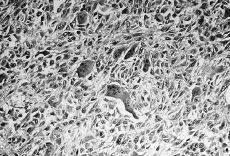
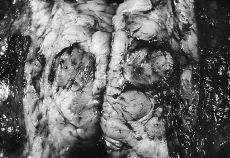
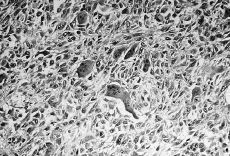
Se realizó mastectomía radical modificada derecha con vaciamiento ganglionar de los tres niveles de Berg. El estudio anatomopatológico informó que se trataba de un sarcoma mamario desarrollado en el seno o adyacente a un fibroadenoma preexistente (Fig. 1), cuyas características histológicas corresponden a un sarcoma de células gigantes tipo epulis (Fig. 2). No se observa afectación de los ganglios linfáticos axilares. En el postoperatorio fue sometida a radioterapia adyuvante. En el último control tras 16 meses de seguimiento posterior la paciente presentaba metástasis pulmonares y hepáticas, siendo exitus por progresión de su enfermedad.
Fig. 1. Imagen histológica que muestra áreas de fibroadenoma en relación con el sarcoma. (HE, *100.)
Fig. 2. Corte histológico del tumor. Se observa cierto pleomorfismo celular con predominio fusocelular, atipias, mitosis y numerosas células gigantes multinucleadas de aspecto osteoclástico. (HE, *200.)
DISCUSIÓN
La RT juega un papel importante en el tratamiento de los pacientes neoplásicos. Un 60% de los pacientes con cáncer van a recibir RT durante el curso de su enfermedad, tanto como tratamiento primario de intención curativa como tratamiento paliativo..11
Los sarcomas mamarios de células gigantes tipo epulis son tumores raros. Son más frecuentes otro tipo de sarcomas como cistosarcoma filodes, osteosarcoma, liposarcoma y angiosarcomas. La presencia de células gigantes multinucleadas tipo osteoclasto en sarcomas mamarios es un raro fenómeno descrito en 30 casos desde 1896, el 50% de ellos son sarcomas de células gigantes tipo osteoclástico maligno.
En la serie de 7.620 pacientes con carcinoma de mama tratadas con RT en el Instituto Gustave Roussy entre 1954 y 1983, 11 pacientes desarrollaron sarcomas que pueden ser inducidos por RT, lo que demuestra una incidencia acumulada de SMIRT de 0,2% a los 10 años..9 Pierce et al observan una incidencia de 0,18%, con un riesgo actuarial a los 10 años de 0,8%..12
Valagussa et al estudiaron entre 1973 y 1978 a 845 pacientes sometidas a mastectomía, de las que ninguna recibió RT y 666 recibieron quimioterapia. Se desarrollaron tumores sólidos en 21 pacientes, ninguno de los cuales resultó ser un sarcoma..13
Se ha cuestionado si la RT en el tratamiento del cáncer de mama puede condicionar un aumento del riesgo de cáncer de mama contralateral debido a la irradiación difusa. Sarrazin et al, en el Gustave Roussy, en el seguimiento a 10 años de dos grupos randomizados de pacientes sometidos a mastectomía o cirugía conservadora y RT no encuentran diferencia en la incidencia de carcinomas contralaterales..14
La radioterapia postoperatoria puede inducir el desarrollo de tumores en las áreas irradiadas. El origen de estos tipos de tumores es controvertido, dado que existen pocos casos publicados y no están completamente estudiados..15 Algunos autores opinan que los sarcomas se desarrollan en fibroadenomas preexistentes a partir del sarcoma. En nuestro caso es obvia la relación con el fibroadenoma adyacente. Sin embargo, el mecanismo por el cual se induce el desarrollo de estos tumores es la transformación metaplásica de las células del estroma mamario. Los mayores cambios histológicos inducidos por la RT se producen en el ducto lobular terminal, por lo cual es mayor el riesgo de desarrollo de un nuevo carcinoma ductal.
Es importante destacar en este caso que el tumor se ha desarrollado en la mama contralateral (fuera del campo directo de tratamiento), donde la dosis de radiación es teóricamente menor. En dicha zona se había realizado 10 años antes una biopsia por una tumoración benigna (fibroadenoma). La aparición de SMIRT ha sido descrita con una frecuencia creciente, probablemente con el incremento del uso de la RT y la mayor supervivencia de las pacientes irradiadas.
Para la definición de SMIRT se siguen los criterios de Cahan et al (1948), que son: a) historia previa de radioterapia; b) seguido de un período de latencia de varios años; c) desarrollo de un sarcoma dentro de un campo previamente irradiado, y d) confirmación histológica del sarcoma..16
Clínicamente se presenta como una tumoración indolora, bien delimitada, móvil, de aspecto benigno, que se puede confundir clínicamente y por las técnicas de imagen con un fibroadenoma.
El tipo histológico más frecuente en los SMIRT es el angiosarcoma..7 Son factores pronósticos: el tamaño tumoral, el grado de diferenciación y la existencia de márgenes libres en la resección..7
Con la mejoría de la supervivencia de los pacientes oncológicos es preciso revisar la morbilidad relacionada con el tratamiento empleado. Los sarcomas se pueden desarrollar en el campo irradiado tras la radioterapia..11 En la revisión de la Universidad de California sobre 1.089 sarcomas, 37 tenían historia previa de RT, de los cuales siete eran carcinomas de mama..11
El vaciamiento axilar no modificada el pronóstico. El 75% de los pacientes con ganglios negativos evolucionan mal y la afectación ganglionar se observa sólo en el marco de una diseminación neoplásica amplia, por lo cual tampoco tiene valor en la estadificación del tumor..17
La mayor parte de la literatura sugiere la mastectomía como tratamiento estándar de los sarcomas de mama. Los pacientes con tumores menores de 5 cm de diámetro pueden ser subsidiarios de cirugía conservadora y tienen mayor supervivencia libre de enfermedad (SLE) y supervivencia global (SG). Los tumores menores de 5 cm evolucionan igual con cirugía conservadora o mastectomía..17 La quimioterapia o radioterapia adyuvantes mejoran la supervivencia. Los tumores mayores de 5 cm de diámetro deben ser tratados con cirugía radical y se debe tener en cuenta la posibilidad de añadir quimioterapia o radioterapia adyuvante..17
En conclusión, podemos decir que el SMIRT es un tumor que con el advenimiento de la cirugía conservadora del cáncer de mama se observará probablemente con más frecuencia, que ha de sospecharse clínicamente, pese a la apariencia benigna del mismo y cuyo manejo es quirúrgico, destacando que hay variedades histológicas, como la del caso que nos ocupa, que aparte de su rareza comportan un peor pronóstico.
RESUMEN
Propósito: Los sarcomas mamarios representan menos del 1% de los tumores malignos de la mama. Concomitantemente con el mayor empleo de la cirugía conservadora en el tratamiento del cáncer de mama, asociada a radioterapia, se han publicado casos de sarcomas de mama inducidos por radioterapia (SMIRT).
Paciente y método: Se presenta el caso de una paciente de 58 años con una tumoración maligna en la mama contralateral 3 años después de haber sido sometida a cirugía conservadora y radioterapia por un carcinoma ductal infiltrante de mama izquierda. Se realiza mastectomía radical modificada, identificándose como un sarcoma mamario con células gigantes tipo epulis.
Resultado: La paciente fue sometida a radioterapia postoperatoria. La evolución postoperatoria fue de progresión de la enfermedad, falleciendo la paciente 16 meses después de la intervención.
Conclusiones: Ante un tumor mamario luego de cirugía conservadora y radioterapia debemos descartar un sarcoma de mama inducido por radioterapia. Se destaca la escasa frecuencia de este tipo de tumores y la mala respuesta al tratamiento adyuvante en esta variante de sarcomas.
BIBLIOGRAFÍA
1. Fisher B, Redmond C, Posson R, et al. Eight-year results of a randomized trial compagina total mastectomy and lumpectomy with or without irradiation in the treatment of breast cancer. New Engl J Med 1989;320: 822-8.
2. Veronesi U, Banfi A, Delvecchio M, et al. Comparison of Halsted mastectomy with quadrantectomy, axillary dissection and radiotherapy in early breast cancer: long-term results. Eur J Cancer Clin Oncol 1986;22: 1085-9.
3. Ciatto S, Bonardi R, Cataliotti L, Cardona G. Sarcomas of the breast: a multicenter series of 70 cases. Neoplasma 1992;39:375-9.
4. Fowble B. Local-regional treatment options for early invasive breast cancer. En: Fowble B, Goodman RL, Glick JH, Rosato EF, eds. Breast cancer treatment: a comprehensive guide to management. St. Louis: Mosby Year Book; 1991. p. 25-88.
5. Llombart A, Peydró A. Malignant mixed osteogenic tumors of the breast. An ultraestructural study of two cases. Virchows Arch A 1975;336:1-4.
6. Vera F, Llombart A. Malignant fibrohistiocitoma of the breast. Primari and postirradiation variants. An ultraestructural study. Path Res Pract 1984;178:289-96.
7. Moore MP, Kinne DW. Breast sarcoma. Surg Clin North Am 1996;76:383-92.
8. Meunier B, Levêque J, Le Prisé E, Kerbrat P, Grall JY. Three cases of sarcoma occurring after radiation therapy of breast cancers. Eur J Obstet Gynecol Reprod Biol 1994;57:33-6.
9. Taghian A, De Vathaire F, Terrier P, et al. Long-term risk of sarcoma following radiation therapy for breast cancer. Int J Radiat Oncol Biol Phys 1991;21:361-7.
10. Kurtz JM, Amalric R, Brandone H, Ayme Y, Spitalier JM. Contralateral breast cancer and other second malignancies in patients treated by breast-conserving therapy with radiation. Int J Radiat Oncol Biol Phys 1988;15:277-84.
11. Mark RJ, Poen J, Tran LM, Fu YS, Selch MT, Parker RG. Postirradiation sarcomas. Cancer 1994;73:2653-62.
12. Pierce SM, Recht A, Lingos TI, et al. Long-term radiation complications following conservative surgery (CS) and radiation therapy (RT) in patients with early stage breast cancer. Int J Radiat Oncol Biol Phys 1992; 23:915-23.
13. Valagussa P, Tancini G, Bonadonna G. Second malignancies after CMF for resectable breast cancer. J Clin Oncol 1987;5:1138-42.
14. Sarrazin D, Le MG, Arriagada R, Contesso G, et al. Ten-year results of a randomized trial comparing a conservative treatment to mastectomy in early breast cancer. Radiother Oncol 1989;14:177-84.
15. Wojnerowicz C. A case of giant cell sarcoma of the mammary gland (osteoclastoma malignum). Oncología 1963-16:64-74.
16. Cahan WG, Woodward HQ, Higinbothan NL, Stewart SW, Coley BL. Sarcoma arising in irradiated bone: report of eleven cases. Cancer 1948;1:3-29.
17. Gutman H, Pollock RE, Ross MI, et al. Sarcoma of the breast: implications for extent of therapy. The MD Anderson experience. Surgery 1994;116:505-9.