Hemos revisado el estado actual de las técnicas de intervencionismo mamario con finalidad terapéutica para carcinomas de mama, considerando su reflejo en la literatura y sus perspectivas futuras como tratamiento local.
Destacan las técnicas de ablación térmica, basadas en aplicación directa de calor o frío en el interior de los tumores, a fin de destruirlos mediante necrosis coagulativa. Las principales técnicas conocidas son: radiofrecuencia, ultrasonidos focalizados de alta intensidad, láser, microondas y crioterapia. Describimos todas ellas y comentamos las referencias de cada una en la literatura.
El diagnóstico previo debe incluir todas las técnicas de imagen disponibles, incluida, a ser posible, la resonancia magnética. Con anterioridad a la ablación, es imprescindible realizar un estudio histológico tumoral completo, así como la estadificación ganglionar.
El desarrollo de estas terapias está muy ligado a la capacidad de las técnicas de imagen para definir la extensión tumoral y planificar su destrucción. La ultrasonografía y la resonancia magnética son las técnicas más utilizadas para ello.
Existe evidencia de que el carcinoma infiltrante menor de 2cm puede ser eficazmente tratado mediante termoablación, especialmente radiofrecuencia. Antes de validarla como alternativa, serán necesarios ensayos clínicos fase iii, comparándola con la terapia establecida, en términos de progresión local y supervivencia global.
We review the state-of-the-art of interventional techniques for breast cancer, as reflected in the literature, and their future prospects as local treatment.
There is widespread use of thermal ablation techniques, based on direct application of heat or cold within tumors to destroy them through coagulative necrosis. The main techniques are radiofrequency ablation, high-intensity focused ultrasound, laser, microwave, and cryotherapy. We describe all these techniques and discuss the literature on each of them.
Prior diagnosis should include all available imaging techniques, including, if possible, magnetic resonance imaging. Before ablation, it is essential to carry out complete histological analysis of the tumor and lymph node staging.
The development of these therapies is closely linked to the ability of imaging studies to identify tumoral spread and plan tumoral destruction. The most widely used techniques for this purpose are ultrasound and magnetic resonance imaging.
There is evidence that infiltrating carcinomas smaller than 2cm can be effectively treated by thermal ablation, especially radiofrequency ablation. Before this option is validated, phase iii clinical trials are required that compare this technique with the gold standard in terms of local progression and overall survival.
En el último decenio se ha suscitado un creciente interés por el tratamiento mínimamente invasivo de lesiones mamarias de carácter maligno, principalmente tumores infiltrantes. Entre estas técnicas mínimamente invasivas destacan los procedimientos de ablación térmica, todavía en fase de investigación, con resultados preliminares prometedores, aunque con algunos inconvenientes de índole práctica y económica.
La revisión que presentamos trata de exponer el estado actual de las técnicas de intervencionismo mamario de carácter terapéutico para lesiones malignas, su reflejo en la literatura internacional y sus perspectivas futuras.
Técnicas de ablación térmicaLa ablación térmica consiste en la aplicación directa de calor o frío en el interior de los tumores con el objetivo de destruirlos. Las principales técnicas de ablación empleadas en el tratamiento del cáncer de mama son 5: radiofrecuencia (RFA), ultrasonidos focalizados de alta intensidad, láser, microondas y crioterapia1,2.
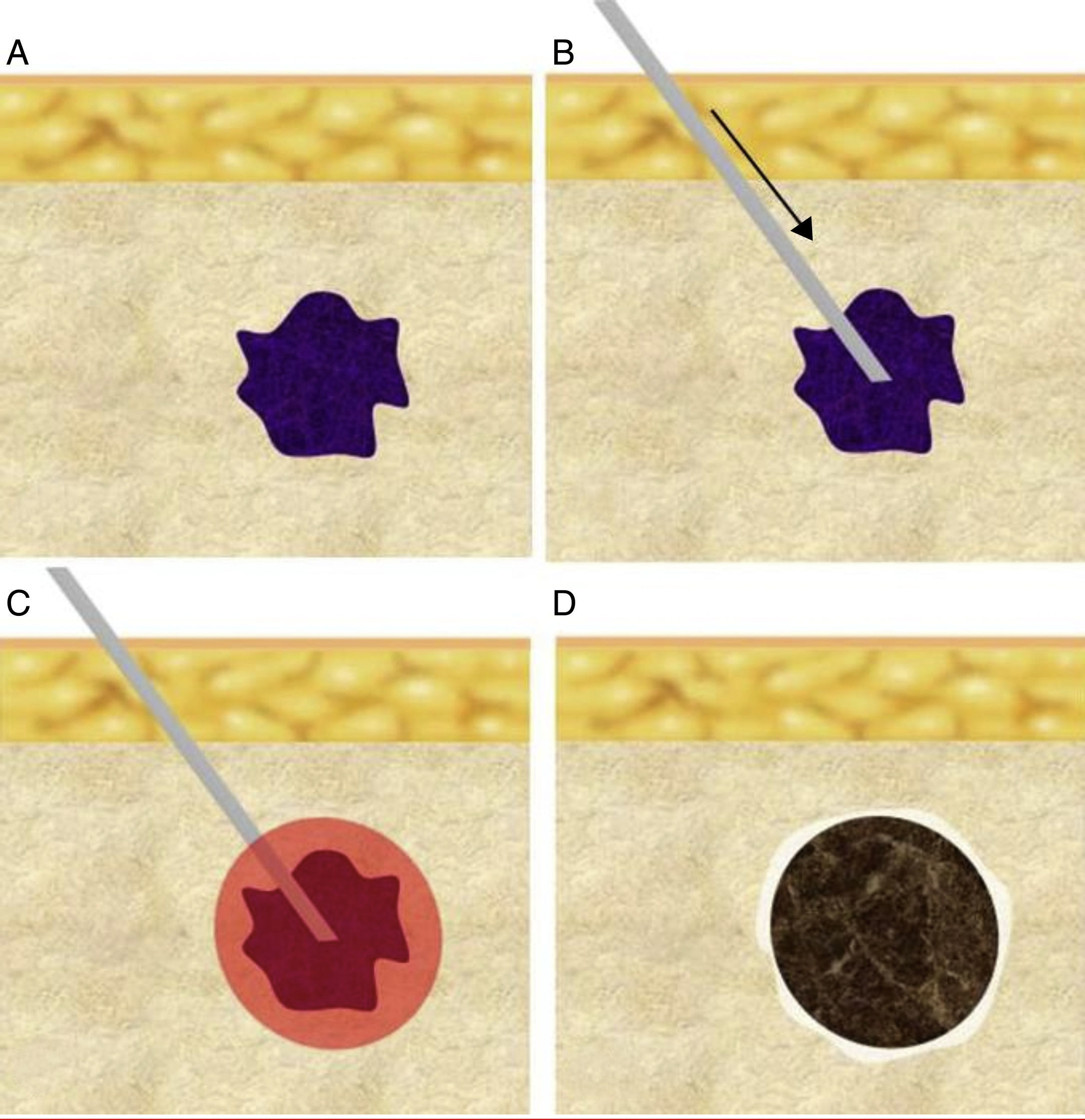
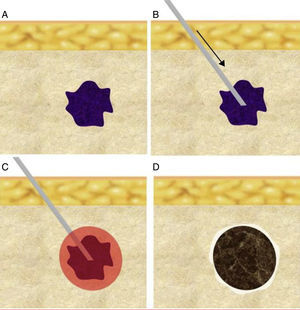
Salvo la ablación transcutánea por ultrasonidos focalizados de alta densidad, el resto requieren la inserción percutánea intratumoral de una cánula o aplicador. La morfología de la zona de ablación suele ser ovalada o esferoidal, y el objetivo ideal del tratamiento es destruir el tumor y un margen de tejido circundante de 5-10mm. Es importante colocar la cánula-electrodo en el centro del tumor y, a ser posible, siguiendo el eje mayor del mismo, para garantizar que la zona de ablación incluya el volumen total planificado (fig. 1). El tipo y tamaño del aplicador empleado deberán garantizar un efecto térmico de volumen suficiente.
La técnica más utilizada para guiar la inserción del aplicador es la ultrasonografía (US), seguida de la resonancia magnética (RM) y, con mucha menos frecuencia, la estereotaxia.
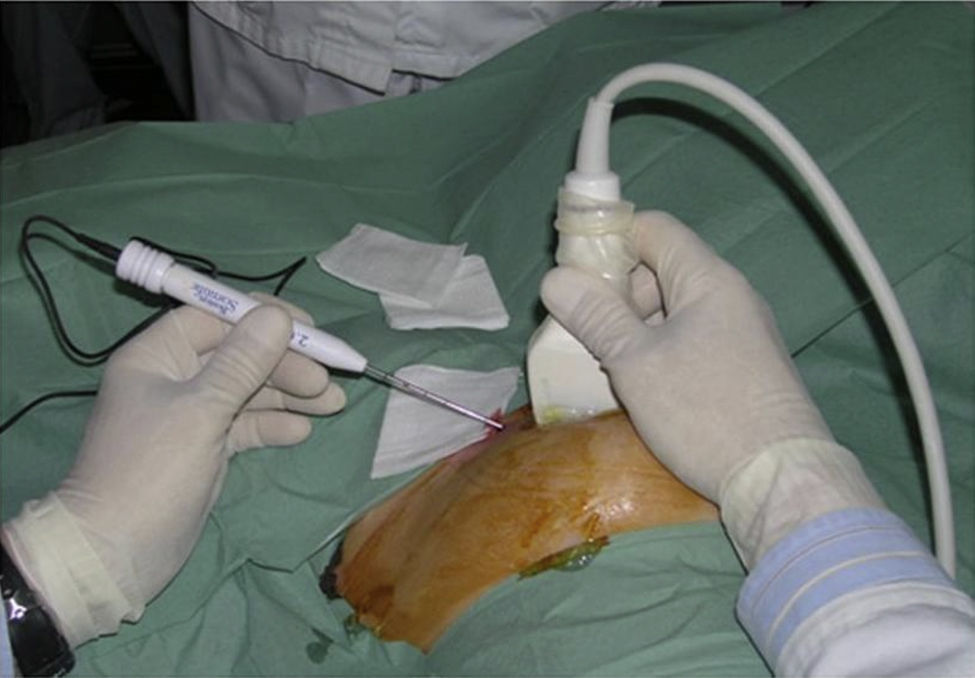
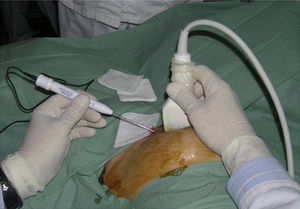
La utilización de la ecografía como guía requiere que la lesión sea perfectamente identificable por US y presente buena delimitación con el parénquima adyacente. La inserción del aplicador debe ser muy precisa y por ello debe ser realizada por radiólogos expertos en punción ecoguiada, usando equipos de alta resolución3 (fig. 2). A menudo es difícil monitorizar el efecto del tratamiento debido a la instauración, lenta y progresiva, de una zona hiperecoica mal definida que oculta el tumor e impide visualizar el tejido subyacente. Esta zona parece debida a microburbujas de vapor de agua y otros productos celulares, formados como resultado de la vaporización tisular.
La RM supera a la US en la definición de la extensión local del carcinoma infiltrante, permitiendo monitorizar el tratamiento de forma no invasiva mediante el empleo de secuencias específicas termosensibles. La RM también permite monitorizar la temperatura mediante la incorporación de sensores térmicos, ubicados en la punta de algunos aplicadores, proporcionando información muy útil sobre la respuesta al tratamiento (disminución, total o parcial, de la captación del carcinoma infiltrante)4–6. No obstante, el uso de la RM es todavía limitado por motivos de índole práctica, como una menor disponibilidad, un tiempo prolongado de ocupación de sala, la frecuente incompatibilidad de la mayoría de los sistemas ablativos con la RM o los artefactos producidos por el aplicador.
Describiremos las técnicas de ablación térmica actualmente existentes.
Técnicas de ablación por calorSu fundamento consiste en inducir coagulación tisular mediante calentamiento lento y progresivo de los tejidos. En esencia, las técnicas de termoablación difieren únicamente en el método físico de generar calor.
Ablación por radiofrecuenciaBases físicasLa RFA consiste en la inserción intratumoral de un electrodo, a través del cual se aplica una corriente alterna de alta frecuencia que induce agitación oscilante de los iones tisulares, produciendo calor por fricción, que eleva la temperatura local, ocasionando finalmente coagulación tisular. El calor generado en la vecindad del electrodo se dispersa ulteriormente como resultado de los efectos de conductividad y convección7.
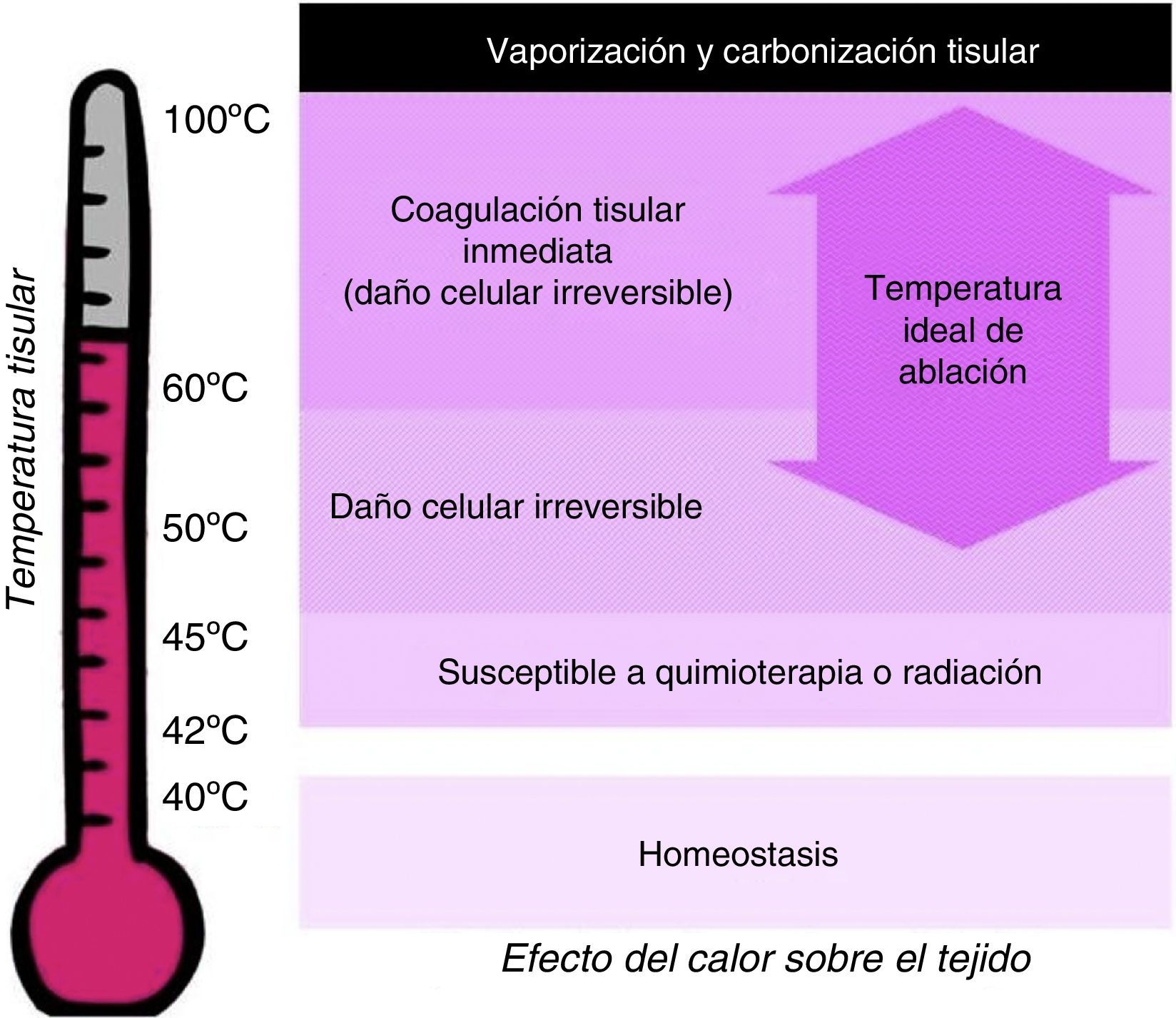
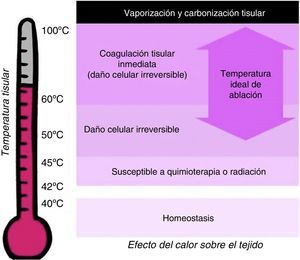
El daño tisular depende de la temperatura y la duración del calentamiento. La homeostasis celular se mantiene por debajo de 40°C. Las células se vuelven más susceptibles a la quimioterapia o la radiación cuando la temperatura tisular sube a 42°C (hipertermia). El calentamiento a 45°C durante varias horas produce daño celular irreversible, mientras que a 50-55°C, el mismo efecto se consigue en escasos minutos. Entre 60 y 100°C se produce coagulación tisular inmediata, manifestada como daño irreversible de las enzimas citosólicas y mitocondriales. Por encima de 100°C se produce vaporización y carbonización tisular8,9 (fig. 3).
ProcedimientoLa técnica más empleada como guía es la US. Es importante aplicar una potencia inicial baja e incrementarla lentamente, a fin de evitar una rápida necrosis del tejido cercano a la punta del electrodo, que impediría la ulterior propagación del calor por el incremento inmediato de la impedancia tisular.
El tipo y el tamaño del electrodo determinan la extensión de la zona de ablación. Existen diferentes modelos (electrodos multifilamento expansibles, electrodos enfriados internamente, electrodos de perfusión)10. Los sistemas disponibles producen volúmenes de ablación esferoidales, con diámetros entre 2 y 5cm. Se ha publicado un trabajo comparando 2 tipos diferentes de electrodo, con resultados similares en cuanto a eficacia, si bien el electrodo tipo Cool mejoró al electrodo LeVeen en cuanto a facilidad de inserción y acortamiento del tiempo necesario para completar la ablación11.
Hay sistemas autorregulados por la impedancia tisular y otros basados en el registro de la temperatura mediante un termómetro próximo a la punta del electrodo. En los primeros, la impedancia se registra en el monitor del generador. Cuando la ablación está próxima a completarse, la impedancia asciende exponencialmente, por lo que la potencia desciende, sin que sea posible elevarla desde el conmutador. La técnica se prolonga 10-20min, si bien la preparación de la paciente, la instrumentación y los cuidados posteriores la prolongan algo más de tiempo. Los efectos adversos son infrecuentes e incluyen la posibilidad de quemadura cutánea o de pared torácica, lo que hace desaconsejable el uso de la RFA para tumores localizados a menos de 1cm de estas estructuras3.
Es imprescindible haber realizado un estudio histológico completo del tumor antes de la RFA, incluyendo la determinación del tipo y el grado histológicos, así como los receptores hormonales y el análisis de la expresión del oncogén HER2/neu. En la biopsia percutánea realizada con ese fin es aconsejable incluir un cilindro en alcohol, válido para ser utilizado como muestra «testigo» para certificar la validez de la prueba de la NADH-diaforasa (NADH-d), técnica enzimática que permite estudiar la viabilidad celular tras la RFA.
En las series con comprobación quirúrgica posterior, el estudio histológico de la pieza quirúrgica con hematoxilina-eosina puede presentar grados variables de necrosis coagulativa, caracterizados por deshidratación celular, picnosis nuclear y eosinofilia citoplasmática más o menos intensas, pudiendo llegar hasta la destrucción celular completa. Puede haber células aparentemente normales en la zona de coagulación tisular que, sin embargo, se demuestran inviables en el estudio específico mediante la NADH-d12,13. Esta técnica consiste en la reducción de un compuesto químico (nitroazul de tetrazolio) por la enzima NADH-d, lo que resulta en un pigmento citoplasmático azul intenso. La actividad de esta enzima, constitutivamente presente en las células viables, cesa inmediatamente tras la muerte celular, por lo que esta técnica permite determinar de forma precisa e inmediata la muerte celular y su extensión. Es mucho más objetiva que el estudio convencional con hematoxilina-eosina, ya que su interpretación se basa solamente en la presencia o ausencia del pigmento azul intracitoplasmático13. No obstante, su realización e interpretación puede resultar en ocasiones problemática, planteando dificultades a la hora de realizar los cortes para congelación sobre tejidos adiposos y/o necrosados, así como dudas a la hora de elegir la zona más adecuada para congelar y cuánto material se ha de congelar en los tumores más pequeños. Se ha propuesto para este mismo objetivo el uso de otra técnica, la inmunohistoquímica citoqueratina 8, con buenos resultados comparativos14.
El estudio diagnóstico previo debe incluir todas las técnicas de imagen disponibles, incluida, a ser posible, la RM, ya que es necesario conocer todas las características del tumor (tamaño, morfología, márgenes, componente in situ y multiplicidad), factores determinantes en la selección de los casos. También es obligada la estadificación ganglionar, mediante punción ecoguiada de adenopatías axilares sospechosas, si has hay, o mediante biopsia del ganglio centinela, en caso contrario. La demostración de afectación axilar no contraindica la ablación.
Recientemente, algunos grupos15 han estudiado la variabilidad del efecto de la RFA según el mayor o menor contenido adiposo del tejido, concluyendo que el tejido adiposo podría reducir dicho efecto, por su menor conductividad eléctrica.
Si se decide utilizarla como alternativa a la cirugía conservadora, la RFA tiene como desventaja la imposibilidad de estudiar histológicamente el margen de ablación. Por ello, es aconsejable excluir el carcinoma ductal in situ puro y los tumores invasivos con componente in situ extenso, habitualmente indetectables por US. El carcinoma lobulillar infiltrante es también excluido en muchas series por razones similares.
ResultadosLa RFA es el método de ablación térmica más utilizado en el tratamiento local experimental de los tumores malignos de mama. El trabajo más clásico, considerado como pionero, es el publicado por Jeffrey et al. en 199916. Concluyeron que la RFA causa muerte celular en el carcinoma invasivo, aunque, por la extensión de la zona de ablación, la técnica es aplicable solo a tumores menores de 3cm.
Posteriormente, se han publicado numerosas series de casos, la gran mayoría, ensayos clínicos fase ii, en los que la RFA se sigue de tratamiento quirúrgico, con el objetivo de determinar su seguridad y los efectos de la ablación sobre la pieza quirúrgica3–5,17–27. La guía utilizada en los estudios fue la US, con una sola excepción, en que se utilizó la RM22. La mayoría de los procedimientos fueron realizados en quirófano e inmediatamente antes del tratamiento quirúrgico, bajo anestesia general o local con sedación4,5,19,23. La técnica es generalmente bien tolerada y los efectos adversos son infrecuentes, limitados fundamentalmente a quemaduras cutáneas leves. La mayoría de las series se refieren a tumores infiltrantes menores de 2cm.
Los resultados son consistentes: la RFA produce destrucción completa del tumor en el 90-100% de los casos. Esta conclusión se sustenta también en numerosas revisiones bibliográficas sistemáticas publicadas en los últimos años27–29.
Nuestro grupo de trabajo inició en 2005 un ensayo clínico fase ii consistente en realizar RFA de tumores malignos infiltrantes de mama menores de 2cm, seguida de tratamiento quirúrgico diferido25. Los 35 procedimientos se realizaron en la sala de ecografía, bajo anestesia local y sin sedación. El 85,7% de las pacientes no sintieron molestias. El 11,4% de ellas refirió dolor ligero, controlado tras administrar más anestésico local. Una paciente presentó dolor intenso que obligó a detener el procedimiento. No se registraron efectos adversos. En todos los casos se demostraron cambios histológicos de necrosis coagulativa, catalogada como completa en el 91,4%. La NADH-d fue negativa en 27 de los 32 casos en los que se realizó; en un caso fue débilmente positiva, y en 4, no valorable. Nuestros resultados coinciden con otros publicados3,4,17,21,24.
Una limitación inherente a estos estudios es que siempre cabe un posible error en la obtención de muestras de la pieza quirúrgica, ya que a pesar de un muestreo exhaustivo, podrían quedar fuera focos aislados de tumor residual viable. Las principales causas descritas de destrucción incompleta son el tamaño superior a 2cm3,16,23,26 y la presencia de áreas tumorales radiológicamente ocultas, especialmente de carcinoma in situ3,26.
El número de series en las que la RFA no se siguió de tratamiento quirúrgico posterior es menor30–37 y todas ellas son estudios experimentales longitudinales, sin grupo control. El seguimiento del lecho tumoral es esencial en estos casos, pero todavía objeto de debate, y aunque la mayoría de los autores proponen la combinación de técnicas de imagen (fundamentalmente RM) y de punción percutánea, aún no existe consenso en cuanto al tipo y secuencia de estudios necesarios.
La serie más numerosa sin comprobación quirúrgica es la de Oura et al.30, que incluyó a 54 pacientes con carcinomas hasta 2cm y, tras un seguimiento medio de 15 meses, no detectó progresión tumoral local ni metástasis ganglionar o a distancia en ningún caso. Las técnicas de seguimiento fueron exploración física, punción-citología, US y RM. El resultado estético se consideró, en la mayoría de las pacientes, superior al de la cirugía conservadora.
Todavía no disponemos de suficiente información sobre la historia natural de los cambios que se producen tras la RFA. Es previsible que el resultado estético sea mejor que el de la cirugía conservadora, debido al menor volumen de tejido tratado y a la ausencia de cicatriz, pero esto todavía debe ser demostrado en estudios longitudinales. Además, tras la ablación, seguida o no de radioterapia externa, se pueden producir cambios locales (secundarios a reacción aberrante del tejido peritumoral o a necrosis grasa), cuya frecuencia, intensidad y evolución se desconocen.
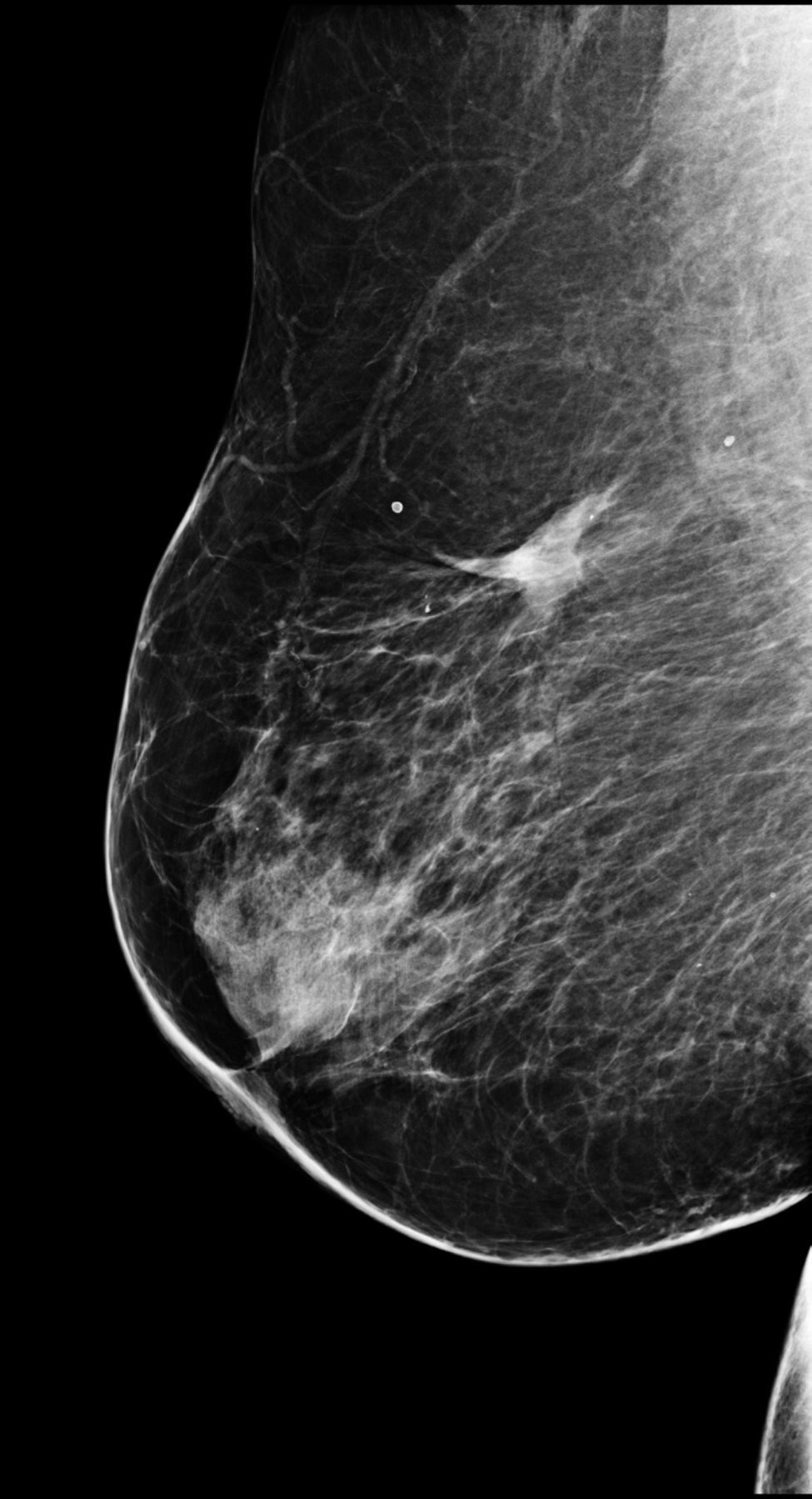
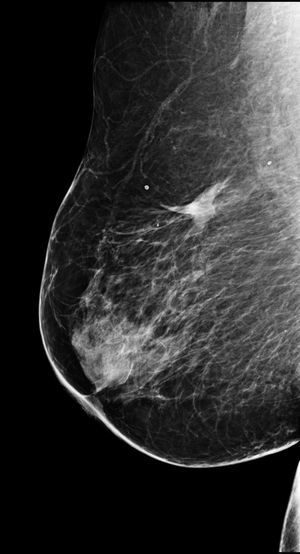
La experiencia de nuestro grupo en este aspecto es escasa, limitada a un solo caso: una mujer de 78 años, exenfermera y afecta de numerosos procesos patológicos (obesidad, cardiopatía hipertensiva isquémica, diabetes descompensada…). Tras ser diagnosticada de un carcinoma ductal infiltrante en el CSE de la mama derecha, sugirió ser tratada por algún método no quirúrgico. Tras consentimiento informado verbal y escrito, fue tratada mediante RFA con anestesia local. La ablación resultó indolora y sin complicaciones. La paciente continúa en seguimiento 5 años más tarde, sin presentar signos de recurrencia y con resultados cosméticos excelentes (fig. 4).
Podemos concluir que la RFA es una técnica efectiva, bien tolerada bajo anestesia local en entorno ambulatorio y con escasos efectos adversos. No obstante, la verdadera demostración de la ausencia de viabilidad celular tras la RFA deberá conseguirse mediante el seguimiento a largo plazo de pacientes no intervenidas quirúrgicamente, comparando tasas de progresión tumoral local y supervivencia en pacientes tratadas con RFA más radioterapia y en las tratadas con la terapia actualmente establecida (cirugía conservadora más radioterapia). Uno de los grupos más activos en la investigación de estos temas, el del MD Anderson Cancer Center (Houston, EE. UU.), tiene en marcha un estudio experimental, no aleatorizado, de estas características38.
Mientras tanto, una indicación potencial de la RFA incluiría pacientes ancianas o con enfermedad intercurrente que contraindique la cirugía, siempre con estricto consentimiento informado31–36.
El efecto de la RFA en el carcinoma de mama recurrente ha sido estudiado por Lamuraglia et al.39, que refieren dificultad en la inserción del electrodo por la alta consistencia del lecho tumoral.
Más recientemente se plantean nuevas opciones terapéuticas, como combinación de RFA con quimioterapia liposomal, que podría potenciar la necrosis térmica40,41.
Asimismo, la administración intralesional de interleucinas (IL-7 e IL-15) tras la RFA podría desencadenar una respuesta inmunitaria antitumoral que inhibiría la progresión tumoral local o de metástasis, lo que abre otra posible línea terapéutica futura42–44.
Ablación por ultrasonidosBases físicasEsta es la única técnica termoablativa que no requiere la inserción de un aplicador intratumoral, por lo que la piel permanece íntegra. Consiste en focalizar un haz de US de 0,5 a 4MHz, en un punto concreto localizado a la distancia precisa del generador. La energía acústica, transformándose en calor, consigue un calentamiento del tejido diana que ocasiona coagulación tisular. La piel y los tejidos circundantes muestran un incremento insignificante de la temperatura.
ProcedimientoEl volumen de tejido lesionado por cada haz de US tiene una morfología esferoidal y un tamaño equivalente a un grano de arroz, por lo que la destrucción del volumen tumoral completo, más un margen de seguridad, requiere la superposición de múltiples haces de forma planificada. Ello prolonga considerablemente la duración del procedimiento, que oscila entre 45 y 150min.
La técnica de imagen más utilizada es la RM, que posibilita la monitorización de la ablación mediante el uso de secuencias específicas termosensibles. El procedimiento es generalmente bien tolerado bajo anestesia local, y no conlleva complicaciones importantes, aunque está limitado por la baja disponibilidad de la RM y su prolongada duración. La US también se ha utilizado como guía, si bien todas las experiencias publicadas proceden del mismo grupo44.
ResultadosEn general, se obtuvieron mejores resultados en las series guiadas por US, probablemente porque se planificó un margen de ablación mayor. Las experiencias con esta técnica incluyen series con y sin cirugía posterior44–49, y los resultados son heterogéneos, con porcentajes de ablación completa de entre el 20 y el 100%.
Ablación por láserBases físicasEsta técnica utiliza fibras ópticas, insertadas en el tejido, para administrar energía luminosa, que incrementa la temperatura local y, en última instancia, ocasiona coagulación tisular.
ProcedimientoLa inserción de las fibras ópticas puede guiarse por diferentes técnicas de imagen. La RM, en concreto, puede utilizarse tanto para guiar la correcta colocación de las fibras como para monitorizar el proceso de ablación térmica mediante el uso de secuencias específicas termosensibles. Además, proporciona información sobre la respuesta al tratamiento50.
El procedimiento suele ser bien tolerado bajo anestesia local y habitualmente no conlleva complicaciones importantes.
ResultadosLas primeras referencias sobre esta técnica se remontan a principios de los 90, y desde entonces pocas series han sido publicadas50–56. La técnica puede ser efectiva en el tratamiento percutáneo del carcinoma ductal infiltrante de pequeño tamaño sin componente intraductal extenso54–56.
Ablación por microondasBases físicasEs la técnica menos conocida. Es un método electromagnético que induce destrucción tumoral mediante dispositivos con frecuencias comprendidas entre 900 y 2.450MHz57–59.
ProcedimientoExige la inserción intratumoral ecoguiada de una antena que emite radiación electromagnética, la cual crea un campo eléctrico oscilante que interacciona con las moléculas de agua, agitándolas y generando calor por fricción. A diferencia de la RFA, no se aplica una corriente eléctrica alterna, así que no precisa almohadillas de retorno, aunque la necrosis resultante es similar en ambas técnicas60,61.
ResultadosLas series publicadas son contadas y con resultados dispares, generalmente pobres62,63. En un estudio multicéntrico prospectivo de 25 pacientes63, bajo anestesia local y seguida de tratamiento quirúrgico diferido, con tamaños tumorales entre 7 y 25mm, el procedimiento fue tolerado, con o sin dolor, por 24 pacientes. En las 19 en que se alcanzó la temperatura deseada, se obtuvieron porcentajes de necrosis tumoral muy heterogéneos, de entre el 0 y el 100%. La dosis térmica resultó ser el mejor factor predictor de la necrosis tumoral. Como complicaciones, se registraron: eritema cutáneo frecuente, edema mamario en 5 pacientes y quemaduras cutáneas en 3. Sin embargo, un estudio publicado en 2012 proclama tasas de necrosis tumoral completa en alrededor del 95% de los casos64.
Técnicas de ablación por frío: crioablación o crioterapiaBases físicasEl fundamento es la destrucción tisular mediante congelación, que conduce a la disrupción de las membranas induciendo la muerte celular65. Como tratamiento paliativo en tumores localmente avanzados ha sido referida en la literatura desde la primera mitad del siglo xx.
Técnicamente, consiste en la aplicación directa de temperaturas citotóxicas (<−20°C) mediante la inserción de una criosonda en el tejido. En los dispositivos actuales, la congelación en la punta de la sonda se produce por descompresión de gas argón, según el efecto Joule-Thomson.
ProcedimientoEl método comprende 2 ciclos consecutivos de congelación-descongelación. Durante el primero, se crea una «bola de hielo» anecoica, que aumenta progresivamente hasta abarcar el volumen tisular planificado. Una ventaja frente a la RFA es que el margen anterior de la bola de hielo está muy bien definido y se ve perfectamente por ecografía, permitiendo controlar la extensión de la lesión térmica en tiempo real. La descongelación subsecuente es pasiva, por interrupción del flujo de argón, y su objetivo es sensibilizar las células para el siguiente ciclo de congelación. Tras finalizar el segundo ciclo, se realiza un último ciclo de descongelación activa, por helio, que facilita la extracción de la criosonda.
ResultadosLa indicación más frecuente es la ablación de fibroadenomas y sobre ello se han publicado varias series, con gran número de pacientes66–72.
La técnica es virtualmente indolora, dado el efecto anestésico del frío, y carece de complicaciones. Los resultados son excelentes en términos de desaparición de la masa palpable y la imagen radiológica, aunque la desaparición completa del nódulo es lenta y puede requerir meses, incluso años. El efecto citotóxico es mayor en el componente epitelial que en el fibroso, por lo que responden mejor los fibroadenomas hipercelulares.
Se han descrito reacciones anómalas del tejido circundante, un efecto bien conocido, también tras resecciones quirúrgicas.
La crioterapia es aceptada por la FDA como método idóneo para pacientes que deseen un tratamiento de fibroadenoma sin cirugía68–72.
Más recientemente, se han publicado series de crioterapia en tumores malignos inferiores a 2cm73,74 con buenos resultados en términos de efectividad (destrucción tumoral completa en el 78%) y ausencia de complicaciones. Como sucede con otras técnicas ablativas, la principal causa de persistencia tumoral es la existencia de componente intraductal, no tanto por la incapacidad del procedimiento, sino por la conocida dificultad de las técnicas de imagen para establecer fielmente el componente intraductal de algunos tumores, impidiendo una adecuada planificación del volumen a tratar.
La crioterapia ha sido también utilizada para la localización prequirúrgica de carcinomas no palpables, como alternativa al uso de arpones. En un ensayo multicéntrico que comparó ambas técnicas75, el porcentaje de márgenes afectos no difirió significativamente, pero el volumen de tejido extirpado fue menor en la localización crioasistida (p=0,002). La crioterapia fue también superior en otros parámetros, como facilidad de la resección, resultado cosmético a corto plazo o satisfacción de las pacientes. No obstante, este procedimiento puede causar una distorsión nuclear considerable en el estudio histológico, alterando los resultados del estudio inmunohistoquímico, por lo que dichos parámetros deben ser estudiados con anterioridad76.
Mediante experimentación en ratones se ha descrito un efecto inmunológico de la crioterapia, que induciría una respuesta de linfocitos T antitumorales específicos en los ganglios que drenan el tumor, y también respuestas sistémicas natural killer antitumorales, efectos que reducirían el riesgo de recidiva77,78.
ConclusionesExiste una creciente evidencia de que los pequeños carcinomas infiltrantes de mama pueden ser eficazmente tratados mediante la aplicación de técnicas mínimamente invasivas, particularmente la RFA, evidencia que mantiene su actualidad en las publicaciones más recientes79–81. Se acepta que permanecen algunas dudas y serán necesarios ensayos clínicos fase iii, bien diseñados y realizados, que permitan comparar estas técnicas con la cirugía conservadora, en términos de progresión tumoral local y supervivencia, antes de confirmarlas como alternativa válida. El desarrollo de estas terapias dependerá en gran medida de la capacidad de las técnicas de imagen para planificar y dirigir con precisión la destrucción tumoral.
Responsabilidades éticasProtección de personas y animalesEl autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosEl autor declara que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoEl autor declara que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.