REVISIÓN
Tratamiento hormonal sustitutivo en la menopausia y riesgo de cáncer de mama
Hormone replacement therapy during menopause and breast cancer
M. Vernet, M. A. Checa, S. Pérsico, R. Carreras
Servicio de Ginecología y Obstetricia. Hospital del Mar. Barcelona.
Correspondencia:
M.a del Mar Vernet Tomás.
Hospital del Mar.
Passeig Marítim, 25-29.
08003 Barcelona.
SUMMARY
The influence of sexual hormones on breast cancer development is well known. In the last years, the use of hormones to treat or prevent menopausal disturbances has considerably increased. A higher breast cancer risk when prescribing hormones is easily presumed, specially when given during a life period with increased breast cancer incidence. In fact, the literature suggests that hormone replacement therapy slightly increases this risk. In the other hand benefits of hormone replacement in cardiovascular disease and bone fractures have to be considered: the risk of death for all causes is lower in users than in none users. The conclusion is that hormone replacement therapy has to be administered when there is a clear prescription and an objective benefit, it never has to be given without a previous normal breast exploration and mammography and periodic controls are necessary to diagnose the breast cancer as early as possible.
Palabras clave
Tratamiento hormonal sustitutivo, Estrógenos, Gestágenos, Cáncer de mama, SERM.
Key words
Hormone replacement therapy, Estrogens, Gestagens, Breast cancer, SERM.
INTRODUCCIÓN
La vinculación entre el desarrollo del carcinoma de mama y las hormonas sexuales se basa en observaciones epidemiológicas, clínicas y experimentales. Las observaciones epidemiológicas clásicas son, entre otras, la mayor incidencia de carcinoma de mama en pacientes con menarquía precoz, menopausia tardía, nuliparidad, primiparidad más allá de los 30 años y obesidad (las mujeres obesas presentan con frecuencia menarquía precoz y menopausia tardía, así como mayores niveles de estrona y estradiol libre por disminución de la SHBG). 1 Entre las evidencias clínicas que confirman el papel de las hormonas sexuales en la aparición del carcinoma de mama podríamos citar el mayor riesgo de cáncer de mama en pacientes postmenopáusicas sin tratamiento hormonal sustitutivo (THS) en la menopausia, pero con niveles estrogénicos en sangre aumentados (Toniolo et al 2); o el hecho de que la ovariectomía bilateral en pacientes de menos de 35 años reduce el riesgo de neoplasia de mama a un tercio (Trichopoulos et al 3). El influjo hormonal en la evolución del carcinoma de mama queda demostrado por el hecho de que la castración en el carcinoma de mama premenopáusico es tan efectiva como la quimioterapia, reduciendo las recidivas y aumentando la supervivencia, 4 o que el 60% de las neoplasias de mama presentan receptores hormonales, estando actualmente la eficacia del tratamiento con antiestrógenos bien establecida. 5, 6
Ante esta evidente hormonodependencia del carcinoma de mama nos debemos plantear qué efectos tienen estrógenos y progesterona sobre el tejido mamario promoviendo su transformación neoplásica y sobre las células cancerosas estimulando su crecimiento
ACCIÓN DE ESTRÓGENOS Y GESTÁGENOS SOBRE LA MAMA
Los estrógenos y la progesterona tienen un efecto trófico sobre el tejido mamario, induciendo fundamentalmente su crecimiento, y conjuntamente con otras hormonas su diferenciación.
Está demostrado que los estrógenos estimulan la proliferación del epitelio mamario y el trofismo de la mama en general. Así, durante la pubertad, el aumento de volumen de la glándula mamaria es fundamentalmente estrogenodependiente. 1 La manera como ejercen esta función es de forma directa, estimulando la transcripción génica al unirse a los elementos respondedores a estrógenos (ERE) del DNA y de forma indirecta incrementando la producción de factores de crecimiento (TGF-alfa, TGF-beta), enzimas (catepsina D, activador del plaminógeno), activando protoncógenes (c-fos,c-myc,HER-2/neu), incrementando la síntesis de los propios receptores de estrógenos y de los receptores para el EGF. 7 De todas formas hay que recordar que de forma concomitante incrementan fisiológicamente factores inhibidores como el TGB-beta, que induce apoptosis, así como ciclinas y otras sustancias reguladoras del ciclo celular. 8
Más controvertido es el papel de los gestágenos en la mama. La antigua idea de que compartían el efecto protector en el endometrio y en la mama está puesta en duda por varias observaciones: en los ciclos menstruales normales la máxima proliferación epitelial en la mama se produce durante la fase lútea, en la que aparece y aumenta la progesterona 9 (Fig. 1);cuando las adolescentes inician ciclos menstruales ovulatorios con producción de progesterona, los lóbulos mamarios pasan al tipo II de Russo, con gran proliferación de ductos, pero no se diferencian totalmente al tipo más maduro, el IV, hasta la lactancia 10 (Fig. 2). Estudios experimentales diversos se contradicen en cuanto al efecto mitógeno o no de los gestágenos sobre líneas celulares de cáncer de mama, probablemente por la dificultad de reproducir en medios de cultivo un ambiente hormonal parecido al que existe in vivo. 11 En todo caso actualmente se tiene la idea de que una exposición corta a gestágenos incrementaría el número de mitosis, mientras que exposiciones prolongadas a niveles altos inhibirían la proliferación epitelial 12 mamaria por disminución en la síntesis de receptores de estrógenos, estimulación de apoptosis e incremento de la estradioldeshidrogenasa. 13 A nivel molecular este efecto dual parece confirmarse ya que los gestágenos podrían detener el ciclo celular en una fase temprana de G1 en determinadas condiciones y acelerar el paso de la fase G1 a S en otras.14
Fig. 1. Representación esquemática de los niveles hormonales y de la proliferación endometrial y ductal durante el ciclo menstrual. La máxima proliferación endometrial se observa en la fase folicular, mientras que la máxima proliferación ductal se produce en la fase lútea, cuando aumentan los niveles de progesterona.
Fig. 2. Representación esquemática del desarrollo de los lóbulos mamarios, tomado de Russo et al. 10 La producción de progesterona en los ciclos menstruales no es suficiente para la diferenciación definitiva de la glándula mamaria, que no se produce hasta la lactancia.
Todo ello explica que las hormonas sexuales actúen no como inductoras, pero sí como promotoras en el carcinoma de mama: al aumentar la proliferación celular (mitosis) en la glándula mamaria se aumenta el riesgo de que se produzcan mutaciones y de que éstas se acumulen hasta derivarse en carcinogénesis. Es lógico, pues, que nos planteemos muy seriamente si no estamos incrementando el riesgo de cáncer de mama al administrar THS, iniciándolo además en una época de la vida en que la incidencia aumenta notablemente. ¿Qué evidencias hay en la literatura de ello?
THS Y CÁNCER DE MAMA: REVISIÓN DE LA LITERATURA
Desde 1975 hasta ahora muchos estudios han aparecido del tipo caso/control y cohortes: el riesgo relativo (RR) varía de 0,3 [intervalo de confianza (IC) del 95%, 0,1 a 0,8) a 1,93 (IC95%, 1,35 a 2,75), y la mayoría consideran el THS con estrógenos solos. 15 Los distintos resultados de estos estudios se deben a problemas metodológicos por diferentes criterios de exclusión/inclusión, distintos tipos, dosis y tiempos de tratamiento, poblaciones no homogéneas con poco tamaño de muestra, no considerar uso anterior de anticonceptivos, dificultad en la selección de controles, no randomización del THS, sesgo por mayor control en las mujeres que realizan THS, etc. Para aumentar la potencia estadística de los estudios publicados han aparecido metaanálisis de éstos con resultados también contradictorios: así, por poner un ejemplo, mientras Steinberg et al 16 encontraban un incremento de riesgo después de 5 años Stanford et al 17 no lo encontraron.
Dos de los estudios más destacables publicados al respecto recientemente son las últimas conclusiones del Nurses'' Health Study y un metanálisis del Collaborative Group on Hormonal Factors in Breast Cancer, que vamos a comentar a continuación.
El Nurse''s Health Study es el estudio más amplio de tipo prospectivo de que se dispone actualmente. Iniciado en 1975, recoge información sobre THS, la mayoría sólo estrogénico y en mucha menor cuantía estrogestagénico. Distingue las usuarias actuales de las usuarias en el pasado y de las no usuarias, con test bienales actualizando ésta y otra información. El uso de THS no es por randomización, sino por libre elección de la paciente, lo cual puede suponer un sesgo por estilo de vida y mayor control en el grupo de usuarias de THS. En una primera lectura de los resultados en 1990 18 no se observó incremento en la incidencia de cáncer de mama entre usuarias en el pasado [RR, 0,98, e intervalo de confianza (IC95%), 0,81 a 1,18] y sólo un ligero aumento en las usuarias actuales (RR, 0,1.36, e IC95%, 1,11 a 1,67). Con unos años más de seguimiento, en 1995 19 publicaban un aumento del riesgo para el uso prolongado (de 5 a 9 años: RR, 1,46, e IC95%, 1,22 a 1,74), aunque la mortalidad global era menor para las usuarias de THS. Este último aspecto se confirma en las conclusiones de este trabajo prospectivo publicadas en el NEJM de junio de 1997, 20 observando una mortalidad global inferior en el grupo de usuarias de THS (RR, 0,63, e IC95%, 0,56 a 0,70), beneficio que se va perdiendo a partir de los 10 años de uso (RR, 0,80, e IC95%, 0,67 a 0,96) por un incremento en la mortalidad por cáncer de mama (Fig. 3).
Fig. 3. Riesgo relativo e intervalo de confianza de muerte por cáncer de mama, muerte de causa cardiovascular y muerte por todas las causas en el grupo de usuarias actuales de THS según datos del Nurse''s Health Study, en las conclusiones de 1997. 20
Otro trabajo de interés publicado recientemente es un metaanálisis del Collaborative Group on Hormonal Factors in Breast Cancer: 21 incluye 52 trabajos que suman 52.705 mujeres con cáncer de mama y 108.411 controles; de 17.830 usuarias de THS en algún momento de su vida el tipo de hormona se conocía en 4.640, y de ellas, el 80% sólo usaban estrógenos y el 20% estrógenos y progesterona. El RR se elevaba ligeramente en usuarias actuales o recientes de THS (RR, 1.023, e IC95%, 1.011 a 1.036) y algo más si el uso era superior a 5 años (RR, 1,35, e IC95%, 1,21 a 1,49) (Fig. 4). Los propios autores se plantean si ello no se debe a un sesgo por mayor control en usuarias, dado que el exceso de neoplasias halladas se produce a expensas de estadios muy iniciales. Otra conclusión interesante en este trabajo es que el riesgo relativo se iguala entre usuarias y no usuarias de THS a medida que aumenta el peso de la mujer, confirmando la obesidad como uno de los factores de riesgo de la neoplasia de mama.
Fig. 4. Estimación del número acumulado de casos de neoplasia de mama para 1.000 no usuarias de tratamiento hormonal sustitutivo, 1.000 usuarias durante 5 años y 1.000 usuarias durante 10 años, tomado del Collaborative Group on Hormonal Factors in Breast Cancer. 21 En el eje de las X, la edad en años; en el eje de ordenadas, el número de neoplasias diagnosticadas.
Como hemos comentado, la mayoría de estudios se refieren al THS sólo estrogénico, pero desde 1990, conocido el incremento de riesgo de neoplasia de endometrio al administrar estrógenos sin progesterona, el tratamiento que se administra en mujeres no histerectomizadas es un estrógeno en combinación con un gestágeno. La información de que se dispone en la literatura del tratamiento combinado y riesgo de cáncer de mama es escasa: hay estudios que describen ligeros aumentos o disminuciones del RR que nunca alcanzan la significancia estadística. 15 En el Nurses'' Health Study no existen diferencias del RR para cáncer mamario entre usuarias de terapia estrogénica y usuarias de terapia combinada (RR, 1,32; IC95%, 1,14 a 1,54 frente a 1,41, e IC95%, 1,15 a 1,74, respectivamente) 20 ni tampoco existieron diferencias en el metaanálisis del Collaborative Group on Hormonal Factors in Breast Cancer. 21 La información actual es que no hay evidencias de que añadir gestágenos a pacientes histerectomizadas represente una ventaja. Otro tema pendiente sería la forma como se administraría el gestágeno en las mujeres no histerectomizadas dado que, según las teorías de Wren, 12 la administración ideal sería continua y no cíclica por el mayor efecto proliferativo sobre el epitelio que esta última tendría. Ninguna evidencia se ha publicado al respecto.
Habrá que esperar a estudios prospectivos randomizados como el Women''s Health Initiative 22 en EE. UU.para obtener información clara sobre THS y carcinoma de mama. Se trata de un trabajo iniciado en 1991 en el que se determina el efecto de la dieta y el THS sobre osteoporosis, enfermedad coronaria y cáncer de mama. Las pacientes se randomizan para recibir placebo, estrógenos equinos conjugados o estrógenos equinos conjugados más medroxiprogesterona. La duración del estudio se prevé en unos 14 años.
CARCINOMA DE MAMA FRENTE A OTROS BENEFICIOS DEL THS
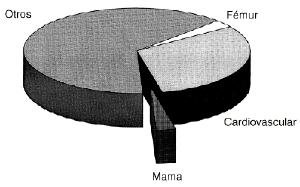
Aún si se confirma este ligero aumento en el riesgo relativo de carcinoma de mama en los trabajos prospectivos randomizados en el futuro hay que poner en la balanza los beneficios del THS en otros aspectos. Según el consenso de la Sociedad Europea de Menopausia, 23 los beneficios que se pueden obtener del THS son la prevención de la enfermedad cardiovascular, prevención de la osteoporosis, posible reducción en la incidencia de Alzheimer y carcinoma colorrectal y de los accidentes vasculares cerebrales, aparte de la mejoría en la calidad de vida en las mujeres que viven muy mal los síntomas climatéricos (sofocaciones, irritabilidad, depresión, disfunciones sexuales, etc.). Hay que recordar que el riesgo acumulativo de muerte en una mujer entre 50 y 94 años se calcula del 31% para la enfermedad cardiovascular, 2,8% para fracturas de fémur y 2,8% para la neoplasia de mama 24 (Fig. 5), y que al THS se le atribuye una reducción del 30% del riesgo de morir por IAM 25 y del 50% de sufrir una fractura de fémur. 26 Estos datos vienen reforzados por las últimas conclusiones del Nurses'' Health Study, 20 en las que hay un claro descenso de mortalidad para todas las causas en usuarias (RR, 0,63, e IC95%, 0,56 a 0,70), especialmente entre las mujeres que presentaban alto riesgo cardiovascular (disminución del 49% en la mortalidad global; RR, 0,51, e IC95%, 0,45 a 0,57). Aún aceptando un RR del 1,5 para carcinoma de mama con el THS, la mortalidad de las usuarias seguiría siendo menor. 15
Fig. 5. Riesgo acumulativo de muerte en una mujer entre 50 y 94 años según datos de Cumings et al:24 31% por enfermedad cardiovascular, 2,8% por fractura y 2,8% por cáncer de mama. El escaso aumento de riesgo de cáncer de mama por THS se vería compensado por una reducción de hasta un 30% de morir de infarto agudo de miocardio.
La supervivencia global del cáncer de mama está alrededor del 60% a los 5 años, mayor que la supervivencia a los 5 años después de un infarto agudo de miocardio. Además una cosa es la incidencia de neoplasia de mama y otra la mortalidad que ésta produce en este sentido; Henderson et al 27 hallan una menor mortalidad entre las pacientes afectas de cáncer de mama usuarias y las que no lo son, y el Collaborative Group on Hormonal Factors in Breast Cancer 21 describe neoplasias más localizadas en usuarias. Todo ello sugiere que gran parte del beneficio del THS es por el mayor control a que estas pacientes están sometidas, posibilitando diagnósticos precoces en estadios curables.
THS EN PACIENTES DIAGNOSTICADAS DE CARCINOMA DE MAMA
Estos beneficios tan espectaculares en la prevención de la enfermedad cardiovascular y osteoporosis, así como el síndrome climatérico severo que viven algunas pacientes, plantean a algunos autores el hecho que pacientes seleccionadas tratadas de carcinoma de mama y no exentas de otros riesgos potencialmente mortales son candidatas a beneficiarse del THS. Escasos estudios hay al respecto; algunos retrospectivos observacionales 28 con pocas pacientes, y dos caso-control, 29, 30 también poco potentes, que llegan a concluir que el THS puede ser beneficioso en mujeres tratadas con cáncer de mama por lo que respecta a mortalidad global.
Para llegar a alguna conclusión habrá que esperar al resultado de estudios prospectivos como el iniciado en 1994 por Vassiloupoulou-Sellin et al 31 en el que se randomizan pacientes con historia de carcinoma de mama estadios I y II, libres de enfermedad, para recibir estrógenos o ningún tratamiento. Por el momento parece prudente tratar con alternativas no hormonales la sintomatología climatérica y confiar en los beneficios del tamoxifen en el perfil lipídico y densidad ósea.
POSIBILIDADES FUTURAS
Una de las posibilidades en el futuro sería identificar las pacientes con un riesgo elevado para carcinoma de mama en las que el THS significaría una clara potenciación de este riesgo. Los trabajos publicados hasta ahora no encuentran sinergismo entre factores de riesgo clásicos (enfermedad mamaria benigna, historia familiar de cáncer de mama, nuliparidad y primer parto en edad tardía) y THS. 28 Hay de hecho poca (ninguna) experiencia en THS y pacientes con mutaciones del BRCA 1 y 2. La identificación de factores de riesgo más específicos en el futuro tal vez nos permitan ser más selectivos a la hora de prescribir THS.
Otra a línea a desarrollar es el uso de los moduladores selectivos del receptor de estrógenos (SERM por selective estrogen receptor modulators), como el raloxifeno y el propio tamoxifeno, que poseen efectos antiestrogénicos en determinados tejidos y agonistas parciales en otros. 32 Así aumentan la densidad ósea y favorecen el perfil lipídico como los estrógenos, pero tienen efecto antiestrogénico en la mama. Los SERM benzotiofenos como raloxifeno superan a los trifeniletilenos (tamoxifeno) en el sentido de que son antiestrogénicos también en útero y no incrementan el riesgo de cáncer de endometrio. 33 Todavía está en estudio la forma como efectúan su agonismo-antagonismo parcial, aunque se sabe que en parte se realiza por interacción de alta afinidad con el receptor de estrógenos, siendo el antagonismo por la vía clásica de competición por el receptor. Por contra, la actividad agonista en el hueso, por ejemplo, se produciría por mecanismos que implicarían pasos postreceptor utilizados in vivo por los metabolitos de los estrógenos. 33 El problema de los SERM es que no controlan bien la sintomatología climatérica, una de las indicaciones del THS. En todo caso parecerían adecuados para plantear THS en mujeres de claro alto riesgo de cáncer de mama o en mujeres tratadas por cáncer de mama. En este sentido resultan muy interesantes trabajos prospectivos realizados con el tamoxifeno en mujeres seleccionadas con alto riesgo para cáncer de mama 34 y con raloxifeno como THS en mujeres postmenopáusicas, 35 en los que se observa una menor incidencia de cáncer de mama en el grupo tratado con el SERM.
CONCLUSIONES
Por los datos actuales no se puede excluir que exista un ligero incremento en el riesgo relativo de cáncer de mama entre las usuarias de THS. A pesar de ello no hay que transmitir a las pacientes un alarmismo injustificado que les lleve a rechazar un tratamiento que globalmente les aportará más ventajas que riesgos. El THS debe tener una indicación clara, nunca debe administrarse sin una mamografía previa normal y se debe garantizar a la paciente un diagnóstico precoz de la neoplasia en el caso de que ésta aparezca mediante controles clínicos y mamográficos estrictos. En un futuro más o menos próximo tendremos otras opciones terapéuticas como los SERM que permitirán individualizar y diversificar el THS sin tener que asumir riesgos innecesarios.
RESUMEN
El papel de las hormonas sexuales en la aparición y desarrollo del carcinoma de mama es un hecho conocido. En los últimos años se está generalizando su uso para tratamiento y prevención de alteraciones iniciadas o potenciadas por la menopausia en la mujer. Dado que se administran a una edad en que la incidencia de carcinoma de mama aumenta notablemente, pueden incrementar al menos en teoría el riesgo de desarrollar una neoplasia mamaria. La literatura publicada al respecto así lo sugiere, aunque el incremento de riesgo relativo es escaso. Por otra parte cabe considerar los beneficios del tratamiento hormonal en cuanto a prevención de enfermedades cardiovasculares y fracturas: el riesgo de mortalidad por todas las causas globalmente es menor en usuarias de hormonas que en no usuarias. La conclusión es que el tratamiento hormonal sustitutivo debe administrarse cuando existe una indicación y la paciente puede obtener un beneficio objetivo de éste, nunca debe administrarse sin una exploración mamaria y mamografía normales previas y que deben realizarse estrictos controles periódicos para diagnosticar el carcinoma de mama en el estadio más favorable en caso de que éste aparezca.
BIBLIOGRAFÍA
1.Speroff L. The endocrinology of breast cancer. En: Speroff L, Glass RH, Case NG. Clinical gynecologic endocrinology and infertility, 5.a ed. Williams and Wilkins; 1994. p. 547-82.
2.Toniolo PO, Levitz M, Zeleniuch-Jacquotte A, Banerjee S, Koenig KL, Shore RE et al. A prospective study of endogenous estrogens and breast cancer in postmenopausal women. J Natl Cancer Inst 1995;87:190-7.
3.Trichopoulos D, MacMahon B, Cole P. Menopause and breast cancer risk. J Natl Cancer Inst 1972; 48:605-13.
4.Bilimoria MM, Jordan VC. Is it time to develop an optimal endocrine therpy for premenopausal patients with axillary node positive and negative breast cancer? Semin Surg Oncol 1996;12:339-45.
5.Vogel CL. Hormonal approaches to breast cancer treatment and prevention: an overview. Semin Oncol 1996; 23:2-9.
6.Jackisch C, Schneider HPG. Biological effects of estrogen and progestogen on human breast carcinogenesis. Men Rev 1997;2:26-34.
7.Hartwell LH, Kastan M. Cell cycle control and cancer. Science 1994;266:1821-28.
8.Kenny NJ, Dockson RB. Growth factors and sex steroids interaction in breast cancer. J Mam Biol Neoplasia 1996;1:189-98.
9.Going JJ, Anderson TJ, Battersby S, Macintyre CCA. Proliferative and secretory activity in human breast during natural and artificial menstrual cycles. Am J Pathol 1988;130:193-8.
10.Russo J, Russo IH. Development of the human mammary gland. En: Neville MC, Daniel C, eds. The mammary gland. Plenum: New York; 1987. p. 67-93.
11.Shi YE, Liu YE, Lippman ME, Dickinson RB. Progestins and antiprogestins in mammary tumour growth and metastasis. Human Reproduction 1994;9(suppl I): 163-73.
12.Wren BG. Hormonal replacement therapy and breast cancer. Eur Menopause J 1995;2:13-9.
13.Clarke CL, Sutherland RL. Progestin regulation of cellular proliferation. Endocr Rev 1990;11:266-301.
14.Musgrove EA, Lee CSL, Buckley MF, Sutherland RL. Progestins both stimulate and inhibit breast cancer cell cycle progression while increasing expression of transforming growth factor a, epidermal growth factor receptor, c-fos and c-myc genes. Mol Cell Biol 1991; 11:5032-43.
15.Birkhäuser MH. Hormone replacement therapy and breast cancer risk revisited in 1997. Menopause Review 1997;1:35-47.
16.Steinberg KK, Thacker SB, Smith SJ, Stroup DF, Zack MM, Flanders, et al. A meta-analysis of the effects of estrogen replacement therapy on the risk of breast cancer. J Am Med Assoc 1991;265:1985-90.
17.Stanford JL, Weiss NS, Voigt LF, Daling JR, Habel LA, Rossing MA. Combined estrogen and progestin hormone replacement therapy in relation to risk of breast cancer in middle-aged women. JAMA 1995;74:137-42.
18.Colditz GA, Stampfer MJ, Willet WC, Hennekens CH, Rosner B, Speizer FE. Prospective study of estrogen replacement therapy and risk of breast cancer in postmenopausal women. JAMA 1990;264:2648-53.
19.Colditz GA, Hankinson SE, Hunter DJ, Willet WC, Manson JE, Stampfer MJ, et al. The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. NEJM 1995;332:1589-93.
20.Grodstein F, Stampfer MJ, Colditz GA, Willet WC, Manson JE, Joffe M. Postmenopausal hormone therapy and mortality. NEJM 1997;336:1769-75.
21.Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52705 women with breast cancer and 108411 women without breast cancer. Lancet 1997;350:1047-59.
22.Eaker E, Hahn RA. Women''s health initiative. N Engl J Med 1994;330:70-1.
23.Consensus on Menopause of the European Manopause Society. Human Reproduction 1996;11:976-9.
24.Cummings SR, Black DM, Rubin SM. Lifetime risks of hip, Colle''s or vertebral fracture and coronary heart disease among white postmenopausal women. Arch Intern 1989;149:2445-8.
25.Ernster VL, Bush TL, Huggins GR, Hulka BS, Kelsey JL, Schottenfeld D. Benefits and risks of menopausal estrogen and/or progestin hormone use. Prev Med 1988;17:201-23.
26.Weiss NS, Ure CL, Ballard JH, Williams AR, Daling JR. Decreased risk of fractures of the hip and lower forearm with postmenopausal use of estrogen. N Engl J Med 1980;303:1195-8.
27.Henderson BE, Paganini-Hill A, Ross RK. Decreased mortality in users of estrogen-replacement therapy. Arch Intern Med 1991;151:75-8.
28.Scheele F, Kenemans P. HRT in patients at high risk of primary or recurrent breast cancer. Menopause Review 1997;1:48-55.
29.Eden JA, Bush T, Nand S, Wren BG. A case-control study of combined continuous estrogen-progestin replacement therapy among women with personal history of breast cancer. Menopause 1995;2:67-72.
30.Disaia PJ, Grosen EA, Kurosaki T, Gildea M, Cowan B, Anton-Culver H. Hormone replacement therapy in breast cancer survivors: a cohort study. Am J Obstet Gynecol 1996;174:1494-8.
31.Vassilopoulou-Sellin R, Theriault RL. Randomized prospective trial of estrogen replacement therapy in women with a history of breast cancer. Monogr Natl Cancer Inst 1994;16:153-59.
32.Mitlak BH, Cohen FJ. In search of optimal long-term female hormone replacement: the potential of selective estrogen receptor modulators. Horm Res 1997; 48:155-63.
33.Bryant Hu, Dere WH. Selective estrogen receptor modulators: an alternative to hormone replacement therapy. Proc Soc Exp Biol Med 1998;217:45-52.
34.Fisher B, et al. Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst 1998; 90:1371-88.
35. Jordan VC, et al. Incident primary breast cancers are reduced by raloxifene: integrated data from multicenters, double-blind randomized trials in 12,000 postmenopausal women. Proc Am Assoc Clin Oncol 1998; 17:466.