Se ha demostrado que la radioterapia después de la cirugía conservadora por cáncer de mama reduce las tasas de recurrencia local y la mortalidad. El tratamiento convencional de radioterapia postoperatoria era 50 a 50,4 Gy, administradas en 25 a 28 fracciones durante un período de 5 a 6 semanas. En los últimos 20 años hay evidencia clínica para considerar los esquemas de tratamiento hipofraccionados seguros y eficaces. El hipofraccionamiento moderado, administrado en 3 semanas, se puede considerar el estándar de tratamiento tras una cirugía conservadora o mastectomía, así como en irradiación de áreas ganglionares, con resultados respecto al control local y la supervivencia similares y con efectos en el tejido normal agudo y crónico, similares o menores. El tratamiento ultrahipofraccionado, administrado en 5 sesiones durante una o 5 semanas, es un tratamiento seguro y eficaz tras la cirugía conservadora y la mastectomía sin reconstrucción. Se han comunicado resultados precoces de que el tratamiento ultrahipofraccionado en una semana es seguro cuando se irradian áreas ganglionares.
Radiotherapy (RT) after breast-conserving surgery for breast cancer (BC) has been shown to reduce local recurrence rates and mortality. The conventional treatment of postoperative radiotherapy was 50 to 50.4 Gy, administered in 25 to 28 fractions over a period of 5 to 6 weeks. In the last 20 years, there is clinical evidence to consider hypofractionated treatment regimens safe and effective. Moderate hypofractionation, administered over 3 weeks, can be considered the standard of care after conservative surgery or mastectomy, as well as in irradiation of lymph node areas, with similar results regarding local control and survival and with effects on acute and chronic normal tissue. , similar or smaller. Ultrahypofractionated treatment, administered in 5 sessions, for 1 or 5 weeks, is a safe and effective treatment after conservative surgery and mastectomy without reconstruction. Early results have been reported that ultrahypofractionated treatment in 1 week is safe when lymph node areas are irradiated.
Se ha demostrado que la radioterapia (RT) después de la cirugía conservadora por cáncer de mama (CM) reduce las tasas de recurrencia local y la mortalidad, en ensayos de fase III y metaanálisis1. La RT postoperatoria es un tratamiento oncológico fundamental para las pacientes con cáncer de mama que se operan mediante cirugía conservadora o mastectomía2. Las dosis de radiación consideradas convencionales eran 50 y 50,4 Gy, administradas en 25 a 28 fracciones durante un período de 5 a 6 semanas. Esta larga duración de estos tratamientos se tradujo en incumplimiento del tratamiento, disminución de la calidad de vida y aumento del costo de la atención3.
En los últimos 20 años, se han publicado múltiples estudios prospectivos y ensayos clínicos con esquemas de tratamiento de menos número de sesiones y más dosis por sesión, hipofraccionamiento (HF), que han cambiado el estándar de tratamiento de la RT postoperatoria en cáncer de mama, pasando de 5 a 6 semanas de tratamiento frente a 3 semanas de tratamiento. El HF moderado, 40–42·56 Gy en 15–16 fracciones (fx) durante 3 semanas, es al menos igual de eficaz en el control local y supervivencia, que el tratamiento normofraccionado (NF) de 25 fx y con menores efectos adversos en los tejidos normales4.
En la comunidad científica de oncología radioterápica, se ha aceptado denominar ultrahipofraccionamiento a los estudios con esquemas de tratamiento donde la dosis por sesión es mayor a 5 Gy, estos tratamientos se administran en 5-6 sesiones con dosis de 26-32,5 Gy/ 5,2–6,5 Gy/ fx, durante una o 5 semanas. Los esquemas de tratamiento ultrahipofraccionado, no son inferiores con resultados a 5-10 años, en términos de recurrencia local (RL) y con efecto en los tejidos normales menores, en comparación con los tratamientos hipofraccionados moderado y normofraccionados, por lo que estamos ante un cambio en el tratamiento postoperatorio en el cáncer de mama, después de que los datos a largo plazo estén disponibles5,6.
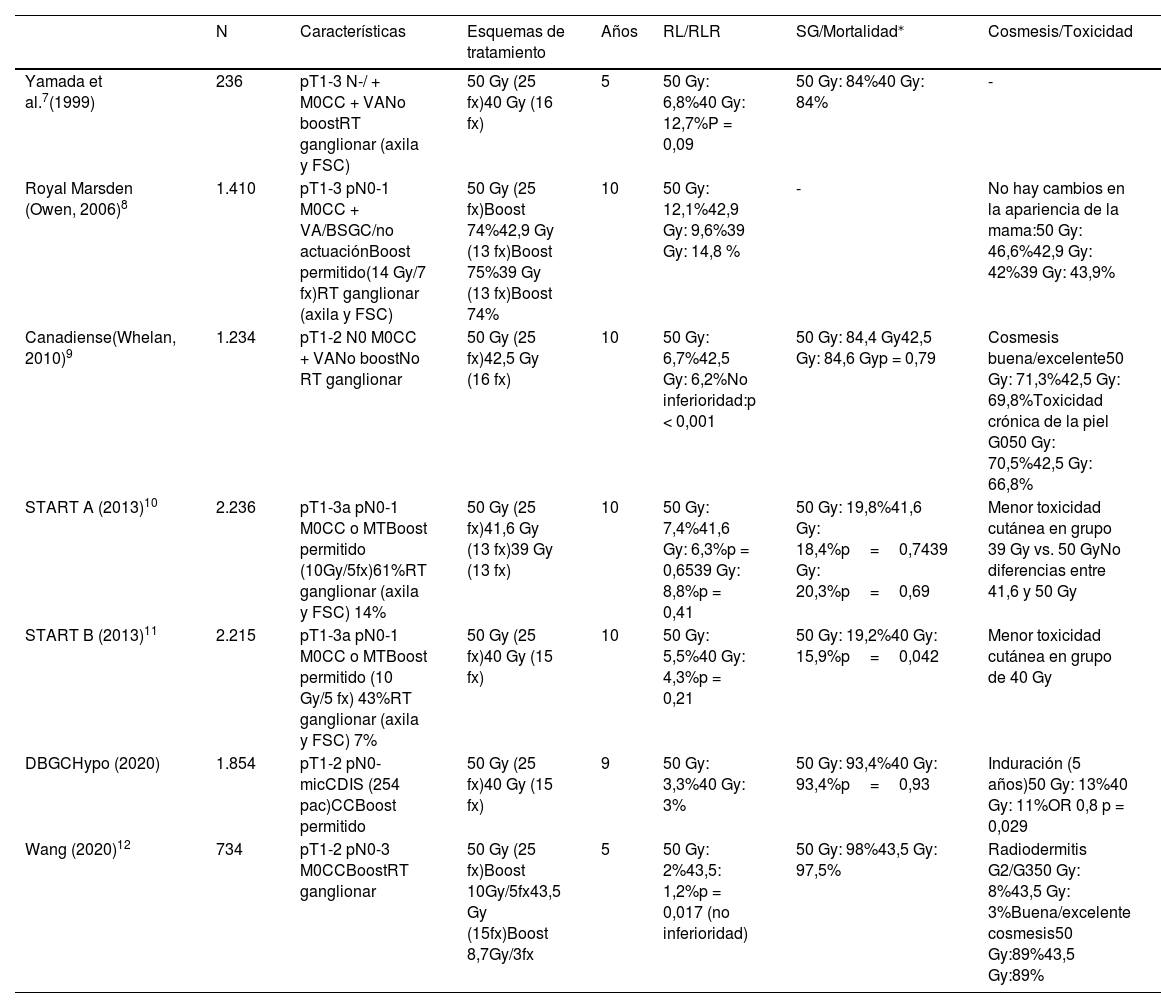
Hipofraccionamiento moderado tras la cirugía conservadoraSon varios los artículos que avalan la eficacia y seguridad del uso del HF moderado en el tratamiento radioterápico del cáncer de mama (tabla 1).
Hipofraccionamiento moderado
| N | Características | Esquemas de tratamiento | Años | RL/RLR | SG/Mortalidad⁎ | Cosmesis/Toxicidad | |
|---|---|---|---|---|---|---|---|
| Yamada et al.7(1999) | 236 | pT1-3 N-/ + M0CC + VANo boostRT ganglionar (axila y FSC) | 50 Gy (25 fx)40 Gy (16 fx) | 5 | 50 Gy: 6,8%40 Gy: 12,7%P = 0,09 | 50 Gy: 84%40 Gy: 84% | - |
| Royal Marsden (Owen, 2006)8 | 1.410 | pT1-3 pN0-1 M0CC + VA/BSGC/no actuaciónBoost permitido(14 Gy/7 fx)RT ganglionar (axila y FSC) | 50 Gy (25 fx)Boost 74%42,9 Gy (13 fx)Boost 75%39 Gy (13 fx)Boost 74% | 10 | 50 Gy: 12,1%42,9 Gy: 9,6%39 Gy: 14,8 % | - | No hay cambios en la apariencia de la mama:50 Gy: 46,6%42,9 Gy: 42%39 Gy: 43,9% |
| Canadiense(Whelan, 2010)9 | 1.234 | pT1-2 N0 M0CC + VANo boostNo RT ganglionar | 50 Gy (25 fx)42,5 Gy (16 fx) | 10 | 50 Gy: 6,7%42,5 Gy: 6,2%No inferioridad:p < 0,001 | 50 Gy: 84,4 Gy42,5 Gy: 84,6 Gyp = 0,79 | Cosmesis buena/excelente50 Gy: 71,3%42,5 Gy: 69,8%Toxicidad crónica de la piel G050 Gy: 70,5%42,5 Gy: 66,8% |
| START A (2013)10 | 2.236 | pT1-3a pN0-1 M0CC o MTBoost permitido (10Gy/5fx)61%RT ganglionar (axila y FSC) 14% | 50 Gy (25 fx)41,6 Gy (13 fx)39 Gy (13 fx) | 10 | 50 Gy: 7,4%41,6 Gy: 6,3%p = 0,6539 Gy: 8,8%p = 0,41 | 50 Gy: 19,8%41,6 Gy: 18,4%p=0,7439 Gy: 20,3%p=0,69 | Menor toxicidad cutánea en grupo 39 Gy vs. 50 GyNo diferencias entre 41,6 y 50 Gy |
| START B (2013)11 | 2.215 | pT1-3a pN0-1 M0CC o MTBoost permitido (10 Gy/5 fx) 43%RT ganglionar (axila y FSC) 7% | 50 Gy (25 fx)40 Gy (15 fx) | 10 | 50 Gy: 5,5%40 Gy: 4,3%p = 0,21 | 50 Gy: 19,2%40 Gy: 15,9%p=0,042 | Menor toxicidad cutánea en grupo de 40 Gy |
| DBGCHypo (2020) | 1.854 | pT1-2 pN0-micCDIS (254 pac)CCBoost permitido | 50 Gy (25 fx)40 Gy (15 fx) | 9 | 50 Gy: 3,3%40 Gy: 3% | 50 Gy: 93,4%40 Gy: 93,4%p=0,93 | Induración (5 años)50 Gy: 13%40 Gy: 11%OR 0,8 p = 0,029 |
| Wang (2020)12 | 734 | pT1-2 pN0-3 M0CCBoostRT ganglionar | 50 Gy (25 fx)Boost 10Gy/5fx43,5 Gy (15fx)Boost 8,7Gy/3fx | 5 | 50 Gy: 2%43,5: 1,2%p = 0,017 (no inferioridad) | 50 Gy: 98%43,5 Gy: 97,5% | Radiodermitis G2/G350 Gy: 8%43,5 Gy: 3%Buena/excelente cosmesis50 Gy:89%43,5 Gy:89% |
BSGC: Biopsia Selectiva del Ganglio Centinela; CC: Cirugía conservadora; FSC: Fosa supraclavicular; fx: fracciones; MT: Mastectomía; RT: radioterapia; VA: Vaciamiento axilar.
Yamada et al.7 publicaron en 1999 los resultados de un estudio en el que incluyeron 236 pacientes con cáncer de mama en estadio precoz tratadas con 2 esquemas de radioterapia (50 Gy en 25 fx vs. 40 Gy en 16 fx). La tasa de RL a 5 años fue 6,8% (50 Gy) y 12,7% (40 Gy), aunque no fue estadísticamente significativo (p = 0,09).
En 1986, se inició un ensayo clínico en el Hospital Royal Marsden8; aleatorizaron 1.410 mujeres con cáncer de mama pT1-3 pN0-1 M0 a recibir 50 Gy en 25 fx, 39 Gy en 13 fx o 42,9 Gy en 13 fx. En todas las pacientes se realizó cirugía conservadora con variabilidad de actuación sobre la axila (no cirugía vs. biopsia selectiva del ganglio centinela [BSGC] vs. vaciamiento axilar). Con un seguimiento de 10 años, la tasa de RL fue del 12,1% en el grupo de 50 Gy; del 14,8% en el grupo de 39 Gy y del 9,6% en el grupo de 42,9 Gy. Se evidenció diferencia significativa en cuanto a la RL en el grupo de 39 Gy con respecto al de 42,9 Gy (p = 0,027).
En el estudio de Whelan et al.9 se incluyeron 1.234 pacientes en estadio pT1-2 pN0 M0; 622 pacientes recibieron 42,5 Gy en 16 fx y 612 pacientes 50 Gy en 25 fx. Con una mediana de seguimiento de 10 años, se objetivó una RL del 6,2% para el esquema hipofraccionado y del 6,7% para el estándar. En el análisis por subgrupos se objetivó que el HF fue inferior en cuanto al control local (CL) en las pacientes con tumores G3 (HR 3,08; IC 95%: 1,22-7,76). No se realizó boost.
Entre 1999 y 200213, 4.451 mujeres con tumores pT1-3 pN0-1 M0 fueron incluidas en los estudios START A10 y B11, que comparaban el NF vs. HF de 41,6 Gy y 39 Gy/13 fx (START A) y 40 Gy/15 fx (START B). En el 14 y 7% de los casos respectivamente, se realizó irradiación de la axila y la fosa supraclavicular o axila y en el 61 y 43% de los casos, boost secuencial de 10 Gy en 5 fx al lecho tumoral. En el START A no se evidenciaron diferencias significativas en cuanto a la recurrencia locorregional (RLR), supervivencia global (SG) o supervivencia libre de enfermedad (SLE). En el START B la proporción de RLR fue similar, pero se objetivó una menor tasa de recaída a distancia para el esquema de 40 Gy (12,3% vs. 16%, p = 0,014) repercutiendo en la SG (p = 0,042).
En el año 2020 se publicaron los resultados del ensayo DBCG HYPO14, se incluyeron 1.854 pacientes con estadio pT1-2 pN0-mic M0 o carcinoma ductal in situ (254 pacientes). Se aleatorizan a: 50 Gy en 25 fx vs. 40 Gy en 15 fx. Se realizó boost secuencial en el 23,1% de los casos. Mediana de seguimiento de 9 años, la RL fue 3,3% (IC 95%; 2-5%) en el grupo de 50 Gy y del 3% en el de 40 Gy (IC 95%; 1,9-4,5%).
En el estudio de Wang et al.12, publicado en 2020, se aleatorizaron 734 pacientes con tumores pT1-2 pN0-3 M0 y cirugía conservadora a recibir 50 Gy en 25 fx o 43,5 Gy en 15 fx. A la mayoría de las pacientes (99,7%) se les realizó boost secuencial. El 3,6 y el 0,3% recibieron radioterapia sobre ganglios supra/infraclaviculares y axilares respectivamente. No hubo diferencias significativas en cuanto a RL, RLR, SLE ni SG.
En algunos de los estudios anteriores, se permitía la realización de boost, pero este se realizaba de forma secuencial. Varios estudios han demostrado que el boost integrado (SIB) mejora la homogeneidad de la dosis, la eficacia biológica y disminuye el tiempo total de tratamiento15,16. En 2022 se publica una revisión sistemática de 9 estudios que evaluaban la realización de SIB en HF moderado. La dosis prescrita a la mama variaba entre 40-46,8 Gy (15-20 fx) y la dosis al boost entre 2,4-3,4 Gy/fx (48-52,8 Gy). No se objetivó aumento de toxicidad aguda ni tardía, con buen resultado cosmético. Concluyeron que la administración de boost integrado es eficaz y segura, pero debe validarse en ensayos prospectivos17.
En ASTRO de 202218 se han dado a conocer los resultados de RTOG 1005, un ensayo fase III que aleatorizaba 2.262 pacientes diagnosticadas de cáncer de mama precoz de alto riesgo a recibir 50 Gy en 25 fx con boost secuencial o 40 Gy en 15 fx con SIB de 8 Gy (0,53 Gy/fx). Con una mediana de seguimiento de 7,3 años, no se han evidenciado diferencias significativas en cuanto a RL, toxicidad o cosmesis.
Hipofraccionamiento moderado tras la mastectomíaHasta hace unos años, ningún estudio aleatorizado a gran escala había comparado la radioterapia hipofraccionada con el fraccionamiento convencional tras la mastectomía. La evidencia disponible se basaba en series de casos, estudios retrospectivos o análisis de subgrupos de otros ensayos clínicos.
En los ensayos START A (XI) y START B (XII), un 15 % (336/2.236) y un 8% (177/2.215) respectivamente de las pacientes incluidas habían sido tratadas con HF tras mastectomía, sin evidenciarse diferencias significativas en cuanto a recurrencia local ni toxicidad tardía a 10 años.
En 201319, se publica un estudio prospectivo, no aleatorizado con pacientes de alto riesgo (pT3/T4, pN2), que han recibido una mastectomía, cuyo objetivo es estudiar la eficacia y la tolerabilidad. La dosis en la pared torácica FSC es 35 Gy/3,5 Gy, en 2 semanas, sobreimpresión de 8 Gy (4 Gy/fracción) a la cicatriz quirúrgica (5 cm de ancho). Con extensión extranodal, la axila y FSC se irradio con 38,5 Gy/3,5Gy. En una mediana de tiempo de seguimiento de 44 meses, se observó un edema subcutáneo moderado fuera y dentro del área torácica de refuerzo en 5 de 112 (4,4 %) y 8 de 112 (7,1 %) casos, respectivamente. La supervivencia libre de recidiva local a 5 años del 97%.
En 2019, Wang et al.20 publica resultados a 5 años de un ensayo fase 3 aleatorizado, de no inferioridad que comparaba el 43,5 Gy/15 fx vs. 50 Gy/25 fx, sobre pared torácica y áreas ganglionares (nivel III y FSC) en 820 pacientes con cáncer de mama localmente avanzado (pT3-T4 o pN2-3, si la cirugía era el tratamiento primario o ypN+ tras QT neoadyuvante). Intervenidas mediante mastectomía y vaciamiento axilar. Ninguna paciente recibió RT sobre niveles I-II, ni cadena mamaria interna. A los 5 años, la RL (convencional 8,1% vs. HF moderado 8,3%; p < 0,0001) ni SG (convencional 86% vs. HF moderado 84%; p = 0,52) (tabla 2).
Hipofraccionamiento moderado en pacientes mastectomizadas
| Estudio | Pacientes (n) | Características | Esquemas de tratamiento | Resultados |
|---|---|---|---|---|
| Koukourakis et al.19 (2013) | 112 | pT3-4 pN2 | 35 Gy (10 fx)Boost: 8 Gy/2fxÁrea ganglionar:35-38,5 Gy/10-11 fx | RL: 3/112 pSLRL (5a): 97%SCE: (5a): 84% |
| Wang et al.12 (2019) | 820 | T3-4 o pN2-ypN+Mastectomía + VA | 50 Gy (25 fx) vs. 43,5 Gy (15 fx) | RLR (5 a)8,1% (25 fx) vs.8,3% (15 fx)SG:86% (25 fx) vs.84% (15 fx) |
RLR: Recurrencia locorregional.
Tampoco hubo diferencias significativas en cuanto a toxicidades agudas ni crónicas, excepto que se evidenció menor toxicidad cutánea grado 3 aguda en el grupo de HF moderado que en el convencional (3% vs. 8%; p < 0,0001).
En 2020 Lui et al.21 publicaron un metaanálisis, en el que se incluyen 24 estudios retrospectivos y un EC controlado aleatorizado con 3.780 pacientes a las que se había realizado mastectomía. El área de tratamiento abarcaba la pared costal y/o FSC ipsilateral. Ocho estudios permitían irradiar niveles axilares o cadena mamaria interna si era necesario. La dosis variaba de 39 a 48,3 Gy con un fraccionamiento de 2,3-3,2 Gy/día. No se evidenciaron diferencias estadísticamente significativas en cuanto a resultados y toxicidad, siendo un tratamiento seguro y eficaz.
Son necesarios ensayos clínicos consistentes y con seguimiento a largo plazo que evalúen los resultados del tratamiento hipofraccionado sobre áreas ganglionares, sobre todo en la cadena mamaria interna. Los datos hasta el momento no parecen evidenciar un empeoramiento en cuanto a resultados clínicos o toxicidad22.
En 2022 se han publicado los resultados de un estudio prospectivo que comparaba RT normofraccionada vs. HF moderado en pacientes sometidas a reconstrucción diferida o inmediata. Los resultados parecen ser comparables en cuanto a tasa de complicaciones23.
Existen varios ensayos en curso, como el Alliance 221505 y el ensayo Dana-Farber, que evalúan actualmente el uso del HF moderado en este escenario.
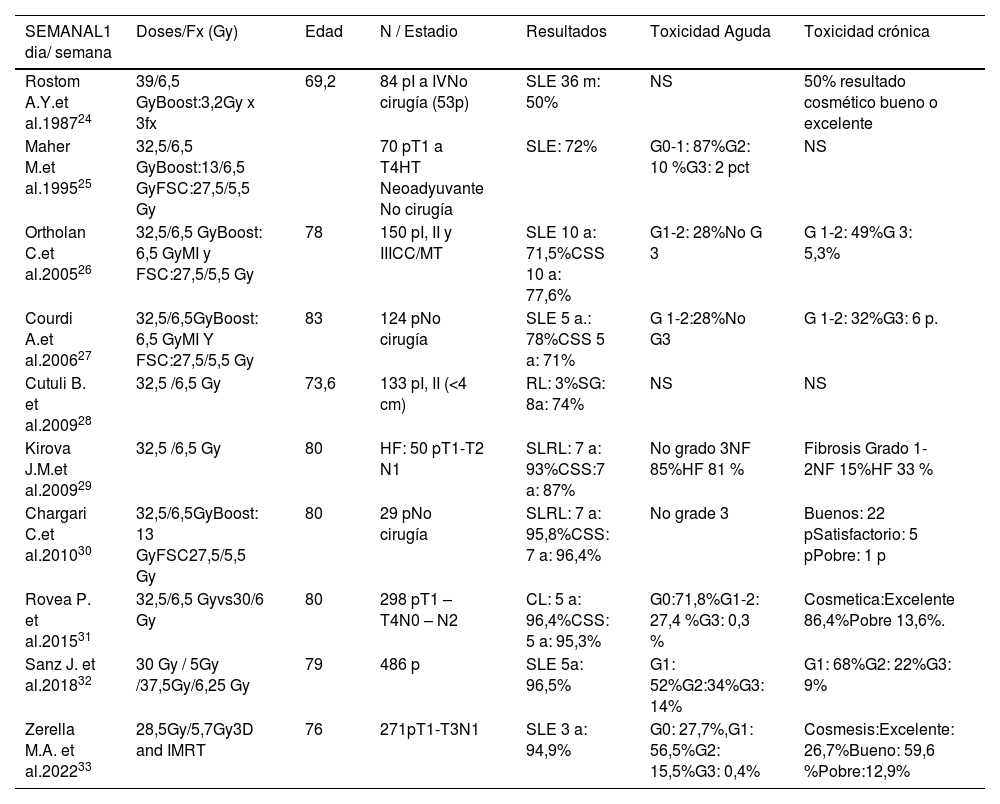
Tratamiento ultrahipofraccionadoEn los últimos años, se han publicados ensayos clínico fase I-II y fase III, de tratamiento UHP o de tercera generación (III), de radioterapia postoperatoria tras la cirugía conservadora en cáncer de mama. Aunque tenemos publicados estudios prospectivos y retrospectivos de tratamiento ultrahipofraccionado, desde el año 198724. Posteriormente se publicaron 9 estudios25–33 con esquema de tratamiento semanal entre los años 1995 y 2022. La dosis administrada en estos estudios es de 28,5-39 Gy, con un fraccionamiento de 5,5–6,5 Gy/ fx, una fracción al día, durante 5-6 semanas (tabla 3).
Estudios retrospectivos-prospectivos de ultrahipofraccionamiento semanal
| SEMANAL1 dia/ semana | Doses/Fx (Gy) | Edad | N / Estadio | Resultados | Toxicidad Aguda | Toxicidad crónica |
|---|---|---|---|---|---|---|
| Rostom A.Y.et al.198724 | 39/6,5 GyBoost:3,2Gy x 3fx | 69,2 | 84 pI a IVNo cirugía (53p) | SLE 36 m: 50% | NS | 50% resultado cosmético bueno o excelente |
| Maher M.et al.199525 | 32,5/6,5 GyBoost:13/6,5 GyFSC:27,5/5,5 Gy | 70 pT1 a T4HT Neoadyuvante No cirugía | SLE: 72% | G0-1: 87%G2: 10 %G3: 2 pct | NS | |
| Ortholan C.et al.200526 | 32,5/6,5 GyBoost: 6,5 GyMI y FSC:27,5/5,5 Gy | 78 | 150 pI, II y IIICC/MT | SLE 10 a: 71,5%CSS 10 a: 77,6% | G1-2: 28%No G 3 | G 1-2: 49%G 3: 5,3% |
| Courdi A.et al.200627 | 32,5/6,5GyBoost: 6,5 GyMI Y FSC:27,5/5,5 Gy | 83 | 124 pNo cirugía | SLE 5 a.: 78%CSS 5 a: 71% | G 1-2:28%No G3 | G 1-2: 32%G3: 6 p. |
| Cutuli B. et al.200928 | 32,5 /6,5 Gy | 73,6 | 133 pI, II (<4 cm) | RL: 3%SG: 8a: 74% | NS | NS |
| Kirova J.M.et al.200929 | 32,5 /6,5 Gy | 80 | HF: 50 pT1-T2 N1 | SLRL: 7 a: 93%CSS:7 a: 87% | No grado 3NF 85%HF 81 % | Fibrosis Grado 1-2NF 15%HF 33 % |
| Chargari C.et al.201030 | 32,5/6,5GyBoost: 13 GyFSC27,5/5,5 Gy | 80 | 29 pNo cirugía | SLRL: 7 a: 95,8%CSS: 7 a: 96,4% | No grade 3 | Buenos: 22 pSatisfactorio: 5 pPobre: 1 p |
| Rovea P. et al.201531 | 32,5/6,5 Gyvs30/6 Gy | 80 | 298 pT1 – T4N0 – N2 | CL: 5 a: 96,4%CSS: 5 a: 95,3% | G0:71,8%G1-2: 27,4 %G3: 0,3 % | Cosmetica:Excelente 86,4%Pobre 13,6%. |
| Sanz J. et al.201832 | 30 Gy / 5Gy /37,5Gy/6,25 Gy | 79 | 486 p | SLE 5a: 96,5% | G1: 52%G2:34%G3: 14% | G1: 68%G2: 22%G3: 9% |
| Zerella M.A. et al.202233 | 28,5Gy/5,7Gy3D and IMRT | 76 | 271pT1-T3N1 | SLE 3 a: 94,9% | G0: 27,7%,G1: 56,5%G2: 15,5%G3: 0,4% | Cosmesis:Excelente: 26,7%Bueno: 59,6 %Pobre:12,9% |
Tabla de elaboración propia.
CC: Cirugia Conservadora; FSC: Fosa supraclavicular; HT: Hormonoterapia; IMRT: Radioterapia de Intensidad Modulada; MT: Mastectomia; NS: nos especificado; RL: Recurrencia local.
Las características de las pacientes incluidas en estos estudios son: pacientes de edad avanzada, mayores de 65 años, con comorbilidades, diagnosticadas de cáncer de mama, operadas mediante cirugía conservadora o mastectomía. En 3 estudios se incluyeron pacientes no candidatas a cirugía24,25,27. En 4 estudios25–27,30 se irradian áreas ganglionares con esquema de tratamiento de 27,5 Gy / 5,5 Gy por fx, en todos se irradia la fosa supraclavicular y en 2 estudios26,27 también se irradia la cadena mamaria interna con mismo esquema de tratamiento.
Los resultados clínicos de estos estudios medidos como SLE y supervivencia causa especifica (SCE), a 5 y 10 años están por encima del 70% con datos de toxicidad dérmica aguda y crónica muy tolerable y con baja tasa de toxicidad mayor a grado II.
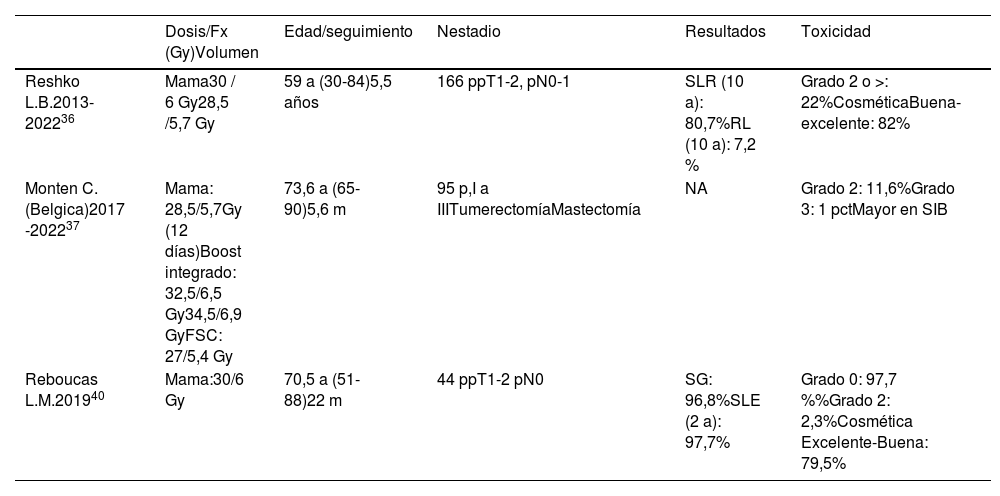
Los estudios fase I-II publicados, se han realizado en 3 instituciones: Universidad de Louisville, Kentucky (EE. UU.)34–36, Universidad de Ghent (Bélgica)37–39 y en la Universidad Federal do Ceara, Fortaleza (Brasil)40 (tabla 4).
Estudios fase I-II de tratamiento ultrahipofraccionado
| Dosis/Fx (Gy)Volumen | Edad/seguimiento | Nestadio | Resultados | Toxicidad | |
|---|---|---|---|---|---|
| Reshko L.B.2013-202236 | Mama30 / 6 Gy28,5 /5,7 Gy | 59 a (30-84)5,5 años | 166 ppT1-2, pN0-1 | SLR (10 a): 80,7%RL (10 a): 7,2 % | Grado 2 o >: 22%CosméticaBuena-excelente: 82% |
| Monten C.(Belgica)2017 -202237 | Mama: 28,5/5,7Gy (12 días)Boost integrado: 32,5/6,5 Gy34,5/6,9 GyFSC: 27/5,4 Gy | 73,6 a (65-90)5,6 m | 95 p,I a IIITumerectomíaMastectomía | NA | Grado 2: 11,6%Grado 3: 1 pctMayor en SIB |
| Reboucas L.M.201940 | Mama:30/6 Gy | 70,5 a (51-88)22 m | 44 ppT1-2 pN0 | SG: 96,8%SLE (2 a): 97,7% | Grado 0: 97,7 %%Grado 2: 2,3%Cosmética Excelente-Buena: 79,5% |
SLE: Libre de enfermedad; SIB: Boot integrado.
En el estudio de la Universidad de Louisville, se incluyen 166 pacientes, dosis: 28,5-30 Gy/5 fx. La edad de las pacientes es de 30-84 años, mediana de 59 años. A los 7 años, el riesgo de RL es 4,7 %, SLE: 93,6% y SG: 88,6%. La toxicidad aguda de grado 1 o 2, más frecuente fue el dolor de mama, seguido de dermatitis y astenia. Los resultados cosméticos excelentes o buenos vs. cosmética regular o mala fue del 82,3% frente al 17,7% respectivamente.
El estudio de la Universidad de Ghent, se evalúan 2 fraccionamientos, 530 pacientes 15 fx y 196 pacientes 5 fx, en 12 días, intervenidas mediante cirugía conservadora o mastectomía, estadio I a III. La dosis administrada a la mama o pared torácica es 28,5 Gy/ 5,7 Gy (12 días). Las áreas ganglionares se irradian a 27 Gy/5,4 Gy, exceptuando la cadena mamaria interna. Si hay indicación de sobreimpresión en lecho tumoral siguiendo la guía del hospital, se administra un SIB a dosis de 32,5 Gy/6,5 Gy y si márgenes de resección positivos 34,5 Gy/6,9 Gy. Concluyen que los pacientes tratados en 5 fracciones muestran un menor deterioro del bienestar físico de 2 a 4 semanas después radioterapia.
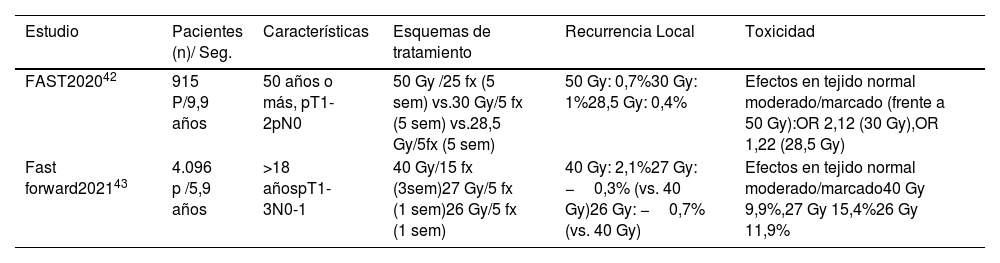
En los 2 últimos años, se han publicado con resultados a 10 y 5 años, 2 estudios fases III, el estudio FAST41,42 y el estudio FAST FORWARD43,44 (tabla 5).
Estudios fase III de esquema ultrahipofraccionado
| Estudio | Pacientes (n)/ Seg. | Características | Esquemas de tratamiento | Recurrencia Local | Toxicidad |
|---|---|---|---|---|---|
| FAST202042 | 915 P/9,9 años | 50 años o más, pT1-2pN0 | 50 Gy /25 fx (5 sem) vs.30 Gy/5 fx (5 sem) vs.28,5 Gy/5fx (5 sem) | 50 Gy: 0,7%30 Gy: 1%28,5 Gy: 0,4% | Efectos en tejido normal moderado/marcado (frente a 50 Gy):OR 2,12 (30 Gy),OR 1,22 (28,5 Gy) |
| Fast forward202143 | 4.096 p /5,9 años | >18 añospT1-3N0-1 | 40 Gy/15 fx (3sem)27 Gy/5 fx (1 sem)26 Gy/5 fx (1 sem) | 40 Gy: 2,1%27 Gy: −0,3% (vs. 40 Gy)26 Gy: −0,7% (vs. 40 Gy) | Efectos en tejido normal moderado/marcado40 Gy 9,9%,27 Gy 15,4%26 Gy 11,9% |
El ensayo FAST41,42 aleatorizó a 915 mujeres (50 años o más, pT1-2pN0) después de la cirugía conservadora a uno de los 3 regímenes: 50 Gy/25 fx vs. 30 Gy/5 fx semanales vs. 28,5 Gy/5 fx semanales. No se permitió la sobreimpresión del lecho tumoral. El objetivo primario fue el cambio en la apariencia fotográfica a los 2 y 5 años. Los datos a 10 años han demostrado un aumento de las tasas de efectos adversos sobre el tejido normal, de moderados/marcados con el brazo de 30 Gy, pero ninguna diferencia con el brazo de 28,5 Gy vs. 50 Gy. Las tasas de recurrencia local fueron 11 eventos (3 recurrencias locales con 50 Gy, 4 con 30 Gy, 4 con 28, 5 Gy). Las limitaciones de este estudio incluyen que no fue diseñado para evaluar el control local, en ningún paciente se administra sobreimpresión del lecho tumoral, ni irradiación de áreas ganglionares. La mayoría de los pacientes tenían más de 60 años.
En el estudio FAST- FORWARD43,44, se aleatorizó a 4.096 mujeres, con rango de edad entre 25 y 90 años, las pacientes incluidas menores de 40 años suponen menos del 2%, y entre 40 y 49 años un 13%. Por estadio se incluyen pT1-3, pN0-1, después de la cirugía conservadora y un 6% de pacientes mastectomizadas. Los esquemas de tratamiento son: 40 Gy en 15 fx vs. 27 Gy en 5 fx diarias vs. 26 Gy en 5 fx diarias. Se permitió sobreimpresión del lecho tumoral, de forma secuencial 10 Gy (76-81% de pacientes) o 16 Gy (19-23% de pacientes) con electrones o fotones a 2Gy/fx y se utilizó en el 24 al 25% de los pacientes. El objetivo principal es recurrencia tumoral en mama ipsilateral, con un diseño de no inferioridad. A los 5 años, RL fue del 2,1% con el brazo de 40 Gy, 1,7% en el brazo de 27 Gy y 1,4% en el brazo de 26 Gy. Los efectos en el tejido normal medidos como moderados o marcados fueron comparables entre el brazo de 40 Gy (9,9%) y el brazo de 26 Gy. Actualmente, se está realizando un subestudio que evalúa estos esquemas de tratamiento en los pacientes tratados con irradiación ganglionar regional.
DiscusiónCon base en los estudios revisados y considerando los niveles de acuerdo del Consenso Europeo (CE) publicado en 202245, podemos considerar que el tratamiento estándar de radioterapia postoperatoria en cáncer de mama tras la cirugía conservadora, es al menos el esquema hipofraccionados moderado, independientemente de la edad, factores pronósticos y sobreimpresión del lecho tumoral. El nivel de acuerdo en el CE fue 100% (CE: 100%).
En las pacientes mastectomizadas, el nivel de evidencia es menor, pero hay estudios que justifican hacer tratamiento HF tras la mastectomía, en la práctica clínica habitual (CE: 95,6%). Así mismo se puede considerar el tratamiento estándar en las pacientes con reconstrucción tras la mastectomía (CE: 86,9%)
Con respecto a la irradiación de áreas ganglionares (nivel I, II, III, IV y mamaria interna), también consideramos el tratamiento hipofraccionado moderado, como el estándar de tratamiento (CE: 82,6%).
Por lo que el tratamiento hipofraccionado moderado, se debe considerar el nuevo estándar de tratamiento en cáncer de mama en todas las situaciones clínicas que se presentan en la práctica clínica habitual.
Respecto al esquema de tratamiento ultrahipofraccionado, se puede considerar el tratamiento estándar en la práctica clínica habitual para las pacientes con cirugía conservadora (CE: 86,9%).
Tras la mastectomía, el nivel de evidencia es menor, pero tenemos resultados de ensayos fase II y estudios prospectivos que es un tratamiento seguro y eficaz (CE: 78,3%). No tenemos datos de pacientes con reconstrucción tras la mastectomía.
Con respecto a la irradiación de las áreas ganglionares, tenemos menor nivel de evidencia. Los datos comunicados en ESTRO de 2022, del estudio FAST-FORWARD, concluyen que es un tratamiento seguro, así como los resultados de estudios fase II y estudios prospectivos, aportan que es un tratamiento seguro y eficaz, por lo que se puede ofrecer a pacientes que se beneficien de un tratamiento en el área ganglionar, pero que por fragilidad, comorbilidad o lejanía al centro sanitario, no puedan realizar el tratamiento de 15 sesiones, hasta que tengamos mayor evidencia y sea el estándar.
ConclusionesEl esquema de tratamiento hipofraccionado moderado, se puede considerar el estándar de tratamiento en todas las situaciones clínicas postoperatoria de cáncer de mama.
El tratamiento ultrahipofraccionado, aunque con menor nivel de evidencia, también ofrece resultados prometedores en el tratamiento postoperatorio de cáncer de mama, en las diferentes situaciones clínicas de la práctica habitual.
LimitacionesAunque en esta revisión se incluyen los estudios más importantes de radioterapia hipofraccionada moderada y ultrahipofraccionada en el tratamiento postoperatorio del cáncer de mama, los criterios de selección empleados por las autoras y autores podrían excluir investigaciones relevantes que se encuentren en curso o documentos publicados en otros idiomas diferentes al inglés. En este artículo tampoco se ha realizado un análisis en profundidad de los diseños metodológicos y posibles sesgos de los estudios presentados, ni de la validez interna de los mismos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticasLos autores declaran que han seguido todas las normas éticas para la publicación de artículos de revisión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.