Analgesia preventiva
La analgesia preventiva consiste en la administración de fármacos para conseguir un estado analgésico previo al trauma quirúrgico que disminuya la respuesta sensitiva periférica y central al dolor; con ella se intenta interrumpir el círculo inflamación-dolor-hiperalgesia-aumento del estímulo doloroso. El objetivo de la analgesia preventiva es la reducción de los requerimientos analgésicos postoperatorios y reducir el riesgo de hiperalgesia (respuesta exagerada a estímulos dolorosos), primaria o secundaria, y alodinia (respuesta relacionada con el dolor a un estímulo que normalmente es inocuo).
Tras varios años de controversia acerca de la analgesia preventiva se ha acabado demostrando su eficacia1. Los analgésicos administrados antes de que se produzca el estímulo nociceptivo son más efectivos durante el acto quirúrgico si la anestesia es general, y antes de que remita el bloqueo si se trata de anestesia locorregional. Se intenta prevenir la sensibilización central causada por la agresión quirúrgica y por los fenómenos inflamatorios. Se iniciaría antes de la incisión y abarcaría el período quirúrgico y el postoperatorio, ya que la ocupación de receptores en el asta dorsal de la médula, antes de la entrada del estímulo nociceptivo, podría reducir e incluso abolir la progresión del estímulo hacia la corteza2.
Muchos autores defienden la teoría de que los neuromoduladores nos ofrecen una nueva herramienta para el alivio del dolor postoperatorio enmarcados dentro del concepto de analgesia multimodal perioperatoria3-11.
El objetivo de este trabajo fue realizar un estudio comparativo de dolor agudo postoperatorio en pacientes intervenidos de hernia umbilical, crural o inguinal por cirugía abierta con colocación de malla, tratados en el período perioperatorio con pregabalina (PGB) o sin ella.
Perfil farmacológico de pregabalina
La PGB es el ácido (S)-3-(aminometil)-5-metilhexanoico, al igual que la molécula que apareció con anterioridad (gabapentina) es un análogo del ácido gammaaminobutírico (GABA), principal neurotransmisor con función inhibitoria del sistema nervioso central (SNC).
Aunque estructuralmente PGB se ve como análogo GABA, no se une al receptor ni es capaz de desarrollar acciones gabaérgicas; además, los efectos antinociceptivos en modelos de dolor neuropático no se revierten con la administración de antagonistas de los receptores GABA.
El mecanismo de acción más aceptado hasta ahora está ligado a la capacidad de unirse a la fracción subunidad proteica (α2-δ) de los canales de calcio de tipo P, Q y N dependientes del voltaje en el SNC, desplazando potencialmente a [3H]-gabapentina. Los mecanismos desencadenados son básicamente la reducción de la liberación de neurotransmisores, con lo que disminuye la hiperexcitabilidad neuronal en las distintas áreas del sistema nervioso relacionadas con patologías, como el dolor neuropático periférico o central, la ansiedad o la epilepsia. Estas acciones se llevan a cabo de manera presináptica y, por eso, la disminución en la entrada del ión calcio a este nivel reduce la presencia de glutamato, sustancia P y noradrenalina en la sinapsis12,13.
En estudios in vitro se ha demostrado que, en neuronas hiperexcitadas, pregabalina reduce la liberación provocada por glutamato14 mediada por iones potasio, sustancia P15 y noradrenalina de forma dependiente al estímulo16. La modulación de la función del canal de calcio y la atenuación de la liberación de neurotransmisores reducen la excitabilidad neuronal, especialmente en condiciones de excesiva actividad neuronal con elevadas concentraciones de potasio o cambios plásticos relacionados con el dolor neuropático16.
La PGB, administrada por vía intratecal en ratas, revirtió la hiperalgesia térmica inducida por la sustancia P. El hecho de que la potencia de pregabalina sea mayor si se administra por vía intratecal apoya el dato de que la médula espinal es el principal foco de la actividad analgésica17.
La PGB bloqueó la inducción y mantenimiento de la hiperalgesia y la alodinia tras la incisión quirúrgica del músculo plantar en ratas18. Se cree que la sensibilización de las neuronas del asta dorsal contribuye a la cronificación de la sensibilidad característica de los estados de dolor crónicos inducidos por lesión tisular o por neuropatía. La prevención de la fase de inducción dolorosa derivada del uso de PGB en este modelo de dolor postoperatorio produjo efectos analgésicos que duraron varios días18.
La PGB aumentó la duración del sueño no REM (fase sin movimientos oculares rápidos durante el sueño) y redujo la del sueño REM tras la administración a ratas en presencia de luz o en la oscuridad. En ambas condiciones PGB aumentó la cantidad de actividad de ondas lentas del electroencefalograma19.
También hay otras posibles interacciones con el sistema de transporte del L-aminoácido, la hiperpolarización de los canales de potasio e inhibición del receptor tipo AMPA, principalmente a nivel espinal, aunque esta interacción se ha cuestionado recientemente20,21.
En cuanto a la farmacocinética, PGB se absorbe rápidamente por vía digestiva, con una concentración máxima de 1 h tras la administración. La biodisponibilidad es del 90% y su farmacocinética es predecible y lineal, con baja variabilidad interindividual22; además, el perfil concentración/tiempo es el mismo si las dosis se administran 2 o 3 veces al día. La PGB no se une a las proteínas plasmáticas y no se metaboliza en el hígado, por lo que no se producen interacciones farmacológicas a estos niveles; se ha demostrado que atraviesa fácilmente la barrera hematoencefálica. La PGB se elimina fundamentalmente por riñón como fármaco intacto, por consiguiente, es necesario reducir la dosis en los pacientes con disfunción renal o en hemodiálisis.
En relación con la seguridad y tolerabilidad de PGB, todos los estudios en los que se ha utilizado dicho fármaco para el tratamiento del dolor neuropático concluyen que se trata de un fármaco seguro. Los efectos adversos más frecuentes que se han descrito con su uso son: mareo (23%), somnolencia (14,6%), edema periférico (10,4%), sequedad de boca (6%) y cefaleas (7,2%); suelen aparecer con carácter leve y se advierte un comportamiento dependiente de la dosis, por lo que los efectos adversos suelen disminuir al reducir la dosis y desaparecen sin dejar secuelas tras la suspensión del fármaco.
Material y métodos
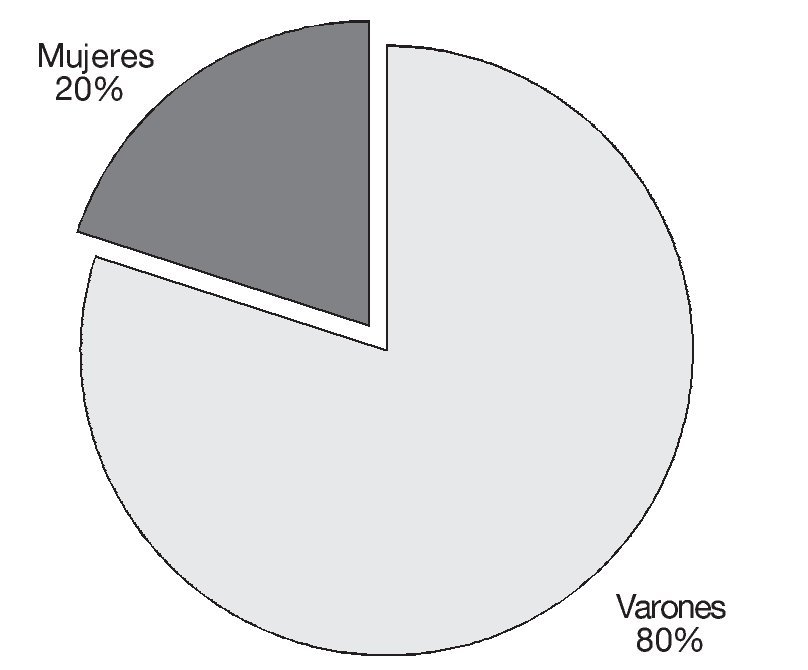
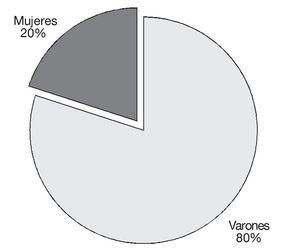
Se realizó un estudio prospectivo, aleatorizado, que incluyó a 140 pacientes intervenidos de hernia inguinal, crural o umbilical con colocación de malla, por cirugía abierta. En lo referente al sexo fueron 112 varones, que supusieron un 80% del total, y 28 mujeres, que supusieron el 20% restante (fig. 1). Los pacientes se distribuyeron en 2 grupos, grupo I: 70 de ellos fueron tratados con PGB 75 mg noche durante 3 días antes de la intervención y 75 mg noche durante 12 días después a partir del mismo día de la intervención. Grupo II: 70 sin PGB. No hubo diferencias entre ambos grupos en edad, que estaban comprendidos entre 18-79 años (edad media: 55,47 ± 13,38) ni tampoco en el grado ASA: entre I-III.
Figura 1 Sexo.
La evaluación del dolor se basó en la escala analógica verbal y consumo de pirazolonas a demanda siempre que el paciente sintiera dolor. También se registró el número de horas de sueño y la mejoría o no en la calidad del sueño según los siguientes ítems: dificultad para iniciar y mantener el sueño, despertarse varias veces por la noche, tener la sensación de pasar las noches en blanco y levantarse de la cama igual de cansado que al acostarse.
Los controles se realizaron después de 1, 6 y 12 meses de la intervención. Se registraron los efectos adversos.
Las mallas quirúrgicas utilizadas fueron mallas tejidas con monofilamento de polipropileno no absorbible.
Se excluyó del estudio a los pacientes con cardiopatía severa, enfermedad respiratoria grave, insuficiencia renal, tratamiento con psicofármacos (ansiolíticos, antidepresivos y/o anticonvulsionantes), ASA IV-V, sospecha de abuso de drogas o alcoholismo y alérgicos a pirazolonas.
El análisis estadístico se realizó con el test de Kolmogorov-Smirnov del programa Statgraphics. Se consideró significativa una p < 0,05.
Resultados
Los resultados analgésicos, la valoración del número de horas de sueño, la mejora de la calidad del sueño y el registro de los efectos adversos se recogieron a través de consultas telefónicas después de 1, 6 y 12 meses de la intervención. Previamente se había excluido del estudio a los pacientes que por algún motivo no habían cumplido los requisitos exigidos.
Los resultados analgésicos en el grupo I (pacientes tratados con 75 mg de PGB al acostarse 3 días antes y 75 mg al acostarse 12 días después incluida la noche de la intervención) fueron:
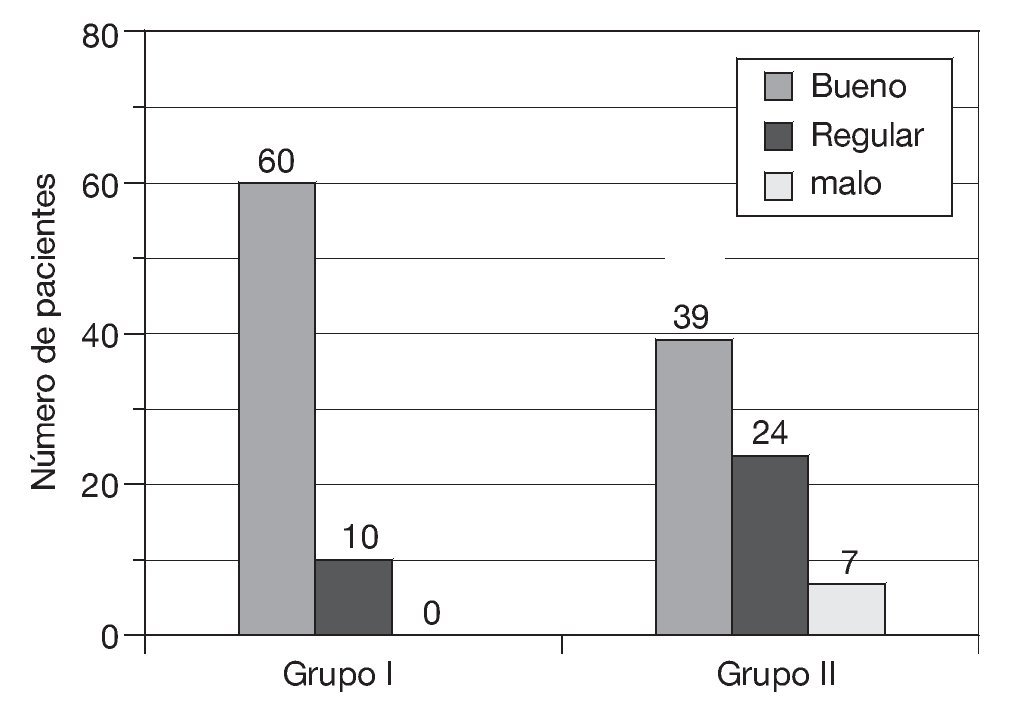
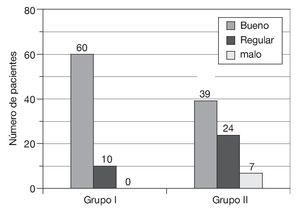
— 1 mes después de la intervención: control del dolor bueno en 60 pacientes, que supuso el 86% del total; regular en 10, que supuso el 14%, y malo en ninguno (0%) (fig. 2).
Figura 2 Resultado analgésico 1 mes después de la intervención.
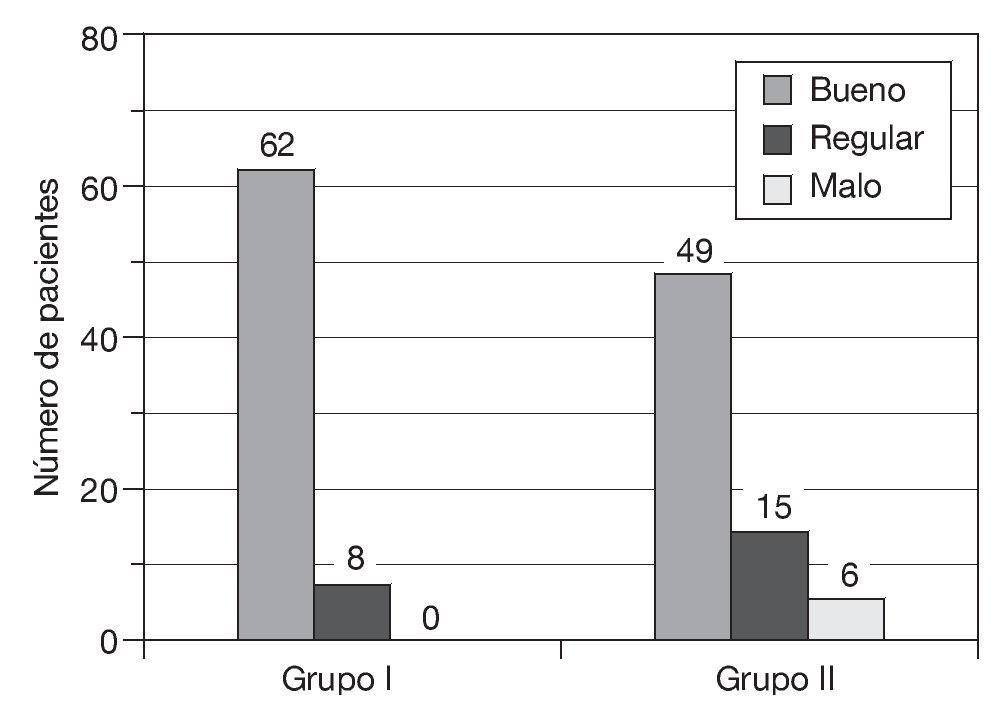
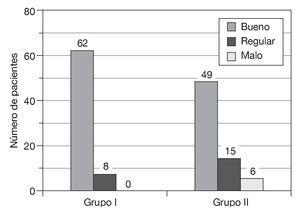
— A los 6 meses: control del dolor bueno en 62 pacientes, que supuso el 89% del total; regular en 8 que supuso el 11%, y malo en ninguno (0%) (fig. 3).
Figura 3 Resultado analgésico 6 meses después de la intervención.
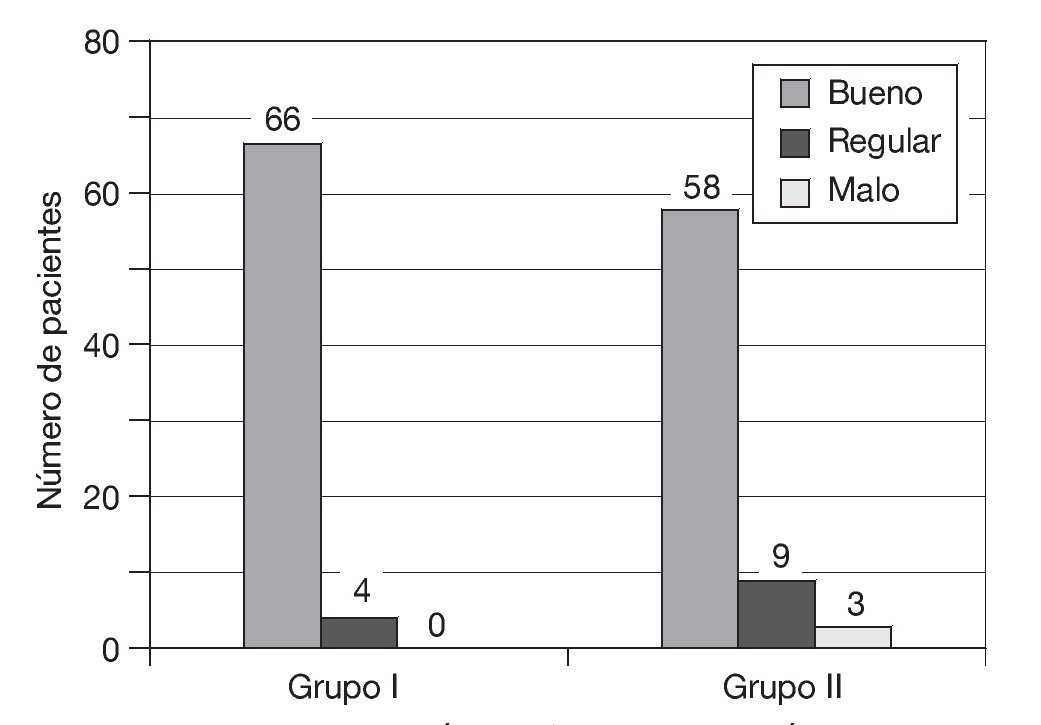
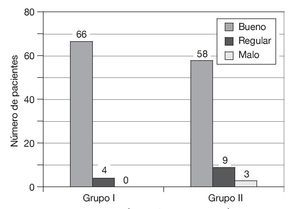
— A los 12 meses: control del dolor bueno en 66 pacientes, que supuso el 94% del total; regular en 4, que supuso el 6%, y malo en ninguno (0%) (fig. 4).
Figura 4 Resultado analgésico 12 meses después de la intervención.
— El dolor presentaba características neuropáticas en el 35%, en el 75% de ellos era neuropático puro y en el 25% mixto.
Los resultados analgésicos en el grupo II (pacientes sin tratamiento de pregabalina) fueron:
— 1 mes después de la intervención: control del dolor bueno en 39 pacientes, que supuso el 56% del total; regular en 24, que supuso el 34%, y malo en 7, que supuso el 10% (fig. 2).
— A los 6 meses: control del dolor bueno en 49 pacientes, que supuso el 70% del total; regular en 15, que supuso el 22%, y malo en 6, que supuso el 8% (fig. 3).
— A los 12 meses: control del dolor bueno en 58 pacientes, que supuso el 83% del total; regular en 9, que supuso el 13%, y malo en 3, que supuso el 4% (fig. 4).
— El dolor presentaba características neuropáticas en el 85%, en el 70% de ellos era neuropático puro y en el 30%, mixto.
En ambos grupos el dolor nociceptivo puro desapareció en las 3-4 primeras semanas.
Debido a que el valor de p fue menor que 0,05 hay una diferencia estadísticamente significativa entre las 2 distribuciones, con un nivel de confianza del 95%.
Por lo tanto, en cuanto a los resultados analgésicos, hubo diferencias estadísticamente significativas en las diferentes determinaciones de cada grupo. Por el contrario, no hubo diferencias entre ambos grupos en edad y grado ASA.
Con respecto al aumento o no del número de horas de descanso nocturno, el 58% de los pacientes del grupo I tratados con PGB registró menor dificultad para iniciar y mantener el sueño, se despertaba menor número de veces por la noche y experimentó un aumento en el número de horas de sueño (entre 1 y 2 h), el 60% de estos pacientes refirió tener la sensación de haber dormido bien y levantarse por la mañana más descansado que al acostarse con un sueño reparador basado en una mejoría en la calidad del sueño.
En los pacientes del grupo II que no tomaron PGB el aumento del número de horas de descanso nocturno y la mejoría en la calidad del sueño no se puso de manifiesto.
Los efectos adversos aparecieron exclusivamente en el grupo I, que correspondía a los que habían tomado PGB, se registraron en el 10% de los pacientes y fueron mareo en 5 casos, somnolencia en 1 y cefalea en 1.
Discusión
El dolor que aparece después de la reparación de una hernia por cirugía abierta puede ser una complicación que representa un importante desafío en el diagnóstico y tratamiento. El dolor postoperatorio normal en estos casos afecta inmediatamente después de la cirugía y gradualmente disminuye en unos días; sin embargo, en algunos pacientes el dolor se prolonga y, a menudo, no responde al tratamiento médico convencional de antiinflamatorios no esteroideos e incluso opioides23.
El dolor neuropático es ampliamente reconocido como causante del dolor crónico postherniorrafia, y uno de los mecanismos responsables es la lesión que se produce en los nervios sensitivos de la región inguinal: ilioinguinal, iliohipogástrico y genitofemoral24,25. El daño o lesión en alguno de los nervios mencionados o en los 3 durante las intervenciones de reparación de hernia por cirugía abierta, se puede producir por lesión directa debida a la tensión forzada, contusión, bisturí eléctrico, sección completa o parcial del nervio, atrapamiento con las grapas o suturas, colocación de la malla y como resultado de una fibrosis perineural26.
La capacidad antinociceptiva de los gabapentinoides se reconoció en los años noventa y además de ser aprobado su empleo como anticonvulsionantes, posteriormente se aceptó su utilización en el dolor crónico neuropático de origen periférico, en trastornos de la ansiedad generalizada y, más recientemente, en el dolor crónico neuropático de origen central y como parte de la analgesia multimodal en el perioperatorio3.
Los resultados analgésicos fueron mejores y estadísticamente significativos en los pacientes del grupo I que habían sido tratados con PGB, con respecto al grupo II sin PGB.
También los pacientes del grupo I registraron menor dificultad para iniciar y mantener el sueño, se despertaban menor número de veces por la noche con aumento en el número de horas de sueño y una mejoría en la calidad de éste. Esto no sucedió en el grupo II, que no experimentó ningún cambio.
La PGB fue bien tolerada en términos generales y los efectos adversos (mareo, somnolencia y cefalea) en el período perioperatorio aparecieron solamente en un 10% de los pacientes tratados con PGB (grupo I) y no obligaron a suspender el tratamiento en ningún caso.
Aunque el número de estudios publicados que evalúan el papel de la PGB en el escenario de dolor postoperatorio es muy limitado, los resultados encontrados son prometedores6,8,9 no sólo en el alivio del dolor en este período, sino también en la disminución de las necesidades de consumo de otros analgésicos y aparición de efectos secundarios provocados por su uso7,10,11; por tanto, PGB encaja dentro del concepto de la analgesia preventiva y/o multimodal y los beneficios relacionados con ella.
Consultados algunos estudios24,25,27-32 sobre la evaluación del dolor crónico después de la intervención de hernia inguinal con colocación de malla por cirugía abierta, los resultados obtenidos son, en muchos casos, similares a los de nuestro trabajo, con un margen de incidencia que varían ampliamente. En la tabla 1 reflejamos los porcentajes.
Dichos autores refieren que la demostrada relación entre disfunción sensorial postoperatoria y dolor crónico25 determina la lesión del nervio como factor patológico, por lo que el dolor, en la mayoría de los casos, es neuropático33,34.
La variación de los resultados entre los diferentes autores entre sí, y entre los diferentes autores y nuestro estudio pensamos que puede depender de distintos factores:
— El tipo de técnica de reparación de la hernia realizada por el cirujano.
— El tipo de anestesia.
— El tipo de malla utilizada.
— La analgesia postoperatoria.
— El grado de lesión de alguno o de todos los nervios sensitivos de la región inguinal: ilioinguinal, iliohipogástrico y genitofemoral que se puede producir a lo largo de la intervención: sección completa o parcial del nervio, contusión, tensión forzada, atrapamiento con las suturas o grapas, colocación de malla o como resultado de una fibrosis perineural.
Los estudios consultados sobre reparación de hernia con colocación de malla por cirugía laparoscópica indican que la prevalencia de dolor postoperatorio es menor35-37.
Las limitaciones que se han encontrado a la hora de realizar el trabajo han sido la escasa bibliografía y estudios realizados sobre analgesia preventiva en los diferentes tipos de cirugía.
El dolor persistente poscirugía es un problema no reconocido, que produce malestar y reduce la calidad de vida de los pacientes. El dolor neuropático iatrogénico es probablemente el tipo de dolor postoperatorio crónico más frecuente. Los avances deberían estar orientados a identificar los pacientes de riesgo y prevenir el desarrollo de dicho dolor.
Futuros estudios deberán ir orientados a explorar el efecto de la analgesia preventiva con la combinación de diferentes fármacos neuromoduladores y analgésicos con bajo potencial de efectos secundarios38.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico:mpacinlazaro@gmail.com (M.P. Acín).
Recibido el 27 de julio de 2008;
aceptado el 21 de abril de 2009