Clínicas de dolor y cuidados paliativos. Normativa en México
El pasado mes de septiembre de 2008, un grupo mexicano de 15 líderes de opinión en el manejo del dolor y cuidados paliativos se reunió en la Ciudad de México con el fin de revisar el manejo de los analgésicos opiáceos y sus efectos adversos periféricos, con especial enfoque en la constipación (estreñimiento) inducida por opiáceos (EIO) y una nueva propuesta para el tratamiento del EIO. La mayoría de los médicos participantes ocupan puestos relevantes en las principales clínicas del dolor y cuidados paliativos en México, así como fueron partícipes activos del desarrollo de la normatividad de éstos. El 25 de noviembre de 2008 se aprobó, por parte del Senado de la Republica Mexicana, la Reforma a la Ley General de Salud en materia de Cuidados Paliativos en México, que entró en vigor el 6 de enero de 2009. El 22 de diciembre de 2008 se publicó en el Diario Oficial de la Federación Mexicana (DOF) la Norma Oficial Mexicana de Cuidados Paliativos, para su revisión y aceptación1.
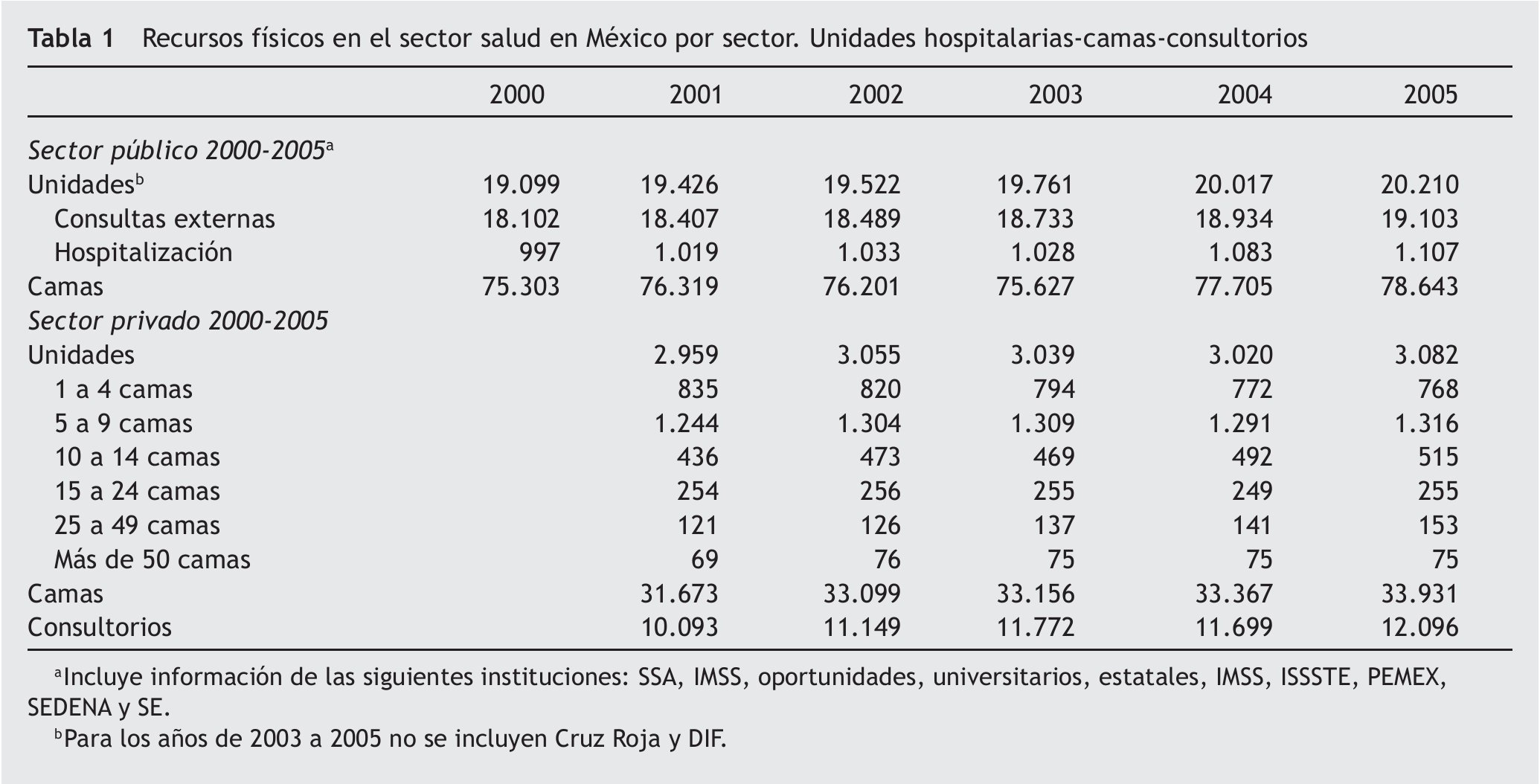
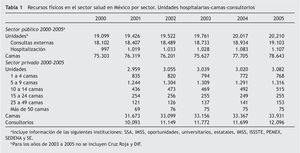
Para poder ubicar la situación de las clínicas del dolor y cuidados paliativos en nuestro país, es necesario hacer un recuento de las cifras del Sistema Nacional de Salud. La población total reportada hasta diciembre de 2007 fue de 108.576.411 mexicanos, con una tasa de crecimiento del 1,4 y fecundidad del 2,4. La esperanza de vida al nacer es, hasta ese momento, de 75,3 años. La población con derecho a un sistema de salud que garantice la atención médica permanentemente es menor del 50%, totalizando 49.523.389 mientras que 59.053.022 no están hoy en día protegidos por una institución de salud representada por IMSS, ISSSTE, PEMEX, SEMARNAP, siendo estos organismos gubernamentales2. Es notorio el crecimiento en la infraestructura de salud, unidades hospitalarias, consulta externa, número de camas, consultorios, tanto en el sector público como en el privado, de 2000 a 2005 (tabla 1).
Hoy en día, se adiciona de manera muy importante el seguro popular al sistema de salud, atendiendo a la proporción de la población que no tiene cobertura a través de otros sistemas públicos, que aún no se refleja en los datos antes mencionados.
Situándonos en este contexto, y sumando todos los esfuerzos médicos institucionales, tenemos que hoy por hoy aún hay un grado de desprotección de salud en nuestra población. El crecimiento y desarrollo institucional no han ido a la par con el crecimiento poblacional. En 1950, cuando el Instituto Mexicano del Seguro Social (IMSS) se desarrolla junto con otras instituciones, prácticamente estaba destinado a la salud del trabajador y su familia, pero el crecimiento poblacional desordenado obligó que éste quedara muy rezagado.
En la actualidad, el Instituto Mexicano del Seguro Social3 cuenta con 25 unidades médicas de alta especialidad (UMAE), las cuales permiten una cobertura poblacional del 60 al 65% en el ámbito nacional; 25 hospitales generales de zona, 1.207 unidades de medicina familiar y 20 unidades médicas de atención ambulatoria, las cuales intermedian entre el tercer y el segundo nivel de atención, permitiendo a los pacientes el acceso a una atención ambulatoria. El IMSS cuenta con 28.427 médicos especialistas, 21.636 médicos generales y familiares, 55.811 enfermeras especialistas y generales, y 30.558 enfermeras auxiliares, en todo el territorio nacional, hasta 2007, según cifras publicadas por el propio instituto2,3.
El desarrollo de los cuidados paliativos en México nos remonta a 20 años atrás, cuando se iniciaron esfuerzos para la atención de pacientes con padecimientos crónicos que cursan con síntomas tan frecuentes como el dolor crónico oncológico y no oncológico, y para este propósito se desarrollaron las clínicas del dolor. Actualmente, se incluye al paciente con dolor crónico y síntomas asociados a una enfermedad incurable, progresiva y avanzada o terminal, como cáncer, sida u otras enfermedades. Estas características nos llevaron a gobernar esta población dentro de un contexto y marco de seguridad institucional que contara con el apoyo médico y de enfermería adecuado, y evitara incurrir en internamientos múltiples y reiterativos a causa del inadecuado, erróneo o desproporcionado manejo de síntomas asociados y derivados de enfermedades crónicas y catastróficas. Es así como se organizan y desarrollan las clínicas del dolor y cuidados paliativos competentes, organizadas, multidisciplinarias y eficaces. En diciembre de 2003, algunos especialistas en el área de dolor, los doctores Sara Bistre, José Alberto Flores Cantisani, Guillermo Aréchiga Ornelas, Miguel Ángel Genis Rondero, Juan Ignacio Romero Romo y Jaime Durán, entre otros colaboradores, presentaron en el foro intitulado "El dolor y su tratamiento", en el salón verde de la Cámara de Diputados en San Lázaro, México D.F., una propuesta nacional en materia de dolor y cuidados paliativos del enfermo para los pacientes terminales ante la Comisión de Salud en la Cámara de Diputados, presidida entonces por el Dr. Ángel Córdova Villalobos (actual Secretario de Salud). La reforma a la Ley General de Salud en materia de Cuidados Paliativos ya fue aprobada el 25 de noviembre de 2008 y publicada en el DOF en diciembre de 2008. Entre otras cuestiones, estipula la organización y operatividad dentro de las instituciones y grupos médicos, el uso de medicamentos incluyendo opiáceos, bajo un contexto dirigido y planeado, para el paciente que presenta dolor intenso y otros síntomas asociados a la enfermedad. Por otro lado, el 22 de febrero de 2008, la Dirección General de Calidad de la Secretaría de Salud realizó una convocatoria de expertos en cuidados paliativos para construir y establecer el "Programa de Cuidados Paliativos", y llegó a la conclusión que el Programa Nacional de Cuidados Paliativos debe inspirarse en los siguientes principios: sensibilidad, atención al dolor, continuidad y cuidados, un modelo de calidad, autonomía de los pacientes y atención a la familia.
En el año 2006, los doctores José Alberto Flores Cantisani y Guillermo Aréchiga se dieron a la tarea de realizar un trabajo de investigación con un modelo conocido como Epimodel, próximo a publicarse, acerca de la epidemiología del dolor en México. La prevalencia del dolor por cáncer se evaluó en un total de 244.849 casos, el 96,7% fue adultos y sólo el 3,3% niños. Del total de casos, el 50,16% corresponde a los sobrevivientes, el restante 49,84% a la incidencia. En cualquier sistema de atención médica del mundo, se sabe que el 50% de pacientes con cáncer morirá durante el primer año en que se desarrolla su enfermedad y el otro 50% lo hará con una supervivencia de 1, 2 o 3 a 5 años, dependiendo del tipo histológico y de la etapa clínica. Tomando en cuenta esta consideración, estos 122.000 pacientes sobrevivientes, potencialmente tendrán dolor en algún momento de su enfermedad, sabiendo que el 80% de los pacientes con cáncer experimenta dolor en cualquier etapa de la enfermedad y mucho más frecuente en la etapa terminal, pero también no podemos olvidar la atención que deben recibir los pacientes que ya están enfermos y morirán durante el primer año.
De acuerdo con este estudio, hay 38 clínicas del dolor registradas y, de acuerdo con la federación, hay 6.246 anestesiólogos certificados en el país. En este mismo año 2006, se expidieron 700 recetarios de estupefacientes con código de barras, cada uno con 50 recetas, lo que nos da solamente un total de 35.000 recetas en 1 año.
Para el año 2009 hay la propuesta de desarrollar en el IMSS, clínicas de dolor y cuidados paliativos en las 25 UMAE, constituidas inicialmente por 3 elementos por unidad: un médico algólogo, paliativista, una enfermera y un psicólogo. Asimismo, se propone implementar en 3 niveles de atención médica el programa de adiestramiento continuo y permanente que se lleva a cabo en la clínica del dolor y cuidados paliativos en las instalaciones del IMSS del país. Hay ya antecedentes de otras instituciones que capacitan a especialistas en algología, cuidados paliativos, como el Hospital General de México, el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán de la Secretaría de Salud (SSA), el Hospital 20 de Noviembre del ISSSTE, el Instituto Nacional de Cancerología (INCAN) de la SSA y otros más.
En conclusión, está claro que las características del paciente del siglo XXI tienden a ser sujeto a enfermedades avanzadas y crónicas, hospitalizado de manera recurrente, con múltiples consultas y consumo de medicamentos variados y altos, variedad y complejidad del manejo de los síntomas y que, en algún momento del proceso de la enfermedad, se tornará en un paciente terminal que requerirá de servicios médicos y de enfermería especializados, basados en modelos de cuidados paliativos que ya están contemplados en la ley mexicana y su norma oficial, que dará protección precisa e idónea al mayor porcentaje de la población.
Opiáceos en las clínicas del dolor y cuidados paliativos
En los últimos 20 años, el tema de la analgesia y el conocimiento de la fisiopatología del dolor ha avanzado más que en toda la historia de la humanidad. Desde el punto de vista práctico, uno de los avances más importantes es la clasificación de los síndromes dolorosos; hay quien la llama etiológica, otros la llaman estructural. Es decir, según la estructura orgánica que cause el dolor, puede haber 3 categorías de éste. En principio está el dolor nociceptivo, modulado básicamente por nociceptores, receptores especializados en dolor, presentes básicamente en 2 tipos de tejido: tejidos somáticos (musculoesqueléticos) y tejidos viscerales (víscera maciza o hueca). Por otro lado, está el dolor neuropático, para el cual al día de hoy se tienen mejores herramientas de diagnóstico y de manejo. Algunos ejemplos son la neuropatía diabética, la neuralgia postherpética, la neuralgia del trigémino y las cada vez más reconocidas neuropatías asociadas al cáncer y al sida. Por último, está el dolor mixto, tercera categoría aún no reconocida por la International Asociation for the Study of Pain. Innumerables autores dicen que además del dolor nociceptivo y del dolor neuropático, hay una tercera categoría a considerar que es, justamente, la coexistencia de una forma nociceptiva y otra forma neuropática de dolor, en la misma topografía, en el mismo momento evolutivo y, obviamente, en el mismo paciente. Ejemplos importantes son la lumbociatialgia, el dolor por cáncer y algunos otros más específicos del área ortopédica4.
Respecto al tratamiento disponible, hay 3 grupos farmacológicos: el primero incluye los no opiáceos, antes llamados antiinflamatorios no esteroideos (AINE) y un subgrupo, los COX 2. En segundo lugar están los opiáceos; en general, y por lo menos es lo que ocurre en Latinoamérica y en algunos otros países del mundo, se tiene una confianza excesiva en el grupo de los AINE y una desconfianza exagerada en el de los opiáceos. El tercer grupo, los adyuvantes, son muy importantes en dolor neuropático, e incluyen antiepilépticos, antidepresivos, también llamados en conjunto neuromoduladores5. Puede haber otros grupos que también tienen algún papel en el dolor, como los esteroides y los relajantes musculares. Se pueden combinar siempre y cuando no se antagonicen entre sí. Esto es, se pueden combinar medicamentos de cada grupo según el caso. No es recomendable combinar 2 medicamentos de cada grupo por tener el mismo mecanismo de acción, y el efecto que se obtiene es más de episodios adversos y, normalmente, no más analgesia. De manera rápida, se podría decir que el tratamiento del dolor nociceptivo, dolor osteomuscular, por ejemplo, responde muy bien con AINE y COX 2; también responde a opiáceos. El dolor neuropático, en cambio, no responde a AINE ni a COX 2, no responde a vitamina B y sí responde, aunque parcialmente (entre un 20 y un 40%), a opiáceos, y responde mejor a neuromoduladores. Para el dolor mixto, habrá que combinar medicamentos para lograr una respuesta, mezclar según la necesidad del paciente y a veces utilizar incluso los 3 grupos6.
Las necesidades analgésicas de los pacientes en las clínicas del dolor nos remonta al tema del cáncer y cómo los opiáceos juegan un papel tan importante en este campo. El cáncer en el siglo XXI es la segunda causa de muerte global; se han reportado 10,1 millones de casos nuevos por año, 6,2 millones de muertes y 22 millones de casos vigentes7. La American Cancer Society reportó en 2005 295.280 muertes en varones y 275.000 en mujeres. Las 10 principales causas de muerte en varón son: pulmón y bronquios, 31%; próstata, 10%; colon y recto, 10%; páncreas, 5%; leucemia, 4%; esófago, 4%; hígado y vía biliar, 3%; linfomas, 3%; vejiga, 3%; riñón, 3%, y otros, 24%. En el caso de la mujer son: pulmón y bronquios, 27%; mama, 15%; colon y recto, 10%; ovario, 6%; páncreas, 6%; leucemia, 4%; linfomas, 3%; cuerpo uterino, 3%; mieloma múltiple, 2%; cerebro/OSN, 2%, y otros, 22%8.
Está claro que hay diferencias en incidencia, prevalencia y tasas de supervivencia a 5 años por cuestiones geográficas; no es lo mismo vivir en Japón, México, Estados Unidos o Europa. Hay una infinidad de diagnósticos oncológicos que finalmente pudieran llegar a enfermedad avanzada y convertir a estos pacientes en oncológicos terminales, y, por lo tanto, merecedores de cuidados paliativos. Hay más casos de cáncer cada año y esto se puede deber a varios factores, como diagnósticos más tempranos, población más envejecida, y también pudiera ser que en sí esté aumentando la incidencia de ciertos tipos de cáncer.
Respecto al dolor oncológico, hay una cantidad enorme de información acerca del tema. La revisión publicada por Bruera y Kim5 reporta que el dolor oncológico lo padecerán muchos pacientes con cáncer. Cuanto más avanzado sea el cáncer, más alto es el riesgo de padecerlo. Uno de cada 3 individuos del mundo desarrollado será diagnosticado con cáncer y la mitad de éstos van a morir durante el primer año del diagnóstico, como ya se dijo antes. Más del 80% de los pacientes con cáncer va a desarrollar dolor durante la enfermedad y antes de morir el 20% puede no tener jamás algún dolor, y morir con otros síntomas porque la prevalencia sintomática es amplia, pero no necesariamente presentará dolor. Del 80% que tendrá dolor, la intensidad se divide en leve, moderado y severo. En general, el dolor es infratratado y muy mal manejado. Es un problema verdaderamente grave, por diferentes circunstancias económicas, culturales y regionales. La prevalencia específica del dolor por cáncer ocurre en el 30-40% de los pacientes con terapia oncológica radical, es decir, buscando la curación, incrementándose hasta un 90% en aquellos con una enfermedad avanzada y tratamiento paliativo. El dolor puede tener la característica de ser agudo o crónico, y también ha sido documentada una serie de síndromes paraneoplásicos9. El cáncer puede invadir por contigüidad, metástasis o por los efectos humorales del tumor (síndromes paraneoplásicos), que también puede dar síndromes dolorosos, como neuropatía periférica. Los tratamientos contra el cáncer, radioterapia, quimioterapia y cirugía radical, claramente pueden dejar secuelas dolorosas. De acuerdo con Fisch y Burton9, el 80% de los pacientes tiene dolor de 2 orígenes y el 34% hasta de 3 orígenes diferentes. El crecimiento tumoral o las metástasis son responsables del 85% de los casos del dolor y el 15% es atribuible al tratamiento antineoplásico9. Otras causas son infecciones por gérmenes oportunistas, como por ejemplo herpes zóster y la consecuente neuralgia postherpética5. Ya desde el año 1995, Bruera et al10 describen en la escala de Edmonton los factores de mal pronóstico para el control del dolor: a) dolor neuropático, suele ser un dolor más refractario que otros; b) dolor episódico, que puede ser el incidental, es decir al movimiento (p. ej., el caso de una fractura), o irruptivo, que aparece sin ningún estímulo que lo provoque, como la neuralgia del trigémino, y el último tipo de dolor episódico es el dolor al final de la dosis, cuando las dosis están muy separadas en el tiempo y no se cubre adecuadamente la vida media del medicamento que se esté usando; c) escalada rápida de opiáceos, generalmente por empeoramiento de la enfermedad o tolerancia al opiáceo; d) antecedente de alcoholismo o abuso de drogas, y e) trastornos afectivos, como depresión o ansiedad.
Por último, está el dolor total, que es de naturaleza multifactorial y se refiere a todos los aspectos involucrados en el cáncer, como miedo al dolor, miedo a morir, futuro incierto, etc. Además, puede haber patología no tumoral concurrente11.
Hay que recordar que la escalera analgésica de la Organización Mundial de la Salud (OMS), publicada en la década de los noventa, es exclusivamente para dolor oncológico12. La OMS no avala ninguna otra indicación para ella. Para dolor leve se pueden utilizar analgésicos del tipo no opiáceo más adyuvantes. En dolor moderado se pueden utilizar opiáceos leves más adyuvantes. Y en dolor severo, opiáceos mayores para justamente complementarse, si hace falta, con adyuvantes. Los intervencionistas proponen un cuarto escalón de analgesia. Hay grupos que piensan que la decisión terapéutica basada en la escalera es lenta, y que más que una escalera debería ser un ascensor, como lo propone la escuela española13.
Los criterios de enfermedad terminal que nos rigen actualmente son los criterios de la Sociedad Española de Cuidados Paliativos14 que, en general, la definen como un padecimiento avanzado, progresivo e incurable sin respuesta a tratamiento específico, con un pronóstico de vida inferior a 6 meses. La presencia de numerosos síntomas, intensos, multifactoriales y cambiantes que causan un gran impacto emocional en pacientes, familia y equipo terapéutico. La realidad es que sí es importante el dolor, pero casi nunca es el principal problema, por eso la clínica del dolor se enfoca primordialmente al dolor, y los cuidados paliativos ven un espectro de síntomas mucho más amplio. Los enfermos que ameritan apoyo paliativo son los pacientes oncológicos, con sida en fases avanzadas, insuficientes orgánicos no candidatos a trasplante (hepáticos, cardíacos, pulmonares, renales, etc.), con enfermedad de motoneurona, con esclerosis lateral amiotrófica, con algunos padecimientos geriátricos (demencias), etc. En el año 2004 la Unidad de Cuidados Paliativos del M.D. Anderson Cancer Center reporta la prevalencia del dolor en una población de 232 pacientes a los cuales se les aplicó la escala visual analógica (EVA, de 0 a 10) y se valoró aquellos con EVA > 5 al ingreso, considerándose como motivo de internamiento a la Unidad de Cuidados Paliativos. Los 3 síntomas más frecuentes fueron: fatiga o astenia, 82%; anorexia, 65%, y dolor, 61%15. El síntoma más prevalente en el paciente terminal es invariablemente la debilidad. El dolor es uno más de los síntomas, pero es muy importante de tratar. Hoy por hoy, se propone que el cuidado curativo debería combinarse con el paliativo, es decir, que no sean mutuamente excluyentes sino que se inicien de manera paralela desde el principio. Y, finalmente, cuando ya va a acaecer la muerte, es importante considerar que la familia requiere apoyo durante la etapa de duelo16.
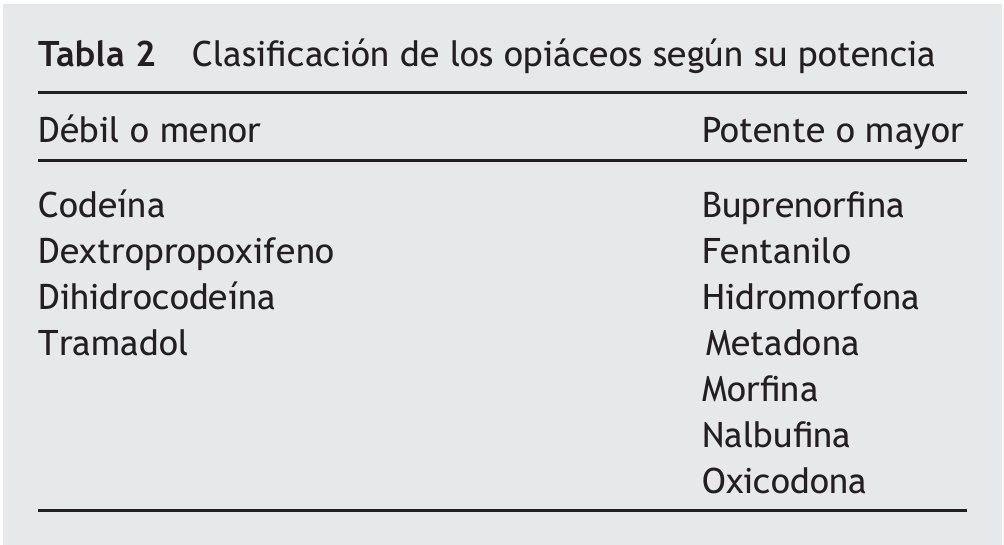
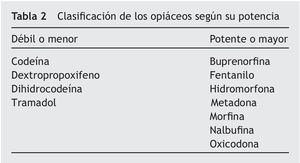
Los analgésicos opiáceos son los medicamentos que tienen efectos similares a la morfina, producen analgesia por su unión específica a receptores dentro y fuera del sistema nervioso central (SNC). Funcionan básicamente como una analogía de lo que harían las sustancias opiáceas endógenas, endorfinas y encefalinas, y los diferentes tipos de receptores opiáceos: μ, δ y κ9. En resumen, los mecanismos por los cuales funcionan los opiáceos y que interesan a los clínicos son que inhiben la entrada de calcio en la neurona, inhiben la liberación de sustancia P, incrementan la entrada de potasio a la célula y, finalmente, inhiben al sistema facilitador descendente17. Hay varias formas farmacéuticas para la administración de los opiáceos, lo que permite que en pacientes terminales con gran variabilidad no sólo de síntomas, sino de cambios constantes en su estado funcional, se puedan hacer los cambios en la vía de administración de manera rápida. La morfina sigue siendo el estándar de oro para la OMS para el manejo del dolor oncológico, es más usada por vía oral, después enteral o rectal; la vía parenteral es otra alternativa (intravenosa o subcutánea). Las clínicas y unidades domiciliarias prefieren vías más fáciles de manejo, como la subcutánea. Las vías espinales son más frecuentes en pacientes hospitalizados. La vía transdérmica cobra relevancia por su comodidad y, comparativamente con otros medicamentos, tiene menos efectos adversos. La transmucosa ofrece ventajas cuando hay problemas de deglución, la vía sublingual se debería considerar como una opción versátil y rápida, y finalmente la vía pulmonar como una de las aportaciones más recientes17. Los opiáceos pueden administrarse nebulizados, aunque en general la nebulización no se usa con fines analgésicos, sino para el control de la disnea o la tos en el paciente terminal. Los opiáceos se clasifican por su potencia en débiles o menores y potentes o mayores (tabla 2). La titulación de la dosis de opiáceos se realiza valorando el alivio del dolor frente a los efectos secundarios. No se deben mezclar 2 opiáceos de grupos farmacológicos diferentes, por sus posibles efectos antagónicos. Es fundamental (y por lo general se olvida) establecer un esquema fijo que incluya los rescates o dosis extras y también los adyuvantes del tipo antiemético, laxante u otros medicamentos para prevenir o contrarrestar los efectos adversos9. La morfina no tiene la misma potencia por vía oral que cuando se administra por vía parenteral, subcutánea o por vía intravenosa; en este sentido, la regla de los tercios para la equivalencia resulta fácil y útil: por ejemplo, la morfina por vía oral equivale a tres tercios (p. ej., morfina oral 60 mg), al cambiar a subcutánea equivale a dos tercios (40 mg), y si se requiere la vía intravenosa, se administra un tercio (20 mg). Todos los opiáceos cuentan con tablas de equianalgesia9,16. Una de las terapias de reciente introducción son los parches de fentanilo y buprenorfina.
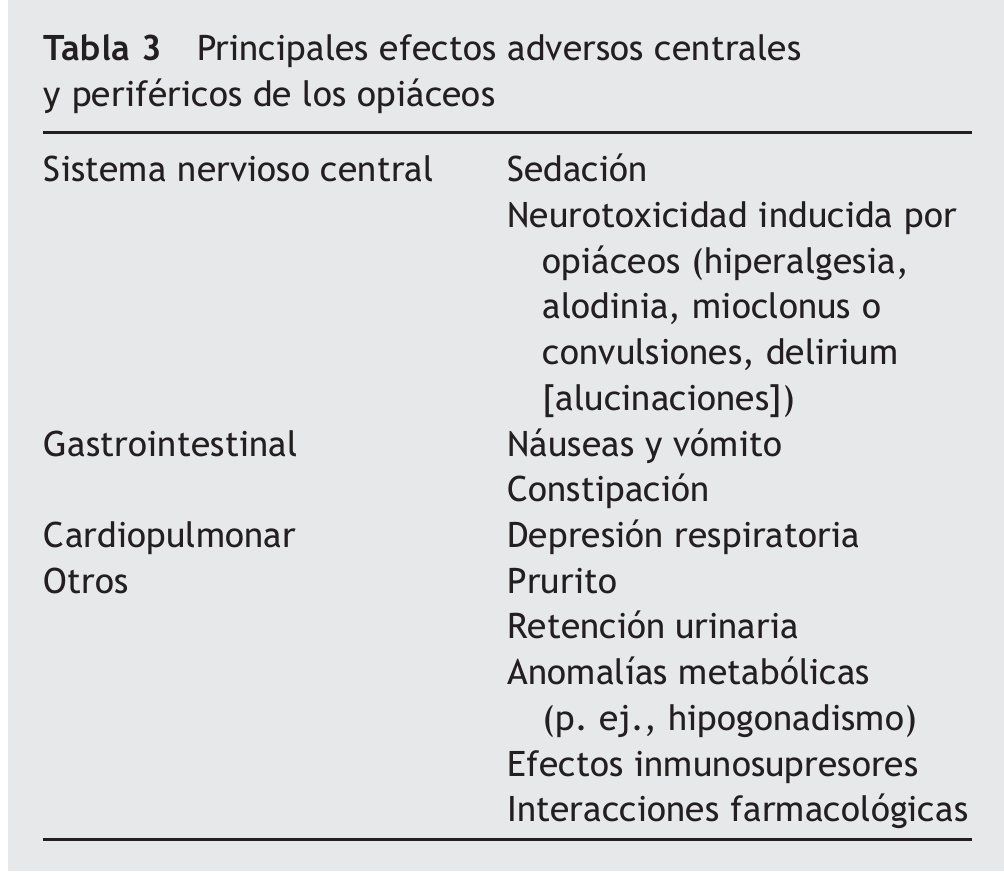
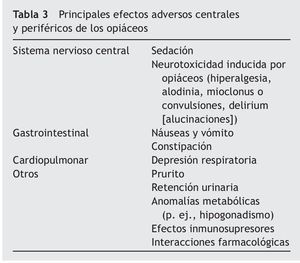
Un aspecto importante para desmitificar los opiáceos es conocer la diferencia entre tolerancia y dependencia, ya que generalmente se confunde a la primera con adicción. La tolerancia es la necesidad de aumentar la dosis a través del tiempo para lograr el mismo efecto analgésico que se logró al principio; la tolerancia no necesariamente es negativa, es el caso de la tolerancia a los efectos secundarios (p. ej., la náusea del primer día del opiáceo hará tolerancia a la primera semana, y desaparecerá). Los pacientes con analgésicos opiáceos son dependientes físicos, es decir, que al quitar o disminuir el medicamento rápidamente puede ocurrir síndrome de abstinencia9. El síndrome de abstinencia no es exclusivo de los opiáceos, sucede con benzodiacepinas, esteroides, etc. Una titulación progresiva descendente hará que el paciente pueda dejar de usarlo sin ningún problema. Los principales efectos adversos de los opiáceos a nivel central son la tríada de neurotoxicidad: hiperalgesia, alodinia, mioclonus o convulsiones y delirium. A nivel periférico, desde el punto de vista gatrointestinal son: náusea, vómito y estreñimiento, en el cual es obvia la secuencia de episodios, dolor abdominal, disminución del peristaltismo y aumento de la distensión intestinal. Si el estreñimiento no se resuelve puede haber impactación fecal y esto agrava otros síntomas, incluso los neuropsiquiátricos; en pacientes geriátricos, tanto el estreñimiento como la retención urinaria pueden ser causa de delirium (tabla 3). A nivel cardiopulmonar, puede presentarse depresión respiratoria, aunque ésta es rara con una adecuada titulación. Otros efectos adversos reportados son prurito, retención urinaria e hipogonadismo9. Se ha demostrado en unidades de cuidados paliativos que el hipogonadismo puede estar presente en un porcentaje de pacientes, justamente por los fenómenos de contrarregulación hormonal.
Otras indicaciones d e opiáceos en cuidados paliativos, más allá de la analgesia, son disnea y tos. El 50% de pacientes con cáncer avanzado y el 70% con cáncer pulmonar presentarán disnea en algún momento de su evolución. El medicamento de elección es morfina, ya que disminuye la sensibilidad al CO2 del centro respiratorio. Las vías más usadas son la subcutánea, la intravenosa y la nebulizada. La tos sólo se trata cuando es excesiva y se maneja con derivados de opiáceos, como el dextrometorfan o directamente con opiáceos, como podrían ser desde los menores hasta los mayores.
En conclusión, la vía oral es la más recomendada para la prescripción de opiáceos por ser la más fisiológica, seguida de la rectal, la transdérmica y la subcutánea. La vía subcutánea es una excelente alternativa, sobre todo porque se puede usar en casa, no es tan invasiva y es raro que se infecte el sitio de inyección. Una alternativa son las bombas de perfusión continua subcutánea. Vale la pena enfatizar que las inyecciones intramusculares se consideran prehistóricas, por ser una vía poco predecible, muy invasiva y porque es una muy mala idea quitar el dolor ocasionando otro.
Farmacología de los opiáceos. Receptores μ centrales y periféricos
El primer registro del uso de los opiáceos se remonta a la época de Mesopotamia18. Los opiáceos han evolucionado conforme ha evolucionado el hombre. Por muchos años, el uso de los opiáceos permanece puramente por sus efectos farmacológicos, y no es hasta 1972 cuando se descubren los receptores opiáceos, y en 1979 los péptidos endógenos que actúan sobre estos receptores. Los receptores opiáceos se localizan en el SNC y en neuronas periféricas, células inmunes, tejidos inflamados periféricos, tejidos respiratorios y tracto gastrointestinal. Hay 3 tipos de receptores opiáceos: μ, δ, y σ, el receptor σ ya no se considera un receptor opiáceo, pues no tiene las características farmacológicas de los receptores de opiáceos.
Los receptores μ se localizan fundamentalmente en tronco encefálico y tálamo, son responsables de la analgesia supraespinal, la depresión respiratoria, la euforia, la sedación, la disminución de la motilidad gastrointestinal y la dependencia física. El receptor μ tiene 3 subtipos de receptores μ1, μ2 y μ3, y es el principal blanco del efecto farmacológico de los analgésicos opiáceos más utilizados; abren canales de potasio, hiperpolarizan la célula y favorecen condiciones previamente desfavorables para ser estimulada. Estas acciones son también responsables de muchos de los efectos adversos asociados al uso de los opiáceos.
Los receptores κ se localizan en área diencefálica y límbica, tronco encefálico, médula espinal, y son responsables de la analgesia espinal, la sedación, la disnea y la dependencia, entre otras. Los efectos de los receptores δ aún no han sido bien estudiados19.
Los 3 subtipos de receptores de opiáceos (μ, δ y κ) pertenecen a la superfamilia de receptores acoplados a la proteína G que median las acciones de los opiáceos endógenos y exógenos. Una vez que el receptor es activado, libera una porción de la proteína G, la cual difunde a través de la membrana hasta alcanzar su blanco (sea una enzima o canales de iones). Estos blancos alteran la fosforilación vía inhibición del AMP cíclico, que actúa como segundo mensajero al interior de la célula, dando como resultado la activación de cinasas (efecto de corta duración), transcripción de proteínas genéticas y/o transcripción genética (efecto de larga duración)19,20.
Hay 3 grupos de proteínas G: proteína GS, proteína GI y proteína GQ. La activación de la proteína GS incrementa, al final del proceso, el AMP cíclico y AMP cinasa, esta última responsable de los cambios metabólicos que abren canales de sodio. Los medicamentos que activan GS y por consecuencia AMP cíclico producirán respuestas excitatorias, es decir estimulan al SNC. Los que activan GQ, en este caso a través de la formación final de trifosfato de inositol y diasilglicerol de calcio, traen de la misma manera una respuesta excitatoria.
Por otro lado, los opiáceos que activan proteínas GI inhiben la adelinatociclasa, como consecuencia no hay formación de AMP cíclico, cascada metabólica y entrada de sodio. Al no entrar el sodio en la célula, no se altera la excitabilidad eléctrica y, por consecuencia, los potenciales son inhibitorios a nivel postsináptico. En este caso, las neuronas no solamente están en período de reposo, sino que están por debajo del potencial de reposo, por lo que costará trabajo activarlas posteriormente. Este tipo de medicamentos son, por lo tanto, depresores del SNC. El mecanismo de acción de los opiáceos hasta hoy descritos es a nivel de la proteína GI. Administrar cualquier derivado que actúe sobre éstos, por ejemplo en vejiga, evidentemente dará retención urinaria por relajación del músculo detrusor.
Cuando los receptores opiáceos localizados a nivel presináptico en las fibras C nociceptivas y delta A son activados por un agonista, se inhibe la entrada de calcio, disminuyen los valores del AMP cíclico y se bloquea la liberación de neurotransmisores del dolor como glutamato, sustancia P y el péptido calcitonina, resultando en analgesia.
A manera de repaso, el ión calcio difunde a nivel intracelular en la fisiología celular, activa a su vez un sistema metabólico —calcio-calmodulina— con la formación de sinapsinas, las mismas que despegan del citoesqueleto las vesículas cargadas con el neurotransmisor y presenta degranulación. Al disminuir el AMP cíclico se impide la entrada de calcio, no hay liberación de la vesícula, no hay degranulación y la respuesta es inhibitoria.
Los opiáceos se clasifican en 4 grupos farmacológicos: análogos de la morfina (heroína, codeína, hidromorfona, levorfanol, buprenorfina, naloxona, naltrexona), derivados fenilpiperidínicos (meperidina, difenoxilato, loperamida, fentanilos), análogos de la metadona (L-α-acetilmetadol propoxifeno) y otros (tramadol, pentazocina)19. En la clínica se dividen en analgésicos fuertes y débiles o agonistas parciales, mencionados anteriormente. De acuerdo con la reunión de la International Union of Basic and Clinical Pharmacology realizada en China en 2006, la farmacología actual clasifica a los opiáceos en agonistas, agonistas parciales y antagonistas. La buprenorfina, anteriormente considerada agonista-antagonista, es ahora un agonista parcial, no cumple las características para ser un agonista total. Los 2 antagonistas de los receptores opiáceos conocidos anteriormente eran naloxona y naltrexona. La naloxona tiene una latencia muy corta (latencia: tiempo que transcurre desde la aplicación del medicamento hasta su efecto farmacológico), la naltrexona la tiene mayor. La naloxona se usa para momentos de urgencia y la naltrexona para bloquear los opiáceos.
Actualmente, hay una nueva molécula, metilnaltrexona, antagonista de los receptores opiáceos a nivel periférico. Por sus propiedades fármaco-fisicoquímicas muestra una baja liposolubilidad, lo que le impide traslocarse (transporte de un metabolito a través de una biomembrana) a través de la barrera hematoencefálica, y su acción se queda, por lo tanto, exclusivamente a nivel periférico. Su perfil farmacológico llevó a realizar estudios clínicos en los efectos adversos periféricos causados por el uso de analgésicos opiáceos, como el EIO21.
Enfoque en el tratamiento actual del estreñimiento inducido por opiáceos
El término constipación tiene diferentes significados en México. La gran mayoría de los algólogos y pacientes se refieren a este síntoma como "estoy estreñido" no constipado. La conclusión de los expertos presentes en esta reunión fue continuar con el término estreñimiento.
Se considera que el estreñimiento, en general, afecta a más de 4,5 millones de individuos en Estados Unidos. Genera 2,5 millones de consultas cada año y predomina en mujeres adultas, mayores de 65 años. Sumando algunas características en el paciente, como mujer, cáncer, dolor, daría como resultado un factor de riesgo para tener estreñimiento. El manejo del estreñimiento genera anualmente un gasto de 350.400 millones de dólares22.
Hay varias definiciones para estreñimiento; una propuesta por un grupo de enfermería en EU, la 4 "too's": "too hard", "too small", "too difficult" y "too infrequent", que resulta muy cercana a la definición internacional con característica más nemotécnica. La definición internacional de estreñimiento, que se aplica también para el EIO se refiere al paso con dificultad de heces duras y pequeñas en un tiempo muy prolongado o infrecuente. En la actualización de los Criterios de Roma III referentes al estreñimiento funcional (incluye cualquier tipo de estreñimiento), se menciona que 2 o más de los siguientes síntomas están presentes: forzada en más de un cuarto de la defecación, grumosa o dura en más de un cuarto de la defecación, sensación de obstrucción anorrectal o bloqueo en más de un cuarto de la defecación, maniobras manuales usadas para facilitar más de un cuarto de la defecación, menos de 3 defecaciones por semana, y criterios insuficientes de síndrome de colon irritable, experimentados por lo menos en las últimas 12 semanas, durante los últimos 12 meses.
El sistema nervioso entérico está compuesto por el plexo mioentérico, sistema nervioso mioentérico, y estructuras submucosas. El sistema nervioso entérico tiene un rol en el control de la motilidad, flujo sanguíneo, transporte de agua y electrólitos. El movimiento dual del intestino o reflejo de Sherrington se refiere, por un lado, al movimiento del segmento receptor, de carácter caudal, mezclador y por otro un movimiento cefálico. En la motilidad segmentaria en este mecanismo dual actúa, por un lado, el segmento mezclador que recibe y, por otro, el segmento propulsivo. Cuando el intestino se distiende o hay una torsión, el sistema del plexo mioentérico participa liberando sustancias opiopeptidérgicas, 5-HT, sustancia P y péptido intestinal vasoactivo. El movimiento ascendente depende de la acetilcolina, la relajación descendente, parte mezcladora, depende del péptido intestinal vasoactivo. Los receptores opiáceos μ y δ están presentes en el intestino, los receptores tipo μ en el plexo miontérico de Auerbach, mientras que en el submucoso se encuentran los receptores tipo δ. Un dato interesante es el hecho del potencial polimorfismo del receptor de opiáceos, especialmente por diferencias genéticas. En este sentido pudieran existir variaciones individuales en cuanto a la salida de potasio y entrada de calcio. Desconocemos si este polimorfismo del gen del receptor opiáceo, conocido como OPRM1C-18AG, tiene que ver con una sensibilidad específica en el sistema nervioso mientérico para un opiáceo en particular. Se sabe que este gen puede condicionar a individuos a tener más náuseas y analgesia, particularmente en mujeres caucásicas. Asimismo, se sabe que el polimorfismo puede dictar la sensibilidad analgésica o resistencia analgésica. No se sabe si el polimorfismo en el plexo mientérico pudiera dar origen a la génesis de nuevos medicamentos específicos para pacientes específicos.
Por otro lado, no se puede dejar pasar el hecho de que en el estreñimiento en general están involucradas otras sustancias, como los bloqueadores o agonistas serotoninérgicos. La función secretora, motora y de sensibilización visceral de la serotonina en el tracto gastrointestinal no se puede separar de la acción de los péptidos opiáceos sobre el plexo mioentérico23. Cuando está presente el bolo, las células cromoafines intestinales activadas liberan 5HT4, que tiene efecto sobre el mecanismo de motilidad caudal activado por el péptido G relacionado a calcitonina; el plexo mioentérico lo hace a nivel cefálico, por neuronas ligadas de manera ascendente mediadas por acetilcolina o sustancia P.
Las causas de estreñimiento se pueden dividir en orgánicas, funcionales e inducidas por medicamentos. Una de las causas orgánicas importantes son las tumoraciones, además de las alteraciones neurológicas (lesiones espinales), endocrinas y metabólicas (uremia, hipercalcemia, hipocalemia); las funcionales: inmovilidad, inactividad, debilidad e inclusive la inaccesibilidad del baño, y medicamentos: opiáceos, anticolinérgicos, antiespasmódicos, antidepresivos, antiácidos, antieméticos.
En 1994, Bruera et al sugieren incluir el empleo de la radiografía simple de abdomen dividiéndola en 4 cuadrantes, ascendente, transverso, descendente y recto. Cada cuadrante es evaluado para el contenido de heces presentes marcado de 0-3 (0 ausente, 3 completamente lleno o impactado). El resultado por cuadrante es sumado y el máximo resultado es 12. Un resultado de 7 o más indica que es necesario un manejo más agresivo24.
Existen datos controvertidos del EIO, reportándose del 29 al 90% sin diferencia entre el opiáceo o la vía de administración oral o transdérmica. Los efectos de los opiáceos en el intestino se reflejan en inhibición del vaciamiento gástrico, incremento del tono del esfínter ileocecal y anal, componente peristáltico en el plexo mioentérico, reducen la motilidad del intestino delgado y colon, inhiben la actividad propulsiva y frecuencia del transito intestinal, e incrementan la absorción de agua y electrólitos tanto en intestino delgado como en colon. El reflejo de la defecación se altera, hay una reducida sensibilidad para la distensión e incremento del tono interno de los esfínteres25.
Se ha mencionado que la capacidad de los opiáceos para producir estreñimiento puede variar: oxicodona > morfina de liberación prolongada > fentanilo transdérmico. Hay nuevas formulaciones y nuevos opiáceos que pudieran disminuir la frecuencia de estreñimiento, una propuesta es oximorfona de liberación prolongada.
En la evaluación de los pacientes con EIO es importante incluir la forma de las heces más recientes, antes de la enfermedad, uso de medicamentos que pudieran causar estreñimiento, laxantes y sus efectos, consistencia de heces blandas o duras, existencia de tono anal y reflejo.
"El que no mete el dedo, mete la pata": para un diagnóstico en un paciente con EIO es obligado hacer un tacto justamente en la ámpula. Pudieran estar inhibidas la sensibilización de las raíces sacras por una masa tumoral, agravando además el fenómeno doloroso.
Ante la carencia de medicamentos más específicos para el EIO, las recomendaciones de tratamiento son los laxantes, senna más lactulosa y polietilenglicol. En un reporte reciente se evaluó: a) presencia de obstrucción, recto lleno y heces duras, el tratamiento administrado fue supositorios de glicerina e ingesta de líquidos; b) si las heces eran blandas, supositorio de bisacodil; c) el recto no está lleno, placa de abdomen, descartar colon lleno, colocar enema en caso necesario. En la profilaxis del estreñimiento se sugiere mantener un buen control de síntomas, promover la actividad, mantener una buena ingesta de líquidos orales, maximizar el contenido de fibra en la dieta y, sobre todo, anticipar la aparición del estreñimiento que provocan algunos medicamentos como los opiáceos26. Karam et al reportaron, en 1994, un estudio en población geriátrica en cuidados paliativos de cómo lograron disminuir el consumo de laxantes: 1.500 ml de líquido al día, ejercicio abdominal y pélvico, 1 onza (equivalente a 28 g) de suplemento de fibra y caminar por lo menos 15 min al día27.
Los laxantes se dividen en: laxantes de superficie (docusato sódico); laxantes osmóticos (lactulosa); formadores de bolo (metamucil); agentes hiperosmóticos (sorbitol y sulfato de magnesio); lubricantes (aceite mineral); laxantes por contacto (senna); laxante rectal y mecánicos (enemas, desimpactación), y procinéticos (metoclopramida y cisaprida).
Algunas características que los diferencia son: docusato, un detergente, incrementa la penetración de agua; laxantes osmóticos, particularmente lactulosa, tienen una latencia muy larga de aproximadamente 3 días, pueden provocar cólicos, gas, flatulencia y son costosos; sorbitol, menos costoso, del grupo laxantes osmóticos, evita la deshidratación y puede incrementar la pérdida de líquidos; formadores de bolo, el metamucil comúnmente se considera el ideal, porque se anuncia en las televisiones, es el menos útil particularmente en cáncer, no se recomienda en obstrucción intestinal, tiene un alto contenido de sal, no es el laxante de inicio, sin embargo en pacientes con diarrea, sida en estados avanzados con diarreas profusas, se recomienda metamucil para formación de bolo; agentes hiperosmóticos, lactulosa, sorbitol serán la última línea en cáncer, precaución con el uso concomitante con tetraciclinas por fallo renal o pacientes con enfermedad cardíaca; lubricantes como la parafina y el aceite mineral tienen un sabor desagradable, hay algunos reportes de neumonía lipoidal por aspiración o broncoaspiración con su empleo. Destacan por el énfasis que hacen en el estreñimiento y su manejo las publicaciones en el área de enfermería: protocolo farmacológico para la prevención y manejo del estreñimiento inducido por opiáceos: senna más docusato sódico es el tratamiento profiláctico escalando hasta el nivel 3, posterior al cual se descarta impactación, en cuyo caso se aplicará desimpactación y/o enemas28. Los laxantes rectales, como enemas o desimpatación, no reemplazan a los laxantes orales, nunca serán parte regular del tratamiento del EIO pues tienen efectos negativos en la calidad de vida. Los procinéticos no parecen trabajar en presencia de opiáceos.
En conclusión, el EIO es un efecto adverso casi universal. Hay nuevas propuestas farmacológicas específicas y dirigidas a nivel periférico para el manejo del EIO sin que se tenga que sacrificar la analgesia central. Estas terapias, como la metilnaltrexona, han sido agrupadas en los medicamentos conocidos como actividad en el receptor opiáceo μ periférico (PAMOR, peripherally acting mu opioid receptor)29.
Metilnaltrexona subcutánea. Antecedentes y estudios clínicos
Los datos que se mostrarán a continuación motivaron al registro de metilnaltrexona en Canadá, Estados Unidos, Europa, Venezuela, Chile, México y próximamente en otros países del mundo. El enfoque terapéutico de este medicamento es para los efectos adversos gastrointestinales secundarios al uso de opiáceos, sin olvidar que éstos provocan otros efectos adversos periféricos como en piel, etc.
Ya se ha comentado que a nivel gastrointestinal existen receptores μ periféricos localizados en las neuronas de la capa mioentérica y submucosa del intestino. Los opiáceos a nivel gastrointestinal reducen las secreciones, promueven la absorción de líquidos, aumentan el tono del esfínter y suprimen la peristalsis favoreciendo el EIO como uno de los efectos adversos periféricos más importantes. El tratamiento de la constipación en general, aun la no inducida por opiáceos, se inicia con modificación de conducta, ingesta de líquidos, promoviendo la actividad, ejercicio (que en pacientes terminales muy probablemente no es lo más apropiado). Posteriormente, se administran tratamientos farmacológicos, como laxantes, y finalmente si no funcionan, enemas o incluso desimpactación manual.
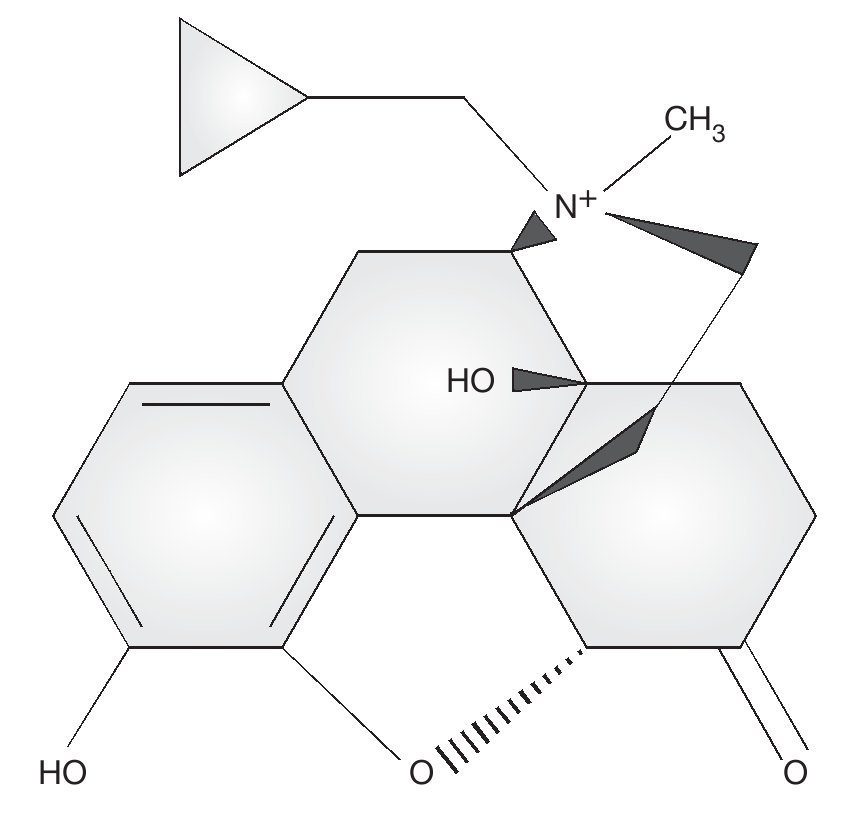
Es aquí, en el EIO, donde participa metilnaltrexona que es un antagonista de los receptores opiáceos μ periféricos (fig. 1).
Figura 1
La diferencia de metilnaltrexona frente a naltrexona es la presencia de un grupo metilo, característica distintiva que lo hace un antagonista periférico selectivo con una capacidad restringida para cruzar la barrera hematoencefálica, mencionado anteriormente30. Los opiáceos actúan en los receptores del SNC y en otras partes del cuerpo, incluyendo el aparato gastrointestinal. Metilnaltrexona tiene actividad gastrointestinal o periférica sin afectar la analgesia que dan los opiáceos a nivel central.
Algunas características farmacocinéticas estudiadas son: concentración máxima (Cmax) 30 min, vida media (t1/2) de 8 h y un grupo metilo que le proporciona una capacidad restringida para cruzar la barrera hematoencefálica.
Los estudios clínicos realizados con metilnaltrexona son:
— Fase 1. Necesarios para análisis de la seguridad y farmacocinética de la molécula, se realizaron en diferentes grupos de pacientes (con fallo renal, fallo hepático, cardiópatas con prolongación del intervalo QT) analizándose metabolismo y excreción y farmacocinética, ninguno de los cuales reportó cambios clínicamente significativos.
— Fase 2. Doble ciego, controlado para análisis de la actividad y tolerabilidad y escalamiento de dosis en pacientes con enfermedad avanzada31.
Previo a describir los 2 estudios fase 3, es importante resaltar la dificultad que representó llevar al cabo estos protocolos en cuidados paliativos, por las características propias de los pacientes, de los cuidadores y, sobre todo, interesar a los investigadores a llevar al cabo estudios en hospices.
— Fase 3. Se realizaron 2 estudios clínicos, aleatorizados, controlados con placebo; la población de pacientes tenía enfermedades avanzadas, es decir, pacientes al final de la vida. La mayoría tenía un pronóstico de 6 meses o menos de vida y todos presentaban constipación que se debía a los opiáceos que tomaban para control del dolor o control de otras molestias relacionadas con sus enfermedades subyacentes.
El primer estudio fase 3 incluyó a 154 pacientes y se administró una sola dosis de metilnaltrexona; el segundo estudio fase 3 abarcó 133 pacientes y la dosificación se administró cada tercer día durante 2 semanas.
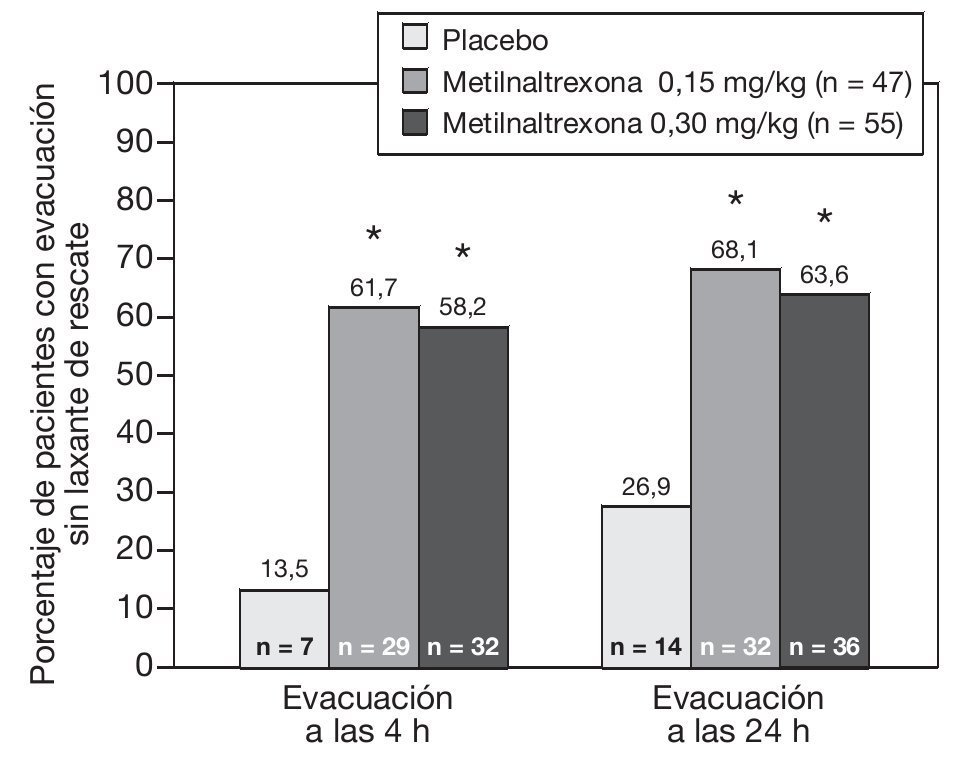
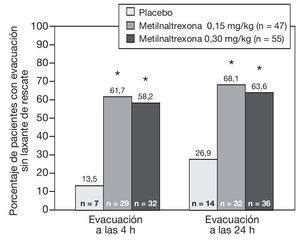
El primer estudio fase 3 de una sola dosis se diseñó de manera aleatorizada, doble ciego, placebo controlado32. Los pacientes podían continuar su laxante de base durante el tiempo del estudio, pero sin recibir laxantes de rescate durante 4 h posteriores a la administración de la dosificación doble-ciego. El objetivo fue determinar la eficacia de una sola dosis subcutánea de metilnaltrexona 0,15 o 0,30 mg/kg de peso comparada con placebo para inducir una evacuación dentro de las 4 h de la administración de metilnaltrexona. La aleatorización fue 1-1-1. La eficacia se evaluó a las 4 y a las 24 h. Los criterios de inclusión fueron pacientes con edad de 18 años o más, con una esperanza de vida de 1 a 6 meses, no presentar evacuaciones clínicamente significativas dentro de las 48 h previas a la primera dosis de metilnaltrexona, un régimen estable de opiáceos para el dolor durante 3 días antes de la asignación aleatoria, su esquema de laxantes sin cambios durante 3 días antes pero sin recibir laxantes de rescate dentro de las 4 h antes de la primera dosis de metilnaltrexona. Un criterio de exclusión muy importante fue la obstrucción gastrointestinal. La evaluación se dividió en los que recibieron metilnaltrexona más el estándar de atención, contra placebo y estándar de atención. Todos los pacientes continuaron con el programa de laxantes que normalmente recibían. Los pacientes podían tener otras razones para estar estreñidos, pero es muy importante destacar que metilnaltrexona está indicada específicamente para el estreñimiento inducido por opiáceos, no estreñimiento global. La mayoría de los pacientes tenían cáncer como enfermedad subyacente, otros diagnósticos incluyeron insuficiencia cardíaca congestiva y sida. La mediana de edad fue de 60 años. El 13,5% de los pacientes con placebo tuvo una evacuación dentro de las 4 h después de recibir el placebo y alrededor del 60% de los que recibieron metilnaltrexona tuvo respuesta, con una diferencia estadísticamente significativa entre ambos grupos (fig. 2). Para las 2 dosis diferentes de metilnaltrexona no hubo diferencia significativa. La respuesta a las 24 h fue similar a la anterior, es decir 26,9% para los que recibieron placebo, 68,1% para el grupo que recibió 0,15 mg/kg y 63,6% para el grupo con 0,30 mg/kg.
Figura 2 Evacuaciones sin laxante de rescate a las 4 y 24 h de la administración de a dosis doble ciego.
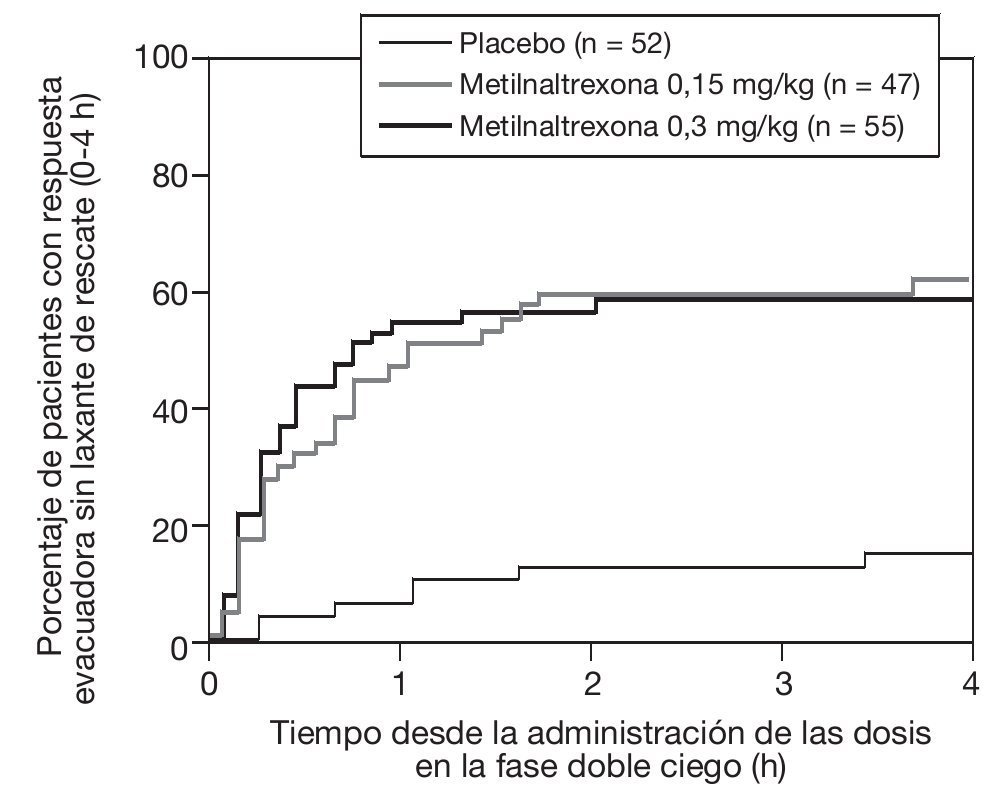
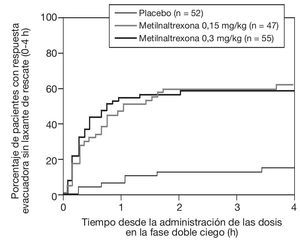
Es interesante resaltar que los pacientes que respondieron a metilnaltrexona lo hicieron entre los 40 y 60 min de la dosificación (fig. 3).
Figura 3 Gráfica Kaplan-Meier del tiempo a la primera evaluación sin laxante de rescate en las 4 h posteriores a la dosis de la fase doble ciego.
Posterior a la fase doble ciego, los sujetos pasaron a una fase de extensión abierta durante 28 días adicionales y luego, si lo deseaban, podían continuar otros 3 meses más, con un total de hasta 4 meses después de la dosificación doble ciega. En la fase abierta, los pacientes podían usar metilnaltrexona según fuera necesario, siempre y cuando no fuera más de 1 dosis en 24 h. El investigador podía ajustar la dosis, bajándola a la mitad 0,075 o hasta 0,3 mg/kg. 147 pasaron a la fase abierta, 72 completaron, 27 continuaron los 3 meses adicionales y 9 completaron el estudio; la razón principal del abandono fue la mortalidad debida a las enfermedades en etapa terminal.
El 54% de los pacientes que recibieron placebo en la fase doble ciega y luego recibieron metilnaltrexona en fase abierta, presentó evacuaciones a las 4 h y el 71% a las 24 h. La respuesta en las primeras 2 semanas fue del 56 y el 63% a las 8 semanas. El número de dosis recibidas por los pacientes varió de 10 (22,7%) a 20 dosis (9,3%). El intervalo fue de 3 días promedio entre las dosificaciones. Los episodios adversos que se presentaron, por lo menos en un 5% de pacientes con placebo o metilnaltrexona, fueron: dolor abdominal, flatulencia y náusea con un ligero aumento del dolor abdominal con la metilnaltrexona.
El segundo estudio fase 3 fue aleatorizado, doble ciego, placebo controlado, con una dosificación cada tercer día por 2 semanas33. El diseño es igual al anterior descrito, los pacientes continuaron su estándar de laxante sin usar laxante de rescate en la fase doble ciega y sin recibir laxantes de rescate dentro de las 4 h de la primera dosis. La dosis de metilnaltrexona fue de 0,15 mg/kg. Después de las primeras 4 dosis, el investigador tenía la opción de escalar la dosis a 0,30 mg/kg. Los criterios de inclusión fueron semejantes a los previamente descritos. La definición de EIO usada por los centros fue: ausencia de evacuación en 48 h y agregaron la posibilidad de menos de 3 evacuaciones a la semana. Los criterios de exclusión fueron semejantes. Además de considerar la eficacia en un período más largo, este estudio evaluó el estrés causado por el estreñimiento en los pacientes, se evaluó el dolor y abstención a los opiáceos. Recibieron metilnaltrexona 62 sujetos, 52 terminaron el estudio y 10 suspendieron. Las razones fueron: 2 por episodios adversos y 5 por mortalidad relacionada con la enfermedad subyacente; muy pocos suspendieron por motivos de seguridad.
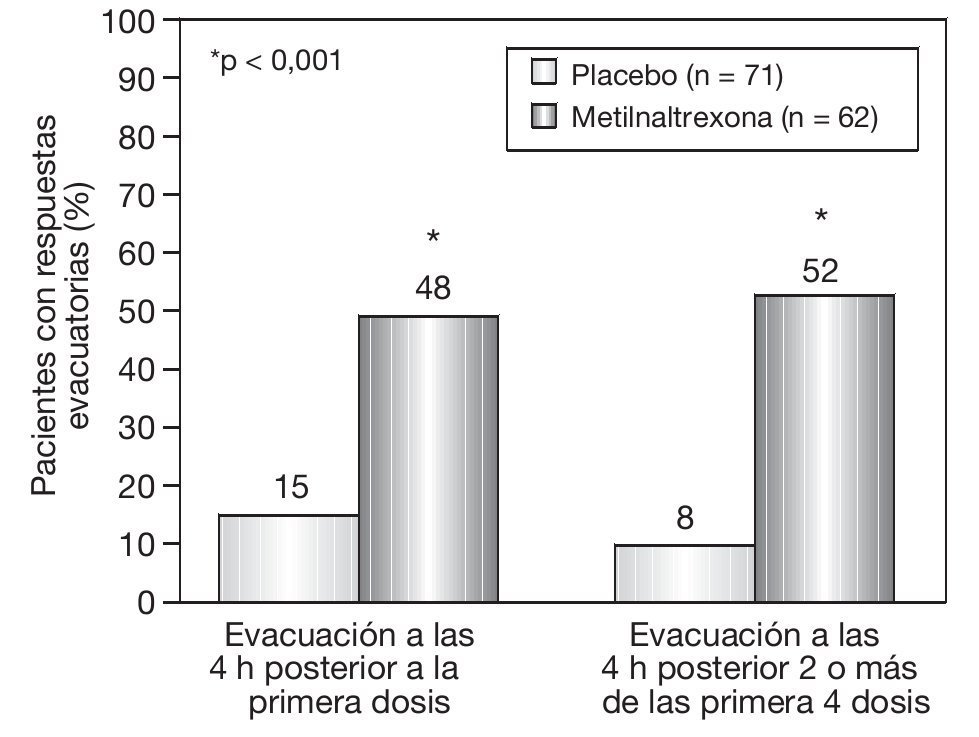
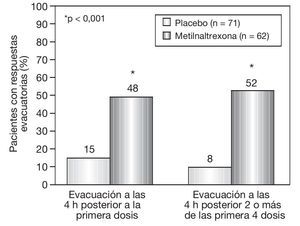
La edad promedio fue 70 años. En este estudio sólo el 58% fueron pacientes con cáncer, otros tenían enfermedad pulmonar obstructiva crónica, demencia, enfermedad cardiovascular, principalmente de insuficiencia cardíaca congestiva, y otras enfermedades que requirieran de opiáceos para control del dolor; asimismo, los pacientes tenían enfermedad terminal. Se analizaron la respuesta de evacuaciones en las 2 semanas y también después de 2 de las primeras 4 dosis. El grupo placebo presentó un 15% de evacuaciones, frente a un 48% con metilnaltrexona a las 4 h. Después de esa primera semana, el 52% reportó 1 evacuación a las 4 h con 2 o más de las primeras 4 dosis (fig. 4).
Figura 4 Resultados primarios de eficacia en el grupo metilnaltrexona y el grupo placebo: evacuación a las 4 h posteriores a la primera dosis del medicamento en estudio, y evacuación a las 4 h posteriores a 2 o más de las primeras 4 dosis.
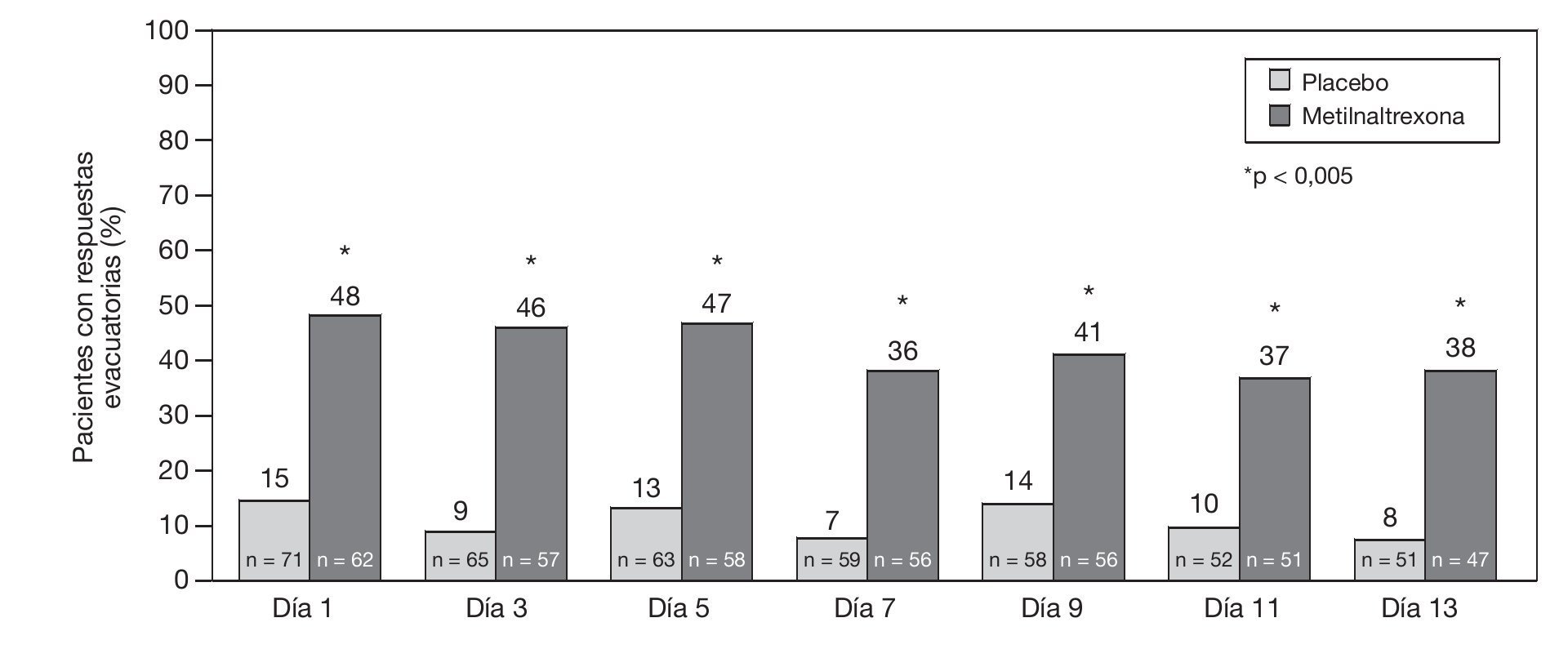
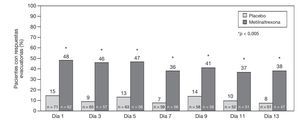
El tiempo de respuesta para la primera evacuación es similar al estudio anterior, 30 min posteriores a la primera dosis y a lo largo de las 2 semanas los sujetos continuaron respondiendo más con metilnaltrexona que con placebo, y esta respuesta fue estadísticamente significativa (fig. 5).
Figura 5 Evacuación sin laxantes de rescate a las 4 h posteriores a cada dosis durante un período de 13 días.
Referente al uso de laxantes, el 20% de los pacientes en el grupo placebo utilizó más enemas.
A través del uso del instrumento "impresión clínica global de cambio", que evaluó el bienestar global del paciente, fue interesante observar que los pacientes del grupo tratado con metilnaltrexona y los investigadores coincidieron en la mejor evaluación con el tratamiento activo. El control del dolor fue semejante en ambos grupos. La escala modificada de Himelsback se utilizó para evaluar el síndrome de abstinencia central de los opiáceos en investigación al terminar las dosis de metilnaltrexona, e incluye 7 síntomas: bostezos, lagrimeo, rinorrea, transpiración, temblores, piloerección y agitación, el grado de severidad varía de 1 (ninguno) a 4 (severo). No hubo diferencia significativa entre placebo y metilnaltrexona.
Los episodios adversos reportados en por lo menos el 5% de los pacientes son: molestias gastrointestinales, dolor abdominal, flatulencia y vómito. En cuanto a episodios adversos serios en el período doble ciego, las diferencias no fueron estadísticamente significativas: el 17,5% de pacientes en el grupo de metilnaltrexona tuvo episodios adversos serios, así como el 28,2% en el grupo de placebo. El estudio 302 también tuvo una fase de extensión y permitió usar metilnaltrexona por hasta 3 meses.
La tasa de respuesta global a los 3 meses fue del 52% para los pacientes que habían recibido placebo en la fase doble ciego y pasaron a metilnaltrexona, y del 57% para los que habían recibido metilnaltrexona desde el inicio, el intervalo de dosificación tuvo una mediana de 4 días.
Los episodios adversos serios a lo largo de 3 meses se catalogaron como no relacionados o probablemente no relacionados, 2 pacientes tratados con metilnaltrexona tuvieron espasmos musculares, dolor abdominal y exacerbación del dolor.
En conclusión, los resultados de los 2 estudios doble ciegos, aleatorios, placebo controlados para evaluar la eficacia y seguridad de metilnaltrexona subcutánea en una población de pacientes con enfermedad avanzada y EIO, mostraron que la evacuación se presentó muy rápida y la eficacia persistió durante el período de 2 semanas con dosificaciones cada 2 días. Los efectos adversos que más comúnmente fueron reportados incluyen flatulencia, náusea y dolor abdominal. En la fase abierta, metilnaltrexona se usó según fuera necesario pero no más frecuente de cada 24 h. La extensión del estudio hasta 4 meses muestra que se continuó induciendo evacuaciones y el perfil de episodios adversos no cambió.
Discusión
En general, en México, el término y estructura de cuidados paliativos son comprendidos y el concepto es parcialmente conocido. Los criterios para ingresar a un sistema de atención paliativa en las instituciones donde existen aún no están definidos. Los médicos en cuidados paliativos aplican clínicamente los criterios internacionales como a un paciente con diagnóstico de enfermedad oncológica; sin embargo, todos los pacientes, incluyendo los no oncológicos, llegarán en algún momento del progreso de su enfermedad a ser terminales; enfermedad progresiva, incurable, potencialmente letal, sin tratamiento curativo, que se asocia a alteraciones sistémicas y complicaciones derivadas de ésta. Esta definición va muy acorde a la de la Sociedad Española de Cuidados Paliativos (2002) que actualmente funciona de guía.
Está claro que un paciente, para ingresar en cuidados paliativos no necesariamente es siempre por dolor, puede tener otros síntomas relacionados a su enfermedad terminal.
Un 90% de los cuidados paliativos se ejerce en las instituciones públicas en el ámbito nacional. En el ámbito privado es mínima, 10% (en ambos casos con atención domiciliaria incluida).
Los especialistas médicos que están involucrados, para así recibir entrenamiento específico en cuidados paliativos, son fundamentalmente los algólogos o algiólogos que, por lo general, son anestesiólogos con entrenamiento en manejo del dolor y cuidados paliativos. Sin embargo, otros especialistas, como oncólogos, médicos internistas, geriatras, pediatras, médicos generales, dado que hay algunas poblaciones en el país que carecen de los médicos especialistas, atienden a estos pacientes al final de la vida.
En general, el uso de opiáceos en las diferentes áreas hospitalarias y extrahospitalarias, según los líderes de opinión en México, es: quirófano, 100%; terapia intensiva, 20-100%; sala de emergencias, 20-100%; dolor oncológico, 70-100%; dolor no oncológico, 5-60%; ambulatorio 30-100%, y otras, 5-20%. Los opiáceos que se usan con mayor frecuencia en cuidados paliativos son: tramadol, 8-50%; morfina, 40-100%; buprenorfina, 0-30%; fentanilo parches, 0-50%, y oxicodona 30%. La medicina en cuidados paliativos no está necesariamente basada en evidencias, sino en existencias; esto es, la disponibilidad de los medicamentos antes descritos, y no quiere decir que sean la opción número uno.
Las condiciones del paciente que exige el uso crónico (mayor de 1 mes) de opiáceos es al 100% en paciente oncológico. Hay otras condiciones, como sangrado del tubo digestivo por uso excesivo de AINE, artritis reumatoide, radiculopatías, síndrome de cirugía fallida y síndrome de dolor regional complejo. El tiempo promedio del tratamiento con opiáceos es de 1 a 12 meses en pacientes oncológicos y se sugiere que en dolor crónico no oncológico se utilicen opiáceos, al no haber otro recurso, por tiempo indefinido o considerar el tratamiento intervencionista. No hay guías locales para el uso de opiáceos, todos están basados en criterios internacionales y las guías que se siguen son las dictadas por la OMS. La única regulación local para el uso de opiáceos clasificados en fracción I es el recetario de estupefacientes que proporciona 50 recetas en cada solicitud con código de barras, y está regulado por la Secretaría de Salud. Hay medicamentos (p. ej., buprenorfina) que no necesitan una receta de código de barras aunque también está controlada su adquisición (fracción II). A excepción de los medicamentos clasificados en fracción I, los demás pueden ser prescritos por los médicos en general; la única variante es la retención de la receta en farmacias, lo que se puede convertir en un obstáculo para el adecuado manejo del paciente con dolor. Por la especialidad involucrada en el manejo del dolor, los algólogos y anestesiólogos son los que cuentan con recetarios para fracción I, además de poder prescribir, como cualquier otra especialidad médica, medicamentos opiáceos clasificados en las otras fracciones.
El problema del EIO no es desconocido. Simplemente, no se le da la importancia adecuada. El tratamiento puede estar ausente o ser inadecuado. Las medidas generales, como la deambulación, ingesta de líquidos, medicamentos y atención médica inespecífica, son la regla general. El problema del EIO es reconocido por los pacientes al ser muy obvio, ya que aparece después de tomar específicamente el opiáceo. Al no ser pacientes con monoterapias, en ocasiones éstos no diferencian con precisión.
En la experiencia del grupo de expertos, los factores más importantes para que un paciente desarrolle con mayor frecuencia EIO son: potencia del opiáceo, dosis y tiempo de uso. El porcentaje de pacientes que toman opiáceos y que desarrollan estreñimiento es aproximadamente del 80-100% en el oncológico y del 40-100% en el no oncológico, dependiendo esto último de la práctica clínica.
La recomendación uniforme del grupo de expertos fue que antes de prescribir el opiáceo se interrogara la presencia o no de estreñimiento, sobre todo en mujeres. El estreñimiento inducido por opiáceos afecta la calidad de vida del paciente. "La mano que prescribe opiáceos, prescribe laxantes"; aunque no necesariamente se aplica desde el momento de iniciar el tratamiento con opiáceos, se considera que el 60% de los médicos sigue este enunciado con sus pacientes.
Aún no hay guías locales para el tratamiento del estreñimiento; la recomendación del grupo de expertos es desarrollarlas y continuar como hasta ahora, utilizando las internacionales. El paciente y la familia hacen todo lo que está en sus posibilidades para sobrellevarlo: dietas, remedios caseros, ingesta de líquidos, laxantes, masaje en el abdomen y calor local. En ocasiones, suspenden el opiáceo o abandonan el tratamiento o bajan la dosis del opiáceo. Las opciones de tratamiento para el EIO disponibles son: laxantes, supositorios, aceites minerales, ablandadores y cuando no responden se debe utilizar enemas y desimpactación. El grupo de expertos considera que el nivel de satisfacción de los pacientes es menor del 50%.
Según los expertos, la metilnaltrexona se va a convertir en el "antídoto de un efecto adverso"; llegará el momento en que la prescripción del opiáceo conlleve la de metilnaltrexona como opción para evacuar. Hay que enfatizar que metilnaltrexona no es un laxante, es un inhibidor selectivo de opiáceos; si no se entiende así, se podría usar incorrectamente en cualquier tipo de estreñimiento. Algunas medidas que se toman actualmente para el control de este tipo de padecimiento van a desaparecer; "analógicamente será como cuando se usan los relajantes musculares en la anestesia, después se utiliza prostigmina para reversión de los efectos colaterales o naloxona con los fentanilos". Habrá que valorar con análisis farmacoeconómicos el valor real de este nuevo medicamento, pues ya hay un impedimento, pero sólo en el imaginario, pues se están utilizando otros recursos mucho más caros y nada efectivos para estreñimiento causado por opiáceos. Incluso hay pacientes que están internados por el estreñimiento, con los costes que esto implica.
Por último, el paciente en cuidados paliativos requiere de una atención médica multidisciplinaría, sin olvidar el papel medular de enfermería en el monitoreo y en la comunicación entre el paciente y el médico. Es importante llevar a cabo programas de educación médica continua para sensibilizar a los médicos que están involucrados en el manejo de pacientes con enfermedades avanzadas, del adecuado manejo de los analgésicos opiáceos, sus efectos adversos más frecuentes, como el EIO, y las medidas terapéuticas y preventivas para el manejo de éstas.
Resalta la importancia que representa para los médicos involucrados en el área de dolor y cuidados paliativos la reciente reforma de la Ley General de Salud en materia de Cuidados Paliativos, que se ha convertido en una realidad en nuestro país con su reciente publicación y entrada en vigor el pasado 6 de enero de 2009, y la cual dará el marco jurídico de aplicación institucional e individual para bien de los pacientes con enfermedades en etapa terminal.
Conflicto de intereses de los líderes de opinión
Los líderes de opinión manifiestan no tener ningún conflicto de intereses.
Los doctores Diana Morgenstern, Guadalupe la Villa, Mónica González y Hans Bierschwale forman parte del equipo médico de soporte a metilnaltrexona en Wyeth USA y México, y Centro América.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* El listado completo del Grupo de Expertos en Cuidados Paliativos se detalla en el anexo 1.
* Autor para correspondencia.
Correo electrónico:
dolormty@terra.com.mx; dolormty@infosel.net.mx (J.A. Flores Cantisani).
Recibido el 24 e febrero de 2009;
aceptado el 5 de mayo de 2009