Introducción
El rápido desarrollo del estudio y tratamiento del dolor en los últimos años provocó una gran dispersión y diversidad en los conceptos y denominaciones referentes a este nuevo concepto patológico. La IASP (International Association for the Study of Pain) se encargó de revisar e integrar todos los conocimientos existentes hasta el momento, con la intención de crear una taxonomía uniforme; en 1994 propone aplicar el término de dolor neurogénico al "dolor iniciado o causado por una lesión primaria, disfunción o perturbación transitoria del sistema nervioso central o periférico". El dolor neuropático (DN) se considera como una subentidad de aquel y se define como "dolor que se produce como consecuencia de una lesión o disfunción primaria del sistema nervioso central o periférico", omitiendo de la primera definición la inclusión del concepto "perturbación transitoria"1. Algunos autores propugnan omitir también el término "disfunción", argumentando que al aplicar este vocablo la definición del DN se podría extender a cualquier tipo de dolor permanente somático o visceral, ya que todos ellos desarrollan con el tiempo cambios funcionales en las estructuras nerviosas involucradas en la transmisión dolorosa. Sin embargo, se entiende que la definición de la IASP se refiere a la disfunción "primaria" del tejido nervioso y no incluye a la disfunción "secundaria" que se produce como consecuencia de la neuroplasticidad desencadenada por un estímulo preexistente2. Al igual que Merskey, se entiende que la definición inicial de la IASP es absolutamente clarificadora, unificadora y pretender acotar la definición al término lesión sin incluir el de disfunción primaria. Esto dejaría fuera cuadros tan frecuentes como la neuralgia del trigémino (NT) o el síndrome de dolor regional complejo tipo I, así como otros menos frecuentes donde la lesión neurológica no se pudiera objetivar3.
La denominación de DN incluye cualquier tipo de lesión o disfunción primaria que afecte tanto al sistema nervioso periférico (SNP) como central (SNC) o al sistema simpático (SNS).
Siguiendo este concepto anatómico, el DN se puede clasificar en 3 grandes categorías3: a) DN periférico: las alteraciones se originan en el SNP; b) DN central (DNC), en el que la lesión o disfunción primaria se localiza en el SNC, y c) dolor simpático (DS), cuyo origen está en la alteración del SNS.
Dado el aumento de pruebas para la eficacia de los tratamientos del DN, es importante para el clínico saber cuáles son los medicamentos más eficaces para aliviar el dolor, asociados con el menor número de efectos adversos. Es por ello que hay una clara necesidad de tener un algoritmo basado en la evidencia para tratar las diferentes condiciones del DN. Idealmente, las pruebas de las diferentes opciones de tratamientos se basan en comparaciones directas de un fármaco con otro a través de la eficacia y los efectos secundarios, aunque hay muy pocas comparaciones directas disponibles. Un enfoque bastante consistente es considerar la estimación de la eficacia y la seguridad utilizando el número necesario de pacientes a tratar (NNT) para obtener una respuesta deseable de eficacia y el número necesario (NNH) para que se presente un efecto adverso. Revisiones sistemáticas recientes han resumido los tratamientos disponibles para el DN utilizando valores NNT4-6, aunque no ha sido posible hacer lo mismo con valores NNH, dada la ausencia de esta información en los estudios que pudieran someterse a un metaanálisis.
No obstante, estas revisiones citadas deben actualizarse debido a la constante publicación de nueva información y a las limitaciones del NNT y NNH, que hacen necesario un enfoque donde puedan tenerse en cuenta aspectos sobre efectos en signos y síntomas, interacciones con otros tratamientos u otras comorbilidades no cuantificadas a través de estos indicadores. Es conveniente, además, considerar otras publicaciones interesantes, aunque de menor rigor en el diseño o análisis, que aporten información acerca de algunas particularidades en este tipo de dolor menos estudiadas.
Material y métodos
El objetivo de este artículo es elaborar unas recomendaciones para el tratamiento del DN que estén avaladas por la evidencia científica y consensuadas por un grupo multidisciplinar de expertos en el tratamiento del dolor y en metodología.
La forma clásica de obtener esta evidencia es a través de un metaanálisis que recoja toda la información disponible, teniendo en cuenta los criterios de selección de publicaciones que deben seguirse con esa técnica, y que permita obtener parámetros cuantificables respecto a la eficacia y la seguridad de los distintos tratamientos posibles en cada tipo de DN.
Las bases de dados consultadas fueron la Cochrane Library, EMBASE (año 2000 en adelante) y PUBMED (año 2000 en adelante), seleccionando ensayos clínicos controlados y aleatorizados, así como metaanálisis. La búsqueda bibliográfica, que se llevó a cabo por 5 revisores, se dividió en las diferentes indicaciones que presentan DN como síntoma principal: dolor periférico, dolor central y DS. Finalmente, se evaluaron y se hicieron las recomendaciones clínicas para el tratamiento del DN por los autores especialistas en dolor.
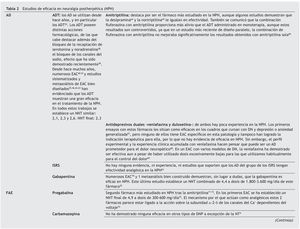
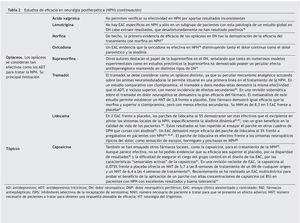
La revisión de esta búsqueda ha dado lugar a plantearse como documentos de referencia 4 artículos que recogen las recomendaciones avaladas por la International Association for the Study of Pain4-7, por la European Federation of Neurological Societies (EFNS)5 y por la Canadian Pain Society8. En dichos artículos se realizan metaanálisis que cumplen con todas las condiciones de calidad (tipo de estudios, número mínimo de pacientes, etc.). La medida principal de eficacia es el NNT para obtener respuesta aceptable en un paciente, que se calcula como el inverso de la diferencia de riesgos absolutos entre tratamiento y placebo, para lo cual sólo se pueden utilizar los artículos que contienen la información que permite realizar dicho cálculo. En el caso de la seguridad, lo ideal sería utilizar una medida similar (NNT para que se produzca un efecto adverso), pero no se ha podido realizar por no tener datos suficientes para ello. Posteriormente, las recomendaciones dadas por la EFNS en el artículo de 2006 se han actualizado y publicado en la National Guideline Clearinghouse (EFNS guidelines of pharmacologic treatment of neuropathic pain) en enero de 20089 (tabla 1). Se ha tenido en cuenta, además, otro metaanálisis realizado también por la International Association for the Study of Pain (2007)10, donde se toma como referencia para la medida de eficacia la escala visual analógica en lugar de la NNT.
Analizada la información antes reseñada, no parece procedente realizar un nuevo metaanálisis para obtener evidencia de la eficacia, dado que no aportaría ninguna información relevante a la ya existente; de los resultados se pueden extraer claras recomendaciones para los tratamientos basándose en su eficacia según el tipo de DN.
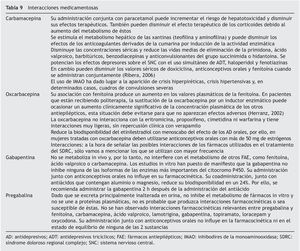
Sin embargo, hay algunos tipos de DN de los cuales no hay suficiente información para realizar un metaanálisis y que no están incluidos en las publicaciones citadas, pero dado el objetivo de que estas recomendaciones proporcionen la mayor información posible para el tratamiento de este dolor, se han incluido recomendaciones basadas en publicaciones científicas que no contienen parámetros tan estándares como el NNT o que no son ensayos controlados. Por otra parte, dado que el tema de la seguridad no está definido mediante metaanálisis, se ha revisado también la información disponible en diferentes publicaciones con el fin de poder establecer otros parámetros de interés, que además de los efectos adversos, tengan en cuenta el alivio de posibles síntomas, la calidad de vida o las interacciones con otros fármacos (tabla 9).
Revisiones por cuadros clínicos
Dolor neuropático periférico
Neuralgia postherpética
La neuralgia postherpética (NPH) define al dolor crónico de características neuropáticas que se localiza en la metámera en donde se produjo el herpes zóster agudo y que persiste más allá de 3 meses tras la curación de las lesiones11. Sin embargo, no hay un criterio uniforme sobre el tiempo que debe transcurrir desde que se inicia el herpes hasta la desaparición del dolor, por lo que algunos autores proponen varias fases para el dolor que acompaña al herpes zóster (HZ): una fase aguda, en la que el dolor acompaña al período eruptivo y que habitualmente tiene una duración de 30 días desde el inicio del cuadro; una fase subaguda, que se manifiesta por la persistencia de dolor tras la desaparición de las lesiones y que debe estar resuelta durante los 3 primeros meses desde el inicio clínico, y una última fase, que recibe el nombre de NPH en la que el dolor perdura después de 3 meses desde que comenzó el cuadro12,13.
La NPH se presenta de un 2 a un 35% de los pacientes que han presentado un episodio de HZ14. La incidencia varía con la edad y así como en los pacientes jóvenes la incidencia es menor a un 5% de los casos de HZ13-15, por encima de los 60 años asciende hasta un 47%16 e incluso puede llegar al 80% en los pacientes que hayan cumplido 80 años17.
Clínicamente, el cuadro se caracteriza por la presencia de dolor de distintas características: dolor continuo quemante y escociente, dolor agudo intermitente en forma de intensas parestesias que recorren la zona; algunas alteraciones sensoriales como la alodinia (dolor provocado por mínimos contactos) y de forma característica la alodinia dinámica, provocada por roce o deslizamiento suave sobre la piel afectada, se presenta de forma casi universal en esta patología, entre el 70 y el 90% de los casos de NPH18-20. Aunque a menudo la NPH se resuelve en algunos meses, en muchos pacientes el dolor persiste durante años causando un devastador impacto sobre la calidad de vida y produciendo grandes costes sanitarios21. Esta condición se considera el prototipo humano de DN crónico, ya que los pacientes presentan signos reveladores de tener múltiples trastornos neurológicos referidos tanto al SNP como al SNC22,23.
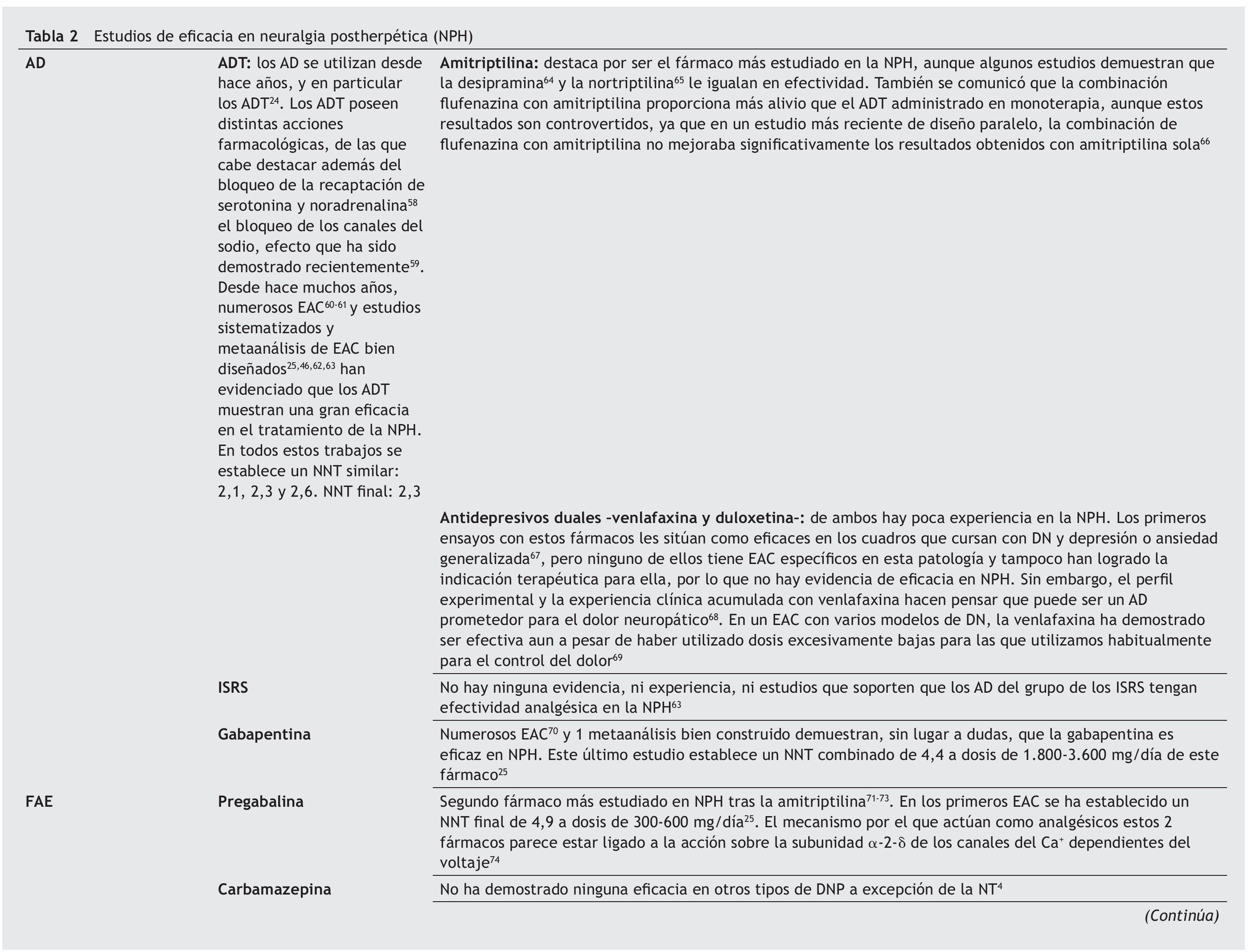
Estudios de eficacia y seguridad. Para tratar el dolor de la NPH, además de los analgésicos comunes se utilizan numerosos agentes farmacológicos sistémicos que también se emplean indistintamente para otros tipos de DN. De todos ellos, los 2 grupos de fármacos más utilizados son los antidepresivos (AD) y los fármacos antiepilépticos (FAE).
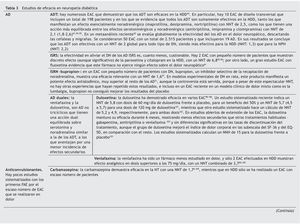
Los AD se utilizan desde hace años y, en particular, los AD tricíclicos (ADT)24. En la tabla 2 se encuentran reflejados todos los datos encontrados en la búsqueda de los trabajos publicados acerca de la eficacia en el tratamiento con AD y FAE para el dolor por neuralgia.
La principal limitación para la utilización de ADT es la alta incidencia de efectos secundarios, presentando un NNH (frente a placebo) de 5,725. Algunos de estos efectos son muy mal tolerados, destacando boca seca, cansancio, mareos, sedación, estreñimiento, retención urinaria, temblor, palpitaciones, visión borrosa y aumento de peso. Aunque menos frecuentes, también se debe destacar la posibilidad de efectos más graves, como hipotensión ortostática o bradicardia por prolongación del QT, que cuestiona el tratamiento con ADT en cardiópatas con bloqueos cardíacos previos26. Para evitar los efectos secundarios de los ADT, se pueden utilizar otros AD con mecanismos similares y que por su doble acción frente a serotonina y noradrenalina se les da el nombre de AD duales. Tanto duloxetina como venlafaxina se toleran mejor que los ADT, y aunque tienen un mejor perfil de seguridad, la toxicidad hepática de la duloxetina aconseja su restricción en los pacientes con enfermedades hepáticas conocidas, de la misma forma que se debe considerar el aumento de riesgo cardíaco con el uso de venlafaxina al aumentar las cifras tensionales.
En las recomendaciones ya publicadas de algunos autores10 para el tratamiento del DN, en un segundo nivel de tratamiento se sitúan los analgésicos opiáceos y el tramadol. En este sentido, algunos opiáceos han demostrado su eficacia en la NPH. En la tabla 2 se muestran los diferentes opiáceos con los resultados encontrados.
Aunque hay muchas dudas sobre los últimos mecanismos que están involucrados en la alodinia táctil dinámica, su protagonismo en la NPH ha sido motivo de múltiples investigaciones. En este sentido, los últimos hallazgos hacen sospechar que la alodinia mecánica estática se rige por mecanismos distintos que la alodinia dinámica27, entre ellos se señala especialmente la responsabilidad de la proliferación glial con activación de los astrocitos y la microglia, así como la producción de citocinas proinflamatorias en el asta dorsal28. Pero también es importante el descenso del tono GABAérgico inhibitorio, secundario a la baja expresión y el descenso de la actividad neuronal de GAD65 (una isoforma de la enzima ácido-glutámico decarboxilasa) que se encuentra fuertemente ligada a la producción de GABA espinal29. Este último mecanismo pone de nuevo en primer plano el importante papel que pueden jugar los fármacos con actividad tónica sobre las vías descendentes GABAérgicas en el tratamiento del dolor acompañante al HZ30,31.
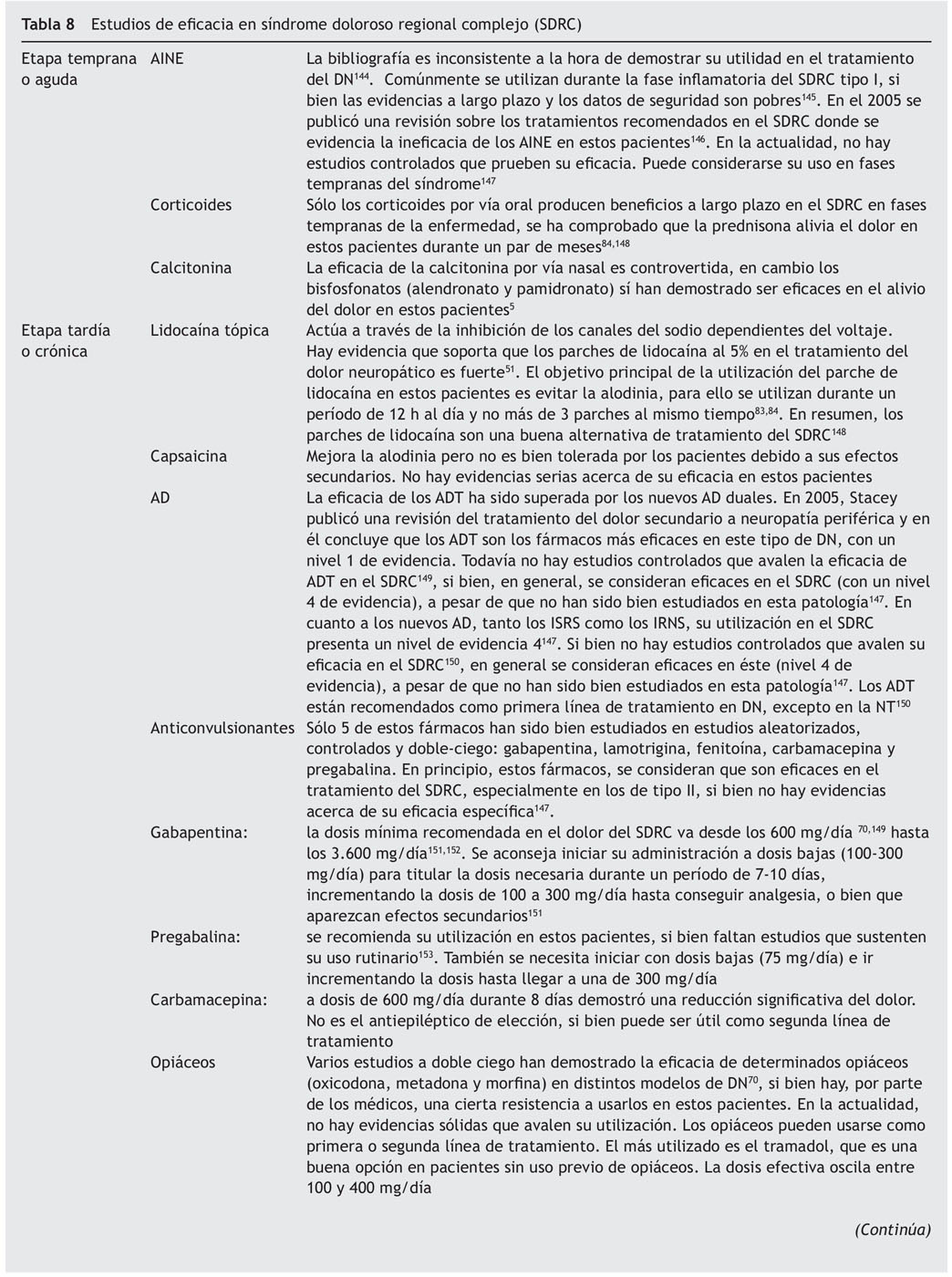
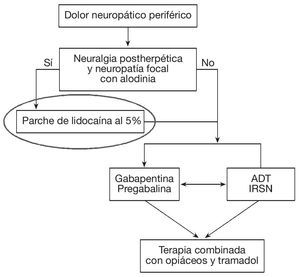
Precisamente la alodinia, componente primordial del DN en la NPH13,32, ha motivado que los productos dirigidos a su alivio, como los parches de lidocaína al 5%, se hayan situado en la primera línea de los algoritmos de tratamiento de esta entidad4,33,34 (fig. 1). En la tabla 2 se describen los estudios del parche de lidocaína al 5% que demostraron su eficacia en la alodinia dinámica.
Figura 1 Algoritmo para el tratamiento del dolor neuropático periférico, según Finnerup et al4. ADT: antidepresivos tricíclicos; IRSN: inhibidores de la recaptación de serotonina-noradrenalina.
En un ensayo clínico aleatorizado doble ciego con el parche de lidocaína al 5% frente a pregabalina se pudo demostrar que hubo una mayor respuesta en el grupo del parche (el 62,2 frente al 46,5%) y la reducción en la escala NRS fue también superior en ese grupo35.
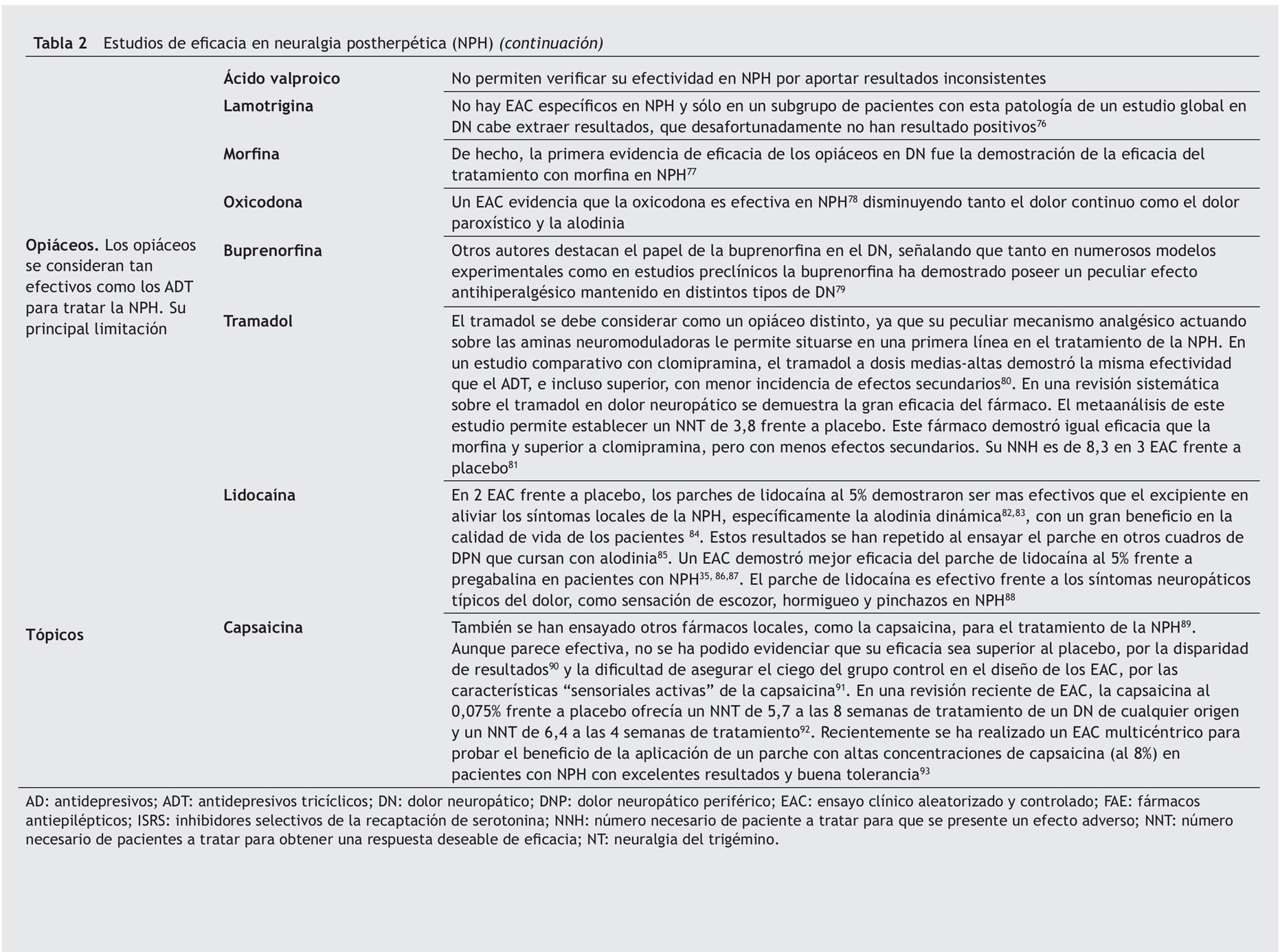
No hay evidencia suficiente que permita aconsejar el uso de otros productos en el tratamiento de primera línea de la alodinia y otros síntomas evocados de la NPH. En una revisión reciente se establece que solamente hay pobres evidencias de que ketamina, alfentanil y morfina, utilizadas por vía intravenosa, tengan algún beneficio y, por tanto, quedarían reservadas para una segunda línea de tratamiento36.
Neuropatía diabética dolorosa
La neuropatía diabética dolorosa (NDD) es una de las complicaciones más temidas de la diabetes mellitus (DM)37,38 y se define como la presencia de dolor por alteración de los nervios periféricos a causa de la DM. Se puede manifestar clínicamente de diversas formas y su presencia es reflejo de una alteración funcional multifactorial de los nervios periféricos, cuyo origen primordial y fundamental es el daño isquémico por afectación de los vasa nervorum39.
La mayoría de los pacientes con NDD describe DN en las zonas acras, fundamentalmente en los pies, que además del sufrimiento les ocasiona altos grados de invalidez e importante deterioro de la calidad de vida40,41. El dolor en la NDD se percibe como el resultado de la suma de 2 percepciones: una puramente sensorial, y la otra afectiva y emocional producida por 2 sentimientos: uno de carácter inmediato que genera un fenómeno de "evitación" del contacto y otro ligado al temor de las consecuencias limitantes del daño neurológico. De estos sentimientos conjuntos nacen conductas emocionales de frustración, ansiedad y depresión42 que empeoran la percepción dolorosa y que aportan elementos complejos y de amplificación que suelen complicar la terapia cuando el dolor permanece durante largo tiempo43.
La NDD afecta aproximadamente al 50% de los pacientes portadores de DM, pero solamente un 11% de ellos desarrolla DN, es decir, afortunadamente sólo un 5% de los pacientes con DM desarrollará DN44. La presencia de NDD es más frecuente en pacientes con DM del tipo 2 y, según numerosos estudios, su aparición y severidad están relacionadas de forma directa con el deficitario control de las cifras de glucemia37,44,45. Habitualmente, la NDD se manifiesta por dolor continuo, de localización inicial en regiones distales de los miembros inferiores, generalmente bilateral, con distribución en calcetín, que inicialmente afecta a las plantas de los pies y regiones acras, y que evoluciona hacia regiones más proximales de las extremidades inferiores y, finalmente, afecta a otros territorios como las regiones distales de los miembros superiores y, en última instancia, al tórax37. El dolor se percibe habitualmente como mortecino y constante, quemante y punzante, y se manifiesta con claros componentes neuropáticos, como escozor frecuente, disestesias, entumecimiento, alodinia mecánica y debilidad en los miembros46. Todo esto afecta a la marcha del paciente, interfiere con el sueño y altera de forma considerable su calidad de vida40,45. Se ha detectado que los pacientes con NDD tienen una incidencia de depresión mayor que los pacientes con DM sin esta complicación42,43 e incluso mayor que la que presentan otros grupos de pacientes portadores de dolor crónico de otras etiologías47.
Estudios de eficacia. La NDD, al igual que la NPH, puede ser tratada con eficacia por los mismos grupos farmacológicos descritos para aquella patología35,48, y que hemos señalado en la parte relativa a NPH, y que en el caso de la revisión de NDD se encuentran descritos por grupos terapeúticos en la tabla 3.
Neuralgia del trigémino
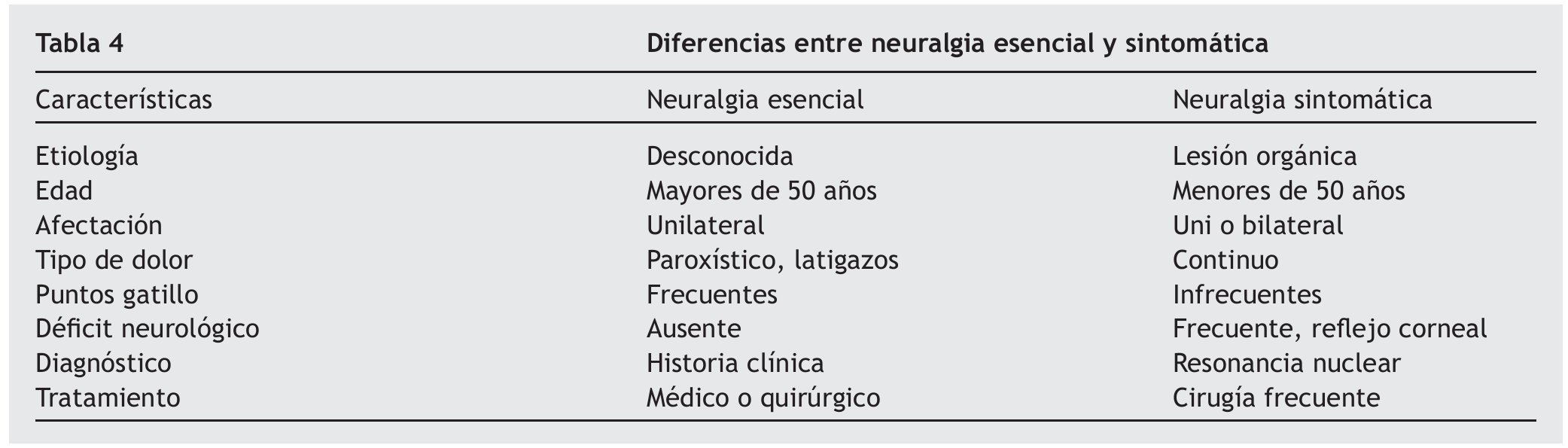
La NT se define como "un cuadro de dolor paroxístico, lancinante y de breve duración, generalmente de 5-20 s de duración", generalmente unilateral y localizado en el territorio de una o más ramas del nervio trigémino. Afecta con mayor frecuencia a las ramas II (maxilar) o III (mandibular), si bien en su evolución la neuralgia puede extenderse a otra/s rama/s. El dolor puede aparecer de forma espontánea o ser desencadenado por estímulos externos sobre determinadas zonas sensibles en el territorio de alguna de las ramas del V par. No suele acompañarse de déficit neurológico en los casos idiopáticos y la detección de anomalías sensitivas debe sugerir la presencia de una neuralgia sintomática. La NT se puede dividir a su vez en: a) clásica (idiopática), secundaria a una compresión vascular del nervio trigeminal en el ángulo pontocerebeloso o por una causa no fundada, o b) sintomática, cuando es secundaria a tumoraciones benignas o metastásicas en el ángulo pontocerebeloso. Los pacientes con neuralgia sintomática se consideran menos respondedores al tratamiento49. El patrón temporal es recurrente, con fases sintomáticas de meses o años de duración que se alternan con remisiones de duración variable.
Epidemiología. El trigémino es el principal nervio sensitivo de la cabeza y el nervio motor de la masticación. Se llama así por presentar 3 ramas: oftálmica, maxilar y mandibular, que recogen la sensibilidad de casi toda la cara. La NT presenta una incidencia anual de 4,5 por cada 100.000 personas50, siendo algo más frecuente en mujeres que en varones, con una edad de presentación en las etapas medias y tardías de la vida.
Fisiopatología. El dolor puede ser desencadenado por estímulos que normalmente no lo producen, como el tacto, el roce del viento, masticar, etc. La causa más frecuente de la NT es la compresión vascular de la raíz del nervio en su punto de entrada en la protuberancia, descrito por primera vez por Jannetta en 196751; dicho origen constituye el 80-90% de los casos. Esta compresión se puede deber a: a) una tumoración propiamente dicha; b) por la interposición de un vaso sanguíneo, o c) por alteración del contenido de la fosa posterior por desplazamiento de la raíz nerviosa contra un vaso sanguíneo o contra la base del cráneo.
Diagnóstico. El diagnóstico es fundamentalmente clínico y se basa, sobre todo, en la anamnesis, donde la exacta localización del dolor, intervalos libres, puntos sensitivos bucofaciales, desencadenantes al masticar, etc., son orientativos. En la exploración física hay que tener presente la distribución anatómica de las 3 ramas del V par (oftálmica, maxilar y mandibular) y la evaluación sensitiva facial, reflejo corneal con examen de los músculos masticadores que adquieren una particular relevancia.
Los criterios de la International Headache Society (Headache, 2004) para el diagnóstico de la NT esencial son: a) ataques paroxísticos de dolor facial o frontal con una duración de entre 1 s y 2 min, que afectan a una o más divisiones del nervio trigémino; b) el dolor presenta al menos 2 de las siguientes características: intenso, agudo, superficial o punzante. Se produce por estimulación de zonas gatillo o por factores desencadenantes, como comer, hablar, lavarse la cara o los dientes, etc.; c) los ataques son característicos de cada individuo; d) no hay déficit neurológico, y e) no es atribuible a otras causas de dolor facial.
El examen complementario por excelencia, ante la duda, es la resonancia magnética. Ello nos permitirá una selección mejor de los pacientes que serían beneficiarios de la descompresión microvascular.
Formas clínicas. La NT se puede dividir a su vez, en: a) clásica (idiopática), secundaria a una compresión vascular del nervio trigeminal en el ángulo pontocerebeloso o por una causa no fundada, o b) sintomática, cuando es secundaria a tumoraciones benignas o metastásicas en el ángulo pontocerebeloso. Los pacientes con neuralgia sintomática se consideran menos respondedores al tratamiento49.
El patrón temporal es recurrente, con fases sintomáticas de meses o años de duración que se alternan con remisiones de duración variable (tabla 4).
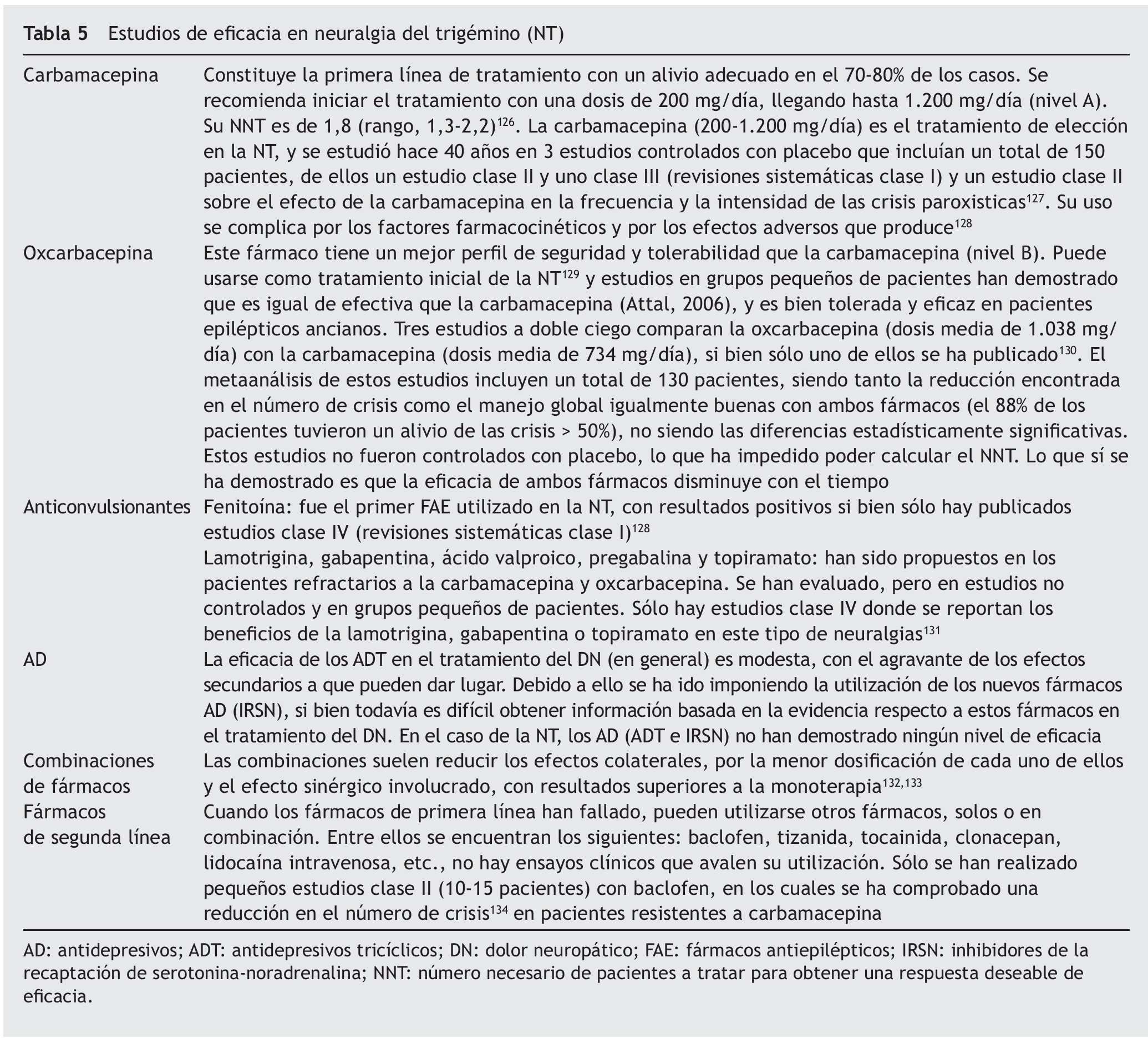
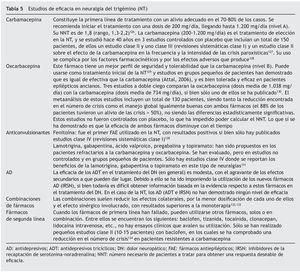
La mayoría de los estudios realizados, en DN, se ha llevado a cabo en 3 indicaciones fundamentales: NPH, neuropatía diabética y NT52. La información acerca de la eficacia de las alternativas farmacoterapéuticas se encuentra recogida en la tabla 5 con los estudios de eficacia seleccionados.
Apoyándonos en la demostrada eficacia de los fármacos en estos tipos de DN, los médicos los administramos en otros tipos de DN, tanto central como periférico.
En tema de seguridad de las alternativas farmacoterapéuticas utilizadas en la NT los efectos adversos más frecuentes de los fármacos recomendados como primera línea de tratamiento en este tipo de DN se encuentran en los estudios registrados en la tabla 6.
Dolor neuropático central
El comité de taxonomía de la IAPS define el DNC como el causado por una lesión primaria o una disfunción en la medula espinal, tallo cerebral, tálamo, córtex y estructuras supratalámicas. El rasgo común anatómico de todas las lesiones, según Tasker53, parece ser la extensión en el tracto espinotalámico o en la proyección rostral talamoparietal
Como DN proveniente del daño en la neurona primaria sensorial, aparece pérdida de la sensibilidad somática en la zona dolorida perceptible, y no hay ninguna correlación entre la extensión de la lesión y la severidad del dolor, por lo general asociado con sensibilidad anormal. El rasgo común anatómico de las lesiones causantes del dolor está en la extensión espinotalámica y en la porción ventral posterior talamoparietal.
Su distribución metamérica tiene correlación con la localización de la lesión en el cerebro o la médula espinal.
Su aparición puede ser instantánea, pero normalmente suele aparecer después de un período prolongado desde que se produce la lesión.
El dolor suele ser espontáneo y continuo y puede ser aumentado o evocado por estímulos somáticos, no tiene una cualidad característica y es diferente de unos pacientes a otros.
Su etiología es muy variable, siendo las más importantes:
— Las lesiones vasculares en el cerebro y en la médula.
— La esclerosis múltiple.
— Lesiones traumáticas de la médula espinal y del cerebro.
— Siringomielia y siringobulbia.
— Mielitis secundarias a virus.
— Tumores.
— Abcesos.
— Epilepsia.
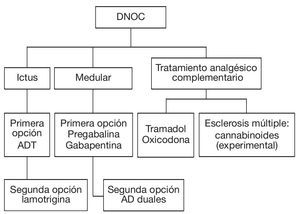
Hay grandes diferencias en la prevalencia de las etiologías del DNC, y las lesiones de la médula espinal son las de mayor prevalencia, seguidas de las de la esclerosis múltiple y después los ictus.
El DN resultante de la lesión de la médula espinal puede estar localizado unilateralmente o bilateralmente muy difuso y situado a nivel o por debajo de la lesión, suele ser a menudo severo en el periné, es generalmente continuo con una sensación quemante, presenta fuertes dolores paroxísticos y puede presentar un dolor visceral que llegue a hacerse insoportable.
Cuando la lesión es cervical o torácica puede presentarse una respuesta exagerada de los centros simpáticos medulares, la cual se puede desencadenar por estrés, fatiga o un simple movimiento.
En el cerebro las lesiones limitadas al mesoencéfalo causan DN; las lesiones vasculares, sea cual sea su etiología (infarto, hemorragia o malformación), cursan en un porcentaje elevado con dolor. La localización de la lesión en el tálamo es importante cuando se demostró en un trabajo que sólo aparecía DN en los pacientes que presentaban lesión en la zona ventral posterior del tálamo. La localización habitual del dolor es unilateral: es un dolor muscular con calambres u opresión, que presenta hiperpatía disestesia y, a veces, alodinia. Además, se suele presentar dolor visceral con molestias en la vejiga y el dolor es paroxístico.
En la esclerosis múltiple, el dolor tiene una localización predominante en las extremidades inferiores, éste es continuo con crisis paroxísticas, muchas veces con un dolor mixto.
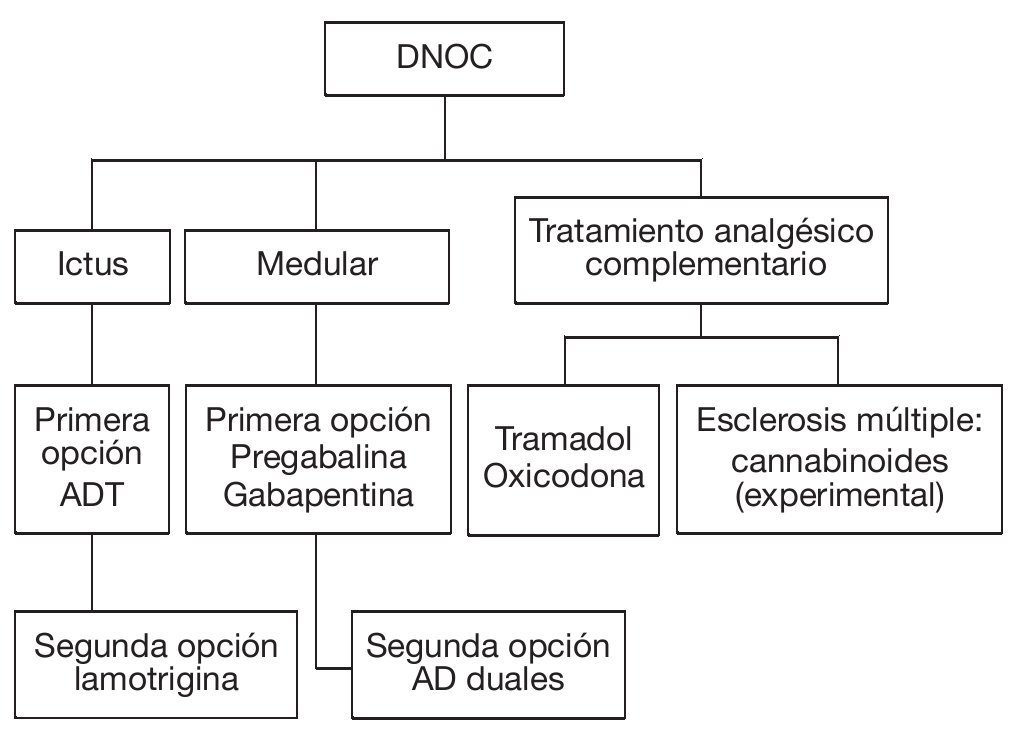
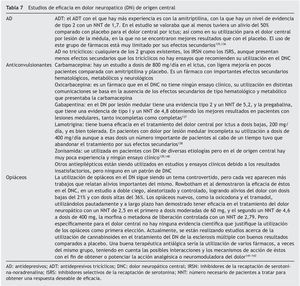
La evidencia ideal para la elección de los fármacos en un algoritmo de tratamiento estaría basada en la comparación de los fármacos, tanto en su eficacia como en sus efectos secundarios, pero a pesar de ello no hay un consenso entre los expertos en las directrices a seguir en el tratamiento del DNC, posiblemente debido a la heterogeneidad de las etiologías de los mecanismos y síntomas del DN, a pesar de los estudios metaanalíticos o revisiones de artículos. La tabla 7 muestra los resultados de los estudios seleccionados.
Dolor neuropático simpático
Síndrome doloroso regional complejo
El síndrome doloroso regional complejo (SDRC) es una entidad clínica de difícil diagnóstico. Fue descrita por primera vez en 1864 por Silas Weir-Mitchell y desde entonces ha recibido múltiples definiciones. El término "causalgia" fue acuñado en 1864 para describir un "dolor desproporcionado en los dedos, posterior a un daño nervioso, junto a otros cambios clínicos que fueron reportados como nutricionales". En un principio, ésta comenzó a denominarse "distrofia simpático refleja". Desde entonces se han desarrollado múltiples hipótesis sobre el origen del cuadro clínico.
El SDRC agrupa a una serie de entidades nosológicas que aparecen después de un daño o lesión, con presencia de dolor regional con predominio distal y que se acompaña, al mismo tiempo, de alteraciones sensitivas.
Posiblemente, el SDRC sea el que más desconcierta tanto al paciente como al clínico, ya que a pesar de las innumerables publicaciones aparecidas sobre él, todavía continúan siendo aspectos desconocidos su fisiopatología, su evolución natural y su tratamiento más adecuado, debido en gran parte a que todo lo que se ha publicado acerca de este síndrome ha sido de tipo descriptivo, basado en experiencias clínicas, que con gran frecuencia no reflejan de una manera adecuada su gran diversidad clínica.
En 1994, la IASP lo definió como "un síndrome complejo, fundamentalmente doloroso, neuropático, crónico, desproporcionado a la lesión traumática tisular o neurológica que lo origina, que incluye una gama de síntomas y signos variados y de tipo neurovegetativo". La IASP, para facilitar la interpretación clínica y su identificación, delimitó 2 subtipos54: a) tipo I, en ausencia de daño neurológico (conocido como "distrofia simpaticorrefleja"), y b) tipo II, cuando existe daño neurológico (conocido como "causalgia").
Fisiopatología. Su fisiopatología no está del todo aclarada. En la mayoría de las ocasiones, el paciente reconoce la presencia de un estímulo traumático previo. El SDRC se caracteriza clínicamente por la presencia de 2 situaciones distintas: un estado agudo acompañado de síntomas de inflamación regional y un estado crónico, que se caracteriza por la presencia de trastornos neuropáticos.
Durante mucho tiempo se pensó que la causa principal de este síndrome era una alteración del SNS. Dicha idea provino de la experiencia clínica demostrada, por la cual muchos pacientes con este síndrome encontraban alivio de su dolor después de la realización de uno o varios bloqueos del simpático. Pero no se consiguió que los clínicos aceptaran, de forma unánime, la presencia de algún criterio diagnóstico particular y, debido a ello, pacientes diagnosticados de este síndrome por un médico no eran ratificados en él por otro médico.
Diagnóstico. Los criterios diagnósticos del SDRC son, fundamentalmente, clínicos. Por ello, se le dividió en 2 tipos, según cuál fuese el tipo de lesión desencadenante del proceso: a) tipo I, que aparece después de una lesión de partes blandas, y b) tipo II, cuyo desencadenante es una lesión nerviosa.
Los SDRC se caracterizan por la presencia de síntomas sensoriales, autónomos y motores precedidos, habitualmente, por una lesión o inmovilización, con un curso clínico normalmente desproporcionado con respecto a la lesión inicial, tanto en la intensidad de los síntomas como en su duración. Ante un paciente aquejado con este síndrome es necesario: a) llevar a cabo una búsqueda exhaustiva de la existencia de una lesión nerviosa; b) evitar (dentro de lo posible) los procedimientos intervencionistas, sobre todo los que no han demostrado una eficacia significativa, y c) nunca se debe descuidar la existencia de un posible origen psicológico del cuadro.
La distribución de los hallazgos es regional, aparecen predominantemente en la parte distal de las extremidades y, según la definición de la IASP, no necesariamente están circunscritos al territorio del nervio periférico.
Los síntomas y signos más importantes son dolor espontáneo o provocado con alodinia e hiperalgesia, asociado (en algún momento del curso clínico) con edemas, cambios en el flujo cutáneo y actividad sudomotora anómala en la región donde aparece el dolor. Suele asociarse con una fuerte alteración de la función motora.
Puede llegar a observarse atrofia de la piel, las uñas y otros tejidos blandos, alteraciones en el crecimiento del vello, pérdida de la movilidad de las articulaciones y, en raras ocasiones, desmineralización ósea.
Formas clínicas. Como se ha indicado, hay 2 formas clínicas distintas, tipo I y tipo II. El diagnóstico diferencial entre ellas se puede hacer teniendo en cuenta los siguientes criterios:
1. Síndrome de dolor regional complejo de tipo I.
— Existencia de un acontecimiento inicial nocivo o una causa de inmovilización.
— Dolor continuo, alodinia o hiperalgesia desproporcionados con respecto a la lesión inicial.
— Evidencia en algún momento del curso clínico de edema, cambios en el flujo sanguíneo cutáneo o actividad sudomotora anómala en el área del dolor.
— El diagnóstico queda excluido ante la presencia de alguna afección que pudiese ser la causa de la intensidad del dolor y de la disfunción.
2. Síndrome de dolor regional complejo tipo II.
— Presencia de dolor continuo, alodinia o hiperalgesia tras una lesión en un nervio, no necesariamente limitados al territorio del nervio lesionado.
— Evidencia en el curso clínico de edema, cambios en el flujo sanguíneo cutáneo o actividad seudomotora anómala en el área del dolor.
— El diagnóstico queda excluido ante la presencia de alguna afección que pudiese ser la causa del dolor o la disfunción.
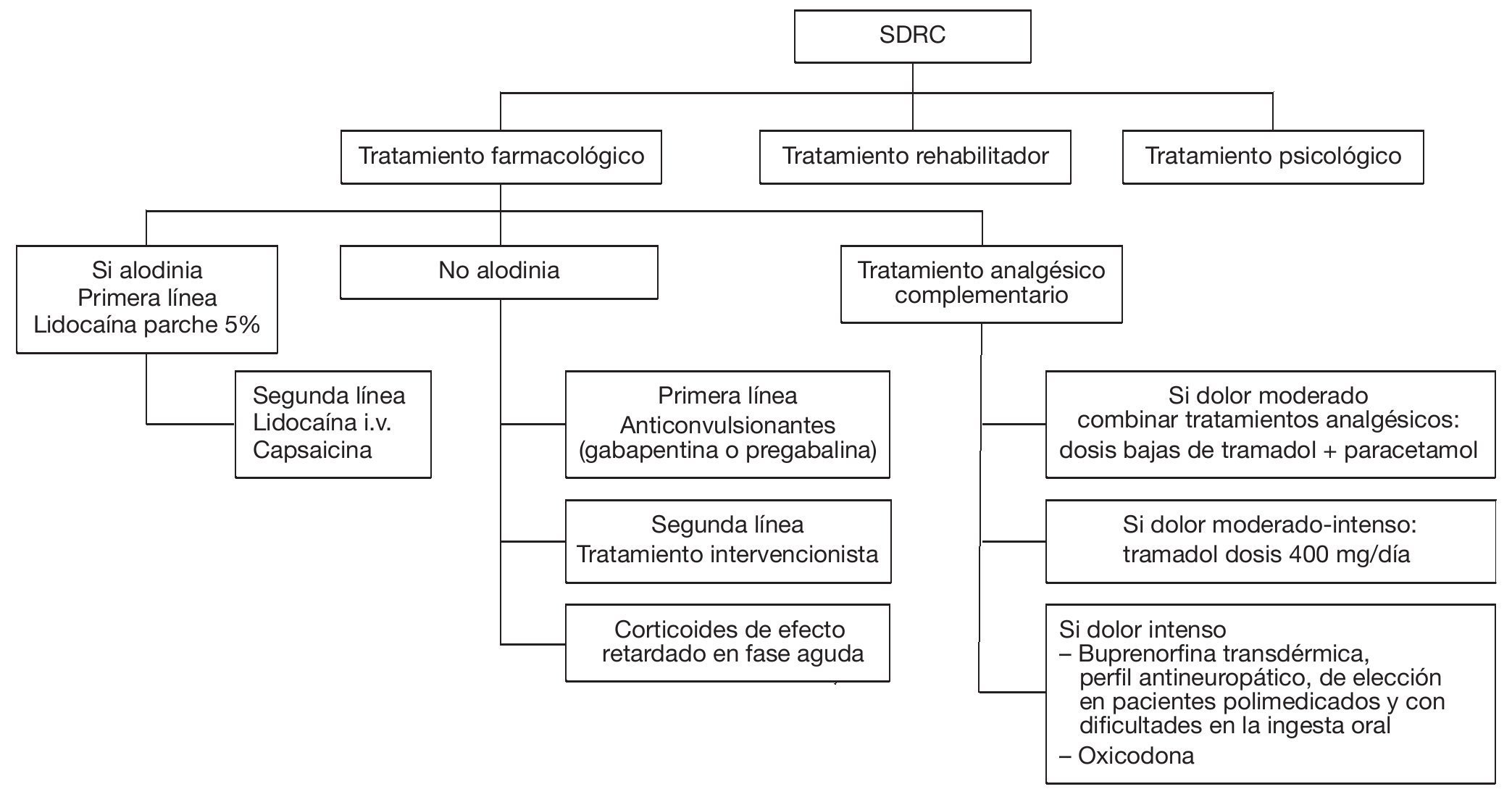
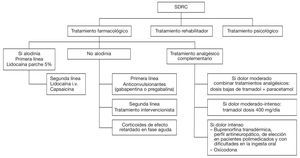
Tratamiento. La mayoría de los estudios sobre tratamiento del DN periférico se han llevado a cabo en 3 indicaciones: NPH, NDD y NT52. Apoyándose en la eficacia demostrada por determinados fármacos en estos tipos de DN, éstos se están utilizando en otros tipos de DN, tanto central como periférico, como: SDRC, dolor lumbar, lesiones medulares, dolor postamputación, etc., en los cuales hay ausencia o debilidad de evidencias acerca de la eficacia de los fármacos55,56. El tratamiento del SDRC también es complejo, ya que es necesario abordar el tratamiento farmacológico al mismo tiempo que el tratamiento rehabilitador. En la actualidad, todavía no hay publicaciones con niveles óptimos de evidencia en el tratamiento farmacológico de este cuadro. Debido a ello, la IASP plantea que el tratamiento farmacológico del SDRC se base en los resultados de los estudios con mejor nivel de evidencia para el tratamiento de la NDD y NPH57.
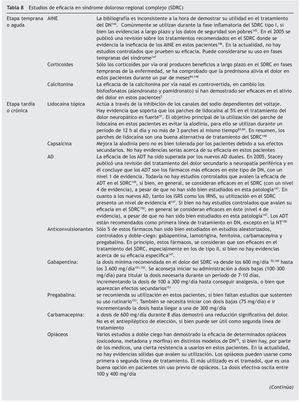
La búsqueda de la revisión para el SDRC dio como resultado los estudios con relación a eficacia que se describen en la tabla 8.
En lo relativo a seguridad de las alternativas farmacoterapéuticas, hoy en día está suficientemente probado que el enfoque del tratamiento del SDRC, tanto del tipo I como del II, debe ser un enfoque multidisciplinario. Se debe iniciar el tratamiento analgésico (que estará en relación con la intensidad del cuadro doloroso) junto con el tratamiento rehabilitador y, finalmente, el psiquiátrico. Este planteamiento debe quedar muy claro para el médico que trate a un paciente con este síndrome, ya que es imposible conseguir una recuperación funcional del paciente si no se hace un enfoque multidisciplinar.
En cuanto al tratamiento farmacológico de estos pacientes, éste se encuentra al revisar la bibliografía que, prácticamente, se han utilizado todo tipo de fármacos sin ajustarse a ningún criterio a la hora de su administración. Con estas recomendaciones, se ha intentado hacer una recopilación de los distintos fármacos que cuentan con un nivel de evidencia suficiente para "recomendar" su utilización en este cuadro doloroso.
Con relación a la valoración de su nivel de seguridad, todos los fármacos "recomendados" en el SDRC ya se valoran en otros apartados, por lo que no se ha considerado necesario volver a hacerlo.
Algoritmos de decisión
Neuralgia postherpética y neuropatía diabética dolorosa
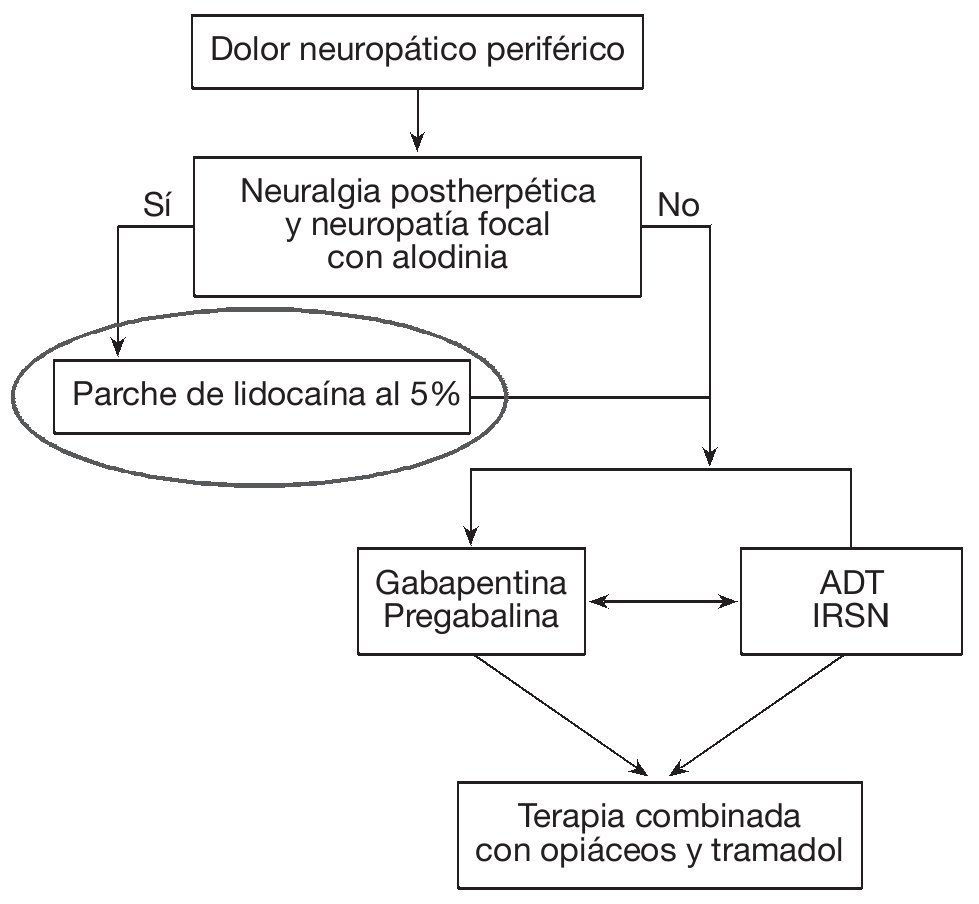
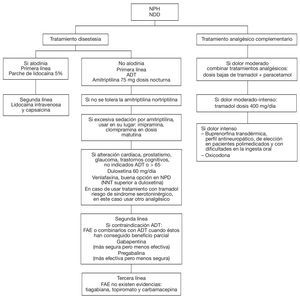
Para tratar el dolor crónico, neuropático, que presentan ambos grupos de pacientes (NPH y NDD) se utilizan estrategias similares (fig. 2).
Figura 2 Algoritmo para el tratamiento de la neuralgia postherpética (NPH) y la neuropatía diabética dolorosa (NDD). ADT: antidepresivos tricíclicos; FAE: fármacos antiepilépticos; NNT: número necesario de pacientes a tratar.
Neuralgia del trigémino
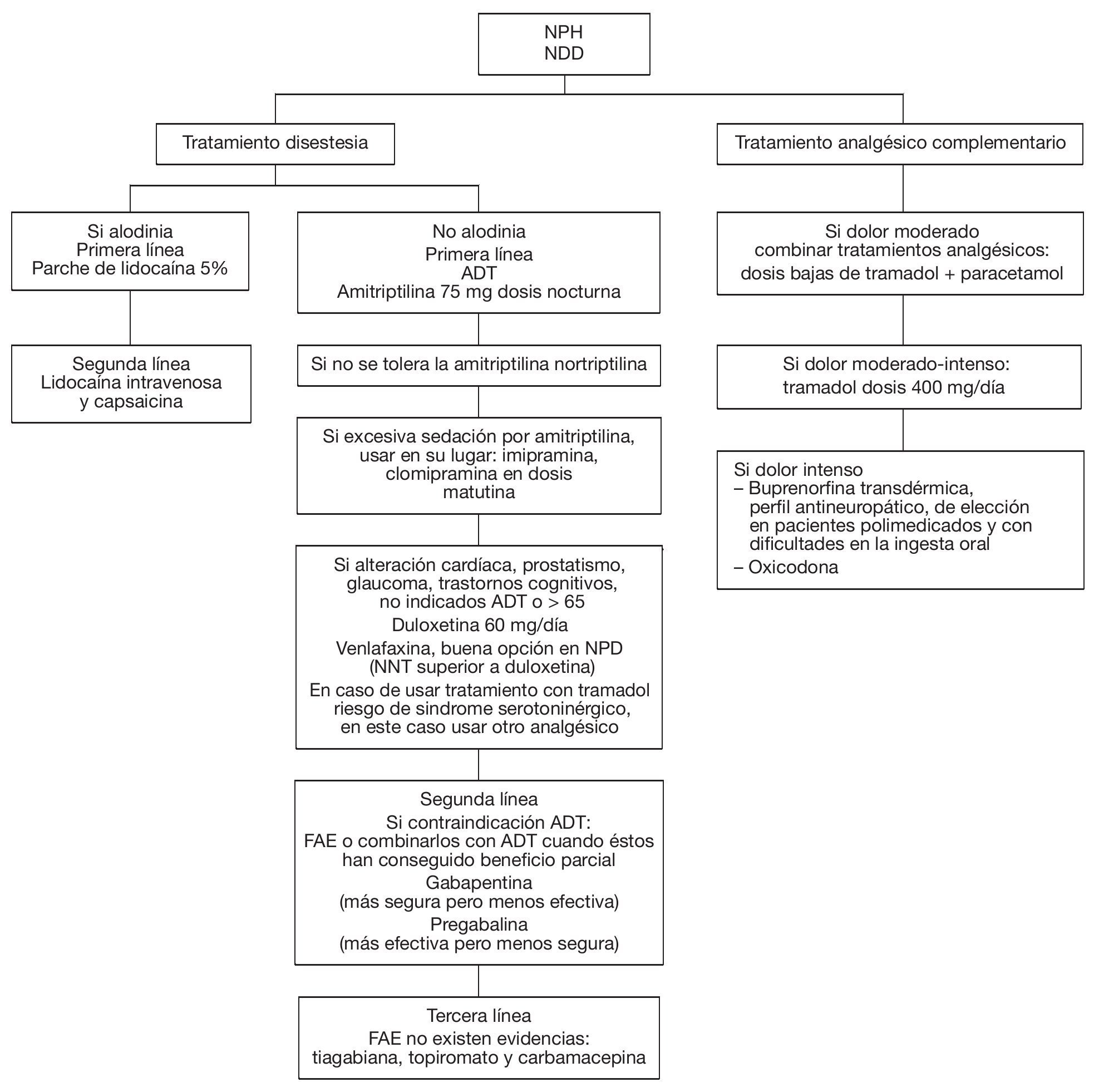
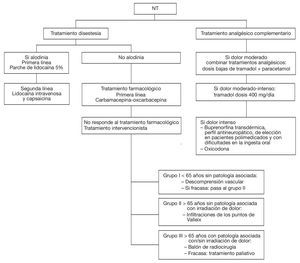
Los 2 fármacos más usados en NT son la carbamacepina (200-1.200 mg/día) (nivel de recomendación A) y la oxcarbacepina (600-1.800 mg/día) (nivel de recomendación B). La oxcarbacepina tiene un menor nivel de evidencia que la carbamacepina. El baclofen y la lamotrigina tienen un nivel de evidencia C. Por lo tanto, se recomendará una primera línea de tratamiento con carbamacepina u oxcarbacepina. No hay evidencias en cuanto a la combinación de fármacos (fig. 3).
Figura 3 Algoritmo para el tratamiento de la neuralgia del trigémino (NT).
Síndrome doloroso regional complejo
Es necesario implicar en profundidad al paciente con SDRC en el tratamiento de su problema y, al mismo tiempo, hacer hincapié en que éste se debe instaurar lo antes posible, de preferencia dentro de los primeros 3 meses después del diagnóstico correcto, si se quiere evitar que hagan su aparición las secuelas que lo acompañan. Dado el polimorfismo y la incertidumbre de su patogenia, es difícil poder establecer un algoritmo terapéutico para esta enfermedad, y eso a pesar de ser una de las que más posibilidades de tratamiento se han propuesto y ensayado. Por lo tanto, es necesario realizar un abordaje terapéutico individualizado y, a ser posible, multidisciplinar, el cual precisará de varias opciones terapéuticas según cuál sea la gravedad del cuadro (fig. 4).
Figura 4 Algoritmo para el tratamiento del síndrome del dolor regional complejo (SDRC). i.v.: intravenosa.
Dolor neuropático de origen central (fig. 5)
Figura 5 Algoritmo para el tratamiento del síndrome del dolor neuropático de origen central (DNOC). AD: antidepresivos; ADT: AD tricíclicos.
Conclusiones
— Establecer correctamente tanto el diagnóstico como la evaluación del DN.
— Una vez establecido el diagnóstico correcto, tratar la causa desencadenante del dolor, siempre que ello sea posible.
— Identificar todas las situaciones que, de una u otra forma, puedan influir en el tratamiento a seguir: fármacos y dosis adecuadas.
— Establecer con el paciente unas expectativas reales a conseguir, explicándole tanto el diagnóstico como las posibilidades reales de tratamiento.
— Los ADT, los inhibidores de la recaptación de serotoninanoradrenalina, los ligandos de los canales de calcio alfa2-delta y la lidocaína tópica han demostrado su eficacia en el tratamiento de distintos tipos de DN; por lo tanto, se pueden considerar como primera línea de tratamiento farmacológico.
— En los pacientes en los que con la administración de esta primera línea de fármacos, solos o en combinación, no se obtenga un alivio suficiente del dolor, es aconsejable la administración de una segunda línea de fármacos, como el tramadol y los opiáceos potentes. Se pueden administrar solos o en combinación con los fármacos de primera línea.
— Los pacientes cuyo dolor no responda de una forma adecuada a la administración, sola o en combinación, de los fármacos de primera y segunda líneas, son susceptibles de la utilización (en ellos) de diversas técnicas invasivas recomendadas en el tratamiento del DN. Para ello, es conveniente que estos pacientes sean derivados a centros especializados en este tipo de tratamiento (unidades de tratamiento del dolor).
— Es muy importante que el médico asuma que con las distintas líneas de tratamiento existentes en la actualidad, sólo es posible conseguir un control adecuado del dolor en el 60% de los pacientes que inician tratamiento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico:
jr.escalada@telefonica.net (J.R. González-Escalada)
Recibido el 1 de julio de 2009;
aceptado 1 de octubre de 2009