Los analgésicos opioides son uno de los pilares fundamentales en el tratamiento farmacológico del dolor moderado-grave, especialmente en el dolor crónico oncológico1. Tras la presentación en 1986 de la escalera analgésica por parte de la Organización Mundial de la Salud (OMS), se ha podido observar que, en el 87% de los pacientes con dolor crónico grave, éste se puede controlar de forma adecuada, lo que ha dado un gran impulso a los tratamientos con opioides. Además, es un grupo de fármacos que presenta como ventaja la ausencia de techo analgésico, es decir, a mayor dosis, mayor eficacia analgésica.
En el tratamiento del dolor moderado-grave oncológico, la morfina sigue siendo el fármaco de referencia (gold standard) debido a su disponibilidad a nivel global, a su demostrada experiencia clínica y al conocimiento de su farmacocinética y farmacodinamia2.
Sin embargo, en determinados pacientes no se logra un control analgésico adecuado, a pesar de utilizar dosis elevadas, o bien aparecen efectos secundarios intolerables antes de conseguir un grado efectivo de analgesia. Por ello, el clínico necesita disponer de uno o varios fármacos dentro del grupo de los opioides como alternativa a la morfina con los que poder realizar una rotación de opioides.
A pesar de no conocerse con exactitud los mecanismos fisiológicos implicados en la rotación de opioides, el cambio de un fármaco opioide por otro puede permitir un control analgésico adecuado o una disminución de los efectos adversos ligados a este grupo farmacológico3-5. En estas situaciones, la hidromorfona, un agonista opioide semisintético, puede ocupar un lugar como alternativa a la morfina en el control del dolor moderado-grave.
Historia
La hidromorfona es una cetona hidrogenada de la morfina sintetizada en Alemania en 1921. La primera referencia clínica sobre la hidromorfona se publica en 19266, pero no será hasta 1981 cuando se estudien las propiedades farmacocinéticas y farmacodinámicas de esta molécula7. La hidromorfona está incluida en las guías de práctica clínica para el tratamiento del dolor oncológico y es un fármaco bien estudiado como analgésico postoperatorio8. Se trata de un opioide que se administra tanto por vía enteral como por vía parenteral. Se la denomina con diferentes nombres genéricos, como dihidromorfinona, dihidromorfona, hidromorfinona e hidromorfona.
Está comercializada como Dilaudid® en Estados Unidos (Knoll pharmaceutical, Whippany, NJ) y Canadá (Knoll pharmaceutical, Whippany, NJ). El Dilaudid® se presenta en ampollas con diferentes concentraciones de principio activo (1 mg/ml, 2 mg/ml, y 4 mg/ml) y una presentación HP® (high potency) de 10 mg/ml, por vía enteral se presenta en tabletas de liberación inmediata de 2 mg, 4 mg y 8 mg y cápsulas de liberación controlada de 3 mg, 6 mg, 12 mg, 18 mg, 24 mg y 30 mg disponibles en Canadá. Asimismo, hay numerosas presentaciones de hidromorfona genérica. En el Reino Unido se prescribe como Palladone® (Napp, Laboratories, Cambrigde), Dilaudid-atropina® en Suiza y Suecia, y recientemente en España en preparados de liberación sostenida Jurnista® (Janssen-Cilag).
Este sistema utiliza la tecnología osmótica de liberación sostenida OROS-Push-Pull® (ALZA Corporation, Montain View, CA), la cual permite liberar el principio activo de forma continua durante las 24 horas. Las presentaciones son de 4 mg, 8 mg, 16 mg y 32 mg; la presentación de 64 mg y los preparados de liberación inmediata no se encuentran actualmente comercializados en España.
Farmacocinética
La molécula de la hidromorfona es estructuralmente muy similar a la morfina, y difiere de ésta en la presencia de un grupo 6-hidroxilo y la hidrogenación del doble enlace 7-8 de la molécula9,10.
Se une principalmente a los receptores opioides μ y en menor grado a los receptores δ, sin presentar efectos en los receptores κ. La unión a receptores tipo u es la causa del efecto analgésico, así como de la aparición de efectos secundarios, entre los que se encuentran estreñimiento, náuseas, vómitos, prurito, depresión respiratoria y tolerancia. Asimismo también puede originar retención urinaria, euforia, miosis y dependencia11,12.
Absorción
La administración del fármaco por vía oral produce una absorción de modo bifásico en la zona proximal del intestino delgado, una fase inicial de absorción rápida (aproximadamente de 2 horas), seguida de una segunda fase de absorción más lenta. Las concentraciones plasmáticas tras una dosis vía oral son de la décima a duodécima parte de la misma dosis administrada por vía intravenosa13.
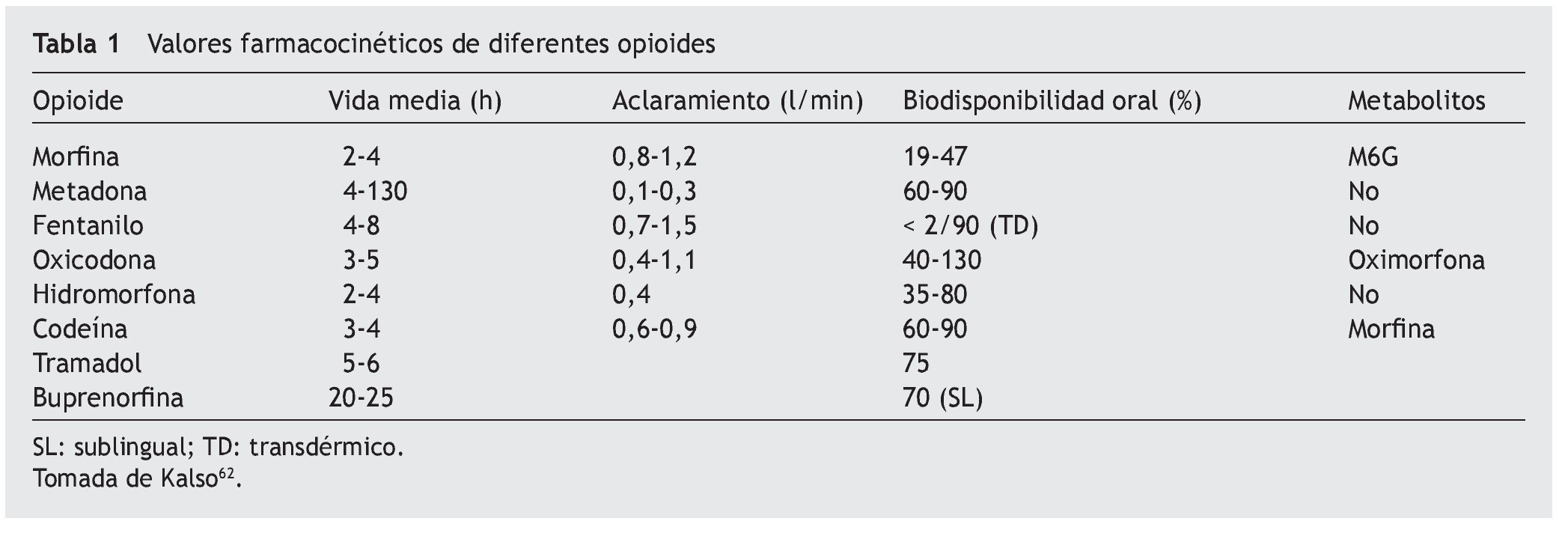
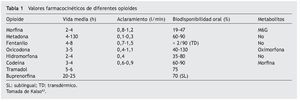
La biodisponibilidad de la hidromorfona es baja debido a su metabolización en el ámbito hepático, de aproximadamente un 62%, aunque presenta una gran variabilidad interindividual, entre el 10 y el 65%14. Esta variabilidad en el grado de metabolización dificulta la determinación de la dosis equipotente por vía oral-parenteral (tabla 1).
Por vía enteral, la hidromorfona puede administrarse como presentación de liberación inmediata o como liberación controlada. El inicio de acción de las presentaciones de liberación inmediata es aproximadamente de 30 minutos con una duración de unas 4 horas, mientras que para las presentaciones de liberación controlada la duración del efecto es de entre 12 y 24 horas, según la formulación. La biodisponibilidad de las fórmulas de liberación controlada es de un 90% de la biodisponibilidad de la presentación de liberación inmediata, por lo que no se precisa conversión entre ambas formulaciones15-17.
Por vía parenteral (intravenosa, intramuscular o subcutánea), la hidromorfona presenta una relación equianalgésica frente a la vía oral de 1:518. El inicio de la analgesia comienza a los 5 minutos de la administración intravenosa, alcanzando el máximo efecto entre los 8 y los 20 minutos19. La disponibilidad tras la administración subcutánea es de un 78% de la dosis intravenosa20. Se trata de un agonista opioide 10 veces más liposoluble que la morfina, por lo que tendrá un inicio de acción más rápido que ésta. Este fármaco puede prepararse en soluciones altamente concentradas (más de 100 mg/ml) permitiendo infundir altas dosis de hidromorfona subcutánea en un volumen menor que la morfina subcutánea21.
Por vía epidural, la hidromorfona presenta una relación equianalgésica de 1:2 frente a la vía parenteral. La duración de acción tras la administración epidural es variable, según diferentes estudios está comprendida entre 7,7 y 19,3 horas22,23, pudiendo ser más prolongada en caso de administrarse conjuntamente con epinefrina24.
Otras vías de administración, como rectal, oral transmucosa, sublingual o transdérmica, presentan una utilización menor debido a su absorción errática, influida por factores como el pH del medio y la superficie de absorción (tabla 2).
Metabolización y eliminación
A pesar de presentar escasas diferencias químicas respecto a la molécula de la morfina, las variaciones que presenta la hidromorfona afectan de manera particular a la metabolización de ésta.
La morfina se metaboliza en el ámbito hepático principalmente en morfina-3-glucurónido, morfina-6-glucurónido y normorfina. Otros metabolitos de la morfina están presentes en menor concentración, entre ellos la morfina-3-sulfato. La morfina-3-glucurónido no presenta actividad analgésica, pero sí una gran actividad neuroexcitatoria. Los metabolitos normorfina y el 6-glucurónido tienen capacidad analgésica, y si se produce una acumulación excesiva de éstos, por ejemplo en situaciones de fallo renal, pueden causar depresión respiratoria y otros efectos adversos25-27.
La hidromorfona se metaboliza principalmente en dihidroisomorfina glucurónido e hidromorfona-3-glucurónido (H-3-G). Este último tiene un efecto neuroexcitatorio 2,5 veces más potente que la morfina-3-glucurónido. La acumulación de H-3-G en altas concentraciones puede causar náuseas28, delírium29 y otros efectos adversos. A diferencia de la morfina, la hidromorfona no se metaboliza en 6-glucurónido (actividad analgésica). Los diferentes metabolitos de la hidromorfona se eliminan por vía renal. Después de administrar una dosis única de hidromorfona, ésta se excreta por vía renal en forma de H-3-G en un 35%, sin metabolización en un 6%, como dihidroisomorfina en un 1 y en un 0,1% en forma de dihidromorfina30.
Vías de administración
En situaciones en las que se quiera administrar hidromorfona por vía enteral, disponemos de fórmulas de liberación inmediata y de liberación sostenida. Actualmente en España no está disponible la formulación de liberación inmediata. Los pacientes que presentan varias enfermedades de base además de la enfermedad dolorosa, necesitan tomar una gran cantidad de fármacos junto con los analgésicos, por lo que la adherencia al tratamiento puede estar disminuida31. En estos casos puede ser más conveniente el uso de formulaciones de liberación controlada, ya que proporcionan concentraciones plasmáticas eficaces durante más tiempo y minimizan las fluctuaciones de éstas, con lo que se evita la aparición de dolor irruptivo32.
El término liberación modificada define a las especialidades farmacéuticas en las que se ha modificado el lugar o la velocidad a los que se libera el principio activo. La liberación modificada agrupa 2 sistemas diferentes: la liberación retardada y la controlada. En la liberación retardada el fármaco es liberado en un momento distinto al de la administración, pero no se prolonga el efecto terapéutico. En la liberación controlada, el fármaco se libera gradualmente en el tiempo a una velocidad limitada por el sistema de liberación, alargándose el efecto terapéutico. Incluye las formas de liberación prolongada y sostenida. En la liberación prolongada el principio activo se libera inicialmente en proporción suficiente para producir su efecto y luego de forma más lenta, no necesariamente constante, manteniendo la concentración eficaz durante más tiempo. En la liberación sostenida el fármaco se libera a una velocidad constante, disminuyendo la fluctuación de los valores plasmáticos, dentro de este tipo se encuentran las llamadas bombas osmóticas, sistema OROS®33.
La hidromorfona se encuentra disponible en presentaciones de liberación controlada durante 12-24 horas y su eficacia clínica y su seguridad se han comparado con las formulaciones de liberación inmediata en pacientes con dolor crónico de origen oncológico34. Se han comercializado 2 preparaciones de hidromorfona de liberación durante 24 horas que utilizan un sistema de liberación diferente, el sistema OROS® y el sistema Palladone®, aunque la farmacodinamia y los resultados clínicos entre las 2 parecen ser similares.
El sistema OROS® utiliza la tecnología osmótica Puhs- PullTM, la cual consiste en un núcleo y una membrana semipermeable que lo recubre. El núcleo está divido en 2 compartimentos: a) uno en el que se localiza el principio activo, y b) otro con agentes osmóticos que actúan de émbolo de éste. La membrana del compartimento que contiene el principio activo presenta un orificio para la liberación del fármaco. En el tracto gastrointestinal, el agua atraviesa la membrana semipermeable a un flujo constante y origina la formación de una suspensión de hidromorfona y la expansión de la capa osmótica, desplazando el principio activo hacia el exterior. Este mecanismo de liberación es independiente del pH del medio y de la motilidad gastrointestinal. Esta tecnología también se ha evaluado con otros fármacos, como albuterol, verapamilo y nifedipino.
La farmacocinética de la hidromorfona de liberación sostenida con el sistema OROS® se ha establecido en diferentes estudios35. Este sistema permite liberar la hidromorfona a velocidad constante y obtener valores terapéuticos del fármaco mantenidos en el tiempo36.
El sistema Palladone® consiste en una cápsula de liberación modificada que puede administrarse mediante gránulos en la comida o a través de una sonda nasogástrica, si fuera necesario. Tras una única dosis, se aprecia un nivel plasmático inicial al cabo de 2 horas, y posteriormente un segundo pico plasmático de aparición más tardía que dura 18-24 horas. Los valores plasmáticos estables se alcanzan al cabo de 3 días37. El sistema de liberación Palladone® se ha retirado del mercado estadounidense por la propia empresa en julio del 2005, debido a que puede dar lugar a una reacción potencialmente fatal si se toma el fármaco con alcohol o medicamentos que lo contengan. Provoca una liberación acelerada del principio activo y produce un aumento de las concentraciones plasmáticas de éste, con el consiguiente riesgo de depresión respiratoria, coma e incluso fallecimiento del paciente38.
Dosis
La hidromorfona puede administrarse por diferentes vías, tanto para el dolor agudo (moderado-grave) como para el crónico. Por vía intravenosa se inicia el tratamiento con 0,2-0,6 mg/2-3 horas; los pacientes que previamente están en tratamiento con opioides pueden tolerar dosis más elevadas. Se puede administrar en infusión continua a 0,5-1 mg/horas (peso medio de 70 kg) o a 7-15 μg/kg/horas, en el dolor postoperatorio en forma de analgesia controlada por el paciente (PCA) en bolos de 0,1-0,2 mg (rango de 0,05-0,5 mg) con un intervalo de cierre de 5-15 minutos y un límite de dosis en 4 horas de 4-6 mg.
Por vía epidural, bolos de 1-1,5 mg, en PCA a una infusión de 0,04-0,4 mg/horas (peso medio de 70 kg), bolos de 0,15 mg y un intervalo de cierre de 30 minutos.
La vía intramuscular y la subcutánea producen una absorción más variable con un efecto pico más tardío que por vía intravenosa; la dosis inicial es de 0,8-1 mg/4-6 horas en un rango de 1-2 mg/3-6 horas. Por vía rectal son necesarios 3 mg/4-8 horas.
El tratamiento por vía oral se inicia con 2-4 mg/3-6 horas, en un rango de 2-8 mg/3-4 horas, hay que tener en cuenta que los pacientes ancianos o más debilitados pueden requerir dosis menores y, por lo contrario, aquéllos con una exposición previa a opioides pueden necesitar dosis más elevadas. El requerimiento de hidromorfona se establece titulando la dosis del fármaco por vía parenteral o por vía oral mediante una presentación de liberación inmediata que está indicada tanto para el dolor agudo como para el dolor irruptivo. Una vez conseguida la analgesia adecuada, en los pacientes con dolor crónico en los que se prevé un uso continuado del fármaco, se puede, mediante un factor de conversión, pasar a hidromorfona de liberación sostenida39. Los pacientes con dolor crónico pueden requerir fármacos contra el dolor irruptivo en preparaciones de liberación inmediata (morfina o hidromorfona), las dosis son el 10-25% de la dosis de hidromorfona en 24 horas.
Respeto a las dosis pediátricas, en niños mayores de 6 meses y con un peso menor de 50 kg: por vía oral son 0,03-0,08 mg/kg/3-4 horas, y por vía intravenosa, 0,015 mg/ kg/3-6 horas. En niños mayores de 12 años se utilizan dosis como en los adultos, de 1-2 mg/3-4 horas40.
Farmacodinamia
Las acciones farmacológicas de la hidromorfona son las derivadas de la acción en los receptores opioides, tanto a nivel del sistema nervioso central, como periférico. La acción más importante es la analgesia por activación de receptores μ y δ, tanto a nivel supraespinal como espinal.
Los efectos secundarios son similares a los producidos por la morfina a excepción del prurito, la sedación y las náuseas/vómitos que ocurren con menos frecuencia (tabla 3). La aparición de prurito es mayor tras la administración de hidromorfona por vía epidural que por vía oral o parenteral41.
En el ámbito gastrointestinal, el estreñimiento es el efecto adverso más frecuente para el cual no se desarrolla tolerancia o bien aparece de forma más tardía42. La incidencia de náuseas y vómitos es del 9% por vía epidural43 frente al 17-35% que presenta la morfina epidural44. La incidencia es ésta sí se administra vía intravenosa, pero es menor por vía oral o rectal45. Asimismo, la hidromorfona disminuye la secreción ácida gástrica, la secreción de somatostatina pancreática y la motilidad gastrointestinal. Puede originar cólicos biliares por contracción del esfínter de Oddi. La sedación secundaria a la administración de hidromorfona ocurre por inhibición de la descarga neuronal del locus coeruleus (noradrenalina).
Respecto al tratamiento con hidromorfona, se debe tener especial precaución en determinadas situaciones, con diferentes enfermedades y en diversos grupos de población.
Así, el fármaco produce depresión del sistema nervioso central, por lo que puede alterar las habilidades físicas y mentales junto con el estado de alerta, por lo cual se debe extremar el cuidado al desarrollar actividades como conducir o trabajar con maquinaria. En pacientes hipovolémicos, con enfermedades cardíacas o en tratamiento con fármacos hipotensores (fenotiacinas), puede producir hipotensión o, en su caso agravarla. En situaciones de insuficiencia adrenal, enfermedad de Addison y disfunción tiroidea, se ha de utilizar con precaución. Puede producir espasmos del esfínter de Oddi, como otros opioides, por lo que se ha de tener cuidado en pacientes con pancreatitis aguda y disfunciones del tracto biliar. También produce retención urinaria en pacientes con hiperplasia prostática o con obstrucción del tracto urinario.
Se ha de ajustar las dosis en pacientes con obesidad mórbida, insuficiencia hepática o renal y en pacientes con enfermedad pulmonar obstructiva crónica o enfermedades pulmonares restrictivas como cifoescoliosis, debido a que los valores plasmáticos del fármaco pueden elevarse y aparecer efectos secundarios graves, como sedación y depresión respiratoria.
Produce un aumento de la presión intracraneal (PIC), por lo que se debe extremar la precaución al utilizarla en traumatismos craneoencefálicos o pacientes con un aumento de la PIC. También se han descrito mioclonías y convulsiones a dosis elevadas.
Se ha de disminuir la dosis en pacientes ancianos o debilitados por el mayor potencial de la aparición de efectos secundarios graves. Está contraindicada en pacientes con hipersensibilidad a la hidromorfona o bien componentes de la formulación, también en pacientes con reacciones de hipersensibilidad a agonistas opioides derivados del fenantreno (codeína, hidrocodona, levorfanol, oxicodona, oximorfona).
Hay una alerta por parte del Institute for Safe Medication Practices que incluye a la hidromorfona entre los fármacos con un riesgo alto de causar daños significativos al paciente por errores en su administración. Se indica la necesidad de tomar extrema precaución para evitar confundir la solución altamente concentrada Dilaudid HP® con la menos concentrada Dilaudid®. Además, Dilaudid® puede confundirse con Demerol® (dolantina) o Dilantin®, en los países en los que se comercialice la presentación parenteral. También señalan que la hidromorfona puede confundirse con el sulfato de morfina y que se han producido casos de sobredosis debido a la administración de hidromorfona en vez de sulfato de morfina, como consecuencia de su parecido o bien de su almacenamiento conjunto. Debemos tener en cuenta que las dosis equianalgésicas de morfina frente a hidromorfona son de 1/5-1/7,539.
Interacciones farmacológicas
La administración de hidromorfona junto con inhibidores de la monoaminoxidasa puede producir excitación o depresión del sistema nervioso central, así como hipotensión o hipertensión. Los anestésicos inhalatorios, como halotano, metoxifluorano y óxido nítrico que disminuyen el flujo sanguíneo hepático, pueden a su vez disminuir la metabolización de la hidromorfona.
La cimetidina puede potenciar la acción de los fármacos opioides por alteración del flujo sanguíneo hepático y/o por efecto en la excreción de éstos.
Las anfetaminas pueden aumentar el efecto analgésico de los opioides. La hidromorfona potencia los efectos depresores en el sistema nervioso central del alcohol y de otros fármacos que actúan en él. También aumenta el efecto serotoninérgico de los antidepresivos inhibidores selectivos de la recaptación de serotonina (fluoxetina, paroxetina) con el peligro de producir un síndrome serotoninérgico39.
Para mayor información sobre incompatibilidades descritas, pueden consultarse las referencias siguientes46-48.
Indicaciones clínicas
Quigley49 ha revisado las propiedades analgésicas de la hidromorfona, tanto para el dolor agudo como el dolor crónico oncológico y no oncológico, para la Cochrane Database of Systematic Review y, posteriormente, el mismo autor en una nueva revisión en la que se incluían 5 artículos más50. En la última revisión se analizan 48 artículos (3.510 participantes) la mitad de los cuales se consideraron artículos de baja calidad metodológica. Además, los estudios presentan una gran heterogeneidad: así, 12 se refieren a dolor crónico y 36, a dolor agudo. La hidromorfona se compara con placebo, con otros opioides, con anestésicos locales (como bupivacaína) y respecto a sí misma usando diferentes formulaciones. También se utilizan diferentes rutas de administración, como intravenosa, oral, espinal, intramuscular y subcutánea. Respecto a las conclusiones, los autores resaltan que la hidromorfona es un analgésico potente, sus acciones farmacológicas son dependientes de la dosis y los efectos adversos son similares a otros opioides, aunque sigue considerando a la morfina como tratamiento de referencia.
En el tratamiento del dolor agudo, la evidencia clínica demuestra que la hidromorfona presenta una equivalencia analgésica similar a otros opiodes. Administrada por vía parenteral, la relación entre la morfina y la hidromorfona varía según los estudios entre 5:1 y 7:151,52. En cuanto a la aparición de efectos adversos, las náuseas, el prurito y la sedación son los más frecuentes y se tratan de efectos dependientes de la dosis. Pese a que la mayoría de los estudios revisados no encuentran diferencias significativas entre los efectos adversos de la hidromorfona y la morfina, hay 2 estudios que describen una incidencia menor de prurito después de administrar hidromorfona53,54.
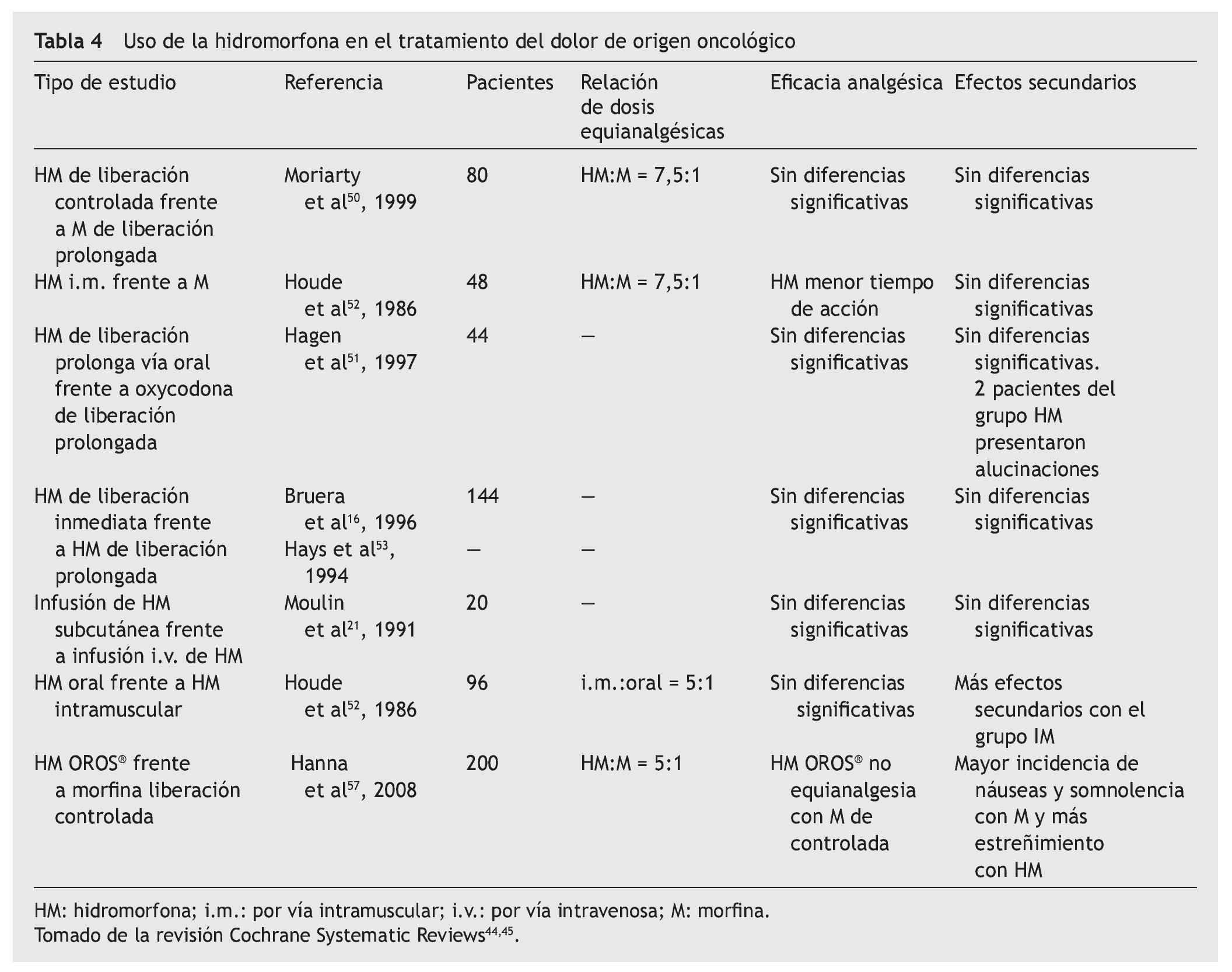
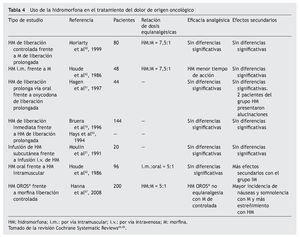
El papel de la hidromorfona en el tratamiento del dolor oncológico se ha evaluado en varios estudios frente a otros opioides y con diferentes formulaciones, y se ha observado que se trata de un fármaco equivalente a la morfina en cuanto a eficacia analgésica. En 1999, Moriarty et al55 realizaron un estudio prospectivo, aleatorizado, doble ciego, en el que se comparaba la administración de hidromorfona de liberación controlada frente a morfina de liberación controlada en 100 pacientes adultos con dolor oncológico, sin que se observaran diferencias significativas en cuanto a la intensidad del dolor y a la aparición de efectos adversos. En otro estudio, Hagen y Babul56 comparan hidromorfona frente a oxicodona de liberación prolongada en 44 pacientes oncológicos y no encuentran diferencias significativas entre los 2 fármacos respecto a la analgesia o los efectos secundarios. Bruera et al16 obtuvieron resultados similares al comparar la acción de la hidromorfona de liberación inmediata y la de liberación prolongada en 144 pacientes con dolor de origen oncológico (tabla 4).
En un estudio aleatorizado, prospectivo y doble ciego, Hanna et al57 comparan la equivalencia de dosis de la hidromorfona OROS® frente a la morfina de liberación retardada en el tratamiento del dolor crónico oncológico. Participan 200 pacientes que reciben morfina o hidromorfona de liberación inmediata durante 2-9 días y luego se convierten a formulaciones de liberación sostenida. En el estudio se demuestra que la hidromorfona es equivalente a la morfina de liberación inmediata para el alivio del dolor de origen oncológico, equivalencia que no se demuestra para la formulación OROS® con un factor de conversión 5:1. La hidromorfona mostró superioridad respecto a la morfina en la variable "el peor dolor experimentado en las últimas 24 horas" del inventario breve del dolor. También mostró una incidencia mayor de náuseas, vómitos y somnolencia junto con menor estreñimiento que la morfina.
En el tratamiento del dolor crónico no oncológico, no hay ensayos clínicos controlados que otorguen evidencia científica a la hidromorfona en estos pacientes. Sin embargo, múltiples publicaciones abogan por el uso de opioides en el tratamiento del dolor crónico no oncológico, lo cual hace pensar que la hidromorfona puede ejercer una acción similar a la morfina, a la oxicodona y al resto de agonistas opioides en estas situaciones. En un estudio multicéntrico, abierto, que englobaba a pacientes con dolor crónico oncológico y no oncológico (81,9%), se obtiene un alivio eficaz del dolor utilizando un coeficiente de conversión 5:1 de la dosis equivalente de morfina oral a hidromorfona de liberación sostenida OROS®36. Se observó un descenso en la media para la intensidad del dolor y mejora en la calidad de vida relacionada con la salud medida con el Brief Pain Inventory (BPI) respecto al tratamiento previo. Respecto al dolor lumbar crónico, en un estudio multicéntrico, abierto y no aleatorizado que incluía a 207 pacientes, se sustituyó el opioide previo por hidromorfona OROS® utilizando un coeficiente de conversión de 5:1, y se obtuvo un efecto analgésico adecuado. También se pudo apreciar un descenso en el grado de interferencia del dolor en las actividades físicas y sociales de la vida diaria58. Para finalizar, en un estudio abierto, aleatorizado, de grupos paralelos y multicéntrico, que incluía a 138 pacientes, se comparó la eficacia analgésica y la seguridad de la hidromorfona de liberación sostenida OROS® con la oxicodona en pacientes con dolor asociado a la artrosis de cadera y rodilla y tratados con antiinflamatorios no esteroideos59. Durante el período de tratamiento de 6 semanas, se apreciaron valores analgésicos similares con ambos opioides. En el grupo tratado con hidromorfona de liberación prolongada, se apreció una mejoría significativa de la calidad del sueño según las escala MOS (Medical Outcomes Study Sleep Measure) y mejoró los índices de funcionalidad, dolor y rigidez medidos por la escala WOMAC (Western Ontario McMaster).
En los pacientes que desarrollan tolerancia o bien presentan efectos adversos no controlados con medicación coadyuvante, puede ser de utilidad realizar una rotación de opioides, y se estima que ocurre entre el 2 y el 3% de los pacientes en tratamiento con opioides60. No se han encontrado ensayos que valoren la hidromorfona OROS® como estrategia de rotación de opioides en los pacientes en los que no se logra una analgesia adecuada con morfina o en los que ésta se ha de suspender por efectos adversos. En el caso de realizar una rotación de opioides, la dosis inicial de hidromorfona se calculará multiplicando la dosis total diaria del opioide por la relación equipotente de éste con la hidromorfona. Tras la dosificación escogida, se requiere un control frecuente del paciente durante los primeros 15 días para valorar la analgesia inadecuada, así como posibles efectos secundarios por el exceso de dosis61.
Conclusiones
La hidromorfona presenta un perfil farmacológico, propiedades analgésicas y efectos secundarios similares a la morfina, aunque todavía persisten ciertas controversias en lo referente a las dosis equianalgésicas entre la hidromorfonamorfina y entre la dosis oral-parenteral.
Hay un nivel de evidencia adecuado en la utilización de la hidromorfona para el tratamiento del dolor agudo y en el dolor crónico oncológico, con un control efectivo del dolor y no hay diferencias significativas respecto a la morfina en el grado de analgesia o en los efectos secundarios.
En la actualidad hay pocos estudios publicados de calidad sobre el papel de la hidromorfona en el tratamiento del dolor crónico no oncológico, aunque la rotación de la morfina por hidromorfona ha presentado un grado de analgesia adecuado y, en algunos estudios, se ha observado una mejoría en la calidad del sueño. Es necesario realizar más ensayos clínicos que estudien la utilización de la hidromorfona en el dolor crónico no oncológico y en la rotación de opioides.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico: franciscodeborja.garciacasal@osakidetza.net (B. García).
Recibido el 15 de marzo de 2009;
aceptado el 15 de junio de 2009