Introducción
El síndrome de dolor miofascial se define como un trastorno osteomuscular que presenta síntomas sensoriales, motores y autonómicos, que son ocasionados principalmente por puntos gatillo (trigger point) musculares activos. Los disturbios sensoriales que se manifiestan son hiperalgesia, disestesia y dolor referido1.
El punto gatillo se define como un punto hiperirritable, entre una banda tensa muscular o en la fascia muscular, el cual es doloroso a la compresión, que puede ser referido y con características de disfunción motora y fenómenos autonómicos (lagrimeo, salivación, cambios en la temperatura de la piel, sudoración, piloerección y trastornos propioceptivos)2.
Hay 2 tipos de puntos gatillo, los activos y los latentes; estos últimos son los más comunes.
El dolor que se relaciona con una contracción muscular excesiva o involuntaria puede estar ocasionado por una gran variedad de condiciones clínicas, algunas de las cuales se asocian a trastornos del movimiento o a padecimientos en donde el dolor y el espasmo muscular son los únicos síntomas, entre los que se encuentran problemas oteomusculares dolorosos, como el síndrome de dolor miofascial, lumbalgias, disfunción temporomandibular y el dolor cervicotorácico3-5.
Además, diversos estudios han sugerido un papel importante en el control de las cefaleas crónicas, como la migraña, la cefalea tensional, la cefalea cervicogénica y la cefalea en racimos6-8.
Hay reportes de la utilización de la toxina botulínica A en algunos síndromes neuropáticos (neuralgia trigeminal, neuralgia postherpética, síndrome doloroso complejo regional tipo I)9-11.
La finalidad del tratamiento debe ser la restauración de la función. La inyección de anestésicos locales o antiinflamatorios esteroideos en los puntos gatillo puede producir un alivio temporal.
Cuando el cuadro doloroso mejora parcialmente con los tratamientos convencionales, se puede considerar la utilización de toxina botulínica tipo A para brindar un beneficio más prolongado, lo cual facilitará la terapia física y, por lo tanto, mejorará la funcionalidad12,13.
Se menciona que un requisito primordial para la utilización racional de la toxina botulínica A en el control del dolor es que el paciente debe tener dolor crónico secundario a un diagnóstico conocido o presumible, para el cual no hay un tratamiento curativo y que éste no ha respondido exitosamente a los diferentes tratamientos antiálgicos conservadores y no invasivos14.
Las neurotoxinas botulínicas son proteínas sintetizadas de la bacteria anaerobia gramnegativa (o grampositiva en cultivos jóvenes) Clostridium botulinum.
Se han identificado 7 neurotoxinas serológicamente distintas: A, B, C, D, E, F, y G, de las cuales 2 están comercialmente disponibles (A y B).
Por lo tanto, el mecanismo clásico de la neurotoxina es la inhibición en la liberación de la acetilcolina de las terminaciones nerviosas periféricas15.
El objetivo de este estudio fue demostrar que el uso de la toxina botulínica tipo A (Botox®) en los pacientes con dolor crónico miofascial en nuestro servicio es efectivo en el alivio del dolor, mejorando la funcionalidad y la calidad de vida en los pacientes.
Material y métodos
El estudio fue aprobado por el Comité de Ética del Centro Médico Nacional 20 de Noviembre ISSSTE y todos los pacientes admitidos firmaron la hoja de consentimiento informado.
El diseño del estudio fue de tipo prospectivo, descriptivo, longitudinal y aleatorio.
Se estudió a un total de 30 pacientes de ambos sexos, que acudieron a la consulta externa del servicio de Clínica del Dolor del Centro Médico Nacional 20 de Noviembre del ISSSTE con diagnóstico de síndrome de dolor miofascial crónico cervical o lumbar de 1 año de evolución, clínicamente con presencia de bandas musculares y/o puntos gatillo, con una respuesta parcial al tratamiento con analgésicos no opiáceos y adyuvantes, sin tratamiento intervencionista previo y con edades comprendidas entre 25 y 50 años de edad.
Se localizaron los puntos gatillo cervicales y lumbares mediante la palpación de éstos, y para la realización del procedimiento de infiltración se utilizó un electrosonomiógrafo (ESMG) (Allergan Inc. Irvine California) con una aguja de 27 G × 37 mm (Botox® injection needle Allergan Inc. Irvine, California), inyectándose el complejo de toxina botulínica tipo A a dosis de 10 Um por punto en región cervical y de 40 Um por punto en región lumbar, con una dosis total 200 a 400 Um, respectivamente (100 a 200 Um por lado afectado). La dilución de las 100 Um de toxina botulínica tipo A se hizo con un volumen de 1 ml de solución salina.
A todos los pacientes se les realizó la técnica de infiltración de músculos superficiales y profundos afectados, localizados por la aguja conectada al ESMG, que al estar en el punto gatillo incrementaba la señal acústica indicando el sitio de aplicación de la toxina.
Se valoró la intensidad del dolor a través de la escala visual analógica (EVA; donde 0 = nada de dolor, 10 = el peor dolor), así como el índice de discapacidad de Oswestry16 (porcentaje de discapacidad del 0 al 100%), el cual valora la capacidad del paciente para realizar sus actividades de la vida diaria. Este cuestionario comprende 10 diferentes subtipos de 6 variables cada uno, en donde cada paciente elige la acción más adecuada para su condición, cada variable esta graduada de 0 (normal) a 5 (más afectado), previo a la infiltración y a la 1.ª, 2.ª, 3.ª, y 4.ª semanas posteriores al tratamiento.
Para el análisis estadístico se utilizaron la prueba comparativa multifactorial de Tuckey, ANOVA, coeficiente de correlación de Pearson y estadística descriptiva, considerando una p < 0,05 para establecer diferencias estadísticas.
Resultados
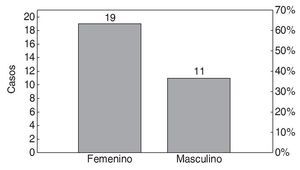
Se incluyó a 30 pacientes en el estudio. Las características demográficas relacionadas con el sexo y la edad se muestran en las figuras 1 y 2.
Figura 1 Histograma: distribución por sexo.
Figura 2 Edad.
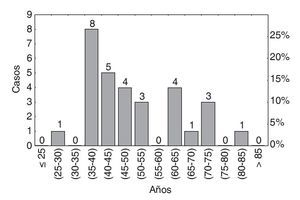
El promedio de edad de los pacientes incluidos fue de 35 ± 5 años (fig. 3).
Figura 3 Histograma: distribución por edad.
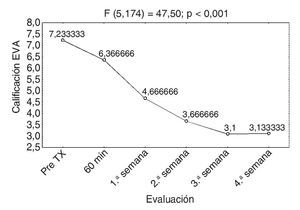
En lo que respecta al control del dolor, el promedio inicial de la EVA fue de 7,23 y al finalizar el estudio de 3,13, con una p < 0,01, estadísticamente significativa (fig. 4).
Figura 4 Respuesta promedio de la escala visual analógica (EVA).
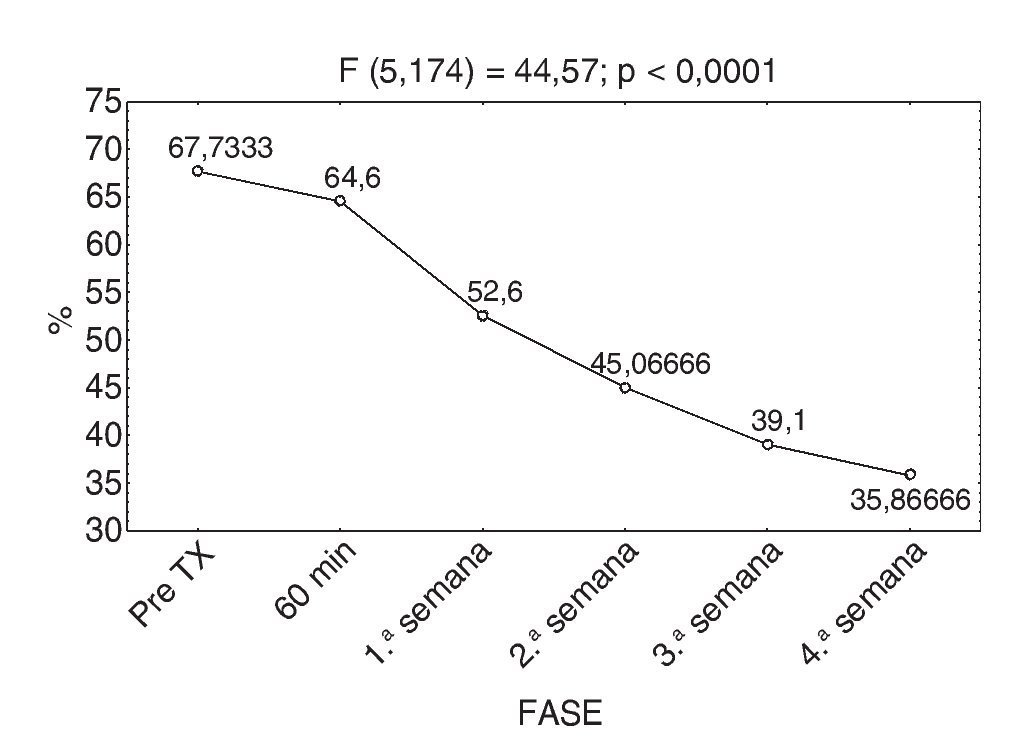
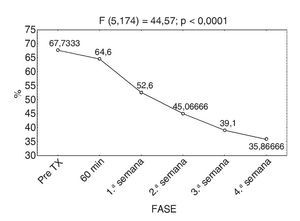
Con relación al índice de discapacidad de Oswestry, la evaluación inicial fue del 67,7% y al término del estudio del 35,8%, con una p < 0,0001, estadísticamente significativa (fig. 5).
Figura 5 Respuesta promedio del índice de Oswestry.
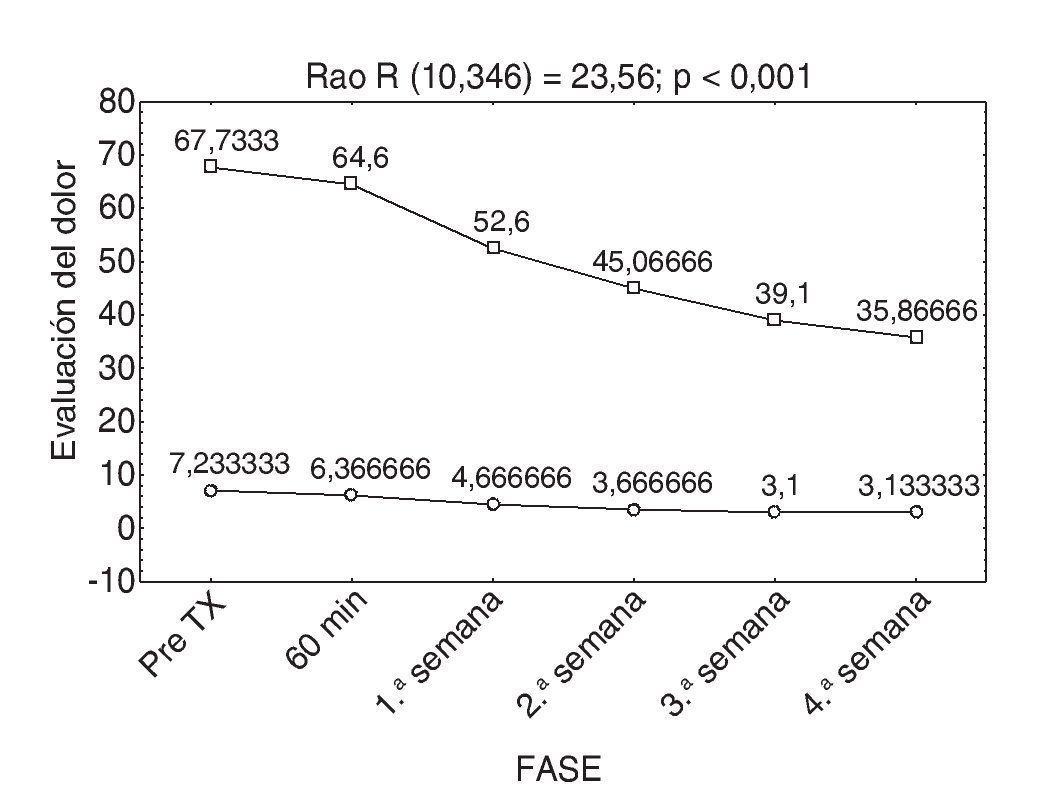
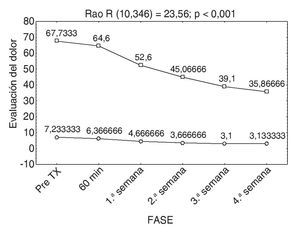
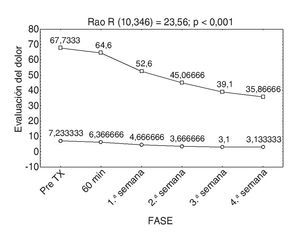
Cabe mencionar que ningún paciente había recibido tratamiento con toxina botulínica y que la disminución del dolor y la mejoría del índice de discapacidad de Oswestry se presentaron a partir de la primera semana posterior a la infiltración de la neurotoxina; esto se debió al inicio de la acción de ésta. Es importante decir que existe una relación estadísticamente significativa en la disminución del dolor y la capacidad funcional de los pacientes infiltrados con la toxina, tal como muestra la figura 6.
Figura 6 Comparación de la Escala Visual Análoga (EVA) y el índice de Oswestry.
El 80% de los pacientes (24) tuvo un período de alivio del dolor somático de 6 meses, el 10% (3) de 4 meses y el 10% (3) de 3 meses.
Es importante citar que al término del estudio los pacientes se enviaron al servicio de medicina física y rehabilitación como parte de la terapia interdisciplinaria.
Únicamente se reportó como complicación dolor en el sitio de infiltración posterior al procedimiento en 30 pacientes (100%).
Discusión
El dolor miofascial es una causa importante de incomodidad en los pacientes con sintomatología dolorosa regional. La prevalencia de dolor miofascial es de aproximadamente el 20% en los pacientes con dolor lumbar crónico, en un 30% de la población que acude a la consulta de primer nivel y superior al 85% en las clínicas del dolor17-19.
Se menciona que hay diversas limitaciones inherentes en el tratamiento farmacológico del dolor miofascial. En primer lugar, éste representa un grupo heterogéneo de trastornos, los cuales tienen su propia fisiopatología; en segundo lugar, hay diferentes mecanismos de nocicepción en estos grupos, y, por último, porque las causas de dolor miofascial son tan amplias como lo son los tratamientos a utilizar.
Es importante considerar que el tratamiento del dolor miofascial debe ser multimodal y multidisciplinario, considerando utilizar tanto métodos no intervencionistas como intervencionistas, como la retroalimentación biológica, el entrenamiento en relajación, la acupuntura y las inyecciones de puntos gatillo20.
Childers21 refiere que el uso de la toxina botulínica en el síndrome miofascial se puede considerar cuando los pacientes no responden a los tratamientos conservadores.
En nuestro estudio hubo una mayor incidencia de dolor miofascial en el sexo femenino (63,3%) en relación con el masculino (36,6%), datos compatibles con los de otros estudios realizados22.
La disminución de la intensidad del dolor valorada de acuerdo a la EVA fue de 7,2 a 3,1 (p < 0,05), la cual se sostuvo durante todo el estudio. Estos resultados fueron similares a los reportados por Foster et al23, De Andrés et al22 y Cheshire24.
Igualmente que en otros estudios realizados22, también se decidió utilizar el cuestionario de Oswestry, el cual ha demostrado ser de gran valor para la evaluación de la discapacidad en el paciente postoperado de columna, así como un factor predictivo en el aspecto laboral25. La escala demostró una disminución estadísticamente significativa, p < 0,05, durante el estudio con los valores de 67,7 a 35,8%.
Comparando ambas escalas (EVA y Oswestry), se observó que a menor dolor menor discapacidad, con esto el resultado se traduce en una mejor calidad de vida de los pacientes y un desarrollo mejor de sus actividades diarias.
Es importante mencionar que se utilizaron volúmenes bajos (100 Um de toxina botulínica A en 1 ml de solución salina) para disminuir el posible riesgo de difusión del medicamento a otros grupos musculares y evitar complicaciones.
Es importante mencionar que otros estudios realizados22, en los que se utilizaron volúmenes mayores, no reportan complicaciones severas, lo que nos habla de un perfil de seguridad importante del medicamento.
También sugerimos la utilización de un equipo de ESMG para la localización del punto gatillo y que se logre una infiltración adecuada y segura de la neurotoxina a volúmenes bajos.
Es importante señalar que la mayoría de los problemas en donde se ha producido control del dolor con la toxina botulínica son padecimientos que producen espasmo muscular importante, aminorándolo debido a su efecto relajante. Dicho efecto produce disminución en la compresión de los vasos sanguíneos por el espasmo, mejorando la isquemia local muscular. Otro posible mecanismo es la activación de nociceptores aferentes, ocasionada por la compresión de un nervio, que al liberarse puede aliviar el dolor. Por último, se menciona que al reducir el espasmo muscular los efectos sobre los husos musculares aferentes (Ias aferentes) mejoran26-28.
Sin embargo, hay datos que sugieren que no sólo la disminución del espasmo muscular explica el alivio del dolor, por ejemplo los trastornos ostemusculares como las distonías, en los cuales el efecto analgésico es en ocasiones más importante que el efecto motor, lo que sugiere una actividad analgésica directa que puede justificar el control de éste en síndromes en los cuales no hay espasmo muscular.
Diversos estudios han demostrado in vitro que hay una disminución en la liberación de neuropéptidos en neuronas del ganglio dorsal en ratas o en músculos del iris de conejo, o sobre los vasos sanguíneos, inhibiendo un cotransmisor de acetilcolina. También se ha discutido que la toxina botulínica A puede actuar en el cordón espinal29-33.
La toxina botulínica A puede reducir la inflamación neurogénica mediante la inhibición de la liberación de neuropéptidos, como la sustancia P y el péptido relacionado con el gen de calcitonina y, por tanto, aliviar el dolor.
Esta reducción en la liberación de neuropéptidos de los nociceptores aferentes primarios mediante la neurotoxina A puede también quitar el entumecimiento y el dolor en condiciones en donde el tejido dañado altera la sensibilidad34.
Esto podría explicar la mejoría del dolor con la administración de la neurotoxina en las cefaleas, incluyendo la migraña.
Varios estudios han evidenciado la inhibición del dolor por proceso inflamatorio con la utilización de toxina botulínica tipo A mediante modelos en ratas induciendo este tipo de dolor con formalina. Los resultados suponen que hay un efecto antinociceptivo mediante la inhibición en la liberación de neuropéptidos de las terminaciones aferentes primarias, así como disminución en la liberación de glutamato.
Por lo tanto, se propone que la neurotoxina A puede bloquear la sensibilización periférica e indirectamente reducir la sensibilización central35,36.
Cabe mencionar que la regulación mediante mediadores inflamatorios en la superficie de los receptores de expresión y de los canales en las terminales de neuronas aferentes nociceptivas puede ser un mecanismo para el desarrollo y el mantenimiento de la hiperalgesia inflamatoria. Se estimularon neuronas del ganglio de la raíz dorsal in vitro, lo que resultó en una expresión aumentada de los receptores vaniloides tipo 1 (TRPV1) en la superficie neuronal y que este incremento de la expresión de los TRPV1 se bloqueó por la toxina botulínica A. Esto puede representar otro mecanismo por el cual la neurotoxina reduciría el dolor inflamatorio, principalmente el desarrollo de la hiperalgesia37.
Conclusiones
Por lo tanto, podemos resumir que el dolor es un fenómeno complejo y que tiene muchos componentes que se deben atender.
Aunque la toxina botulínica A no se considera como un tratamiento de primera elección para el manejo de dolor miofascial crónico, puede ser una opción terapéutica en los casos en que éste es refractario. Además, consideramos de suma importancia iniciar la terapia física en los pacientes a la segunda semana posterior a la infiltración de la neurotoxina, para obtener un mejor alivio de su dolor.
Recientes avances en el entendimiento de la estructura de la neurotoxina y su función han presentado la oportunidad de modificar la molécula para producir nuevas estructuras moleculares que sean capaces de inhibir la función nociceptiva aferente sin efectos sobre otras neuronas, incluyendo las motoras38.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico: semili@avantel.net, aneshams@hotmail.com (J.C. Torres Huerta).
Recibido el 7 de abril de 2009; aceptado el 21 de septiembre de 2009