La osteoartrosis (OA) es la forma más común de artropatía que afecta universalmente a todo grupo étnico1. Su etiología es desconocida, pero los progresos en el conocimiento de su fisiopatología demuestran cambios bioquímicos, estructurales y metabólicos del cartílago articular que conducen a su degradación; proceso en el que son protagonistas las citocinas proinflamatorias2,3. La gonartrosis, u OA de rodilla, es la forma más común y rara vez se presenta antes de los 50 años3. Su incidencia es de 240/100.000 personas/año y la prevalencia es del 30% en los pacientes de 70 años o mayores2. Las limitaciones funcionales y su consiguiente repercusión en la calidad de vida perfilan la expresión clínica de la OA2,4. El dolor es el síntoma predominante, aunque su origen no está totalmente esclarecido5. Éste se atribuye a la deformación del tejido periarticular y hueso subcondral con incremento de la presión intraarticular asociado a la inflamación de la membrana sinovial6. Se acepta que la sinovitis es la vía final común de todas las artropatías7. Además, se
ha demostrado en modelos animales de OA, hiperexcitabilidad del cuerno dorsal espinal (CDE) mediada por la vía glutamato/receptores N-metil-D-aspartato/óxido nítrico (NO)6,8,9. Por otra parte, se ha detectado en humanos un incremento en la concentración de aminoácidos excitatorios y NO en la articulación de la rodilla inflamada6. Estos elementos sugieren la participación de mecanismos periféricos y centrales que conducen a estados de sensibilización en los dolores crónicos articulares6,8.
Específicamente, se ha establecido que el dolor y la impotencia funcional que acompañan al cuadro clínico de la OA de rodilla se asocian a la inflamación del tejido sinovial5. Múltiples estudios con artroscopia han demostrado la presencia de sinovitis en el curso de la OA desde sus fases tempranas, y se ha sugerido el vínculo entre el proceso inflamatorio y la progresión de la degeneración articular5,10. El diagnóstico clínico de la sinovitis de rodilla es empírico y la introducción de las técnicas de imágenes, como la artroscopia, la resonancia magnética (RM) nuclear y el ultrasonido (US) de partes blandas lo soportan con mayor objetividad2,5,11. La ultrasonografía es, además, una técnica no invasiva y de fácil acceso para el estudio de un número importante de pacientes. Ésta permite la determinación de la efusión de líquido, la hipertrofia y morfología de la membrana sinovial y ha sido validada para el estudio de estas enfermedades con resultados comparables a los obtenidos por artroscopia y RM5,11.
Además de los factores epidemiológicos considerados de riesgo en esta entidad, como la edad, el sobrepeso, los traumatismos y los factores genéticos, se ha implicado en la patogénesis de la OA al estrés oxidativo. Las especies reactivas de oxígeno y nitrógeno son importantes mediadores de la cascada inflamatoria y la hiperalgesia2,3,12. Ellas promueven el daño tisular en la articulación a través de la inflamación, por aumento de la presión intraarticular y de la actividad metabólica. Los antioxidantes se han aceptado como otros fármacos con propiedades modificadoras de la sintomatología de la OA. Las dietas antioxidantes ricas en betacarotenos y el consumo de vitaminas C y E protegen contra la progresión de esta enfermedad3,13.
Dentro del grupo de fármacos modificadores de síntomas de acción lenta para el tratamiento de la OA se incluyen productos naturales, como la diacereína y el piascledine, por sus acciones moduladoras sobre la producción de citocinas14. El Vimang® es una marca comercial registrada en Cuba que cubre varios tipos de formulaciones a partir del extracto de la corteza del árbol de mango (ECAM)15-17. Algunas de las formulaciones han sido registradas como suplemento nutricional antioxidante o alimento funcional y están dirigidas a facilitar el restablecimiento del balance redox del organismo humano. Dado el cúmulo de información en el campo básico y clínico que demuestra sus propiedades antioxidantes, analgésicas, antiinflamatorias e inmunomoduladoras, las tabletas Vimang® han sido registradas como medicamento de origen natural para el tratamiento adyuvante de enfermedades con componentes de dolor y/o inflamación17,18. El objetivo del presente estudio fue determinar la actividad analgésica del Vimang® en pacientes portadores de OA de rodilla y la posible mejoría de la capacidad funcional postratamiento. De igual manera, determinar mediante ultrasonografía los efectos del Vimang® en la inflamación sinovial (efusión y proliferación) que se asocia a la entidad.
Material y métodosParticiparon en este estudio, que se desarrolló en el período de abril a julio de 2007, 10 pacientes del Hogar Santovenia. El protocolo se aprobó por el Comité Científico y de Ética de Investigación de la institución y los pacientes dieron su consentimiento informado por escrito. El diseño del estudio se realizó de acuerdo a las Directrices de las Buenas Prácticas Clínicas y la Declaración de Helsinski en lo relativo al consentimiento informado de los pacientes. Los criterios de inclusión consideraron a pacientes de ambos sexos y de edad adulta, que presentaran diagnóstico de OA de rodilla según los criterios del Colegio Americano de Reumatología, de al menos 6 meses de evolución y con evidencia radiológica según los criterios definidos por Kellgren y Lawrence en grados 19,20. Éstos debían presentar puntuaciones diarias medias del dolor (PDMD) de 4 o superiores la semana anterior al inicio del tratamiento. Para estos fines se utilizó una escala de Likert de 11 puntos, donde se consideró 0 no dolor y 10 el peor soportable21. Los criterios de exclusión fueron el consumo de esteroides u opiáceos como parte de su tratamiento el mes previo, otras artropatías asociadas (artritis reumatoide, artritis psoriásica, gota, etc.) o proceso infl amatorio relacionado al traumatismo agudo. Se aplicó una asignación aleatoria secuencial de los pacientes a los grupos, mediante una lista de asignación aleatoria generada por ordenador en bloques de 3: el grupo Vimang tabletas 900 mg/día (n = 4), el grupo Vimang tabletas 1.800 mg/día (n = 3) y el grupo Vimang tabletas 900 mg/día + crema Vimang 1,2% (n = 3). La administración de las tabletas se repartió en 3 tomas cada 8 h. La crema se aplicó 3 veces al día con el mismo intervalo en la rodilla afectada. La extensión del tratamiento en este estudio fue de 3 meses. Se realizó el interrogatorio y el examen físico correspondiente en las consultas, para la evaluación sistemática y la búsqueda de complicaciones.
Los pacientes efectuaron por sí mismos una valoración diaria del dolor de las 24 h previas al levantarse por la mañana. El cambio de la PDMD entre la semana basal y la semana final del tratamiento se consideró como la variable principal del estudio21. La puntuación inicial consistió en la media de los registros del diario de dolor de los últimos 7 días previos a la asignación aleatoria. La puntuación final fue la media de los registros del diario de dolor de los últimos 7 días antes de la consulta a los 3 meses. Se evaluaron los pacientes semanalmente en consulta hasta los 3 meses. Para todos los grupos se recogió como dato adjunto en la planilla de diario de dolor, la necesidad de asociar otro fármaco y su dosis/día, como una variable de control. Además, se aplicó el índice de capacidad funcional de WOMAC (The Westerm Ontario and McMaster Universities Osteoarthritis Index) en la consulta inicial y al concluir el estudio4,10. De igual manera, se realizó US de partes blandas de ambas rodillas al inicio y postratamiento a los 3 meses (equipo ALOKA 1100 con transductor de 7,5 MHz). Ecográficamente, la sinovitis se definió como un área intracapsular hipoecoica no compresible (engrosamiento sinovial). Ésta puede asociarse a áreas anecoicas (efusión sinovial) que fue medida en el receso suprapatelar con la pierna en extensión completa según los criterios US OMERACT y se clasificó desde el punto de vista semicuantitativo22,23.
— Sinovitis ligera: engrosamiento mínimo sinovial, relleno del ángulo entre los huesos periarticulares sin curvatura sobre la línea que vincula las cúspides de los huesos.
— Sinovitis moderada: engrosamiento sinovial con curvatura sobre la línea que vincula las cúspides de los huesos periarticulares, pero aún sin extensión hacia las diáfi sis de los huesos.
— Sinovitis severa: engrosamiento sinovial con curvatura sobre la línea que vincula las cúspides de los huesos periarticulares y con extensión hacia al menos una de las diáfisis de los huesos.
Para el procesamiento de los datos se utilizó el paquete estadístico Graph Pad Prism para Windows XP. Para la evaluación de la evolución de los pacientes, los grupos se clasificaron según el factor tratamiento recibido para la OA de rodilla. Se consideraron las medias elaboradas a partir de los valores categóricos para la escala numérica de Likert. En cada caso, se realizó la estadística descriptiva de las variables mediante el cálculo de las medias, desviación estándar (DE) y el error estándar de la media (EEM). Para evaluar la diferencia entre las medias de cada variable en 12 consultas se utilizó la prueba de análisis de varianza de una vía y la de Bonferroni’s a posteriori según el tamaño de la muestra por grupos. Se consideraron valores del estadígrafo significativos de p < 0,05. Los resultados fueron presentados como medias ± EEM.
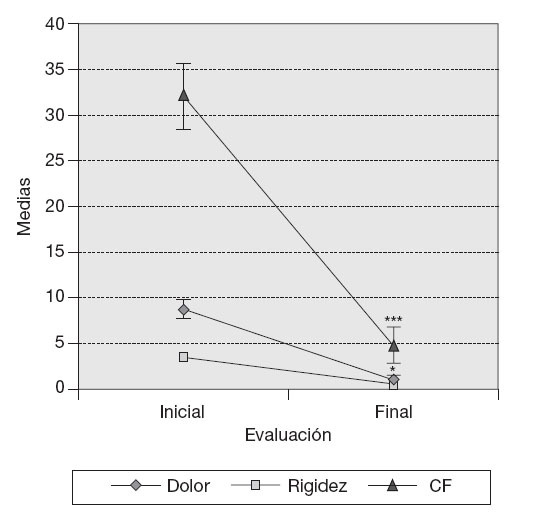
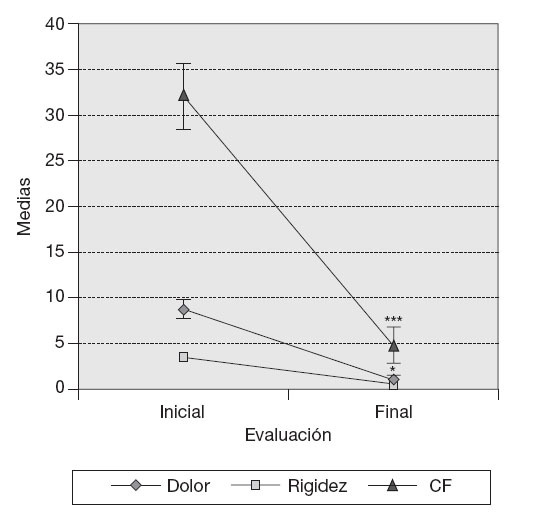
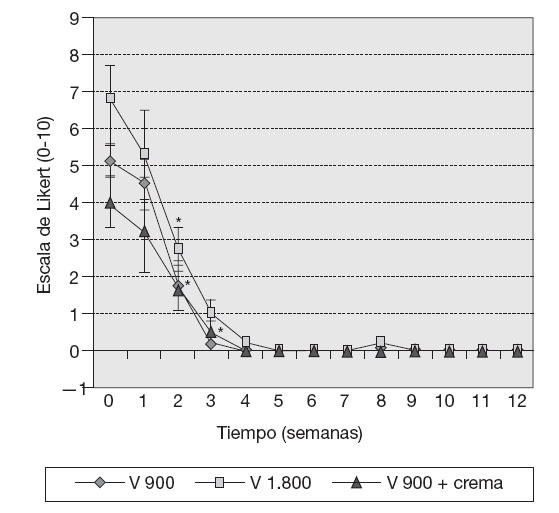
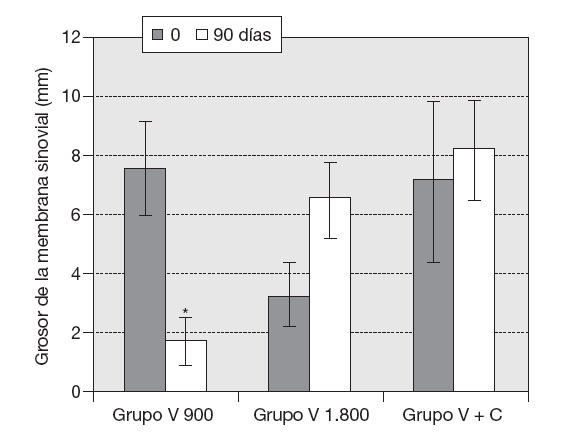
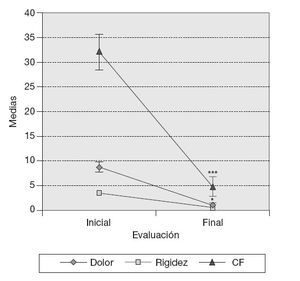
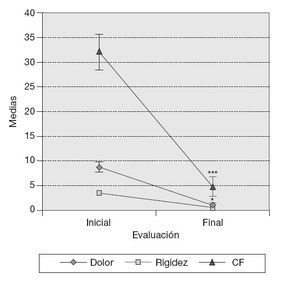
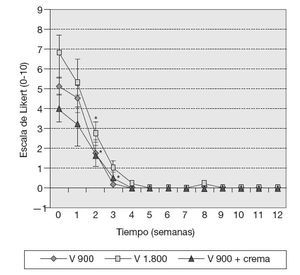
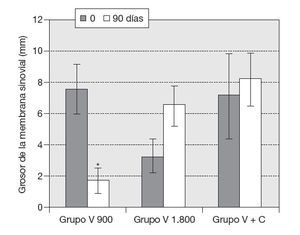
ResultadosVariables clínicas — Índice de WOMAC. El cambio de los valores medios de la subescala de dolor del índice de WOMAC al final del tratamiento fue estadísticamente significativo con respecto a los valores medios iniciales (p < 0,05), y en la subescala capacidad funcional muy significativo (p < 0,001) en los 10 pacientes, independientemente del tratamiento utilizado. Este cambio no mostró significación estadística en el caso de la subescala rigidez (fig. 1). — Cambio de la PDMD según escala numérica de Likert. Se observó la reducción significativa de las PDMD desde la semana 2 de tratamiento con Vimang ® en el grupo Vimang tabletas 1.800 mg/día (p < 0,001) y en el grupo Vimang tabletas 900 mg/día (p < 0,01). No hubo diferencias significativas entre ambos grupos. Los cambios de la PDMD en el grupo Vimang tabletas 900 mg/día + crema fueron significativos con respecto a los valores medios iniciales a partir de la semana 3 (fig. 2). 10 pacientes estudiados, 9 (90%) presentaban sinovitis unilateral o bilateral en el rango de moderada a ligera, sólo en un paciente se consideró grave. Como se estudiaron ultrasonográficamente las 2 rodillas en cada paciente, se analizó esta variable como rodillas afectadas. En el total de pacientes incluidos en este estudio se observaron 17 rodillas con sinovitis, de las cuales 15 presentaban proliferación de la membrana sinovial al inicio del tratamiento. En 7 de ellas se constató aumento de su grosor, pero en una articulación que no mostraba signos de proliferación sino-vial al inicio, ésta se observó al final del estudio, aunque no fue mesurable. Entonces, se consideraron 8 articulaciones (50%) que presentaron promoción de la proliferación a los 3 meses. Por otra parte, en 7 (43,7%) rodillas se observó la disminución de la proliferación con respecto a los valores iniciales y en una articulación (6,25%) ésta se mantuvo sin variación. En la figura 3 se observa la distribución por grupos de tratamientos con relación a la variación del grosor de la sinovial en las 15 rodillas en las cuales se pudo medir la evolución de su grosor en milímetros. En el grupo Vimang 1.800 (3 rodillas afectadas) el 100% aumentó el grosor de la sinovial al final del tratamiento respecto a su inicio, pero este cambio no tuvo significación estadística. En el grupo Vimang 900 (7 rodillas afectadas), 6 (85,7%) disminuyeron el grosor de la membrana sinovial al final del tratamiento significativamente (p < 0,05) y 1 se mantuvo igual; en el grupo Vimang 900 + crema (5 rodillas afectadas), 4 (80%) aumentaron el grosor de la sinovial y 1 disminuyó, pero el cambio no fue estadísticamente significativo respecto al valor inicial.Figura 1 Evaluación de las 3 subescalas del índice de WOMAC (The Westerm Ontario and Mc Master Universities Osteoarthritis Index), con respecto a sus valores medios iniciales en 10 pacientes con OA de rodilla tratados con formulaciones Vimang®. En la fi gura se expresan los valores de la media ± error estándar de la media (EEM). *p < 0,05; ***p < 0,001 indican diferencias signifi cativas respecto a los valores iniciales.
Figura 2 Intensidad del dolor según la escala numérica de Likert en 10 pacientes con gonartrosis que recibieron tratamiento con Vimang® (V) por grupos (grupo V 900: Vimang tabletas 900 mg/día (n = 4); grupo V 1.800: Vimang tabletas 1.800 mg/día (n = 3), y grupo V + C: Vimang tabletas 900 mg/día + crema Vimang 1,2% (n = 3). En la fi gura se expresan los valores de la media ± error estándar de la media. *p < 0,05 indica diferencias signifi cativas respecto a los valores iniciales.
Figura 3 Distribución por grupos de tratamientos de la variación del grosor de la sinovial al concluir el tratamiento. Se consideraron 15 articulaciones con sinovitis proliferativa. Los valores se expresan como media ± error estándar de la media. *p < 0,05 indica diferencias signifi cativas respecto a los valores iniciales.
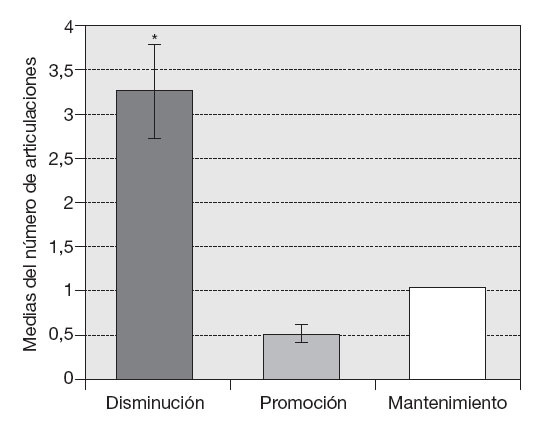
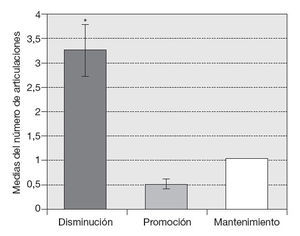
Para evaluar el comportamiento de la efusión sinovial en las articulaciones afectadas se consideró el efecto inhibición, promoción o mantenimiento del volumen a los 3 meses de iniciado el tratamiento. En la tabla 1 se observa el porcentaje de articulaciones que sufrieron cada efecto por grupos. Se observó el efecto inhibición en el 85% del grupo Vimang 900, el 50% del grupo Vimang 1.800 y el 66,6% del grupo Vimang 900 + crema. Este efecto predominó con significación estadística (p < 0,05) sobre los efectos promoción y mantenimiento (fig. 4).
TABLA 1 Comportamiento de la efusión sinovial a los 90 días del tratamiento con formulaciones Vimang® (V) en las articulaciones afectadas de los pacientes mediante ultrasonografía por grupos
Figura 4 Comportamiento de la efusión sinovial a los 90 días de tratamiento con Vimang® en las articulaciones afectadas de los 10 pacientes mediante ultrasonografía. Los valores se expresan como media ± error estándar de la media. *p < 0,05 indica diferencias entre los 3 efectos (inhibición, promoción y mantenimiento).
DiscusiónEn el presente estudio todos los pacientes mejoraron su capacidad funcional como indicador de calidad de vida y este efecto podría estar en gran parte condicionado por el grado de analgesia alcanzado. En los 3 grupos se observó el descenso de las PDMD finales con respecto a las iniciales. Es de
Figura 3 Distribución por grupos de tratamientos de la variación del grosor de la sinovial al concluir el tratamiento. Se consideraron 15 articulaciones con sinovitis proliferativa. Los valores se expresan como media ± error estándar de la media. *p < 0,05 indica diferencias significativas respecto a los valores iniciales.
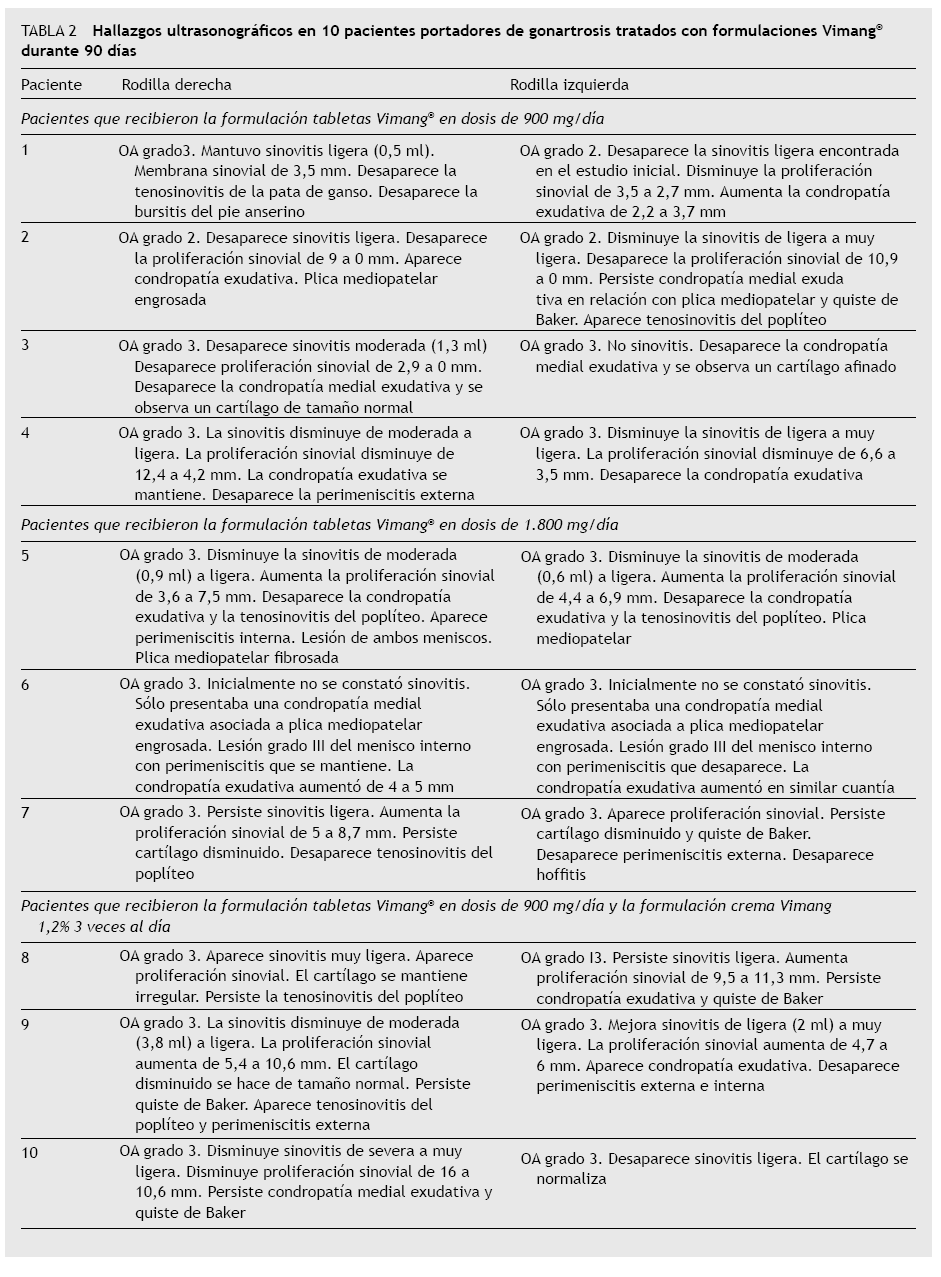
señalar que no se asoció otra terapia o medicación (a excepción de un paciente en el grupo Vimang 1.800 que necesitó 1 tableta de ibuprofeno de 400 mg al acostarse durante 10 días). Además, en este estudio no se describieron efectos adversos o complicaciones con la utilización de las tabletas y la combinación tableta + crema. En los grupos Vimang 1.800 y Vimang 900 se estableció significativamente el descenso en la PDMD a las 2 semanas de iniciado el tratamiento, efecto que se incrementó y mantuvo hasta los 3 meses. Un efecto similar, a los 15 días del tratamiento, se había descrito previamente en un estudio conducido en adultos mayores suplementados con Vimang®, mediante la aplicación de una escala de dolor corporal24. Sin embargo, no todos los pacientes con analgesia satisfactoria en el grupo Vimang 1.800 y en el grupo Vimang + crema mostraron actividad antiproliferativa sobre la membrana sinovial ultrasonográficamente. Los 2 pacientes con sinovitis ultrasonográfica de este grupo presentaban grados de OA similares (3) y mostraron incremento de la proliferación sinovial, e incluso apareció evolutivamente en una de las articulaciones que no presentaba inicialmente, aunque, globalmente, la sinovitis disminuyó o no se incrementó en el sentido de la efusión de líquido sinovial. En modelos in vivo, la inhibición exclusiva de la fase II en la prueba de la formalina al 1% por el Vimang® (DE50 de 8,4 mg/kg) sugiere sus potencialidades para el tratamiento del dolor patológico y su acción antihiperalgésica25. A esta baja concentración de formalina, el hallazgo indica la actividad del producto sobre el componente capsaicina-sensitivo-neurogénico, más que la actividad sobre componentes inflamatorios más complejos con activación glial en CDE (descrito a concentraciones altas del 5%)26. De ahí que el Vimang® podría frenar la actividad antidrómica de fibras C liberadoras de sustancia P, péptido relacionado con el gen de la calcitonina (PRGC) y péptido intestinal vasoactivo, sustancias vasodilatadoras que aumentan la permeabilidad vascular y promueven el edema local27. En especial, este último péptido se encuentra a concentraciones elevadas en suero y líquido sinovial de pacientes con OA9. Asimismo, en un modelo in vivo de OA se demostró su actividad hiperalgésica intraarticular, la cual fue inhibida por antagonistas de sus receptores (VPAC1 y VPAC2)9. Éste podría ser un mecanismo antihiperalgésico y reductor de la extravasación plasmática, dependiente de la actividad inhibidora sobre la liberación de estos neuropéptidos, que inducen sensibilización periférica articular y facilitan la sensibilización central6. En este estudio se observa la inhibición de la efusión sinovial en la mayoría de las articulaciones, que fue predominante en los pacientes del grupo Vimang 900. Además, en la tabla 2, que describe los hallazgos ultrasonográficos de los 10 pacientes, y en la figura 5, se observa que otras alteraciones inflamatorias periarticulares, como la condropatía exudativa secundaria a la plica mediopatelar, de elevada frecuencia en estos pacientes, la perimeniscitis en meniscos lesionados y la tenosinovitis del poplíteo mejoraron evolutivamente. Estos elementos, en conjunto, podrían facilitar la analgesia global de la articulación. No siempre se observó la correspondencia entre analgesia y actividad antiinflamatoria, constatada por US en estos pacientes, por lo que no se pudo excluir un mecanismo analgésico no dependiente de esta actividad bien establecida en el Vimang® y mediada por la inhibición de la activación del factor de transcripción nuclear kappa B (NFκB)28.
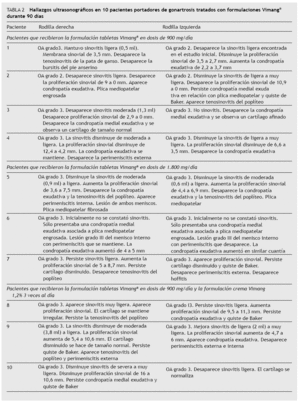
TABLA 2 Hallazgos ultrasonográfi cos en 10 pacientes portadores de gonartrosis tratados con formulaciones Vimang® durante 90 días
Por otra parte, el engrosamiento de la membrana sino-vial, como evidencia de inflamación crónica, además de la proliferación celular incluye al proceso de neovascularización a partir de los vasos preexistentes en el sinovium, el cual constituye un marcador de la sinovitis7. La OA es una artropatía crónica no inflamatoria, pero inevitablemente la inflamación coexiste con ella en la mayoría de los casos, como se constató en este estudio. En un estudio acerca de las diferencias morfológicas vasculares de las artropatías, se demuestra que en la OA los vasos sinoviales poseen una morfología similar a la observada en la artropatía psoriásica y la espondilopatía. Este hecho se ha relacionado con concentraciones elevadas del factor de crecimiento vascular endotelial (VEGF), metaloproteinasas de matriz (MMP)-9 y el bajo nivel de apoptosis en las células endoteliales7. En este sentido, se ha observado que el ECAM (ingrediente farmacéutico activo de las formulaciones Vimang®) en estudios in vitro inhibió la proliferación de células endoteliales humanas estimuladas con el VEGF, con un valor máximo del 56% con relación al control, a dosis de 50 μg/ml e inhibió la liberación de MMP-2 de células endoteliales, con un valor máximo del 52% respecto al control, a dosis de 100 μg/ml (datos no publicados). En los estudios in vitro los efectos antiangiogénicos del ECAM en líneas celulares tu-morales son dependientes de la concentración. En condiciones inflamatorias in vivo, las dosis elevadas de Vimag® podrían mostrar efectos prooxidantes y favorecer la angiogénesis; ésta sería una hipótesis para explicar el aumento del grosor de la membrana sinovial de preferencia en los grupos Vimang 1.800 y Vimang 900 + crema. En cambio, el grupo Vimang 900 mostró correspondencia entre analgesia y efecto antiproliferativo sinovial. El NFκB es un promotor de la síntesis de citocinas proinflamatorias (factor de necrosis tumoral [TNF] α, interleucina [IL]-1β y el factor estimulante de colonias de granulocitos-macrófagos). En especial, el TNFα, que entre muchos de sus efectos amplificadores promueve la activación y la entrada al núcleo del propio factor transcripcional18,29. Éste también promueve la síntesis de enzimas, como la ciclooxigenasa 2 y la NO sintasa inducible, que catalizan la síntesis de metabolitos del ácido araquidónico y NO, respectivamente, protagonistas en la cascada inflamatoria y la hiperalgesia que acompaña a la OA de rodilla29-31. Por otra parte, se comprobó que el ECAM (40 y 400 μg/ml) redujo los valores de ARNm del NFκB en macrófagos peritoneales murinos estimulados con LPS e IFN-γ sin afectar la concentración de IκB, lo que explica que, además de inhibir su activación, reduce la disponibilidad de NFκB en el citoplasma celular y garantiza la presencia del inhibidor IκB28,31-33. Esta acción primaria sobre la vía metabólica de importantes mediadores y sistemas enzimáticos involucrados en el proceso inflamatorio justificaría sus potencialidades en esta entidad. Se ha demostrado mediante estudios inmuhistoquímicos de la membrana sinovial de la rodilla en humanos sanos, que las células predominantes en este tejido son los linfocitos T (CD3, CD4, CD8), los macrófagos y las células positivas a HLADR34. La activación de linfocitos ha sido estudiada, tanto en la inflamación crónica como en la aguda, ya que diferentes poblaciones de células T alteran el balance entre el aclaramiento o eliminación del patógeno y la inducción de daño tisular, lo que depende de las citocinas que ellas secretan. El ECAM in vitro inhibió completamente la proliferación celular mediada por el receptor de células T e inducida por enterotoxina B de Staphylococcus aureus (SEB), el 90% de inhibición se logró con la dosis más baja (10 μg/ml)28. También se demostró que el extracto a una concentración de 25 μg/ml previno, casi completamente, la entrada de las células en las fases SG2M del ciclo celular, o sea, inhibió la progresión del ciclo celular de los linfocitos T estimulados con SEB28. Estas evidencias sugieren que su utilización en dosis menores favorecería la inhibición de la proliferación de estas células y sería una explicación para la disminución del grosor de la sinovial observada en los pacientes del grupo Vimang 900.
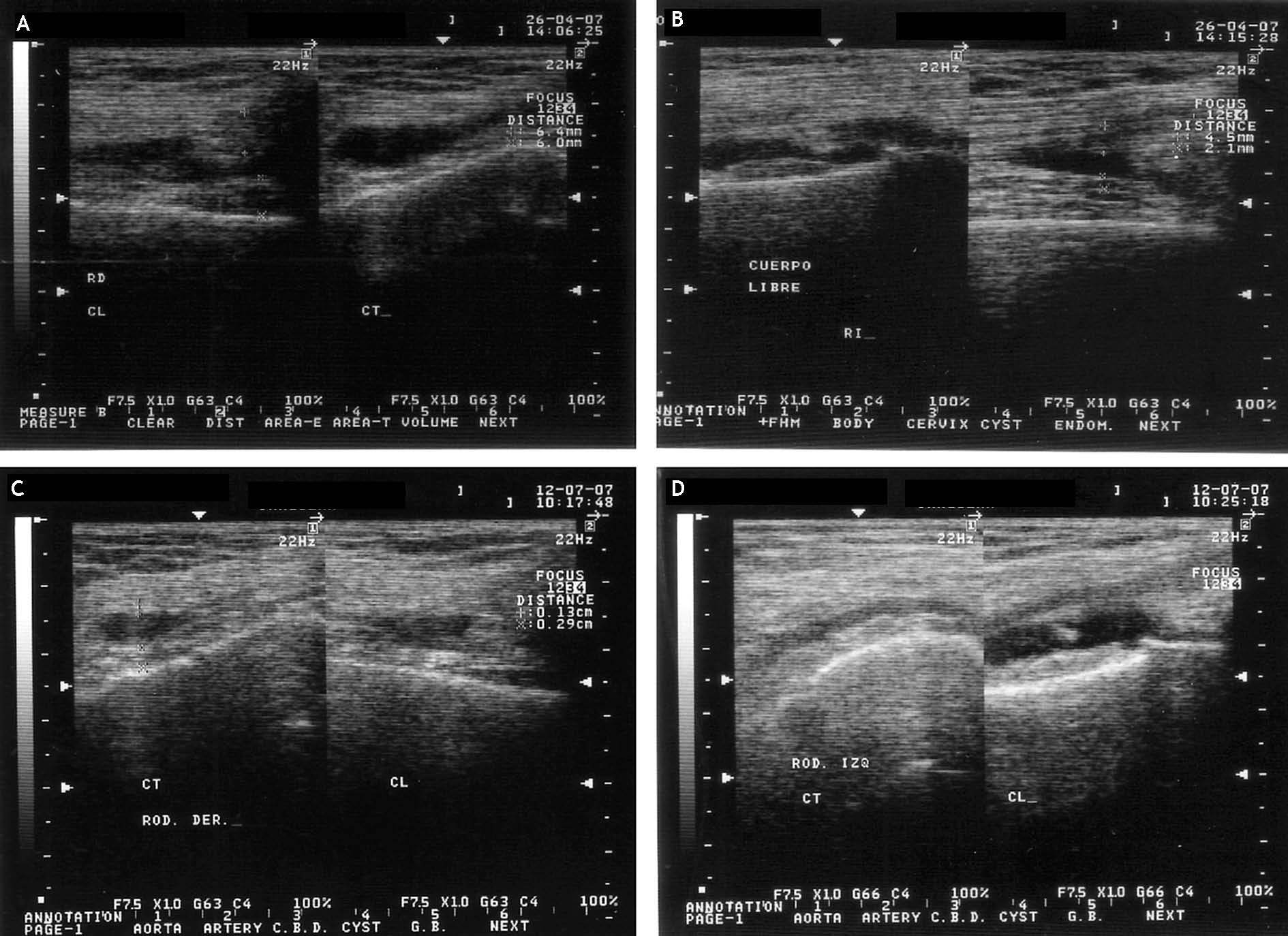
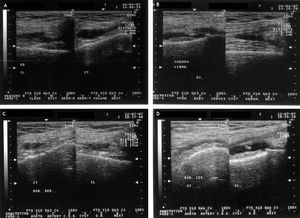
Figura 5 Imágenes ultrasonográficas de una paciente del grupo Vimang 900 (V 900). A) Rodilla derecha inicial. Sinovitis moderada, proliferación sinovial 12,4 mm. Perimeniscitis externa. B) Rodilla izquierda inicial. Sinovitis ligera, proliferación sinovial 6,6 mm. Condropatía exudativa. C) Rodilla derecha a los 3 meses de iniciado el tratamiento. Sinovitis ligera, proliferación sinovial de 4,2 mm, desaparece la perimeniscitis externa. D) Rodilla izquierda a los 3 meses de iniciado el tratamiento. Sinovitis muy ligera, proliferación sinovial de 3,5 mm, desaparece la condropatía exudativa.
Existe el antecedente del efecto inhibitorio del ECAM en la actividad de la enzima β-glucuronidasa en un modelo inflamatorio crónico de artritis reumatoide en ratas inducida por zimosán, de forma dependiente de la dosis (DE50 de 44,5 mg/kg), con el empleo de triamcinolona como fármaco de referencia35. Este resultado permitió demostrar que el extracto inhibe la degradación del cartílago y el tejido conjuntivo de la articulación provocada por enzimas lisosomales. En este estudio, se recoge como dato interesante la normalización del cartílago articular en 2 pacientes a los 3 meses del tratamiento, uno de éstos del grupo Vimang 900 y otro del grupo Vimang 900 + crema.
En resumen, los 10 pacientes estudiados mostraron analgesia satisfactoria a partir de los 15-21 días hasta los 3 meses. Este efecto se corresponde, al menos en parte, con la disminución de la efusión sinovial que se observó en la mayoría de las articulaciones afectadas, al disminuir la tensión intraarticular. Este efecto fue independiente de la disminución del grosor de la sinovial constatada por ultrasonografía, como evidencia de la proliferación de la membrana en el proceso inflamatorio crónico. Se observaron ambos efectos, promoción e inhibición de la proliferación sinovial, independientemente de la analgesia. La inhibición de la proliferación de la membrana sinovial con respecto a los valores iniciales sólo fue significativa en el grupo Vimang 900. Los 10 pacientes mejoraron su calidad de vida en relación con el alivio del dolor y el aumento de la capacidad funcional según el índice de WOMAC. Se hace necesario realizar ensayos clínicos controlados en un mayor número de pacientes y de mayor extensión para la búsqueda de evidencias clínicas, de imagen y bioquímicas que permitan la aplicación racional de este producto en pacientes con OA.
AgradecimientosLos autores de este trabajo agradecen a Laboratorios Farmacéuticos “Oriente”, Cuba, especialmente a la MSc, Ing. Zoe Lemus, por el suministro de las tabletas Vimang®. Este trabajo fue financiado parcialmente por el proyecto N.o 00403238 (CITMA, Cuba)
*Autor para correspondencia.
Correo electrónico: beatriz.garrido@infomed.sld.cu (B. Garrido).