La práctica totalidad de los pacientes con derrame pleural se deben someter a una toracocentesis, ya que sus resultados ayudarán al diagnóstico y tratamiento. El análisis rutinario del líquido pleural (LP) generalmente incluye: recuento celular diferencial, proteínas, lactato deshidrogenasa, glucosa, adenosina desaminasa, citología y, si se sospecha infección, pH y cultivos bacterianos y micobacterianos. La distinción entre trasudados y exudados mediante la aplicación de los criterios de Light es el primer paso diagnóstico ante todo derrame pleural. Si el derrame es un exudado, diferentes pruebas analíticas del LP pueden ayudar a acotar el diagnóstico diferencial: una adenosina desaminasa >35U/l indica generalmente tuberculosis en LP con predominio de linfocitos, o empiema en exudados neutrofílicos; un pH<7,20 o una glucosa <60mg/dl permite identificar derrames paraneumónicos complicados; y una citología convencional es capaz de demostrar células malignas en el 60% de derrames neoplásicos. Otras determinaciones del LP son opcionales y facilitan el diagnóstico de los derrames de etiología incierta. Por ejemplo, los péptidos natriuréticos son buenos biomarcadores de insuficiencia cardiaca, mientras que concentraciones de mesotelina pleural superiores a 20nM sugieren fuertemente el diagnóstico de mesotelioma.
Virtually all patients with a pleural effusion should undergo thoracentesis to aid diagnosis and management. Routine pleural fluid (PF) evaluation usually includes differential cell count, protein, lactate dehydrogenase, glucose and adenosine deaminase determinations, cytology and, if infection is a concern, pH as well as bacterial and mycobacterial cultures. Distinguishing transudates from exudates through Light's criteria is a pragmatic first step. If the effusion is an exudate, various PF tests have proven diagnostic utility: adenosine deaminase levels >35U/L usually indicate tuberculosis in lymphocytic-predominant PFs, or empyema in neutrophilic-predominant PFs; pH<7.2 or glucose <60mg/dL allow the clinician to identify complicated parapneumonic effusions, and conventional cytology may demonstrate malignant cells in 60% of patients with malignant effusions. A number of optional PF tests may complement the diagnostic approach to a pleural effusion of uncertain etiology. For example, natriuretic peptide assays significantly improve the accuracy of diagnosis of cardiac pleural effusions, whereas PF mesothelin levels greater than 20nM are highly suggestive of mesothelioma.
En condiciones fisiológicas, el líquido pleural (LP) es un ultrafiltrado del plasma y su cuantía se estima en 0,15ml/kg de peso para cada hemitórax1. Mediante ecografía se puede ver una mínima película de LP, de alrededor de 3mm, en el 30% de los individuos sanos2. Todo acumulo de cantidades clínicamente detectables se considera anormal. El derrame pleural (DP) puede indicar la presencia de una enfermedad pleural, pulmonar o extrapulmonar. En algunos casos la etiología del DP es evidente desde el punto de vista clínico, pero en otros es incierta. Por ejemplo, un DP bilateral en el contexto clínico de una insuficiencia cardiaca es generalmente secundario a dicha patología, mientras que un DP unilateral masivo en una mujer con antecedentes de cáncer de mama es metastático mientras no se demuestre lo contrario. Sin embargo, en un paciente con artritis reumatoide la causa potencial de un DP no se circunscribe a la enfermedad de base (derrame reumatoide), sino que éste puede deberse a una infección (bacteriana o micobacteriana), una pleuritis inducida por fármacos (metotrexato, etanercept, infliximab) o un seudoquilotórax, entre otras causas.
El análisis del LP obtenido mediante toracocentesis permite establecer una causa definitiva o presuntiva del DP en el 70–80% de los casos y, cuando menos, sirve para descartar fehacientemente algunas etiologías3.
Apariencia macroscópica del líquido pleuralLas características organolépticas del LP pueden proporcionar una información diagnóstica útil. Según su color, podemos clasificar a la mayoría de los LP en alguna de las siguientes categorías: acuosos (amarillo claro), serosos (amarillento), serohemáticos (rojizo), francamente hemáticos (rojo oscuro, similar a la sangre), purulentos (pus), turbios (amarillento, pero viscoso u opalescente) y lechosos (blanquecino y menos espeso que el pus). Aproximadamente la mitad de los LP francamente hemáticos se deben a neoplasias. Sin embargo, el DP maligno es de aspecto seroso en el 50%, serohemático en una tercera parte y francamente hemático en sólo un 10% de los casos4. Una apariencia acuosa del LP es muy indicativa de trasudado (ver definición más abajo), si bien la mayor parte de los trasudados son serosos e incluso pueden tener aspecto serohemático o turbio4.
Un LP de aspecto lechoso es característico del quilotórax (aunque la mitad de ellos no ofrecen esta apariencia) y del seudoquilotórax. Las causas más frecuentes de quilotórax son la cirugía, los traumatismos y el linfoma, mientras que los seudoquilotórax suelen ser secundarios a tuberculosis y, en menos ocasiones, a artritis reumatoide. La obtención de un LP purulento es diagnóstico de empiema. En ocasiones, el aspecto blanquecino de los DP quilosos o quiliformes puede ser difícil de distinguir de la turbidez propia del empiema. Sin embargo, después de la centrifugación del LP, el sobrenadante es claro en el empiema (células y detritos producen la turbidez) pero persiste turbio en los DP quilosos debido al alto contenido lipídico. Además, el quilo es inodoro, mientras que los empiemas anaerobios son fétidos. Rara vez, el aspecto blanquecino del LP se debe a la fuga de un preparado de alimentación enteral desde un catéter central hacia el espacio pleural.
Análisis rutinarios del líquido pleuralSólo se requiere extraer de 10–20ml de LP para su análisis completo que incluye estudios bioquímicos, microbiológicos y citológicos. El LP se deber repartir en tubos estériles que contengan anticoagulante (heparina o EDTA).
Para analizar el pH la muestra se recogerá en condiciones anaeróbicas, sin mezclarse con el anestésico local de la jeringa utilizada para la toracocentesis. La medición se llevará a cabo en un aparato de gasometría arterial durante la hora siguiente a la extracción del LP (en cualquier caso, no más tarde de 4h)5.
Proteínas y lactato deshidrogenasa (¿trasudado o exudado?)La primera cuestión que se debe contestar cuando se descubre un DP es si se trata de un trasudado o de un exudado. Por definición, los trasudados son DP que resultan de un desequilibrio entre las fuerzas hidrostáticas y oncóticas en la circulación pulmonar o sistémica, mientras que los exudados se producen por un aumento de la permeabilidad vascular. Si el DP es un trasudado no se requieren procedimientos diagnósticos adicionales, ya que generalmente la causa es una insuficiencia cardiaca (80%) y, en menor medida, una cirrosis hepática (15%); bastará con administrar diuréticos para que desaparezca el DP3. Por el contrario, los exudados precisan de una evaluación diagnóstica más extensa porque pueden tener numerosas etiologías. En nuestro medio, las causas más frecuentes de exudado pleural son el cáncer, la neumonía y la tuberculosis.
En la práctica clínica, diferenciamos exudados de trasudados mediante la determinación simultánea en sangre y LP de las concentraciones de proteínas y lactato deshidrogenasa (LDH); es lo que se conoce como criterios de Light6 (tabla 1). La principal limitación de los criterios de Light es que, aunque identifican correctamente la práctica totalidad de los exudados, clasifican de forma errónea como «exudados» alrededor de un 20% de trasudados7 (tabla 2). Esta circunstancia es particularmente frecuente en pacientes con insuficiencia cardiaca que han recibido tratamiento diurético o que tienen LP hemáticos (hematíes >10.000×106/l)8. En caso de que un paciente presente clínicamente una insuficiencia cardiaca pero el LP cumpla criterios de Light para exudado por un pequeño margen, se recomienda calcular el gradiente (resta) entre la albúmina o las proteínas del suero y del LP. Si dicha diferencia es superior a 1,2g/dl en el caso de la albúmina o superior a 3,1g/dl en el caso de las proteínas, asumiremos que dicho LP es realmente un trasudado9.
Criterios de Light para diferenciar exudados de trasudados pleurales
| Un derrame pleural se clasifica como exudado si cumple una o más de las siguientes condiciones |
|
LDH: lactato deshidrogenasa.
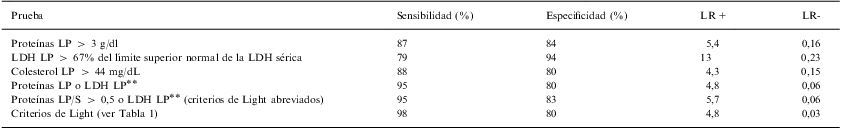
Eficacia de diferentes pruebas para identificar exudados pleurales¿
| Prueba | Sensibilidad (%) | Especificidad (%) | LR+ | LR- |
| Proteínas LP > 3 g/dl | 87 | 84 | 5,4 | 0,16 |
| LDH LP > 67% del límite superior normal de la LDH sérica | 79 | 94 | 13 | 0,23 |
| Colesterol LP > 44 mg/dL | 88 | 80 | 4,3 | 0,15 |
| Proteínas LP o LDH LP¿¿ | 95 | 80 | 4,8 | 0,06 |
| Proteínas LP/S > 0,5 o LDH LP¿¿ (criterios de Light abreviados) | 95 | 83 | 5,7 | 0,06 |
| Criterios de Light (ver Tabla 1) | 98 | 80 | 4,8 | 0,03 |
LDH: lactato deshidrogenasa; LP: líquido pleural; LP/S: cociente entre líquido pleural y suero; LR: cociente de probabilidad; +: (positiva); –: (negativa).
Cuando no es posible realizar una extracción sanguínea (circunstancia inhabitual) la combinación, con una regla en «o», de las proteínas (>3g/dl) y la LDH (>67% del límite superior de la normalidad para la LDH sérica) del LP puede utilizarse como criterio alternativo para identificar exudados6 (tabla 2).
La LDH del LP no solo es útil para discriminar exudados de trasudados sino que, al reflejar fielmente el grado de inflamación pleural, tiene especial interés en los DP asociados a neumonías. Por definición, un DP paraneumónico no complicado es aquel que se resuelve únicamente con tratamiento antibiótico; el DP paraneumónico complicado requiere para su resolución de un tubo de toracostomía, mientras que el empiema es la presencia de pus en la cavidad pleural (siempre indicativo de tubo de drenaje). El reto para el clínico es la identificación de aquellos DPs paraneumónicos de aspecto no purulento que van a necesitar un tubo de drenaje para su curación. En el contexto de un DP asociado a una neumonía, el hallazgo de una LDH pleural >1.000U/l (aproximadamente el doble del límite superior de la LDH sérica) es un factor de mala evolución clínica que nos debe hacer sopesar la necesidad de colocar un tubo de drenaje pleural10. También se pueden observar cifras de LDH pleural >1.000U/l en el 40% de los DP tuberculosos y en el 20% de los DPs malignos, sin que de ello derive ninguna decisión terapéutica11.
Conviene destacar que más del 70% de los DPs tuberculosos exhiben proteínas en el LP superiores a 5g/dl11. Cuando la concentración de proteínas pleurales excede los 7g/dl se sospechará una discrasia de células plasmáticas.
Recuento celular leucocitario (¿patología pleural aguda o crónica?)El número de leucocitos del LP tiene un valor limitado en el diagnóstico diferencial de un DP, aunque cifras superiores a 10.000/mm3 se han descrito mayoritariamente en pacientes con DP paraneumónico. Por el contrario, el recuento diferencial de leucocitos tiene gran interés en todos los exudados pleurales, debido a que el predominio de un tipo celular concreto (neutrófilos, linfocitos) acota el diagnóstico diferencial12.
Derrames pleurales neutrofílicosEl momento de realizar la toracentesis en relación con el tiempo de evolución de la lesión pleural determina el tipo de célula leucocitaria predominante en el LP. En los procesos inflamatorios agudos que afectan a la pleura predominan los neutrófilos (>50%). La neumonía es, con diferencia, la causa más frecuente de DP neutrofílico, si bien este tipo de derrames se pueden asociar también con embolismo pulmonar, patología abdominal (pancreatitis, absceso subfrénico), infecciones víricas o tuberculosas en fase aguda, neoplasias o exposición al asbesto (DP asbestósico benigno)6,12.
Derrames pleurales linfocitariosEn los trasudados pleurales, la existencia de un recuento de linfocitos superior al 50% (circunstancia que se da en alrededor del 85% de los casos) no tiene ningún significado diagnóstico. Sin embargo, la linfocitosis tiene gran importancia en el diagnóstico diferencial de un exudado ya que indica su naturaleza crónica. Ante un exudado de predominio linfocitario los dos principales diagnósticos a considerar son el cáncer y la tuberculosis. Así, el 90% de DP tuberculosos y el 80% de DP malignos son linfocitarios. Causas menos frecuentes de exudados con predominio de linfocitos son el DP poscirugía cardiaca en su fase tardía, la embolia pulmonar, el quilotórax, la pleuritis reumatoide (crónica), el síndrome de las uñas amarillas, la sarcoidosis o el rechazo agudo de un transplante pulmonar, entre otras. En las metástasis pleurales de tumores sólidos la linfocitosis del LP no suele ser tan marcada como en la tuberculosis (mediana 82 vs. 90% respectivamente; datos no publicados).
Derrames pleurales eosinofílicosSe consideran DP eosinofílicos aquéllos que contienen más de un 10% de eosinófilos en el LP. En las distintas series, las tres cuartas partes de los DP eosinofílicos se deben a infecciones (DP paraneumónicos y, menos frecuentemente, tuberculosos), neoplasias y causas desconocidas13. Una miscelánea de entidades completa la lista de etiologías potenciales de DP eosinofílico, donde se incluyen traumatismos, neumotórax espontáneo, DP asbestósico benigno, infecciones parasitarias, fúngicas o virales, fármacos, embolia pulmonar, cirugía de bypass coronario, enfermedades reumáticas autoinmunes (artritis reumatoide) y vasculitis (síndrome de Churg-Strauss), infecciones abdominales, insuficiencia cardiaca, cirrosis, enfermedades pancreáticas o sarcoidosis. Cuanto mayor es el porcentaje de eosinófilos en el LP (p. ej. >40%), menor es la probabilidad de neoplasia y mayor la de una causa idiopática13.
Tradicionalmente, se ha considerado que los DP eosinofílicos son a menudo el resultado de la presencia de aire o sangre en la cavidad pleural (p. ej. hemotórax, neumotórax, toracocentesis repetidas). No obstante, solo el 5% de DP que se someten a una segunda toracocentesis se tornan eosinofílicos13.
Recuento de hematíes (¿cáncer, traumatismo o embolia pulmonar?)Se requieren de 5.000–10.000hematíes/mm3 en el LP para que éste tenga una apariencia rojiza. Tan sólo 1mL de sangre en un DP de tamaño moderado es capaz de producir un LP serohemático. El valor diagnóstico de los DPs serohemáticos es limitado ya que lo son el 15% de los trasudados y, globalmente, una tercera parte de los exudados. De este modo, una concentración de hematíes en el LP superior a 10.000/mm3 se observa en >75% de los DP postraumáticos, el 60% de los DP secundarios a embolismo pulmonar, el 40% de los DP malignos y en una tercera parte de los DPs paraneumónicos11. Mayor interés tiene el hallazgo de un DP francamente hemático, que se corresponde con cifras de hematíes en el LP superiores a 100.000/mm3. Un DP de esas características sugiere tres posibles diagnósticos: cáncer, traumatismo y embolia pulmonar. En todo DP netamente hemático se debe determinar el hematocrito del LP, ya que si éste supera el 50% del existente en sangre periférica estamos ante un hemotórax, la mayoría de los cuales son de causa traumática.
Adenosina desaminasa (¿es el DP tuberculoso?)En zonas geográficas donde la tuberculosis tiene una incidencia moderada (p. ej. España, con 30 casos/100.000 habitantes/año) o alta, la determinación de la enzima adenosina desaminasa (ADA) en el LP es una prueba rutinaria que ha desbancando a la biopsia pleural con aguja para el diagnóstico de DP tuberculoso. Unas cifras de ADA pleural superiores a 35U/l tienen una sensibilidad del 93%, una especificidad del 90%, un cociente de probabilidad o likelihood ratio (LR) de 10 y un LR negativa de 0,07 para establecer el origen tuberculoso de un exudado linfocitario14. La mayoría de los falsos positivos de ADA se han descrito en DP paraneumónicos y empiemas que, a diferencia de los DP tuberculosos, contienen predominantemente neutrófilos. Aproximadamente, el 45% de los DP paraneumónicos complicados no purulentos, el 70% de los empiemas y el 10% de los DPs malignos (porcentaje que se eleva al 50% en el caso de los linfomas) exhiben cifras altas de ADA pleural14. Cuando las concentraciones de ADA son extremadamente elevadas (>250U/l) se sospechará empiema (diagnóstico fácil por la apariencia purulenta del LP) o linfoma14.
pH (¿indicación de tubo de drenaje en DPs paraneumónicos?)En condiciones fisiológicas, el pH del LP es alcalino (7,60–7,66), debido a la acumulación de bicarbonato en la cavidad pleural. Los trasudados pleurales tienen un pH que suele variar entre 7,40–7,55, mientras que en la mayoría de exudados este rango oscila entre 7,30–7,4515. Sin embargo, existe un grupo de DP exudativos con pH<7,30, lo que representa una acumulación substancial de iones hidrógeno en el espacio pleural. La etiología de estos DP, que suelen asociarse con un bajo contenido de glucosa (<60mg/dl), incluye: 1) DP paraneumónicos complicados y empiemas que, con diferencia constituyen la causa más frecuente de acidosis pleural (60%); 2) DP malignos; 3) DP tuberculosos; 4) DP secundarios a conectivopatías tipo artritis reumatoide o lupus eritematoso sistémico, y 5) rotura esofágica (empiema anaerobio)16. El único DP trasudativo (aunque también puede cumplir criterios de exudado) con pH<7,30 es el urinotórax, resultado de la migración de una orina ácida desde la cápsula de un riñón obstruido hacia el espacio pleural, a través de defectos diafragmáticos ipsilaterales17.
El pH del LP tiene interés clínico en el manejo de los pacientes con DP paraneumónico. La acidosis pleural que puede desarrollarse en este tipo de DP es el resultado del incremento de la actividad metabólica en el espacio pleural (fagocitosis neutrofílica y metabolismo bacteriano) con acumulación de productos derivados de la glucosa, CO2 y ácido láctico. Un DP paraneumónico de aspecto no purulento que tenga un pH<7,20 muy probablemente no se resolverá si no colocamos un tubo de drenaje pleural. No obstante, el pH carece, de forma individual, de la suficiente sensibilidad (60%) para identificar DP paraneumónicos complicados18. No tiene ningún interés y, de hecho, no se debe realizar, la medición del pH ni de cualquier otro parámetro, que no sea una tinción de Gram y un cultivo, en un DP purulento, puesto que los empiemas siempre requieren de un tubo de toracostomía.
La acidosis del LP en los DPs malignos (pH<7,30) se observa en aproximadamente el 15% de casos y es el resultado de una infiltración tumoral extensa de la pleura que inhibe el flujo de los productos finales de la glucosa desde el espacio pleural. En consecuencia, el pH bajo en el DP maligno se halla típicamente cuando la enfermedad está muy avanzada y se asocia con una supervivencia pobre, con una mayor rentabilidad (positividad) de los estudios citológicos del LP y con una peor respuesta a la pleurodesis19,20.
Glucosa (¿es el DP reumatoide o paraneumónico complicado?)El significado de una glucosa baja en el LP (<60mg/dl) es similar al de un pH bajo. Las concentraciones más bajas de glucosa, con cifras prácticamente indetectables en algunos casos, son propias de los DP paraneumónicos complicados, empiemas y DP reumatoides (70–80% de DP reumatoides tienen esta característica)15. En el DP paraneumónico unas concentraciones de glucosa en el LP<60mg/dl son un buen substituto del pH para la toma de decisiones terapéuticas.
Citología (¿es el DP maligno o reumatoide?)Un primer estudio citológico es positivo en tan sólo el 50% de los DPs malignos. Si se remite una segunda muestra para análisis, la rentabilidad global se incrementa un 10% (60% en total), pero son menos útiles citologías adicionales21. Este porcentaje significativo de falsas citologías negativas (40%) no solo depende del número de muestras analizadas, sino de otros factores como la experiencia del citólogo, el examen simultáneo de bloques celulares o el tipo de tumor. En una serie de 556 DP malignos sometidos a toracoscopia la sensibilidad de la citología del LP fue del 78% en cánceres de mama, 57% en cánceres de pulmón, 41% en mesoteliomas y 18% en linfomas22. Los análisis morfológicos e inmunofenotípicos de la celularidad pleural mediante citometría de flujo pueden confirmar el diagnóstico de linfoma pleural23.
Por otro lado, el hallazgo en el LP de macrófagos alargados en forma de renacuajo (tadpole cells) es muy característico de DP reumatoide, aunque sólo se observa en el 60% de los casos24.
Cultivos (¿es el DP infeccioso?)La tinción de Gram y los cultivos del LP en medios aerobio y anaerobio tienen interés solo si se sospecha una etiología bacteriana, ya que la identificación de un microorganismo confirma el diagnóstico, permite dirigir una terapia antimicrobiana específica y se considera una indicación para colocar un tubo de drenaje pleural. Desafortunadamente solo una cuarta parte de los DP paraneumónicos complicados no purulentos tienen cultivos positivos en el LP18; el porcentaje de cultivos positivos aumenta hasta el 70% en los empiemas12. La rentabilidad de los cultivos bacterianos parece superior si el LP se inocula en frascos de hemocultivos.
En las pleuritis tuberculosas la tinción de Ziehl del LP tiene una rentabilidad muy escasa (<5%), mientras que el cultivo de Lowenstein es positivo solo en una tercera parte de los casos25. Este hecho se debe a que la tuberculosis pleural es básicamente una reacción de hipersensibilidad retardada a la liberación de antígenos micobacterianos hacia el espacio pleural desde un foco caseoso subpleural. Por el contrario, en el empiema tuberculoso, una rara entidad típica de pacientes con un pulmón atrapado resultante de un neumotórax artificial, el LP es de aspecto purulento y contiene numerosos bacilos tuberculosos.
Análisis opcionales del líquido pleuralPéptidos natriuréticos (¿es el DP secundario a insuficiencia cardiaca?)Los péptidos natriuréticos BNP y NT-proBNP son hormonas que se sintetizan en el miocardio ventricular en respuesta al estrés parietal secundario a una sobrecarga de volumen o de presión. Unas concentraciones de NT-proBNP en LP >1.300pg/ml discriminan DP por insuficiencia cardiaca de aquellos de causa no cardiaca con una sensibilidad del 96%, especificidad del 88%, LR positivo de 8 y LR negativo de 0,0526. Además, el NT-proBNP pleural identifica correctamente el 90% de DP cardiacos clasificados erróneamente como exudados por los criterios de Light; un porcentaje significativamente superior al que resulta de aplicar el gradiente de albúmina (75%) o de proteínas (50%) entre suero y LP a este mismo tipo de derrames26. Finalmente, los péptidos natriuréticos son óptimos para diferenciar entre trasudados cardiacos y hepáticos (cirrosis) dado que el mecanismo fisiopatológico de formación de LP es distinto en ambos procesos27.
Anticuerpos antinucleares (¿es el DP secundario a lupus?)El DP se puede presentar hasta en el 30% de pacientes con lupus eritematoso sistémico en algún momento de la evolución de la enfermedad. Sin embargo, el DP en esta población puede ser debido a causas distintas a la pleuritis lúpica, como infecciones, embolismo pulmonar, síndrome nefrótico, insuficiencia cardiaca o neoplasias. La presencia o no de anticuerpos antinucleares (ANA) en el LP podría tener interés en los sujetos con lupus eritematoso sistémico conocido y DP de causa incierta: unos ANA negativos serían un argumento muy en contra de pleuritis lúpica y obligarían a buscar otras causas alternativas de DP28.
Amilasa (¿es el DP secundario a pancreatitis o rotura esofágica?)Unas cifras de amilasa pleural elevadas (por encima del límite superior de la normalidad para la amilasa sérica) indican generalmente que el DP se debe a una neoplasia, una tuberculosis, una enfermedad pancreática aguda o crónica (seudoquiste pancreático) o una rotura esofágica. Sólo si se sospecha alguna de estas dos últimas entidades está justificado solicitar una amilasa en el LP. La amilasa se encuentra elevada en alrededor del 15 y 10% de pacientes con DP maligno (más comúnmente cáncer de pulmón) o tuberculoso, respectivamente12. En las neoplasias y en la rotura esofágica la amilasa del LP es de origen salival, mientras que en las enfermedades del páncreas predomina la isoenzima pancreática.
Marcadores tumorales (¿es el DP maligno?)Diversos marcadores tumorales de uso clínico común se han estudiado en el LP para diagnosticar malignidad. Sin embargo, cuando se buscan puntos de corte con máxima especificidad (es decir, ningún DP benigno debe superarlos) se obtiene una baja sensibilidad diagnóstica. Por ejemplo, unas cifras pleurales de CEA > 50ng/ml o de CA 15-3 >75U/ml, aunque 100% específicas, se observan solo en el 30% de los DP malignos29. Aproximadamente un 20% de DP malignos con citología falsa negativa se podrían identificar correctamente mediante un panel de marcadores tumorales en el LP29, un porcentaje que probablemente no justifica su uso rutinario en la práctica clínica.
Existe un gran interés en la búsqueda de biomarcadores para el mesotelioma maligno, una neoplasia difícil de diagnosticar. La mesotelina soluble parece un buen candidato. Unas concentraciones de mesotelina soluble en el LP >20nM tienen una sensibilidad del 71% y una especificidad del 90% para distinguir mesotelioma de otras causas de DP (bien sean metástasis pleurales o procesos benignos)30. La medición de mesotelina en LP duplica la rentabilidad de la citología convencional para diagnosticar mesotelioma (70 vs. 35%)30. De forma práctica, unas cifras de mesotelina pleural<20 nM en un DP de etiología incierta harían muy improbable un mesotelioma.
Lípidos (¿es el DP quiloso o quiliforme?)El 85% de pacientes con quilotórax tienen concentraciones de triglicéridos en el LP >110mg/dl, un cociente de triglicéridos entre LP y suero >1 y un cociente de colesterol entre LP y suero<131. Si persisten dudas sobre la existencia de un quilotórax un análisis de lipoproteínas que demuestre quilomicrones en el LP es definitivo. En contraposición, el análisis bioquímico del LP en el seudoquilotórax revela la existencia de cristales de colesterol o de unas cifras de colesterol >250mg/dl.
Interferón-γ (¿es el DP tuberculoso?)La eficacia o valor global del interferón-γ en el LP para discriminar DPs tuberculosos de no tuberculosos es del 95%25. Como en el caso del ADA, tanto empiemas como linfomas pueden producir «falsas elevaciones» de esta citocina. No obstante, la determinación de ADA es una técnica con eficacia similar, pero más sencilla y barata que la medición de interferón-γ.
Reacción en cadena de la polimerasa para Mycobacterium tuberculosis (¿es el DP tuberculoso?)La sensibilidad media de las técnicas comerciales de amplificación de ácidos nucleicos para detectar ADN de M. tuberculosis en el LP es del 60% y la especificidad superior al 95%25. Por ello, estas pruebas sirven más para confirmar que para excluir el diagnóstico de pleuritis tuberculosa. Dado que este procedimiento es más caro y técnicamente más difícil que la ADA o el interferon-γ, no se recomienda su uso clínico rutinario.
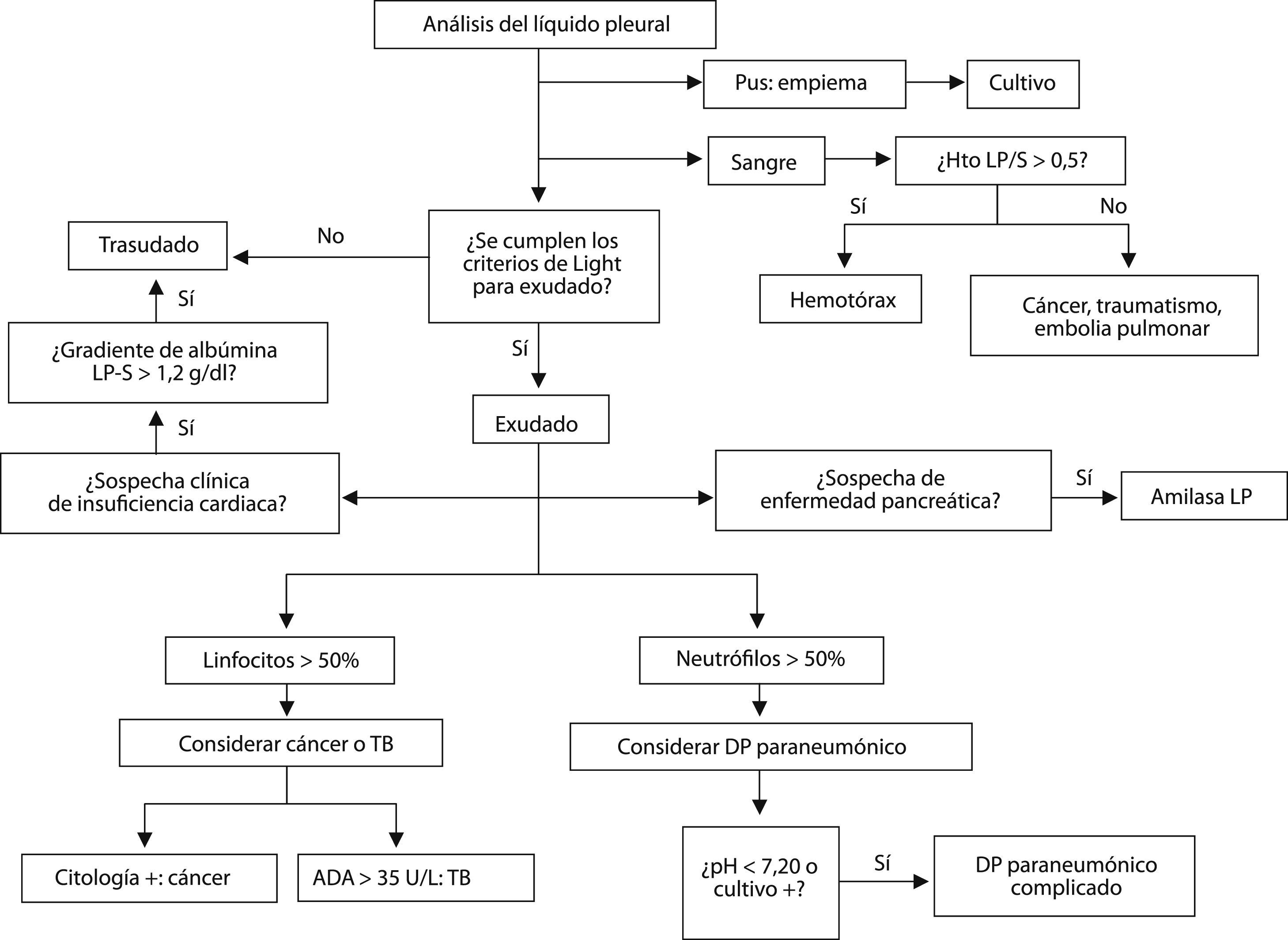
La figura1 representa un algoritmo diagnóstico del DP basado en el análisis del LP. Por último, la tabla 3 resume algunos de los errores más comunes que se cometen al interpretar las características del LP.
Errores frecuentes en la interpretación del líquido pleural
| Aventurar el diagnóstico de exudado por la apariencia macroscópica del LP |
| Diagnosticar un hemotórax por la mera presencia de un DP de apariencia hemorrágica, sin conocer el hematocrito del LP |
| Analizar las características bioquímicas de un LP francamente purulento (empiema) |
| Solicitar cultivos del LP de forma sistemática, aunque no exista sospecha clínica de infección del espacio pleural |
| Solicitar rutinariamente una tinción de Ziehl del LP |
| Indicar la colocación de un tubo de drenaje torácico cuando el pH del LP es<7,20 en un DP que no es secundario a una neumonía |
| Rechazar la posibilidad de que un DP sea maligno por la negatividad (repetida) de la citología del LP |
DP: derrame pleural; LP: líquido pleural.
El autor declara no tener ningún conflicto de intereses.