La fascitis necrotizante es una infección rápidamente progresiva de la piel y de los tejidos blandos que suele asociarse con una importante toxicidad sistémica. Su incidencia se ha incrementado durante los últimos años, afectando actualmente a uno de cada 100.000 habitantes en nuestro medio. Supone la forma más grave de infección de partes blandas, debido a la rápida destrucción y necrosis tisular y al desarrollo, en un tercio de los pacientes, de shock y fracaso multiorgánico. Aunque existen factores predisponentes para su aparición, principalmente en la fascitis tipo I o polimicrobiana, en muchas ocasiones se trata de pacientes jóvenes sin comorbilidad asociada, como sucede en los casos de fascitis necrotizante tipo II o estreptocócica. El diagnóstico es esencialmente clínico y en los casos de alta sospecha no debe retrasarse la exploración quirúrgica, ya que su pronóstico depende en gran medida de un diagnóstico precoz y de un tratamiento agresivo inmediato. Pese al mejor conocimiento de su etiopatogenia y a la disponibilidad de herramientas terapéuticas más eficientes, su mortalidad apenas se ha modificado en los últimos años, superando el 25%. El tratamiento se basa en soporte hemodinámico, tratamiento quirúrgico extenso y precoz, y antibioterapia empírica.
Necrotizing fasciitis is defined as a rapidly progressive infection of the skin and soft tissue that usually involves severe systemic toxicity. The incidence of this infection has increased in the last few decades and is estimated to affect one out of every 100,000 inhabitants in western European countries. This disease is the most serious form of skin and soft tissue infection, due to rapid destruction and necrosis of the fascia and subcutaneous fat, and the development of shock and multiorgan failure in about one third of patients.
Although there are several predisposing factors for the development of the disease, especially for type I, or polymicrobial, necrotizing fasciitis, many patients are young and have no underlying chronic diseases, as is the case for type II, or streptococcal, necrotizing fasciitis. The diagnosis is mainly clinical, and urgent surgical consultation is required as soon as possible once suspicion is high, as the main determinant of mortality is the delay in surgical treatment. Overall mortality remains high, affecting more than 25% of patients. Surgical debridement is the mainstay of treatment, along with hemodynamic support and broad-spectrum antibiotics.
La fascitis necrotizante (FN) es una infección rápidamente progresiva de la piel y de los tejidos blandos, asociada a destrucción y necrosis de la fascia y de la grasa, que se acompaña de importante toxicidad sistémica y alta mortalidad.
Existen en la literatura numerosas referencias de esta patología desde la antigüedad. La primera data del siglo v D.C., recogida de la descripción de Hipócrates de una infección cutánea necrotizante facial1. En 1871 el cirujano militar J. Jones, durante la guerra civil estadouidense, realizó una referencia detallada de la enfermedad, que afectó a 2.642 soldados con una mortalidad cercana al 50%, denominándola gangrena de hospital2.
En 1883, A. Fournier publicó la descripción detallada de la infección necrotizante de la región perineal y genital3 que actualmente se conoce como gangrena de Fournier. No fue hasta 1924 cuando Meleney estableció la etiología estreptocócica de la FN, tras aislar el estreptococo hemolítico en una muestra de 20 enfermos en Beijing, acuñando el nombre de gangrena estreptocócica aguda hemolítica4. En 1952, Wilson estableció finalmente el nombre de fascitis necrotizante5.
La presencia de necrosis fascial es la condición definitoria de la enfermedad, ya que está ausente en la celulitis necrotizante y en la mionecrosis. La FN supone la forma más grave de infección de partes blandas (tabla 1), y su pronóstico depende esencialmente de un diagnóstico precoz y un tratamiento agresivo inmediato. Pese al mejor conocimiento de su etiopatogenia y a la disponibilidad de herramientas terapéuticas más eficientes, la mortalidad de la FN apenas se ha modificado en los últimos años6.
Clasificación de las infecciones necrotizantes
| Celulitis necrotizantes |
| Celulitis clostridial |
| Celulitis anaeróbica no clostridial |
| Gangrena sinergística de Meleney |
| Celulitis necrotizante sinergística |
| Fascitis necrotizantes |
| Tipo I (polimicrobiana) |
| Tipo II (estreptocócica) |
| Miositis necrotizante/gangrena gaseosa |
| Piomiositis |
El US Centers for Disease Control and Prevention estima la incidencia de la FN en unos 500-1.000 casos anuales en Estados Unidos, con una tasa de incidencia anual de 0,4 casos por 100.000 habitantes7, mientras que en la mayoría de países de Europa occidental ronda alrededor de un caso por 100.000 habitantes8. Dicha incidencia se ha incrementado de forma significativa durante los últimos años, probablemente en relación al envejecimiento poblacional y la presencia de mayor número de sujetos inmunosuprimidos9. En nuestro país desconocemos datos de su incidencia, aunque según los datos recogidos por el Instituto Nacional de Estadística durante el año 2009 se produjeron en España 54 fallecimientos por FN; el 57,4% correspondió a varones, y el 64,8%, a mayores de 70 años10.
Etiología y factores de riesgoEn función del agente etiológico, se podrían definir dos entidades diagnósticas11:
- •
FN tipo I (polimicrobiana). Es una infección habitualmente polimicrobiana, causada en dos de cada tres casos por al menos un germen anaerobio (bacteroides, clostridium, peptoestreptococos) y uno o más anaerobios facultativos (estreptococos no A) y enterobacterias, cuya actuación sinérgica origina la infección12.
Streptococcus pneumoniae no suele producir infección de partes blandas, por lo que son infrecuentes las celulitis13 y excepcionales los casos de FN por S. pneumoniae, casi todos en pacientes de edades extremas con enfermedades crónicas14. Vibrios y aeromonas son causantes ocasionales de FN. Las diferentes especies de vibrios suelen producir casos de FN de curso fulminante y con alta mortalidad, especialmente en pacientes con comorbilidad asociada, como hepatopatía crónica y diabetes mellitus15.
- •
FN tipo II (estreptocócica). Suele tratarse de una infección monomicrobiana, producida fundamentalmente por estreptococos beta-hemolíticos del grupo A (en menor medida C y G), y menos frecuentemente por otras especies, como Staphylococcus aureus.
Los estreptococos del grupo A (SGA), como S. pyogenes, son cocos grampositivos aerobios que suelen causar infecciones faríngeas y de piel y tejidos blandos16. Con menos frecuencia ocasionan infecciones invasivas, definidas como bacteriemia, neumonía, FN, miositis gangrenosa o cualquier otra infección en la que se aísle dicho estreptococo de un lugar estéril17.
S. aureus es una causa infrecuente de FN, con una incidencia estimada de 0,1/100.000 habitantes18. A pesar de que la mayoría de ellas son producidas por cepas sensibles a betalactámicos y se asocian con baja mortalidad19, en los últimos años se ha incrementado el número de aislamientos de S. aureus resistente a meticilina (SARM) de probable origen comunitario en los pacientes con FN20, con presencia en la mayoría de ellos de leucocidina de Panton-Valentine (LPV)21–23. De hecho, las infecciones más frecuentes producidas por SARM extrahospitalario son las de piel y las de tejidos blandos24. Existen determinados colectivos con mayor riesgo de infección por SARM extrahospitalario25: niños menores de dos años, atletas, usuarios de drogas por vía parenteral (UDVP), homosexuales, militares, veterinarios e individuos institucionalizados.
Los principales factores de riesgo para el desarrollo de esta FN son la inmunosupresión, la diabetes mellitus, la arteriopatía periférica y las cirugías recientes, condiciones cada vez más prevalentes en el mundo occidental (tabla 2)26–28. La posible relación entre el consumo crónico de antiinflamatorios no esteroideos (AINE) y la incidencia y progresión de FN, que podría ser explicada por el enmascaramiento de los signos inflamatorios en la fase inicial de la enfermedad, no fue confirmada en una revisión de 5 series29.
Principales factores de riesgo para el desarrollo de fascitis necrotizante
| Factores generales |
| Diabetes mellitus |
| Alcoholismo |
| Inmunosupresión |
| Obesidad |
| Glucocorticoides |
| Consumo de antiinflamatorios no esteroideos |
| Enfermedades tumorales |
| Edades extremas |
| Factores locales |
| Heridas cutáneo-mucosas |
| Traumatismo local |
| Cirugía local |
| Venopunción |
| Arteriopatía periférica |
En la literatura se han descrito algo más de 30 casos de FN asociada a enfermedades reumáticas, en su mayoría en pacientes con lupus eritematoso sistémico tratados con corticosteroides30,31. Los estudios poblacionales de pacientes con artritis reumatoide (AR) muestran que dichos enfermos presentan un aumento del riesgo de infección en comparación con pacientes sin dicha enfermedad. En algunos de tales estudios se han encontrado factores predictores de infección, como edad avanzada, manifestaciones extraarticulares, factor reumatoide positivo, comorbilidades (enfermedad pulmonar crónica, alcoholismo, enfermedad orgánica cerebral y diabetes mellitus), uso de glucocorticoides y tratamientos biológicos32,33. Se ha observado asimismo un incremento de riesgo de infecciones de partes blandas en los pacientes con AR34,35, y parece existir un mayor riesgo en los pacientes que reciben tratamiento con anti-TNF respecto a los que reciben fármacos modificadores de la enfermedad (FAME)36,37. Un metaanálisis publicado en 2008 mostró que otros fármacos biológicos para el tratamiento de la AR no anti-TNF, como el rituximab, el abatacept o la anakinra, no parecen relacionarse con un incremento del riesgo de infecciones38. Por último, también aparecen publicados algunos casos de infecciones necrotizantes en enfermos gotosos39.
Patogenia e histologíaEl conocimiento de la patogenia de la enfermedad es esencial para comprender el curso clínico y la importancia del diagnóstico precoz en el pronóstico de la FN40,41. El proceso se inicia en la fascia superficial, donde las bacterias proliferan y producen toxinas y enzimas que permiten la extensión de la enfermedad de forma horizontal por dicha fascia. Se cree que enzimas como la hialuronidasa, capaces de originar la degradación de la fascia, juegan un papel fundamental en este proceso. La proliferación bacteriana produce necrosis de la fascia superficial y trombosis de los microvasos, lo cual origina liberación de mediadores inflamatorios e isquemia tisular, que perpetúan la lesión de dichos tejidos. Cuando se destruye la fascia superficial y existe isquemia del tejido celular subcutáneo la infección progresa de forma vertical, afecta a los planos profundos y a la dermis superficial, y aparecen entonces los signos clínicos locales de la enfermedad: necrosis cutánea, ulceración y presencia de lesiones ampollosas.
Histológicamente, aparece necrosis de la fascia superficial, infiltración de la misma y de la dermis profunda por polimorfonucleares y células del sistema mononuclear fagocítico, trombosis de los microvasos, destrucción y licuefacción de la grasa y proliferación bacteriana. Se ha descrito la presencia de trombosis microvascular a distancia, como en el caso de un paciente que falleció por una FN en el codo, en el que se encontraron trombos en los lechos vasculares pulmonar, esplénico y cardiaco42. A diferencia de la erisipela, no suelen encontrarse microorganismos en la epidermis, y la existencia de linfangitis es excepcional.
Manifestaciones clínicasLa FN tipo I suele afectar a pacientes con comorbilidades asociadas y es frecuente encontrar una puerta de entrada (traumatismos cutáneos, heridas quirúrgicas, venopunciones, lesiones vesiculosas cutáneas, picaduras de insectos, mordeduras animales…). En los diabéticos, el proceso se suele iniciar en la región distal de las extremidades inferiores, en especial en los enfermos con vasculopatía y neuropatía periféricas. Otras localizaciones menos frecuentes son la región cervical y la perineal:
- •
La FN cervical, o angina de Ludwig, se suele originar a partir de un foco infeccioso odontógeno; las piezas dentarias más frecuentemente involucradas son el segundo y el tercer molares43. Con menor frecuencia el proceso tiene su inicio en un traumatismo cervical, abscesos faríngeo o amigdalino, sinusitis, adenitis o infecciones de tumores en la región cervicofacial44.
- •
La infección perineal, o gangrena de Fournier, se origina por la penetración de bacterias entéricas en el espacio fascial perianal, por vía gastrointestinal o uretral, y puede extenderse rápidamente a la pared abdominal anterior, a los glúteos, al escroto y al pene.
Los pacientes con FN tipo II son habitualmente sanos y suele ser difícil documentar una puerta de entrada.
El curso clínico se suele iniciar en forma de dolor de gran intensidad, desproporcionado inicialmente respecto a la ausencia de evidentes signos cutáneos. Se ha descrito una clasificación clínica en 3 estadios para definir el proceso clínico de la FN45:
- •
En una primera fase aparecen los signos inflamatorios locales cutáneos, y lo más llamativo es el dolor. En el 20% de casos aparece un síndrome seudogripal, y en el 10% puede existir un eritema escarlatiniforme.
- •
En un segundo estadio pueden aparecer ampollas o flictenas, induración cutánea y fluctuación. La presencia de ampollas es un dato muy específico pero poco sensible; aparece tan solo en el 25-30% de los casos y suele traducir una extensa destrucción tisular. Su contenido es inodoro en infecciones estreptocócicas y fétido en el caso de infecciones por anaerobios.
- •
En una tercera fase las ampollas se rellenan de contenido hemorrágico, la destrucción de las fibras nerviosas produce anestesia cutánea, la presencia de gas en las infecciones por gérmenes anaerobios da lugar a crepitación y aparece necrosis cutánea. Algunos autores han estimado que durante esta tercera fase clínica de la enfermedad se produce una destrucción de hasta 4cm2 de superficie cutánea cada hora46.
Existen cuatro signos clínicos principales que deben hacer sospechar la presencia de una infección necrotizante: edema e induración más allá del área eritematosa, existencia de ampollas o flictenas (en especial si su contenido es hemorrágico), crepitación o presencia de gas en las pruebas de imagen, y ausencia de linfangitis o adenitis asociada.
Síndrome del shock tóxico estreptocócico (SSTS)Las infecciones invasivas producidas por SGA (bacteriemia, neumonía, FN, miositis gangrenosa o cualquier otra infección en la que se aísle dicho estreptococo de un lugar estéril) se acompañan en casi una tercera parte de las ocasiones de un shock tóxico estreptocócico, definido como una infección estreptocócica asociada a la rápida aparición de shock y fracaso multiorgánico47. Estas infecciones estreptocócicas han incrementado su incidencia en los países desarrollados durante los últimos años, afectando a sujetos de cualquier edad y en su mayoría sin comorbilidad asociada48,49. De forma excepcional se han descrito brotes epidémicos de infecciones graves por SGA50.
El SSTS está mediado por toxinas que actúan como superantígenos y que son responsables de la activación masiva de las células mediadoras de la reacción inflamatoria, produciendo destrucción tisular y toxicidad sistémica. A pesar de que aún no se conocen por completo los factores de virulencia asociados al SSTS, se postula que en dicho proceso existen dos componentes fundamentales:
- •
La proteína M es una proteína filamentosa transmembrana del SGA que tiene propiedades antifagocíticas y contribuye a la adhesión tisular y a la hiperactivación del sistema inmune51. Su gran variabilidad determina la existencia de más de 80 serotipos de SGA; los que carecen de proteína M son menos virulentos, y los tipos 1, 2, 12 y 28 son los más frecuentemente aislados en los pacientes con SSTS52.
- •
Las exotoxinas pirogénicas estreptocócicas (EPS) inducen la liberación de citocinas proinflamatorias (factor de necrosis tumoral alfa [TNF-α], interleucinas 1β y 6) mediante la activación de células presentadoras de antígeno. Se cree que el TNF-α es el principal mediador de la fiebre, el shock y la destrucción tisular del SSTS53,54. Se sugiere un papel patogénico para el superantígeno estreptocócico, una exotoxina pirogénica aislada a partir de un estreptococo del serotipo M-355, aunque todavía no ha sido demostrado.
Clínicamente, el SSTS conlleva la aparición de shock y fracaso multiorgánico. En el 20% de los pacientes con SSTS no existen signos de afectación cutánea. Pese al tratamiento precoz, en el 90% de los pacientes persiste el shock a las 8h de ingreso17. Al diagnóstico, existe deterioro del nivel de conciencia en el 55% de los pacientes, y algo más de la mitad de casos desarrollan un síndrome de distrés respiratorio agudo, que suele aparecer tras la instauración de hipotensión56. Otras complicaciones que pueden aparecer de forma ocasional son la coagulación intravascular diseminada y el síndrome de Waterhouse-Friederichsen57.
Analíticamente, en el 40-50% de los pacientes el fallo renal —definido por la presencia de hemoglobinuria y elevación de creatinina sérica— precede a la hipotensión, por lo que es un acontecimiento precoz en el proceso patogénico17. La hipotensión, la mioglobinuria y la hemoglobinuria (secundaria a hemólisis) contribuyen a la afectación renal, que suele tardar 4-6 semanas en recuperarse y en la que muchos de los enfermos precisan diálisis17. Los hemocultivos son positivos en el 60% de los pacientes con SSTS17.
DiagnósticoEl diagnóstico de la FN es inicialmente clínico, confirmado siempre por los hallazgos quirúrgicos, tanto histológicos como microbiológicos (tabla 3)58.
Criterios diagnósticos de la fascitis necrotizante tipo II
| Necrosis cutánea con afectación fascial |
| Afectación sistémica (al menos uno de los siguientes): |
| Muerte |
| Shock/hipotensióna |
| Coagulación intravascular diseminada |
| Disfunción orgánica: |
| Distrés respiratorio agudo |
| Fallo renalb |
| Hepatopatíac |
| Aislamiento del estreptococo grupo A a partir de un sitio estéril |
| Confirmación serológica del estreptococo grupo Ad |
| Crecimiento de cocos grampositivos en el tejido necrótico |
*Caso definitivo: 1+2+3. Caso probable: 1+2+(4 o 5).
Los hallazgos intraoperatorios suelen incluir la presencia de necrosis cutánea y fascial, falta de adherencia fascial a los planos profundos, ausencia de hemorragia en los planos fasciales durante la disección, y presencia de exudado en los planos cutáneos. La confirmación diagnóstica se obtiene mediante el cultivo y el análisis histológico de los tejidos blandos afectados.
La realización de una biopsia cutánea para el diagnóstico precoz de la FN, que consiste en el análisis histológico y gram inmediatos de una muestra cutánea profunda40, no se aconseja en los casos de alta sospecha; en tales casos debe realizarse una exploración quirúrgica inmediata59.
Analíticamente se pueden encontrar datos de afectación sistémica, en presencia de hepatopatía, coagulopatía y fallo renal. En comparación con las infecciones de partes blandas menos severas, la leucocitosis está presente en el 84% de casos, y frecuentemente hay un recuento leucocitario >20.000/mm3, un nitrógeno ureico >18mg/dl y una creatinina sérica ≥1,2mg/dl59. En 2004, Wong y Khin propusieron el Laboratory Risk Indicator for Necrotizing Fasciitis (LRINEC score), un índice analítico que ayudaría a establecer la probabilidad diagnóstica de la FN de forma precoz, aunque no ha sido validado aún en estudios prospectivos (tabla 4)60,61. Un índice LRINEC ≥6 permitiría establecer la sospecha de FN, mientras que un resultado ≥8 sería altamente predictivo de la enfermedad.
Indicador analítico de riesgo de fascitis necrotizante (Laboratory Risk Indicator for Necrotizing Fasciitis, LRINEC score)
| Puntos | |
| Proteína C reactiva, mg/l | |
| <150 | 0 |
| >150 | 4 |
| Recuento leucocitario, por mm3 | |
| <15.000 | 0 |
| 15-25.000 | 1 |
| >25.000 | 2 |
| Hemoglobina, g/dl | |
| >13,5 | 0 |
| 11-13,5 | 1 |
| <11 | 2 |
| Sodio, mmol/l | |
| ≥135 | 0 |
| <135 | 2 |
| Creatinina, mg/dl | |
| ≤1,6 | 0 |
| >1,6 | 2 |
| Glucemia, mg/dl | |
| ≤180 | 0 |
| >180 | 1 |
La utilidad clínica de la pulsioximetría para establecer el diagnóstico diferencial entre la FN y las infecciones de tejidos blandos menos severas no ha sido establecida62.
Cuando la sospecha clínica es alta, el desbridamiento quirúrgico no debería posponerse por la realización de una técnica de imagen, cuya tasa de falsos negativos es elevada41. La tomografía computarizada (TC) es el estudio de imagen de elección, dada su mayor disponibilidad y rápida realización en comparación con la resonancia magnética (RM)63. La TC permite identificar engrosamiento y edema de la fascia profunda y presencia de gas en los planos fasciales (figs. 1 y 2). La administración de contraste intravenoso no proporciona más información y sí condiciona una mayor duración de la prueba64. La RM posee una sensibilidad del 90-100% y una especificidad del 50-80% para el diagnóstico de las infecciones necrotizantes de los tejidos blandos65,66. La ecografía y la radiología simple son de menor utilidad67,68.
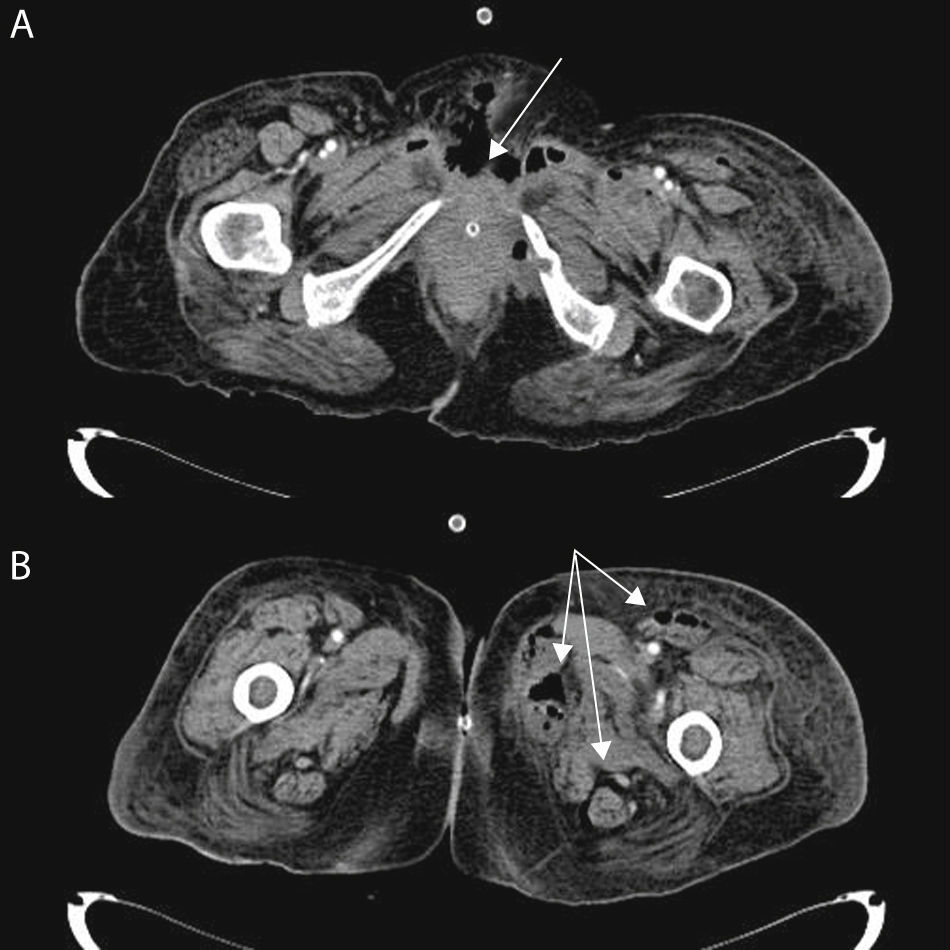
TC abdominopélvica (A) y de las extremidades inferiores (B) de una paciente de 60 años, diabética, con carcinoma endometrial metastásico, con extensa fascitis necrotizante perineal (flecha, imagen A), retroperitoneal, pared abdominal anterior y extremidades inferiores (flechas, imagen B). El cultivo de un absceso del muslo izquierdo fue positivo para E. coli multisensible.
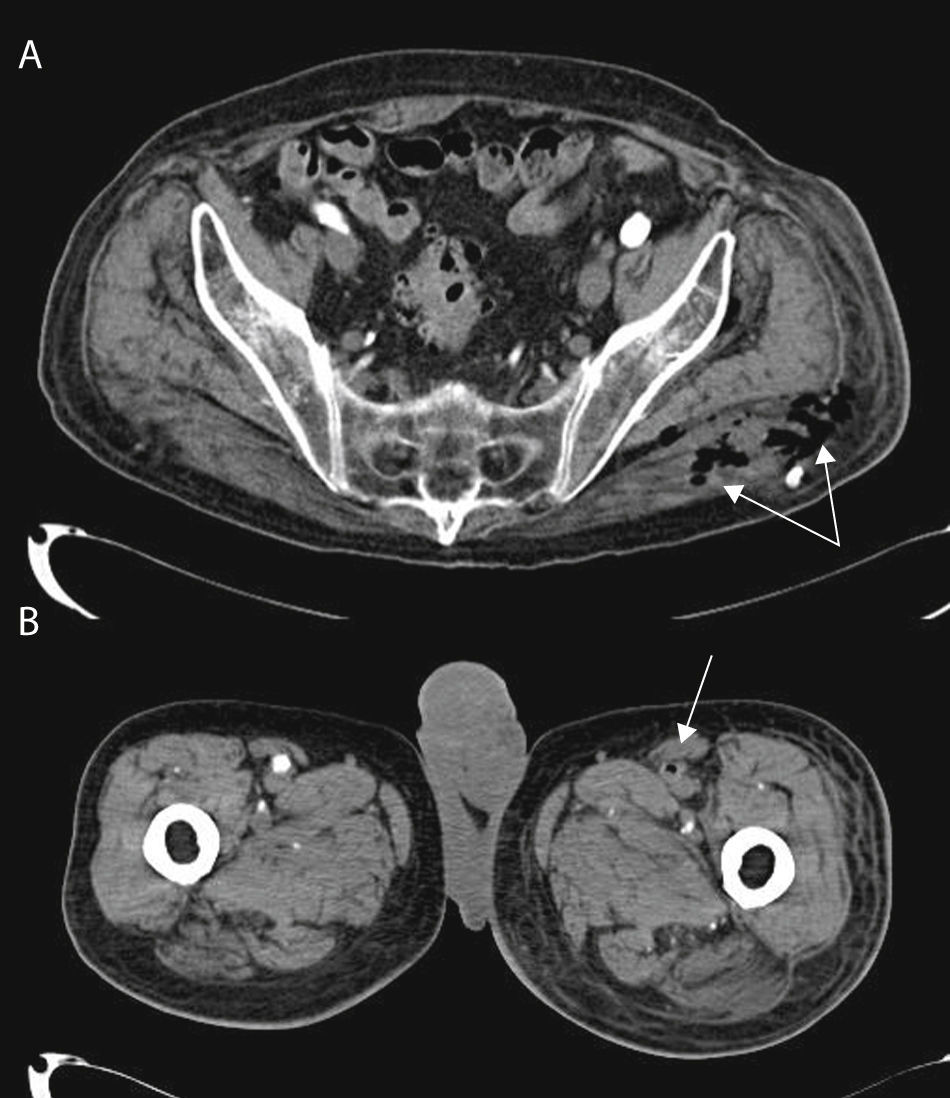
TC abdominal de un varón de 86 años, diabético y con antecedentes de cardiopatía isquémica y enfermedad cerebrovascular, con fascitis necrotizante por Clostridium septicum de localización retroperitoneal con extensión glútea (flechas, imagen A) y cuadricipital izquierda, con trombosis séptica arterial femoral izquierda (flecha, imagen B).
El diagnóstico microbiológico local debe realizarse a partir de los tejidos obtenidos en el proceso quirúrgico, idealmente de la zona periférica a la necrosis, donde existe tejido viable. El cultivo del exudado vesicular o de la superficie cutánea es poco rentable63. Los hemocultivos son positivos en aproximadamente el 60% de pacientes con SSTS48. Los hemocultivos positivos suelen ser polimicrobianos en los casos de FN tipo I, y pueden no reflejar exactamente los microorganismos implicados en la infección local. En un estudio retrospectivo realizado por Hsiao et al. en 2008, los hemocultivos fueron positivos en el 29% de pacientes con FN (en el 7% de ellos polimicrobianos) y los cultivos quirúrgicos en el 76% (en el 30% de ellos polimicrobianos)69.
PronósticoA pesar de un tratamiento intensivo precoz, la mortalidad de la FN es elevada. La tasa de mortalidad se establece en torno al 21% para los pacientes con FN tipo I12 y entre el 14 y el 34% para la FN tipo II9,17, el 22% en los casos de angina de Ludwig70 y del 22 al 40% para la gangrena de Fournier71. De los pacientes con FN tipo 2, la mortalidad es mayor para los que desarrollan un shock tóxico estreptocócico, situándose esta en el 28 al 70%49,72,73.
Los principales determinantes de la mortalidad en los pacientes con FN son el diagnóstico y el desbridamiento quirúrgico precoces, como se ha demostrado en diversos estudios74–76. Wong et al. encontraron una mortalidad 9 veces mayor para los pacientes en los que la exploración quirúrgica se realizaba más allá de las primeras 24h tras su llegada al hospital12. Aunque no existen en la literatura trabajos prospectivos de suficiente tamaño muestral que estudien los factores pronósticos de la enfermedad, se han descrito como posibles factores determinantes de mortalidad9,69,77–78: edades extremas, presencia de hipotensión, leucopenia y bacteriemia, infección por aeromonas o vibrios y localización en la región abdominoperineal. La virulencia de determinadas cepas de SGA se ha postulado también como un determinante de mortalidad48.
La escala APACHE-II parece tener importancia pronóstica en esta entidad al diagnóstico79.
En 2005, Anaya et al. estudiaron de forma retrospectiva los factores pronósticos en 166 pacientes con FN80. Los factores que se asociaron a una mayor mortalidad fueron la presencia de leucocitosis >30.000/mm3, creatinina >2mg/dl, infección por clostridium y presencia de cardiopatía previa.
Elliot et al. demostraron en 1996 una alta morbilidad para los pacientes que sobrevivieron a la enfermedad: otras infecciones nosocomiales (76%), fallo renal agudo (32%), necesidad de ventilación mecánica (29%), crisis comiciales (5%), accidentes cerebrovasculares (4%), paro cardiorrespiratorio (3%) e insuficiencia cardiaca (2%)81.
TratamientoEl tratamiento de la FN comprende medidas de soporte hemodinámico, un extenso desbridamiento quirúrgico precoz y antibioterapia (tabla 5), además de las medidas de cuidado generales cuando sean necesarias (elevación e inmovilización del miembro afectado, sedación, analgesia con opiáceos, diálisis —en presencia de acidosis o hiperpotasemia grave—, nutrición parenteral, corrección de las alteraciones electrolíticas…). Habitualmente es necesario el manejo integral en una unidad de cuidados intensivos, cuyos aspectos específicos no son abordados en esta revisión. El 90% de los pacientes con SSTS precisan intubación y ventilación mecánica73.
Resumen del tratamiento empírico inicial de la fascitis necrotizante
| Soporte hemodinámico y respiratorio, habitualmente en unidad de cuidados intensivos | |
| Desbridamiento quirúrgico precoz y extenso | |
| Tratamiento antibiótico empírico | |
| FN tipo I | FN tipo II |
| • Carbapenem (de elección, en especial si hay un ingreso reciente o antibioterapia previa)• Ampicilina/ampicilina-sulbactam más clindamicina/metronidazol– En la FN cervical suele ser eficaz la penicilina o la clindamicina | • Penicilina G más clindamicina |
| – Se debe asegurar cobertura anti-SAMR en las poblaciones con alta prevalencia, en especial en UDVP | |
| Otras medidas terapéuticas:• Inmunoglobulinas intravenosas: resultados prometedores en estudios no controlados; no aprobado por la FDA para el tratamiento de la FN• Oxígeno hiperbárico: resultados inconsistentes• Anticuerpos anti-TNF: no probados en humanos• Profilaxis post-exposición | |
FN: fascitis necrotizante; SARM: Staphylococcus aureus resistente a la meticilina; FDA: Food and Drug Administration; TNF: factor de necrosis tumoral; UDVP: usuarios de drogas por vía parenteral.
Se debe iniciar la reanimación hemodinámica de forma precoz, en especial cuando existe hipotensión o evidencia de disfunción orgánica, y se deben emplear aminas vasoactivas en caso de shock refractario a la reposición de volumen, aunque no existen estudios controlados que evalúen su eficacia en esta situación.
Tratamiento quirúrgicoComo ya se ha comentado, el tratamiento quirúrgico es la base del tratamiento de la FN, y su retraso es el principal factor determinante de mortalidad. Los objetivos de la cirugía son confirmar el diagnóstico de sospecha, realizar una necrosectomía, un desbridamiento quirúrgico extenso y el drenaje de las posibles colecciones existentes, y la obtención de material para el diagnóstico histológico y microbiológico. Se recomienda realizar reevaluación quirúrgica al menos tras 24h de la inicial, y posteriormente tantas veces como sea preciso hasta conseguir eliminar todo el tejido necrótico y el control de la infección local82.
Las recomendaciones para los agentes tópicos, apósitos y autoinjertos son similares a las de los grandes quemados. El beneficio del desbridamiento enzimático y de las soluciones cáusticas no ha sido establecido mediante estudios controlados, al igual que sucede con los dispositivos de cierre quirúrgico asistidos mediante vacío63.
La amputación de la extremidad es necesaria en el 20% de los casos de FN de las extremidades, y más frecuentemente en UDVP82. Suele requerirse amputación en casos de infección fulminante, afectación articular o persistente pese al tratamiento quirúrgico y antibiótico adecuados.
Tratamiento antibióticoDebe iniciarse de forma precoz y empírica ante la sospecha de FN. El régimen antibiótico debe basarse en la sospecha clínica56,59,81:
- •
Para la FN tipo I se debe basar en una combinación de ampicilina o ampicilina-sulbactam más clindamicina o metronidazol. En los pacientes con hospitalización reciente o toma previa de antibióticos se debería ampliar la cobertura frente a gérmenes gramnegativos, sustituyendo la ampicilina por piperacilina-tazobactam o por un carbapenem. La penicilina o la clindamicina suelen ser eficaces en el tratamiento de la FN cervical.
- •
Para la FN tipo II (estreptocócica), a pesar de que no existen estudios aleatorizados bien diseñados y de amplio tamaño muestral, se recomienda la administración de penicilina G más clindamicina56.
A pesar de que el SGA presenta una alta sensibilidad a betalactámicos, las infecciones severas producidas por dicho germen se asocian con una elevada mortalidad cuando se tratan con penicilina en monoterapia17,48.
La clindamicina parece ser más eficaz que la penicilina como monoterapia en el tratamiento de las infecciones cutáneas por SGA83. Se ha sugerido que esta diferencia se podría deber a varios factores relacionados con la clindamicina: su eficacia no es dependiente del tamaño del inóculo bacteriano o de la capacidad de proliferación bacteriana84, tiene mayor efecto postantibiótico85, es capaz de suprimir la síntesis de exotoxinas bacterianas86, inhibe la síntesis de la proteína M transmembrana87 e induce la supresión del TNF88.
Se debería asegurar cobertura antibiótica frente al SARM de forma empírica en las poblaciones en las que sea prevalente, y en especial en los UDVP22,23,89. La incidencia de SARM resistente a la clindamicina impide la utilización de ésta en monoterapia para asegurar la cobertura de bacterias grampositivas en infecciones graves63.
No hay estudios que determinen la duración óptima del tratamiento antibiótico, por lo que debería individualizarse según la evolución clínica.
Otras medidas terapéuticas- •
Inmunoglobulinas intravenosas (IGIV). Su efecto beneficioso se atribuye a su capacidad para neutralizar las exotoxinas circulantes, impedir la proliferación de los linfocitos T e inhibir la producción de otros factores de virulencia, como el TNF-α y la interleucina 690. Mientras que un estudio no controlado y de pequeño tamaño muestral llevado a cabo por Norrby-Teglund et al. en 2005 mostró un importante incremento de la supervivencia en los pacientes tratados con IGIV91, dos estudios realizados en 2006 limitan su beneficio clínico a los pacientes críticos con infecciones necrotizantes estafilocócicas o estreptocócicas92,93. Se precisa de más estudios para establecer una recomendación definitiva acerca de la eficacia de las IGIV, y su indicación para la FN no ha sido aprobada por la FDA.
Respecto a la utilización de las IGIV en el SSTS, un estudio desarrollado por Darenberg en 2003 encontró una mortalidad 3,6 veces mayor en el grupo que no recibió IGIV94.
- •
Oxígeno hiperbárico. Se sugiere que podría inhibir la producción de exotoxinas y mejorar la capacidad fagocítica de los neutrófilos95. Aunque la evidencia de su eficacia es mayor en las infecciones clostridianas96, los resultados en las infecciones necrotizantes cutáneas son inconsistentes97. Un trabajo desarrollado por Mindrup en 2005 sobre 42 pacientes con gangrena de Fournier encontró un incremento de la mortalidad, de la morbilidad y del coste económico en los pacientes tratados con oxígeno hiperbárico98.
- •
Anticuerpos anti-TNF. A pesar de no haber sido estudiados sus beneficios en humanos, sus efectos en modelos animales son esperanzadores99.
- •
Profilaxis postexposición. Su beneficio en los contactos de pacientes que desarrollan infecciones invasivas por SGA no ha sido suficientemente estudiado. Se cree que podría ser beneficiosa la profilaxis con penicilina en los sujetos que hayan mantenido contacto con el paciente, en especial los inmunodeprimidos, los recién nacidos, los niños con varicela o los sujetos en el postoperatorio inmediato100. Por este motivo, Douglas sugiere realizar aislamiento de contacto en los pacientes con infecciones estreptocócicas graves101.
La FN es una patología de creciente incidencia que asocia una importante morbimortalidad, dado su curso rápido y su amplia destrucción tisular, asociada en muchos pacientes a la aparición de shock séptico. La similitud clínica en sus fases iniciales a determinadas patologías reumatológicas, con predominio del dolor y signos inflamatorios locales, así como el hecho de su mayor prevalencia en pacientes inmunodeprimidos (pacientes con lupus eritematoso sistémico o AR tratados de forma crónica con glucocorticoides y/o fármacos inmunomoduladores), hacen necesario que los reumatólogos conozcamos esta entidad para asegurar una sospecha clínica precoz y un inicio rápido de las medidas terapéuticas adecuadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.