La calcifilaxis, también denominada arteriolopatía urémica calcificante, es una alteración vascular rara, aunque grave, con una elevada tasa de morbimortalidad. Tiene una prevalencia que oscila entre el 1 y el 4% de los pacientes con insuficiencia renal crónica. Con mayor frecuencia afecta a pacientes de edad media-avanzada, de sexo femenino, raza blanca, diabéticos y VIH positivos. La patogénesis de esta enfermedad aún no ha quedado clara, pero se han involucrado diversos factores de riesgo, destacando el hiperparatiroidismo secundario, una elevación del producto CaxP superior a 55mg/dl, niveles normales o elevados de Ca en sangre, altas dosis de metabolitos activos de la vitamina D, etc. Anatomopatológicamente se manifiesta como una vasculopatía de vasos pequeños, en los que se produce calcificación mural con proliferación de la íntima, fibrosis y, finalmente, trombosis del vaso afecto, desembocando en isquemia del tejido irrigado. Clínicamente, se manifiesta con nódulos subcutáneos y placas violáceas, purpúricas o equimóticas, extremadamente dolorosas, sobre una base de eritema moteado o reticular semejante a la livedo reticularis. Estas lesiones progresan en pocos días a la formación de úlceras necróticas recubiertas de escaras negruzcas. El diagnóstico se sospecha por los hallazgos en la anamnesis y examen físico. Las medidas terapéuticas son poco eficaces, debiendo estar dirigidas al control adecuado del P, a la normalización de calcemia y del producto CaxP, y se debe evitar el uso de metabolitos activos de vitamina D.
Calciphylaxis, also known as calcific uremic arteriolopathy, is a rare but serious vascular alteration with a high rate of morbidity and mortality. The prevalence ranges between 1 and 4% of patients with chronic renal failure. This disease most frequently affects the elderly, women, Caucasians, and persons with diabetes or HIV. The pathogenesis remains unclear, but various risk factors are involved, including secondary hyperparathyroidism, elevated calcium x phosphorus product >55mg/dl, normal or high blood calcium levels, and high doses of active vitamin D metabolites, etc.
Pathologically, this disease manifests as a small vessel vasculopathy in which there is mural calcification with intimal proliferation, fibrosis and eventually thrombosis of the affected vessel, resulting in ischemia of the irrigated tissue. Clinically, the disease manifests by subcutaneous nodules and extremely painful violet, purple or ecchymosis plaques, over a mottled or reticular erythema similar to livedo reticularis. In a few days these lesions progress to the formation of necrotic ulcers covered with black eschar. The diagnosis is suspected on the basis of history taking and physical examination. Therapeutic measures are ineffective and should be directed at controlling phosphorus and calcium and standardizing calcium x phosphorus product is< 55mg/dl. The use of active vitamin D metabolites should be avoided.
El término arteriolopatía calcificante urémica acuñado por Coates (1998) comienza a reemplazar al de calcifilaxis, que fue introducido por Seyles (1962). Este último, aunque ampliamente utilizado, corresponde a la unión de dos conceptos, calcificación y anafilaxis, que expresaban lo observado por el autor.
DefiniciónLa calcifilaxis es una alteración vascular rara, aunque grave, con una elevada tasa de morbimortalidad, que se caracteriza por una progresiva calcificación vascular con necrosis isquémica de la piel y de los tejidos blandos.
EpidemiologíaLos primeros casos de calcifilaxis fueron descritos en la década de los 60, como hemos comentado. Tiene una prevalencia que oscila entre el 1 y el 4% de los pacientes con insuficiencia renal crónica. Con mayor frecuencia afecta a pacientes mayores, de sexo femenino, raza blanca, diabéticos y VIH positivos. Afecta casi exclusivamente a pacientes con insuficiencia renal crónica en programa periódico de sustitución renal mediante hemodiálisis o trasplante renal, siendo excepcional en los pacientes sometidos a diálisis peritoneal o en estadios prediálisis1,2.
PatogeniaLa patogénesis de esta enfermedad aún no ha quedado clara, pero se han involucrado diversos factores de riesgo, destacando el hiperparatiroidismo secundario, una elevación del producto CaxP superior a 55mg/dl, niveles normales o elevados de Ca en sangre y altas dosis de metabolitos activos de la vitamina D1–3. Otros posibles factores de riesgo son deficiencia de proteína C y S, anticoagulantes, antagonistas de la vitamina K, acumulación de Ca sobre las valvas del corazón, hipertensión arterial y dislipemia, es decir, toda una serie de factores cuya consecuencia final es una afectación vascular.
Las alteraciones del metabolismo Ca-P y los niveles elevados de PTH están íntimamente relacionados con el desarrollo de la calcifilaxis. Pero diversos estudios demuestran que no necesariamente deben estar alterados dichos parámetros ni se correlacionan con la severidad de la enfermedad. Los pacientes sin enfermedad renal con calcifilaxis que presentan niveles de PTH en sangre superiores a 200pg/ml, sobre todo si no responden al tratamiento médico, suelen beneficiarse de la paratiroidectomía. Los pacientes con enfermedad renal crónica con hiperparatiroidismo severo (PTH>750pg/ml) y que no responden al tratamiento médico (calcimiméticos, análogos de la vitamina D, quelantes, etc.) son subsidiarios de tratamiento quirúrgico mediante paratiroidectomía. En un estudio, Zacharias et al4 concluyen que el uso de sales cálcicas probablemente contribuye a un aumento en la incidencia de la calcifilaxis. Por ello, hay en el mercado quelantes del P que no aportan Ca, como son el carbonato de lantano y el sevelamer, entre otros, que estarían indicados en este tipo de pacientes, evitando el uso de quelantes cálcicos. Otro de los factores de riesgo implicados es la obesidad5. Bleyer et al6, en un estudio que revisa a nueve pacientes con calcifilaxis proximal, identifican como factor de riesgo un elevado índice de masa corporal (35kg/m2). La razón por la cual se relaciona la obesidad mórbida con la calcifilaxis es probablemente por la mayor cantidad de tejido adiposo que está en contacto con la circulación sanguínea; es más frecuente en la mujer7, siendo las lesiones más abundantes a nivel de las caderas, las nalgas, el área infraumbilical y la parte superior de los muslos, por ser ahí donde se localiza la mayor cantidad de depósitos grasos. También se ha presentado en algunas series el desarrollo de calcifilaxis en las zonas de punción con insulina subcutánea o heparina8,9. Los niveles bajos de albúmina sérica se relacionan también con la calcifilaxis, principalmente de localización proximal, y no necesariamente implica la malnutrición como factor de riesgo6. La raza blanca, la administración de warfarina, la administración intravenosa de hierro, los traumatismos y el uso de prednisona (en modelos experimentales) se relacionan también con un posible papel en la patogénesis de la calcifilaxis10–12. Además, se ha implicado como factor de riesgo la terapia con rayos ultravioleta en un paciente con enfermedad renal crónica estadio v, secundaria a lupus eritematoso sistémico con prurito intratable13.
Sin duda, la patogenia de la calcifilaxis es multifactorial y hay implicados factores hasta el presente desconocidos.
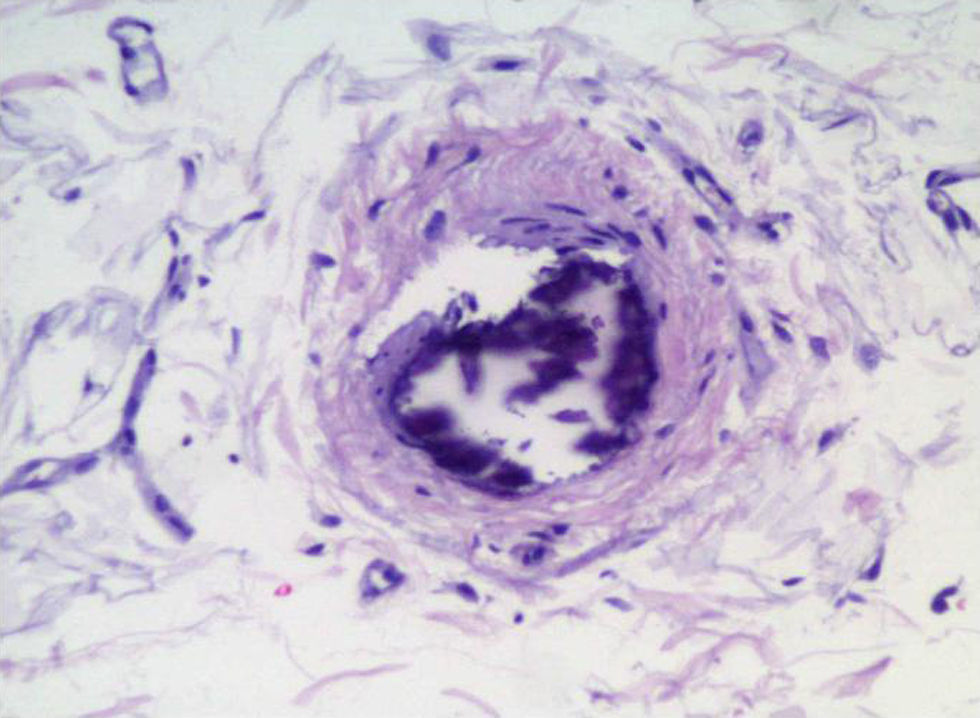
Anatomía patológicaSe trata pues de una vasculopatía (fig. 1) de vasos pequeños, en los que se produce calcificación mural con proliferación de la íntima, fibrosis y, finalmente, trombosis del vaso afecto, desembocando en isquemia del tejido irrigado por dicho vaso. Compromete principalmente a los vasos de la piel y al tejido subcutáneo, pero puede afectar también a otros parénquimas, como el corazón, las articulaciones, los pulmones, el páncreas, el intestino y los ojos, ocasionando infartos isquémicos a distintos niveles14.
ClínicaLas lesiones cutáneas de calcifilaxis se presentan como una serie de nódulos subcutáneos y placas violáceas, purpúricas o equimóticas, extremadamente dolorosas, sobre una base de eritema moteado o reticular semejante a la livedo reticularis. Estas lesiones progresan en pocos días a la formación de úlceras necróticas recubiertas de escaras negruzcas.
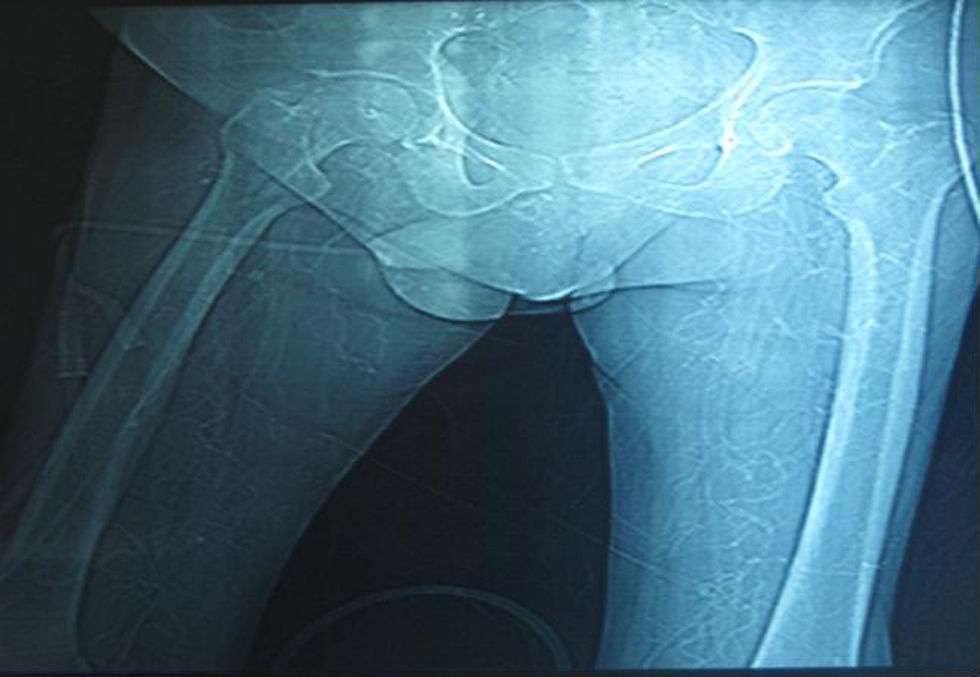
Hay dos formas diferentes de presentación clínica: la calcifilaxis acra y la proximal; las lesiones en ambas entidades se distribuyen preferentemente por las extremidades. La tipo distal o acra, como forma más frecuente, afecta a las piernas, a los pies y a los dedos. La tipo proximal, menos frecuente y de peor pronóstico, afecta a los muslos, las nalgas y el abdomen (fig. 2). Los diferentes estudios relacionan la calcifilaxis proximal con los pacientes diabéticos, siendo las alteraciones del metabolismo Ca-P menos severas que en los pacientes con calcifilaxis acra, y suelen tener un pronóstico mucho peor14,15.
TAC de muslo: en región pélvica baja se observan múltiples calcificaciones vasculares en los vasos de mediano y pequeño calibre a nivel de la región abdominal así como en ambos miembros inferiores, compatible con diagnóstico clínico de calcifilaxis. Llama la atención también la existencia de calcificaciones a nivel de la uretra y los cuerpos cavernosos. Figuras originalmente publicadas en Siete Días Méd. 2009;786(Supl):S1–S12.
El diagnóstico se sospecha por los hallazgos en la anamnesis y el examen físico (dolor, presencia de lesiones ulceradas dolorosas, etc.) y se confirma con el estudio radiológico e histológico.
El procedimiento radiográfico más sensible para detectar la calcifilaxis es la realización de una radiografía usando la técnica de la mamografía (fig. 2).
La gammagrafía ósea se ha mostrado como una técnica diagnóstica muy sensible, observándose una hipercaptación subcutánea del isótopo (tecnecio 99), característica de la calcifilaxis correspondiente a las placas calcificadas16.
Si es posible, se debe evitar la biopsia de la lesión cutánea, ya que puede precipitar su ulceración y posterior infección, con el consecuente riesgo de septicemia. Además, los hallazgos histopatológicos pueden ser inespecíficos.
TratamientoUna vez producidos los depósitos vasculares de Ca, la situación ya se hace irreversible y las medidas terapéuticas son poco eficaces, debiendo estar dirigidas a quelación adecuada del P, fundamentalmente con el empleo de captores no cálcicos, como el sevelamer o el carbonato de lantano, la normalización de calcemia y del producto CaxP, por lo que los quelantes cálcicos deben ser suspendidos para no aumentar el producto; se debe de evitar el uso de metabolitos activos de vitamina D por el mismo motivo.
El control del hiperparatiroidismo secundario mediante el empleo de calcimiméticos o extirpación de las paratiroides ante la falta de rápida respuesta a los calcimiméticos16,17 es una de las medidas más eficaces para frenar la calcificación vascular.
Otra medida por utilizar desde el punto de vista de la terapia sustitutiva renal sería aumentar el número y el tiempo de sesiones de diálisis teniendo en cuenta la situación basal del paciente, pasando, por ejemplo, si el paciente recibía 3 sesiones semanales de 3,5h, aumentarlas a 4 sesiones de 4h. Otra medida sería utilizar bajas concentraciones de Ca en el baño de diálisis (2,5mEq/l) para lograr una mejor depuración del P y disminuir el producto CaxP.
Evitar el uso de anticoagulantes orales, ya que se ha comprobado que favorece la progresión de la enfermedad.
Evitar los traumatismos por el riesgo de infecciones con curas tópicas de las úlceras con antiséptico, sin desbridar para evitar contaminaciones de los tejidos. Del mismo modo, se debe de evitar la administración de medicación por vía subcutánea para del mismo modo evitar contaminaciones e infecciones del tejido.
Las medidas terapéuticas que han resultado eficaces, pero de forma irregular, incluyen17–20:
La cámara de O2 hiperbárica con objeto de aumentar la saturación de O2 tisular y, con ello, la producción de fibroblastos y de colágeno que pueden favorecer la angiogénesis21–23.
Los bifosfonatos24 que poseen un potente efecto inhibitorio sobre la actividad osteoclástica y la resorción ósea. La inhibición de la resorción ósea disminuye la concentración de Ca en sangre y, con ello, reduce la tendencia de los núcleos minerales para formarse y crecer en las paredes arteriales. Por otro lado, los bifosfonatos podrían inhibir la secreción de citoquinas proinflamatorias a nivel de la pared vascular y, con ello, podrían contribuir a mejorar el cuadro. Se pueden emplear bifosfonatos orales o intravenosos. Los bifosfonatos orales tienen la ventaja de poder administrarse a dosis menores y más constantes y homogéneas que los intravenosos y, probablemente, de esa forma los bifosfonatos orales tendrían un efecto menor sobre el hueso y mayor sobre el tejido vascular. Las dosis aconsejadas son alendronato semanal (70mg por vía oral una vez por semana) o risedronato semanal (una dosis oral de 35mg una vez por semana). Si se usa la forma intravenosa, pamidronato (60mg), dosis única al final de la sesión de hemodiálisis.
Otra sustancia utilizada es el tiosulfato sódico intravenoso21. Este producto tiene una estructura química tetraédrica con un átomo central de azufre rodeado de tres átomos de O2 y otro átomo de azufre. En la actualidad se usa como quimioprotector en el tratamiento con cisplatino. En los casos descritos, se aprecia una rápida mejoría del dolor en días y una más lenta resolución de las úlceras isquémicas en meses cuando se utiliza junto con otras medidas. Se ha mostrado eficaz en algunos casos. Se desconoce el mecanismo de acción, aunque probablemente se relaciona con la disolución de las sales de Ca depositadas en los vasos25,26. Sus propiedades antioxidantes ayudan a corregir la disfunción endotelial y favorece la vasodilatación. Además, forma con el Ca tiosulfato cálcico, que es 3.600 veces más soluble que el fosfato cálcico, lo que podría favorecer la eliminación de los depósitos vasculares de Ca. La rápida mejoría del dolor puede deberse a sus efectos sobre los vasa nervórum y endoneuro también calcificados. La ausencia de otros tratamientos eficaces y la baja toxicidad hacen que debamos considerar este fármaco como de primera línea junto con otras medidas, como la cámara hiperbárica y el control riguroso del metabolismo mineral. Se administra como solución de tiosulfato sódico al 25% un total de 25g/1,73m2 a pasar durante una hora al final de cada sesión de hemodiálisis. Se debería administrar hasta la resolución del cuadro.
Otras medidas, como el empleo de bloqueadores de canales de Ca, actúan teniendo en cuenta que son vasodilatadores periféricos pudiendo también ser útiles. La gabapentina como tratamiento para el dolor ocasionado por esta patología también se ha demostrado útil en algunos casos puntuales16.
PronósticoLa calcifilaxis, si bien es poco frecuente, cuando se presenta es un cuadro grave que a pesar de los avances en las técnicas dialíticas tiene pésimo pronóstico, con morbilidad asociada a infecciones y a mortalidad en pocos meses por compromiso séptico y disfunción de los órganos afectados. En la mayoría de los casos llevará a la muerte del paciente antes de 10 meses en el 60–80% de los casos14 de diagnosticado el cuadro y casi siempre la causa final será séptica.
En conclusión, debemos pensar que lo más importante en la calcifilaxis es evitar el desembocar en esta complicación mediante la prevención. Para ello, en un paciente con enfermedad renal crónica es fundamental identificar los factores de riesgo, realizando el control del P, Ca, producto CaxP e hiperparatiroidismo secundario, que debe iniciarse de forma precoz realizando un control adecuado para de este modo evitar las complicaciones a largo plazo.
No existe conflicto de intereses.