INTRODUCCIÓN
La espondilitis anquilosante (EA) es una enfermedad inflamatoria crónica cuya principal característica es la entesitis1. La enfermedad afecta al esqueleto axial, con dolor lumbar de tipo inflamatorio, aunque a menudo coexisten manifestaciones como consecuencia de entesitis, tenosinovitis o artritis en las articulaciones periféricas, mayormente en las extremidades inferiores. Es una enfermedad frecuente, y su prevalencia se estima entre el 0,05 y el 0,25% de la población2. Aunque puede iniciarse a cualquier edad, suele hacerlo en sujetos jóvenes, en la segunda o tercera década de la vida, preferentemente en los varones, con clínica de lumbalgia y rigidez progresiva, muy limitante, que dificulta ostensiblemente la actividad laboral y el reposo nocturno. Las consecuencias económicas derivadas de esta patología son elevadas para la sociedad3. La EA puede cursar con manifestaciones sistémicas como la uveítis, y puede acompañar a otras enfermedades como la psoriasis y la enfermedad inflamatoria intestinal. Las características clínicas de la enfermedad, en general poco específicas y poco conocidas por la mayoría de los médicos, el retardo en la aparición de los hallazgos radiográficos y la ausencia de datos analíticos diagnósticos han favorecido el retraso diagnóstico de esta entidad, estimado en hasta 10 años4. A estas circunstancias cabría añadir la escasa oferta terapéutica, limitada hasta hace muy poco a los analgésicos y a los antiinflamatorios no esteroideos (AINE), en bastantes ocasiones claramente insuficientes para aliviar el dolor y la rigidez de estos enfermos, aunque un ensayo clínico reciente ha sugerido un cierto efecto modificador de los AINE en pacientes con EA5. Un grupo tratado de forma continuada con celecoxib presentó una menor progresión radiográfica que un grupo paralelo tratado con AINE a demanda. La llegada de los inhibidores del factor de necrosis tumoral (TNF), que han demostrado una gran eficacia en el tratamiento de sus manifestaciones clínicas, ha supuesto un salto cualitativo sustancial con la restitución de la calidad de vida y la vuelta a la normalidad para muchos de estos pacientes6-8. Este nuevo escenario invita a un replanteamiento del papel de los AINE en el tratamiento de la EA. Cuándo y cómo administrarlos serían algunas de las inquietudes derivadas de los avances más recientes.
La utilización de un fármaco depende del equilibrio entre los beneficios y riesgos que produce en la situación clínica de cada paciente. Entre los beneficios se deben incluir el alivio de los síntomas y la capacidad de modificar la enfermedad. No todos los fármacos que mejoran las manifestaciones clínicas son capaces de modificar el curso de la enfermedad. En el otro lado de la balanza se deben colocar los efectos secundarios y los costes derivados de la utilización del fármaco (visitas extras, controles analíticos, pruebas por acontecimientos adversos, etc.). El clínico pondera cada una de estas características e individualiza el mejor tratamiento posible para cada enfermo. Hemos seguido un esquema parecido para ubicar el empleo de los AINE en el tratamiento de la EA en nuestros días.
UTILIZACIÓN DE LOS AINE
Los AINE son fármacos con efecto analgésico y antiinflamatorio. Se han considerado la base del tratamiento en la EA, y hasta hace bien poco eran casi la única medida eficaz. La situación se complicaba muchísimo cuando el paciente se mostraba refractario a los AINE o no respondía a dosis plenas de butazolidina o indometacina, ante la ausencia de auténticas alternativas terapéuticas. Al analizar el lugar que ocupan los AINE en la actualidad, parece un paso obligado conocer con qué frecuencia se utilizan en la EA.
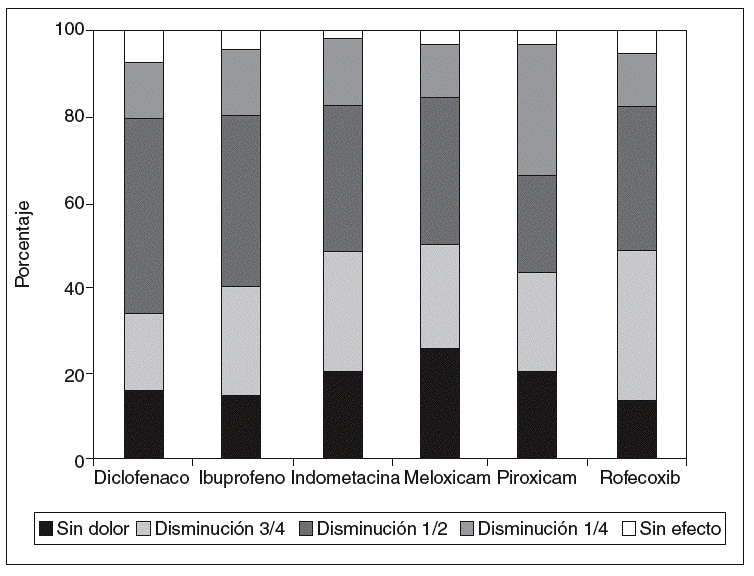
Un estudio publicado en 2006 en Clinical Rheumatology9 revisó el consumo de AINE en un importante grupo de pacientes con EA, mediante una encuesta realizada en el año 2000 sobre su frecuencia, su eficacia y su toxicidad. El 78% de los 1.080 pacientes encuestados consumía de forma regular algún tipo de AINE, y el más común era el diclofenaco. El 34% de los encuestados relataron una reducción del dolor del 50% con la toma de AINE; el 27% observó una reducción del 75%, y sólo el 4% no experimentó ningún beneficio. En la figura 1 se muestran los resultados referentes a los AINE de mayor consumo, y se aprecia que no existen notables diferencias entre ellos.
Figura 1 Eficacia comparada de varios antiinflamatorios no esteroideos (AINE) en la espondilitis anquilosante.
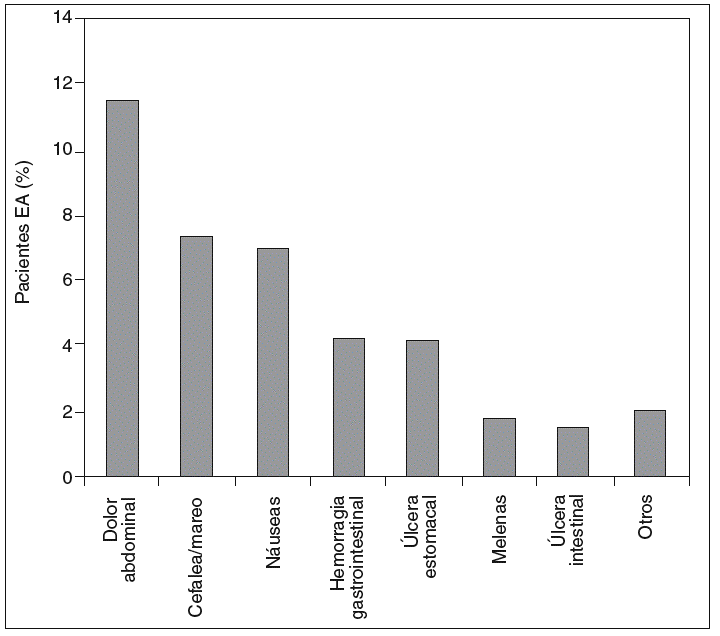
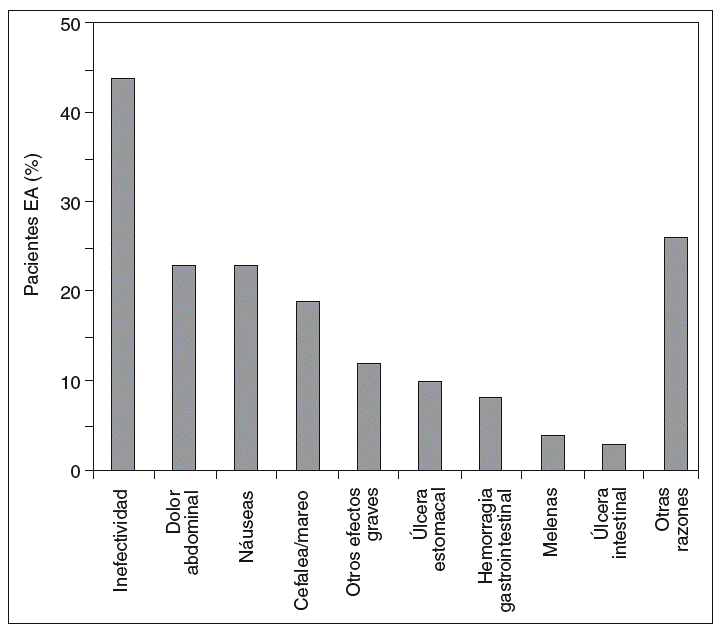
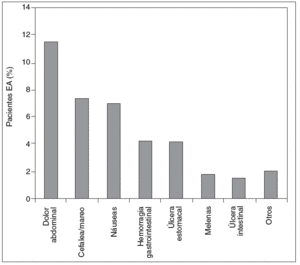
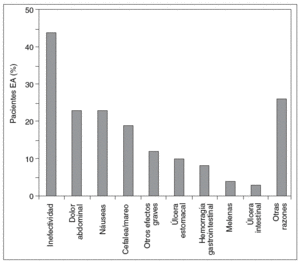
El dolor abdominal fue el efecto adverso más citado por los encuestados, y la inefectividad fue la causa más frecuente de cambio de AINE, como se observa en las figuras 2 y 3.
Figura 2 Distribución de los efectos secundarios calificados como graves por los propios pacientes con espondilitis anquilosante durante el tratamiento con antinflamatorios no esteroideos (AINE) en una encuesta (n = 842).
Figura 3 Motivos mencionados por los enfermos para el cambio de antiinflamatorio no esteroideo (AINE).
En España, los datos del Registro de Espondiloartropatías de la Sociedad Española de Reumatología (REGISPONSER) de 2006 mostraron que de un total de 1.204 pacientes con EA, el 95% tomaba o estaba tomando AINE (el 61% de forma habitual y el 34% a demanda), y era habitual que los pacientes los tomaran durante al menos el 50% de la duración de su enfermedad. Preguntados por las 2 últimas semanas, el 76% afirmaron haber tomado AINE durante las 2 últimas semanas: el 67% de forma habitual y el 9% a demanda.
Estos datos indican que el consumo de AINE en los pacientes con EA sigue siendo elevado, y la mayoría los consume de forma continuada. También son frecuentes los acontecimientos adversos y los cambios de preparado en busca de una mayor eficacia terapéutica.
AINE COMO MODIFICADORES DE LA ENFERMEDAD
La indicación de un fármaco depende de su nivel de evidencia. En este contexto se planteó la siguiente pregunta: ¿existe en la EA alguna evidencia que apoye un papel modificador de la enfermedad para los AINE? Un efecto modificador de los AINE apoyaría su uso más continuado más allá de su efecto analgésico y antiinflamatorio. Para contestar a esta pregunta se partió de la revisión de la evidencia realizada con motivo de la actualización del Documento de Consenso de la SER sobre antagonistas del TNF en espondiloartritis, publicado en 200710. Con ese motivo, se realizó una exhaustiva revisión de la literatura dirigida a contestar las preguntas formuladas por el panel de expertos; una de las cuales fue: ¿tienen los AINE capacidad de modificar el curso de la EA?, entendiéndose como tal la reducción en la progresión radiográfica11. La estrategia de búsqueda hasta el año 2004 produjo 203 resultados, de los cuales sólo 10 estudios te-nían relación con la pregunta y, finalmente, sólo uno cumplía criterios mínimos de calidad. Se trataba de un estudio retrospectivo publicado en 1976, de 40 pacientes con EA12. Los autores encontraron un retardo en la osificación de la columna vertebral en los enfermos tratados de forma continua con fenilbutazona, en comparación con los que la habían tomado de forma discontinua o no la habían tomado. Al no encontrar más información, los revisores concluyeron que el nivel de evidencia sobre el efecto de los AINE en la progresión de la EA era de tipo 2b y se limitaba a un único estudio con fenilbutazona. Cualquier recomendación fuera de este AINE (e incluso de éste, tratándose de un solo estudio observacional) sería del tipo D.
Desde el año 2004 se han publicado algunos ensayos en los que se evaluó la eficacia de nuevos AINE en la EA13-15, y en uno de ellos se pudo analizar además su posible efecto modificador de la enfermedad5.
Wanders et al5 valoraron el efecto del tratamiento con AINE administrados de forma continuada frente a demanda sobre la progresión radiográfica en la EA durante 2 años, mediante un ensayo clínico dividido en 2 fases. En la primera fase aleato rizada, de tipo doble ciego y de 6 semanas de du-ración se comparó la eficacia clínica de celecoxib (100 mg 2 veces/día) frente a ketoprofeno (100 mg 2 veces/día) y frente a placebo15. El estudio fue seguido de una segunda fase abierta, de nuevo aleatorizada, de 2 años de duración, en la que se compararon dos estrategias: tratamiento continuo con AINE frente a tratamiento a demanda. En ambos casos el tratamiento inicial de esta fase abierta fue celecoxib (100 mg 2 veces/día), y se podía incrementar la dosis a 200 mg 2 veces/día o cambiar de AINE según la respuesta clínica. El objetivo de esta segunda fase fue comparar la progresión radiográfica en ambos grupos5.
En este estudio se incluyeron pacientes con EA según criterios de Nueva York modificados que precisaban AINE, definido como la toma diaria de un AINE durante el mes previo a la selección y que tras suprimirlos presentaran un brote de dolor (escala visual analógica $ 40 mm e incremento del 30% en la puntuación del dolor anterior a retirar los AINE). La muestra final incluyó un 70% de varones, con una edad media de 38 años y un tiempo medio de evolución de unos 12 años; algo más del 85% era HLA-B27 positivo y una cuarta parte había tomado sulfasalazina5.
A todos los pacientes se les realizó una visita al inicio (basal), y a los 4, 7, 10, 13, 16, 19, 22 y 24 meses. En la valoración clínica se incluyeron los cuestionarios BASDAI y BASFI, y escalas de valoración global del dolor, valoración del dolor espinal, del dolor nocturno, de la rigidez matutina y del cansancio, y valoración global de la enfermedad efectuada por el paciente y por el médico; así como porcentaje de días de dolor, exploración de la movilidad con prueba de Schober, distancia dedo-suelo, distancia occipucio-pared y expansión torácica; y pruebas de laboratorio como proteína C reacti va (PCR) y velocidad de sedimentación globular (VSG). Se realizaron radiografías de columna cervical y lumbar en la visita basal y a los 2 años. La progresión radiográfica se cuantificó mediante el índice SASSS modificado16, que valora el grado de afección radiográfica en cada una de las esquinas anteriores de los cuerpos vertebrales de la columna cervical (C2-D1) y lumbar (D12-S1) en una escala de 0-3 (0: normal; 1: esclerosis o cuadratura; 2: sindesmófito claro; 3: puente óseo), con una puntuación máxima posible de 72. Las lecturas se realizaron por enfermo, por un único lector, ciego para el tratamiento y la secuencia radiográfica. El análisis estadístico de los grupos comparados se hizo por regresión.
Al final de los 2 años, 96 de los 111 pacientes tratados con AINE de forma continua completaron el estudio (68 con celecoxib, 28 con otro AINE), y 76 (68%) de ellos contaron con radiografías completas; 86 de los 103 pacientes tratados a demanda también completaron el estudio (67 con celecoxib, 19 con otro AINE), con el par completo de radiografías en 74 de ellos (71%). No se encontraron diferencias en las características de la enfermedad o de la actividad clínica entre los enfermos de ambos grupos en la visita basal, ni tampoco entre los enfermos que completaron el estudio respecto a los que no llegaron al final.
A final del estudio no hubo diferencias significativas en la mejoría clínica o funcional entre el grupo tratado de forma continua y el grupo tratado a demanda, aunque se observó una tendencia a una mayor respuesta con el tratamiento continuo. La situación fue distinta con respecto a la progresión radiográfica. El deterioro en el m-SASSS fue de 0,4 ± 1,7 en el grupo tratado de forma continua, frente a 1,5 ± 2,5 en el grupo tratado a demanda, significativamente menor desde el punto de vista estadístico (p = 0,002). A su vez, el 22% de los pacientes en tratamiento continuo mostraron progresión radiográfica (> 0 unidades) comparado con el 45% del tratamiento a demanda. Cuando el punto de corte se elevó a 3 unidades, de nuevo el doble de enfermos tratados a demanda mostraron progresión radiográfica (23% frente al 11%). Estas diferencias se mantuvieron tras ajustar por el grado de actividad clínica o de afección radiográfica basal o el nivel de actividad clínica a lo largo de los 2 años.
Durante el estudio se observaron acontecimientos adversos serios en 22 pacientes del grupo tratado de forma continua (20%) y en 16 del grupo tratado a demanda (16%). Los efectos adversos fueron algo más frecuentes en el grupo tratado de forma continua comparado con el grupo a demanda (hipertensión, 9% frente al 3%; dolor abdominal, 11% frente al 6%; dispepsia, 41% frente al 38%) pero sin diferencias estadísticas. Sólo un paciente que había recibido tratamiento con AINE a demanda requirió hospitalización por dolor abdominal intenso.
Los autores concluyeron que la estrategia de un uso continuado de AINE, comparado con el uso a demanda, en pacientes con EA sintomática redujo la progresión radiográfica sin mejorar las manifestaciones clínicas y sin aumentar la toxicidad de forma sustancial5, por lo que recomiendan el uso continuado de AINE en pacientes con EA sintomática que los precisen.
Se trata del primer estudio a 2 años y con un diseño sólido que muestra un cierto efecto modificador de los AINE en la EA, desde la publicación ya citada de Boersma con la fenilbutazona, de características mucho más modestas. Los autores argumentan el efecto de los AINE, probablemente vía ciclooxigenasa 2, en la inhibición de los osteoblastos17. La capacidad de los AINE de reducir las calcificaciones heterotópicas tras la artroplastia de cadera apoyaría esta explicación18. Al mismo tiempo creen que este efecto sobre el daño radiográfico puede ser independiente del efecto sobre las manifestaciones clínicas, como sugiere la ausencia de correlación entre las variables clínicas y la progresión radiográfica.
A pesar de su cuidadoso diseño, el estudio de Wanders et al presenta algunas limitaciones. Por ejemplo, sólo se registró la dosis de celecoxib en ambos grupos, no así la de otros AINE. A su vez, la dosis media diaria de celecoxib no fue muy diferente entre ambos grupos (243 mg en el grupo continuo frente a 201 mg en el grupo a demanda), y aunque esta diferencia de 42 mg fue estadísticamente significativa, resulta difícil interpretar su impacto dada su escasa magnitud. Tampoco se registraron el consumo de otros AINE, lo que pudo tener importancia. Además, esta fase fue abierta, lo que pudo favorecer cointervenciones o conductas diferentes en ambos grupos. Aproximadamente el 30% de los pacientes en ambos grupos no completaron el conjunto de radiografías, y hubo una falta de relación entre la evolución clínica y los hallazgos radiográficos, lo que contrasta con lo esperable a priori. Por otra parte, el beneficio a los 2 años fue pequeño, con una diferencia media entre ambos grupos de 1,1 en una escala de 0-72, lo cual representa un efecto del 1,5%, un porcentaje escaso de enfermos (el 45% de los pacientes tratados a demanda progresaron, frente al 22% de los tratados de manera continua). En otras palabras, con el tratamiento continuo se evitó una progresión del 1,5% en la escala radiográfica en uno de cada 5 pacientes tratados durante 2 años, sin que se observara una mejoría clínica ostensible.
En un editorial del mismo número de la revista Michel Ward19 sugiere cautela ante unos hallazgos tan provocadores que invitan a reflexiones que van más allá del propio uso de los AINE en la EA. El autor comenta que es prematuro concluir que el tratamiento continuo con AINE actúa como modificador de la enfermedad en pacientes con EA, ya que no se pueden obviar las limitaciones antes citadas, a pesar de lo cual el estudio tiene un gran interés al aportar información relevante en un área no investigada hasta la fecha: el efecto de los AINE en la progresión radiográfica.
¿CÓMO HAY QUE ADMINISTRAR LOS AINE?
Los AINE se deben utilizar como tratamiento sintomático. En el momento actual la evidencia existente no tiene el peso suficiente como para recomendar un uso continuado en los pacientes con síntomas. El efecto demostrado sobre la progresión radiográfica en el estudio de Wanders et al5 es escaso y debe ser confirmado por otros estudios, dada su importancia y lo llamativo del hallazgo. La mejoría clínica, aun siendo algo mayor con el tratamiento continuado, tampoco posee una magnitud relevante. En el otro lado de la balanza están los efectos secundarios de los AINE, que al parecer contrarrestan los posibles beneficios del uso mantenido. Es difícil mantener un AINE de forma indefinida si no existen síntomas que lo justifiquen.