INTRODUCCIÓN
En la mayoría de enfermedades autoinmunes se han demostrado autoanticuerpos, aunque su relación con el desarrollo de la enfermedad es variable y su papel patogénico real resulta controvertido. Parece claro que la presencia de autoanticuerpos por sí misma no supone enfermedad. Y valores bajos de inmunoglobulinas especialmente de baja afinidad y de clase IgM son un hecho fisiológico en la respuesta inmune. Sólo cuando aumenta su concentración y afinidad, y cambia el subtipo, pueden considerarse directamente patológicos. En estos casos deben cumplirse los criterios básicos que asocian causalmente los anticuerpos con la patogenia de la enfermedad, esto es, que se correlacionen con la actividad y las manifestaciones clínicas, que se detecten en las lesiones y que su transferencia pasiva reproduzca la enfermedad1.
Los anticuerpos anticitoplasma de neutrófilo (ANCA) son, generalmente, de clase IgG y reaccionan con antígenos localizados en los gránulos primarios de los leucocitos polimorfonucleares neutrófilos y en los lisosomas de los monocitos humanos. En 1982 se detectaron en pacientes con glomerulonefritis pauciinmune2, asociados inicialmente con infecciones del virus Ross River. Se descubrieron de forma accidental en un estudio pormenorizado de anticuerpos antinucleares (AAN) con técnicas de inmunofluorescencia sobre leucocitos humanos. En 19843 se identificaron anticuerpos similares en 4 pacientes diagnosticados de vasculitis sistémica y en 1985 se relacionaron con la granulomatosis de Wegener4. Posteriormente, otros estudios confirmaron esta asociación y la ampliaron a la poliangeítis microscópica y al síndrome de Churg-Strauss, sugiriéndose la existencia como entidad propia de la denominada vasculitis sistémica asociada a los ANCA5-7.
TÉCNICAS DE DETECCIÓN DE LOS ANCA
Para que la interpretación de los ANCA sea correcta en la práctica clínica es necesario conocer las diferentes técnicas de detección.
Inmunofluorescencia indirecta (IFI)
La detección inicial de ANCA se realiza habitualmente mediante IFI sobre neutrófilos fijados en etanol. Se utilizan neutrófilos de sangre periférica humana de individuos sanos, aislados en condiciones estériles por centrifugación, que se depositan sobre placas de vidrio y se fijan con etanol o formalina. Una vez incubados con el suero del paciente, se lavan para eliminar la unión inespecífica y se incuban con anticuerpos anti-Ig humanos marcados con un fluorocromo. Se vuelven a lavar y se analiza la muestra con un microscopio de fluorescencia. Se considera positivo si a una dilución 1:16-1:50 se detecta fluorescencia en el citoplasma de la mayoría de los neutrófilos.
Dependiendo de la conformación, la carga y la distribución citoplasmática de los diferentes antígenos reconocidos por los ANCA pueden detectarse: patrones citoplasmáticos (C-ANCA), perinucleares (P-ANCA) y atípicos o mixtos (A-ANCA). El patrón C-ANCA se debe a una fluorescencia difusa, fina y granulosa en el citoplasma, con un refuerzo en las zonas interlobulares del núcleo. El patrón perinuclear se caracteriza por una tinción alrededor del perímetro nuclear difícil de diferenciar en ocasiones del patrón producido por los AAN específicos de granulocitos (GS-ANA). Este patrón es, en realidad, un artefacto provocado por la fijación de los neutrófilos en etanol, la cual permite la migración de la mieloperoxidasa y otras proteínas básicas de carga positiva desde los gránulos a la región perinuclear, donde se unen a la membrana nuclear cargada negativamente. Cuando las células se fijan con acetona-formalina se evita este artefacto, y los sueros P-ANCA producen un patrón citoplasmático difuso. Esta circunstancia permite diferenciar los P-ANCA de los GS-ANCA.
Existe otro patrón, llamado atípico (A-ANCA), que suele estar presente en otras enfermedades autoinmunes distintas a las vasculitis sistémicas, como la enfermedad inflamatoria intestinal o las hepatitis autoinmunes.
La IFI es una técnica sencilla, pero no es capaz de identificar los diferentes antígenos reconocidos por los ANCA y la interpretación de los resultados es subjetiva, por lo que la variabilidad interobservador es alta. Además, la metodología varía según los laboratorios y no hay una estandarización ni referencias con respecto a los rangos normales8. En la mayoría de los estudios publicados las determinaciones se han realizado en laboratorios especializados, y es difícil trasladar sus conclusiones a la práctica clínica habitual. Finalmente, pueden observarse patrones C-ANCA y P-ANCA en sueros de pacientes con enfermedades autoinmunes, así como en infecciones, neoplasias, reacciones farmacológicas y hasta en el 2% de individuos sanos, por lo que la especificidad para el diagnóstico de vasculitis puede ser baja.
Enzimoinmunoanálisis (ELISA)
La técnica de ELISA con antígenos purificados permite identificar los diferentes ANCA conocidos. Existen 2 variantes, según el antígeno se una directamente al pocillo de plástico (ELISA estándar) o se una a anticuerpos monoclonales de ratón o policlonales de conejo adheridos al pocillo de plástico (ELISA de captura o tipo sándwich). El más utilizado es el ELISA estándar, pero el tipo sándwich ofrece mayor sensibilidad.
El 80-90% de los sueros C-ANCA por IFI reconocen la enzima proteinasa 3 (PR3), una glucoproteína con capacidad elastolítica y bactericida descrita en 1988 por Rao et al9 que es similar a las proteínas lisosomales AGP7, p29 y mieloblastina de las células mieloides. El resto de los sueros C-ANCA pueden reaccionar contra la mieloperoxidasa (MPO), la elastasa, la proteína catiónica 57, la catepsina G u otras proteínas, conocidas o aún no identificadas. En algunos estudios la mitad de los sueros C-ANCA no presentan anticuerpos anti-PR310.
La mayoría de los sueros P-ANCA contienen anticuerpos anti-MPO (40-70%) pero pueden reaccionar contra la elastasa, la catepsina G, la azurocidina, la lactoferrina, la lisozima y otras proteínas6, como los sueros A-ANCA. La mieloperoxidasa es una proteína catiónica de 130 a 160 kD formada por 2 promotores, cada uno de los cuales tiene una subunidad ligera de 10-15 kD y una pesada de 55-63 kD. Está codificada por un solo gen del cromosoma 17 y se expresa con diferentes isoformas, precozmente en las líneas celulares granulocíticas y más tarde en los monocitos. Los anticuerpos anti-MPO reaccionan con la proteína nativa, pero no con la forma desnaturalizada. La unión de los anticuerpos no inhibe la función de la MPO, lo que sugiere que el epítope de unión es marginal y no interfiere en la actividad enzimática.
La sensibilidad de la prueba de ELISA estándar en la detección de anticuerpos anti-PR 3 y anti-MPO depende en parte de la pureza de los antígenos utilizados. Se han descrito falsos positivos por hipergammaglobulinemia y por la presencia de inmunoglobulinas poliespecíficas en sueros de pacientes infectados por el virus de la inmunodeficiencia humana.
Actualmente, se debe investigar la presencia de anticuerpos anti PR3 y anti-MPO en todos los sueros con ANCA por IFI. Incluso si la IFI es negativa y la sospecha clínica es importante, deben realizarse las técnicas de ELISA, ya que se encuentran anticuerpos anti PR3 o anti-MPO hasta en el 5% de los sueros con IFI negativa11.
ENFERMEDADES RELACIONADAS CON ANCA
Vasculitis de pequeño vaso
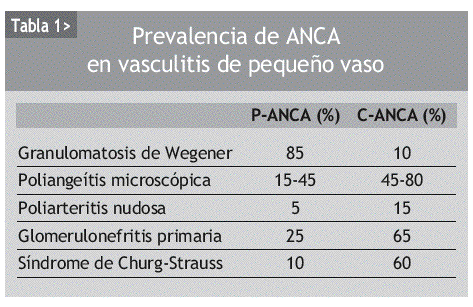
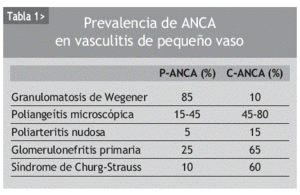
Los ANCA se asocian significativamente con el desarrollo de glomerulonefritis necrosantes o vasculitis de pequeño vaso (tabla 1).
La granulomatosis de Wegener es una vasculitis sistémica que afecta a arterias pequeñas y medianas, vénulas y arteriolas. Se caracteriza histológicamente por una inflamación granulomatosa del tracto respiratorio superior e inferior, aunque puede aparecer en cualquier localización, y glomerulonefritis necrosante pauciinmune. La presentación clínica incluye desde la descarga nasal recurrente con deformación, ulceración, sangrado y/o perforación del septo nasal, sinusitis de repetición, otitis media y estenosis subglótica cuando se localiza en el tracto respiratorio superior, hasta infiltrados pulmonares, hemorragia alveolar o nódulos pulmonares en el tracto respiratorio inferior. Entre el 50 y el 80% de los pacientes presentan glomerulonefritis (hematuria microscópica, proteinuria y cilindros granulomatosos); del 10 al 20%, pericarditis, valvulopatía o cardiopatía isquémica; y del 10 al 50%, manifestaciones del sistema nervioso periférico, en forma de mononeuritis múltiple o polineuropatía axonal sensitivo-motora. En el 10% hay manifestaciones neurológicas centrales, fundamentalmente neuropatías craneales, lesiones ocupantes de espacio o paquimeningitis. Del 50 al 80% de los pacientes desarrollan artralgias o artritis, y del 30 al 60% manifestaciones oculares.
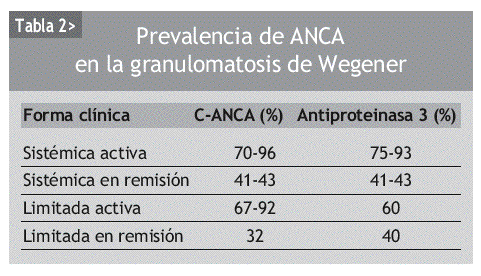
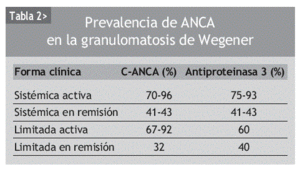
Aproximadamente el 90% de los pacientes con granulomatosis de Wegener generalizada y activa presentan ANCA, mientras que en los pacientes en remisión el porcentaje desciende hasta el 40%. Lo mismo ocurre cuando la enfermedad es limitada, esto es, cursa sin enfermedad renal o pulmonar (tabla 2). Por tanto, la sensibilidad de los C-ANCA o de los anticuerpos anti-PR3 va a depender de la extensión de la enfermedad, de la gravedad y de la actividad clínica en el momento del estudio.
La poliangeítis microscópica afecta principalmente a capilares, vénulas o arteriolas, aunque puede haber inflamación de arterias de pequeño y mediano calibre. La mayoría de estos pacientes tienen ANCA y anticuerpos anti-MPO (70%), y sólo una minoría anticuerpos anti-PR3. La enfermedad cursa con glomerulonefritis (90%), manifestaciones cutáneas (60%), capilaritis pulmonar (50%) y alteraciones gastrointestinales (50%). Es la causa más común del llamado síndrome pulmón-riñón. La similitud de las manifestaciones clínicas de la poliangeítis microscópica y la granulomatosis de Wegener ha llevado a que algunos autores las consideren parte de una sola enfermedad.
El síndrome de Churg-Strauss es una vasculitis de arterias de pequeño y mediano calibre que se caracteriza histológicamente por la presencia de granulomas vasculares y extravasculares e infiltración eosifílica de los tejidos afectados. Usualmente tiene un curso clínico lento y se diagnostica en pacientes con asma, atopia o rinitis alérgica que, años después del inicio de estas manifestaciones, desarrollan eosinofilia en sangre periférica y enfermedad pulmonar con infiltrados pulmonares inespecíficos, hemorragia alveolar y pleuritis. La inflamación puede localizarse también en el riñón (glomerulonefritis extracapilar) (15-40%), en el corazón (cardiomiopatía, isquemia) (20-45%), en el sistema nervioso periférico (70%) y en la piel (50-80%). Es menos frecuente que las anteriores, y su incidencia estimada es de 2,4 pacientes por millón de habitantes. Aproximadamente la mitad de los pacientes presentan ANCA, generalmente P-ANCA y anticuerpos anti-MPO. El porcentaje es mayor en pacientes con enfermedad activa y sin tratamiento.
La vasculitis renal limitada afecta únicamente al riñón, y se observa una glomerulonefritis pauciinmune con inflamación y necrosis glomerular con o sin depósito de IgG, IgA, IgM o complemento. En el 75 al 80% hay P-ANCA y anticuerpos anti-MPO.
Otras enfermedades relacionadas con ANCA
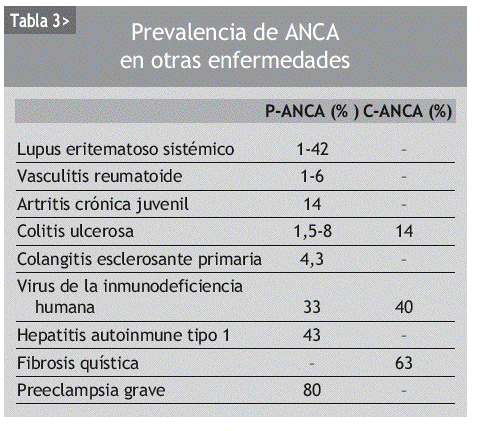
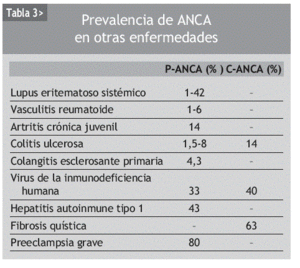
Pueden detectarse ANCA en diversas enfermedades sistémicas autoinmunes, y en otras enfermedades como infecciones o neoplasias (tabla 3). Su utilidad en estas enfermedades es incierta, dado que en la mayoría de los estudios no se detectan diferencias clínicas o histológicas al comparar los pacientes ANCA positivos y ANCA negativos.
PAPEL PATOGÉNICO DE LOS ANCA
Parece claro que los ANCA se asocian en mayor o menor medida con el desarrollo de algunas vasculitis necrosantes sistémicas, pero su papel concreto en la etiopatogenia de este grupo de enfermedades aún no se ha dilucidado. Los ANCA inducen la liberación de radicales libres de oxígeno y la desgranulación de los neutrófilos. Su unión a células endoteliales produce daño celular y el incremento de células endoteliales circulantes se relaciona con la actividad clínica. En esta línea se ha conseguido reproducir un modelo de vasculitis con glomerulonefritis en ratones deficientes en linfocitos T y B (Rag2-/-) mediante la transferencia de sueros con ANCA específicos para MPO12. Sin embargo, no se han descrito casos de vasculitis en fetos o neonatos, hijos de madres con ANCA circulantes, y se han encontrado valores altos de ANCA hasta en el 2% de personas sin dato alguno de vasculitis. Por tanto, es posible que los ANCA sean necesarios pero no suficientes para el desarrollo de la vasculitis.
UTILIDAD DE LOS ANCA EN EL DIAGNÓSTICO DE VASCULITIS
La interpretación de los estudios realizados para determinar el peso real de estos anticuerpos en el diagnóstico de las vasculitis sistémicas es difícil. En parte se debe a la ausencia de consenso en la definición de cada una de las vasculitis. Según se tengan o no en cuenta los hallazgos histológicos observaremos un grado distinto de solapamiento en la clasificación de pacientes13. Estas diferencias modifican la especificidad y la sensibilidad de los estudios. Así vemos que en un estudio publicado por Langford et al14 la sensibilidad de los ANCA para el diagnóstico de vasculitis cambió del 95 al 30% según se tuviera o no confirmación histológica; con una especificidad de menos del 50% a más de un 95%, con confirmación histológica o sin ella.
En la práctica clínica, la ausencia de una prueba histológica de vasculitis es frecuente, y es en estas circunstancias donde los ANCA ofrecen un apoyo significativo al diagnóstico. Sin embargo, no debe olvidarse que una prueba negativa nunca excluye el diagnóstico de vasculitis.
Las recomendaciones internacionales sugieren que la determinación regular de los ANCA es útil en el seguimiento de los pacientes con vasculitis sistémica, aunque los resultados de la detección de ANCA deben interpretarse siempre en función de las manifestaciones clínicas. Numerosos estudios avalan la relación entre los títulos de ANCA y la actividad de la enfermedad, la desaparición con un tratamiento eficaz y la reaparición con las exacerbaciones. Por otro lado, una revisión de 15 estudios demostró que no había reactivaciones en el 42% de 365 incrementos de títulos de anticuerpos por ELISA15. Un tercio de los pacientes estarían sobretratados si sólo se utilizara este marcador biológico para tomar la decisión terapéutica.
¿CUÁNDO DEBEN SOLICITARSE LOS ANCA?
La determinación de ANCA es útil en tres situaciones:
En toda sospecha clínica de vasculitis sistémica.
En el seguimiento de pacientes diagnosticados y poniendo siempre en relación un posible aumento de los títulos con los datos directos e indirectos de actividad inflamatoria, sean clínicos, biológicos o de imagen.
En el paciente crítico, con hemorragia alveolar, mononeuritis múltiple o fallo renal agudo, para la rápida toma de decisiones en el contexto de un riesgo vital importante.