INTRODUCCIÓN
La mortalidad asociada a padecer lupus eritematoso sistémico (LES) es un problema de importancia menguante. Las tendencias en la mortalidad vienen siendo más y más favorables, y se ha pasado de una supervivencia a los 5 años del 50-77% en la década de los sesenta al 64-87% a 10 años en los ochenta y hasta el 68-78% a los 20 años en la última década del pasado siglo. Es posible que esto no sea cierto en países menos desarrollados, como sugiere un estudio de tendencias realizado en la India1, y que tampoco lo sea en determinadas minorías étnicas, como demuestra el estudio de Walsh2, basado en datos del National Center for Health Statistics estadounidense, en el que se constató que la mortalidad directamente atribuible al LES había aumentado un 30% en mujeres afroamericanas en los últimos años.
Comparando con la población general, Urowitz3 observó una drástica reducción del ratio de mortalidad estandarizada (RME: muertes observadas frente a muertes esperadas) de 10,1 a 3,3 de la década de los setenta a los noventa, observación recientemente confirmada en una cohorte multicéntrica de grandes dimensiones4. Este hecho sugiere que la mejoría en la supervivencia no parece atribuible simplemente a la mejoría del estado de salud de la población. Esta mejoría es más evidente en los 5 primeros años de enfermedad, como demuestra el análisis comparativo de dos momentos históricos de la cohorte del Johns Hopkins, en un estudio que incluyó a 1.378 pacientes; en ese estudio, el riesgo relativo (RR) de muerte de los pacientes diagnosticados entre 1985-1990 respecto a los diagnosticados después del 2000 fue de 65.
Sin embargo, la mortalidad sigue superando en 2-3 veces la de la población general3,6-10, y esto sucede así tanto en series hospitalarias como en estudios basados en población como el de Rochester Epidemiology Project11, si bien el RME tiende a ser más bajo en estos últimos12. La diferencia con la población general es mayor para los pacientes más jóvenes; así, en la cohorte de Bernatsky10 la mortalidad resultó hasta 6 veces mayor en el segmento de 20-39 años. El RME también se incrementa con la duración de la enfermedad y, en un estudio, este ratio sólo resultó superior a 1 para pacientes con 10 años de evolución13.
Las razones por las cuales la mortalidad del LES se ha venido reduciendo en los últimos años no están del todo claras. Esta reducción se atribuye sobre todo a un mayor conocimiento de la enfermedad y su historia natural, con el consiguiente aumento de la pericia en su manejo, y a un uso más racional de los tratamientos clásicos (incluyendo la diálisis y el trasplante) más que a la introducción de nuevas terapias. También parecen haber influido las mejoras introducidas tanto en las intervenciones cardiovasculares (antihipertensivos, hipolipemiantes, etc.) como en la antibioterapia. Aunque se intuye que el diagnóstico de casos más leves o posibles cambios en los patrones de enfermedad hayan podido influir decisivamente, esta hipótesis no ha podido ser probada hasta la fecha3.
CONSIDERACIONES METODOLÓGICAS
Predecir la mortalidad en una enfermedad como el LES no es tarea fácil, ya que se trata de una enfermedad crónica, poco frecuente, de carácter multisistémico y tremendamente polimorfa. Además, la mortalidad es baja y predominantemente tardía en la actualidad. Por si fuera poco, la muerte puede sobrevenir tanto por la actividad de la enfermedad como por complicaciones derivadas del daño irreversible acumulado, por infecciones, trombosis, episodios cardiovasculares, linfoma, neoplasias sólidas o por complicaciones derivadas del tratamiento y, por supuesto, por cualquier causa incidental. Además, las causas de muerte varían a lo largo de la evolución de la enfermedad.
Los estudios diseñados con el propósito de analizar la mortalidad en el LES topan con múltiples dificultades metodológicas que no siempre se resuelven satisfactoriamente. Dificultad, en primer lugar, a la hora de establecer si el LES ha sido o no la causa de la muerte, aspecto fundamental si se tiene en cuenta que el valor predictivo de una variable puede cambiar si el cálculo se basa en mortalidad directamente atribuible al LES. Dificultad esta que estriba en que, con frecuencia, se mezclan varias causas (actividad, infección, etc.) y en que, no pocas veces (al menos en Estados Unidos) el LES no figura en los certificados de defunción como causa primaria o secundaria de la muerte del paciente14. Dificultades relacionadas con la limitaciones de los instrumentos utilizados en las medidas de los distintos aspectos de la enfermedad, como puede ser la medida del daño acumulado (SLICC/ACR/DI [-/American College of Rheumatology]) o de la actividad (SLEDAI [Systemic Lupus Erythematosus Disease Activity Index], SLAM [Systemic Lupus Activity Measure], ECLAM [European Consensus Lupus Activity Measurement]). Dificultades derivadas de la modalidad de la cohorte disponible y el tiempo de observación, aspecto que influirá decisivamente en la validez de las conclusiones, si se tiene en cuenta que la cohorte ideal sería una cohorte de inicio, prospectiva y sometida a un largo seguimiento. Una cohorte de inicio minimiza la exclusión de muertes tempranas y resulta idónea para estudiar la mortalidad precoz, pero precisaría muchos pacientes, dado que la medida de desenlace es tardía y poco frecuente, aspecto que incrementa sustancialmente el coste del estudio. La mayoría de los estudios publicados son de carácter retrospectivo, y los prospectivos disponibles pocas veces han sido diseñados con un propó-sito concreto, como puede ser el caso del estudio LUMINA, un estudio de LES en minorías étnicas puesto en marcha en Birmigham (Alabama). Y finalmente, y sin ánimo de ser exhaustivos, dificultades también a la hora de reunir una cohorte de suficiente número de pacientes, que con frecuencia aboca a la necesidad de ensamblar cohortes multicéntricas, con los consiguientes problemas de homogenización de criterios y aumento de costes.
A la hora de analizar los resultados de un estudio de mortalidad lúpica es también importante considerar si la cohorte está o no basada en población (pocas lo están) y cuál es la fuente de los datos: administrativos, historiales clínicos, etc. También es importante considerar los años en que se realizaron las observaciones, ya que los factores asociados a mortalidad han cambiado con el tiempo, y también por supuesto dentro de la propia cohorte. La definición de comienzo de enfermedad puede asimismo variar de un estudio a otro, bien se use la fecha de cumplimiento de criterios o bien la fecha del primer síntoma atribuible a la enfermedad, siempre difícil de establecer.
No es, por tanto, de extrañar que los factores que los diferentes grupos de investigadores han encontrado asociados a mortalidad y su importancia relativa hayan variado considerablemente de estudio a estudio. Con todo esto en mente, trataremos de analizar críticamente la solidez de los diferentes factores que han venido apareciendo en la literatura y su relevancia, a la luz de los datos más actuales de que disponemos.
Se han identificado una pléyade de factores, y a modo de introducción en las tablas 1 y 2 se exponen los que creemos que se sustentan en estudios más sólidos o bien nos ha parecido interesante reseñarlos por su carácter emergente. Todos ellos han mostrado capacidad de predecir mortalidad de forma independiente en al menos un análisis multivariable.
FACTORES SOCIODEMOGRÁFICOS
LES tardío
Si entendemos por LES tardío el que se inicia después de los 50 años, entonces éste corresponde al 10-20% de los sujetos en las diferentes cohortes, y es más frecuente en caucásicos. Estos pacientes parecen tener un perfil clínico diferente, con un inicio más insidioso, menor frecuencia de afectación visceral, menor actividad y mayor daño acumulado que los que comienzan a una edad más habitual. Por tanto, no sería una sorpresa que la mortalidad fuese diferente.
La mayoría de los estudios que han realizado análisis multivariable han concluido que los pacientes con LES tardío se mueren más5,15-18. Pero ¿es esta diferencia mayor que la esperable simplemente por la edad? La respuesta parece ser no, al menos en la mayor cohorte de LES de la historia10, donde en mayores de 60 años el RME resultó de 1. Sin embargo, en la cohorte monocéntrica de Erlanger9, tener más de 40 años al inicio supuso un RR de muerte de 19,9, ajustando para RME. Quizá este elevado RR se explique porque, en ese estudio, se consideró el riesgo de mortalidad por cualquier causa, no sólo la directamente atribuible al LES. Ward17, por su parte, encuentra tendencia a mayor mortalidad directamente atribuible al LES en los pacientes añosos de su cohorte de inicio. Estos datos sugieren que la actividad lúpica podría tener mayor impacto en los pacientes de mayor edad, debido quizás a la mayor comorbilidad y, digamos, "fragilidad biológica". La importancia de la comorbilidad en la mortalidad del LES tardío queda patente en el estudio caso control anidado realizado sobre la cohorte del LUMINA19, donde el odds ratio (OR) resultó de 10 a favor del LES tardío.
Sexo
Posiblemente los varones presenten un LES más grave y desarrollen daño irreversible más acelera-do20, 21.
La mayoría de los estudios retrospectivos europeos encuentran mayor mortalidad en varones12,22-24. Sin embargo, los estudios que la comparan con la mortalidad estandarizada obtienen resultados contradictorios; en la cohorte de Johns Hopkins, Kasitanon et al5 encuentra un hazard ratio (HR) de 2,4, claramente superior al ratio de mortalidad varón/mujer ajustado a edad en población americana. Bernatsky et al10 no encuentran diferencias sexuales en RME. Para estos autores, la mayor mortalidad del varón con LES se explicaría simplemente por su menor longevidad.
En la cohorte de inicio del GLADEL (Grupo Latinoamericano De Estudio del Lupus) tampoco se encontraron diferencias, lo cual sugiere que si se incluyen las muertes por actividad de enfermedad, que suelen predominar al inicio, las diferencias achacables al sexo resultan menos obvias. Sin embargo, en ese estudio se produjeron pocos fallecimientos, en gran parte por un seguimiento corto, demasiado pocos como para poder extraer conclusiones firmes analizando subgrupos21.
También se contradicen los estudios que analizan mortalidad por LES separándola de la global25.
Finalmente, cabe señalar que las diferencias sexuales en mortalidad, de existir, pueden también obedecer a razones no estrictamente biológicas, como la tendencia por parte del varón a consultar menos a los profesionales sanitarios, al menos en determinados ambientes sociales.
Factores étnico-raciales
No entra en nuestros planes extendernos en los aspectos étnico-raciales de la mortalidad del LES, pero dada la tendencia a una mayor heterogeneidad étnica de nuestra sociedad, haremos una sucinta revisión de este aspecto.
Se acumulan pruebas de que el LES es más común y más grave (con mayor mortalidad) en poblaciones no caucásicas. La controversia sobre si el aumento de mortalidad se explica por razones biológicas o socioeconómicas, o ambas, es ya secular. Es importante tener en consideración que mayor gravedad no implica necesariamente que la mayor mortalidad sea atribuible a la raza, ya que existe una importante co-linealidad entre variables socioeconómicas y raciales. A modo de ejemplo, el paciente afroamericano puede llegar en fase más avanzada de su enfermedad al hospital, sin haber dispuesto de control médico previo y registrarse como más grave, y la gravedad ser más atribuible a las condiciones sociosanitarias (menor cobertura sanitaria para la etnia afroamericana en Estados Unidos) que a su raza.
Al menos en Estados Unidos, la mayor mortalidad de afroamericanos es en gran parte explicable por factores socioeconómicos5,17,26,27. En la cohorte del Johns Hopkins, los factores socioeconómicos resultaron más poderosos para predecir mortalidad que la raza negra, si bien el HR siguió siendo mayor de 1 (concretamente 1,5) cuando se incluyeron éstos en el modelo de regresión5. Sin embargo, la disparidad entre afroamericanos y caucásicos que muestran la mayoría de los estudios (2-3 veces) es mayor de la que se suele ver en otras patologías, es decir, excede los ratios étnicos habituales de mortalidad, independientemente de la cobertura sanitaria. Este hecho sugiere que operan factores biológicos específicos del LES y no sólo factores socioeconómicos, como concluye un estudio basado en población28. Otra explicación plausible sería que los factores socioeconómicos tuvieran mayor impacto en enfermedades crónicas, como el LES, que en agudas. Y otra hipótesis, quizá más rebuscada, sería considerar que dada la mayor prevalencia de hipertensión y diabetes en afroamericanos, el LES podría tener un mayor impacto sobre estos pacientes.
En un reciente estudio realizado en Toronto no se ha conseguido encontrar diferencias raciales en la mortalidad. Estos resultados son interesantes en el sentido que nos ocupa, ya que se trata de una población relativamente homogénea, con acceso libre a la sanidad y similar nivel de educación, situación un tanto distinta a la de las minorías étnicas de Estados Unidos. Una limitación reseñable del estudio es que no se basó en población29. Con todo, los mismos resultados han sido consistentemente encontrados en la cohorte multiétnica de LUMINA, después de 10 años de seguimiento y usando definiciones robustas de las diferentes variables socioeconómicas27.
En España, los datos disponibles apuntan a que la mortalidad del LES es, como cabría esperar, similar a la descrita en otras poblaciones caucásicas y menor que en poblaciones hispanas de origen americano30.
Factores socioeconómicos
Fue Dubois quien por vez primera llamó la atención sobre la importancia de los factores socioeconómicos en la mortalidad. Sin embargo, ya se ha señalado aquí la dificultad de separar estos factores de los étnico-raciales.
La pobreza y los factores asociados con la pobreza son poderosos predictores de desenlace desfavorable en gran variedad de enfermedades crónicas, y el LES no debería ser una excepción.
De forma bastante consistente, múltiples estudios han asociado bajo nivel de ingresos a mayor mortalidad, incluyendo los realizados sobre varias cohortes de inicio y en áreas geográficamente bien distantes5,16,17,31-33. Por otro lado, los análisis sobre cohortes de países menos desarrollados tienden a comunicar mayor mortalidad34.
En cuanto a los niveles de educación, parece que el número de años de escolarización alcanzados puede tener un impacto en la supervivencia, como se demuestra en la cohorte multicéntrica iberoamericana GLADEL, donde el OR de muerte resultó de 3,2 para el subgrupo de pacientes con menos de 10 años de currículum educativo, en un reciente estudio del grupo33. En caucásicos estadounidenses el nivel de educación se asocia positivamente a una mayor supervivencia, pero no parece suceder así en las minorías étnicas35. Quizá pueda influir en esto un menor reconocimiento del LES como causa de muerte en afroamericanos con bajo nivel educativo.
La cobertura médica es otro aspecto estrechamente relacionado con la pobreza que se ha asociado con la mortalidad en múltiples estudios26,33,36. En varios países sin cobertura sanitaria universal se comunica una mayor mortalidad en las instituciones sa nitarias públicas respecto a las privadas32,36, y también se han hallado diferencias comparando cobertura sanitaria parcial con cobertura plena33.
FACTORES CLÍNICOS
En cuanto a los factores clínicos, no sin cierta arbitrariedad nos atrevemos a seleccionar como más relevantes, o más sólidamente establecidos, la presencia de afectación visceral (o mayor) y puntuaciones elevadas en los índices de actividad o daño acumulado.
Manifestaciones hematológicas: anemia y trombocitopenia
La mayoría de los estudios, pero no todos, encuentran que la trombocitopenia se asocia a mayor mortalidad, sea cual sea su magnitud16,27,37. Aparece como tal tanto en grandes cohortes retrospecti-vas38, ya antiguas, como en estudios más recientes que realizan análisis multivariable27,37. En un estudio, la trombopenia resultó incluso el único factor clínico independiente18. Este dato contrasta con el hecho de que la muerte por hemorragia asociada a trombopenia está escasamente representada en la mayoría de las series de LES. Estaríamos, por tanto, ante un marcador de gravedad. La anemia, hemolítica o no, es otro de los factores hematológicos tradicionalmente relacionados con la mortalidad. Al igual que sucede con la trombocitopenia, la anemia hemolítica resultó ser el único factor clínico que persistió asociado a la mortalidad, tras todos los ajustes, en un reciente estudio sobre la cohorte del Johns Hopkins5. Curiosamente aparece asociado a mortalidad por infección en al menos 2 estudios5,39. Quizá la explicación esté en que estos pacientes suelen precisar un régimen de inmunosupresión más bien intenso para mantener su hemoglobina en cifras compatibles con la vida, ya que ésta (al contrario de lo que sucede con el riñón) no puede ser sustituida de forma sostenida.
Nefritis lúpica
La supervivencia a los 10 años del LES con afectación renal ronda el 70% en la mayoría de las series. A los 5 años no es muy superior: un 80% de los pacientes permanecen vivos. El RR de muerte en pacientes con afectación renal respecto a los que no la tienen oscila entre 2 y 3. El aumento de mortalidad parece haberse mantenido en el tiempo; sin embargo, las muertes por enfermedad renal respecto a las esperables en población de similar edad y sexo han disminuido. Esto sugiere que la mortalidad asociada a nefritis lúpica se ha reducido, y esta reducción no sólo es achacable a mejoría de los tratamientos sustitutivos (diálisis y trasplante).
Sin embargo, merece la pena analizar esta cuestión en más detalle. Si por afectación renal entendemos presencia de glomerulonefritis lúpica, vemos que algunas cohortes establecidas (no de inicio) no logran demostrar una asociación con mortalidad en los análisis multivariables18,39,40). Por otra parte, en los estudios que han aplicado el modelo de riesgos proporcionales de Cox5,18,37 no se observa fuerte asociación con enfermedad renal, salvo en el caso de que esté presente al inicio. Parece claro, eso sí, que la presencia de glomerulonefritis al inicio (en el primer año de enfermedad) se asocia a mayor mortalidad, con RR de 1,3 a 1,7 según los ajustes realizados. Este hecho ya había sido comunicado por Wallace hace bastantes años: el desarrollo de síndrome nefrótico al inicio se asociaba, en su gran cohorte retrospectiva, ya clásica, a un pronóstico peor que su aparición durante el seguimiento41. Un aspecto menos estudiado de las variables asociadas a mortalidad del LES es la duración de la exposición. A modo de ejemplo, un estudio encuentra una fuerte asociación de la duración de la enfermedad renal con la mortalidad42.
Según la mayoría de los estudios es la azoemia, y no tanto la afectación renal en sí misma, la variable que mejor predice mortalidad. Resulta, desde luego, más constante como predictor de mortalidad el daño renal irreversible que la sola presencia de nefritis, con un RR de 2,6 a 316,43. Incluso al menos ha sucedido así en una cohorte la presencia de nefritis en ausencia de daño renal puede ser un factor protector16. Los factores de riesgo de muerte más constantes en un paciente con nefritis, referidos a la afectación renal, se muestran en la tabla 3. En cuanto a la biopsia renal, Esdaile et al42 encontraron que el índice histopatológico de cronicidad era el único predictor fiable y estable de mortalidad no renal en pacientes con nefritis. Esto ha sido corroborado en estudios similares44,45. Sin embargo, la biopsia renal (el índice de cronicidad, concretamente) sólo añade información pronóstica respecto a la mortalidad en casos sin deterioro importante de la función renal44.
Lupus neuropsiquiátrico
Probablemente sobrestimado como causa de muerte, la presencia de LES neuropsiquiátrico se asocia a mortalidad sólo en el caso de manifestaciones mayores y puede que sólo sea así cuando se acompaña de enfermedad multisistémica46. También aquí han aparecido estudios que encuentran LES neuropsiquiátrico asociado a mortalidad sólo si aparece en el primer año de enfermedad18. Es decir, parece claro que la afectación visceral o mayor al inicio de enfermedad se vislumbra como un dato que ensombrece el pronóstico vital.
Uno de los problemas recurrentes a la hora de estudiar las manifestaciones neuropsiquiáticas del LES como predictoras de mortalidad estriba en que los criterios para definir su presencia son quizá demasiado amplios, incluyendo la reciente definición propuesta por el ACR, de lo que resulta una alta prevalencia de este tipo de manifestaciones, manifestaciones por otra parte de gravedad muy desigual. Así pues, no sorprende que, considerando globalmente, el LES neuropsiquiátrico no aparezca asociado a mortalidad en algunos estudios24 pero sí lo haga si sólo se incluyen las manifestaciones mayores26,47. Sin embargo, un estudio sobre la cohorte sueca de Lund, estudio en el que se hizo esta distinción, no logró demostrar que los pacientes con LES neuropsiquiátrico "mayor" muriesen más que los que no lo tenían48.
Síndrome antifosfolípido
Es el síndrome antifosfolípido secundario, más que la sola presencia de anticuerpos antifosfolípido, lo que se ha asociado a mayor mortalidad. De forma más consistente lo hacen las trombosis arteriales frente a las venosas, y no sólo acontece con las manifestaciones trombóticas: también la trombopenia y la valvulopatía cardíaca asocian mayor mortalidad40,49. La supervivencia puede reducirse sustancialmente, como sugiere un estudio retrospectivo reciente realizado en nuestro país: a los 15 años, el 90% de los pacientes sin el síndrome estaban vivos, frente a sólo el 65% de los que sí lo padecían50. Diferencias no menos marcadas han sido comunicadas por otro grupo a más corto plazo, concretamente a 8 años49.
Parámetros de laboratorio
La asociación de los diferentes autoanticuerpos propios del LES a mortalidad, de existir alguna, es desde luego pobre. Estudios aislados la han encontrado con anti-ADN nativo, anticuerpos anticitoplasma de neutrófilo (ANCA)51 y anticuerpos anti-Sm52, entre otros. El consumo de complemento ha estado, hasta muy recientemente, ausente de las conclusiones de la mayoría de los estudios de mortalidad lúpica. Sin embargo, en una poderosa cohorte de inicio se comunica recientemente que el consumo de complemento se asocia a mortalidad5. Es posible que la asociación resulte más sólida si se analiza separadamente, y con un seguimiento suficientemente largo, el subgrupo de pacientes con nefritis42.
Actividad global de enfermedad
Se conoce su impacto en la mortalidad desde hace 2 décadas. El grado de actividad del LES está sólidamente establecido como marcador de mortalidad, ya sea medido al inicio o estimando actividad acumulada5,16,31,53. Esto sucede así con cualquiera de los instrumentos validados para medirla, aunque el índice más usado con este propósito ha sido el SLEDAI (Systemic Lupus Erythematosus Disease Activity Index).
Una medida aislada al inicio (a la entrada en la cohorte) parece predecir mortalidad, tanto a corto como a largo plazo, aunque en algún estudio esto sólo acontece en rangos altos de actividad. Aunque teóricamente la actividad acumulada debería predecir mejor la mortalidad que una medida aislada, al no disponer de instrumentos validados para su estimación, existen incertidumbres al respecto. Varios grupos han desarrollado modificaciones del SLEDAI (WAS, AM-SLEDAI-2K) y demostrado su capacidad de predecir mortalidad53,54.
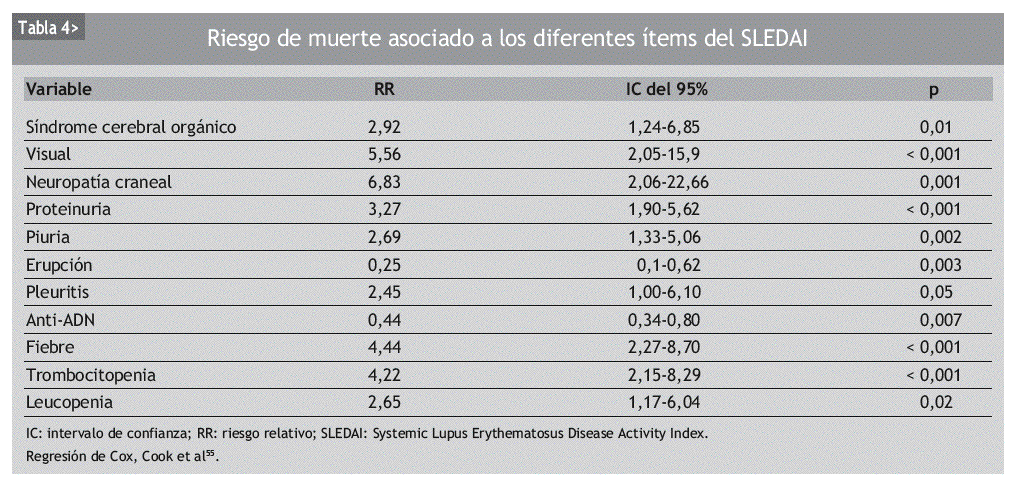
En algún estudio, el grado de actividad resultó incluso el factor predictor independiente más poderoso34. Interesantemente, el SLEDAI se comporta como un buen marcador de mortalidad a corto plazo, como demostró Cook en la cohorte de Toronto55: se constató un gradiente de RR de muerte a 6 meses, paralelo al aumento del SLEDAI (con un RR de hasta 14 para puntuaciones de SLEDAI superiores a 20).
Varios investigadores concluyen que puede resultar mejor predictor de mortalidad el número de brotes (frecuencia de brote) que el grado de actividad56,57. En el estudio de Swaak57, la supervivencia resultó inversamente proporcional al número de exacerbaciones: para pacientes con una, dos o más exacerbaciones, la supervivencia a los 10 años resultó del 91, del 69 y del 33%, respectivamente. Si el paciente no había padecido ningún brote en 10 años tras el diagnóstico, entonces la supervivencia resultó del 100%. Una de las limitaciones de este interesante estudio es que no se usó una definición estandarizada de brote.
Basados en la limitada consistencia interna de los diferentes índices de actividad global, varios autores sugieren analizar por separado cada aparato o sistema. A modo de ejemplo, en la tabla 4 se exponen los riesgos relativos de cada ítem por separado en el estudio, ya mencionado, del grupo de Toronto55.
En pacientes con enfermedad renal, el grado de actividad global aporta información, en lo que se refiere al pronóstico vital, sólo en ausencia de daño renal58.
Daño y mortalidad
Las relaciones entre daño y mortalidad se han estudiado sobre todo en los últimos 5 años, desde que se generalizó el uso de un instrumento adecuado para medir el daño, entendido como lesión ti-sular permanente y clínicamente relevante: el SLICC/DI/ACR (SDI). El daño es fruto de los efectos combinados de la actividad acumulada del LES, el envejecimiento y la iatrogenia, de manera que es previsible su asociación a mortalidad.
Los pacientes que experimentan daño están más graves que los que no lo tienen, y con frecuencia muestran mayor afectación renal y acumulan mayor número de criterios de LES. Asimismo, la mayoría de los estudios constatan un mayor SDI en fallecidos59-61, aunque este hallazgo no es uniforme54.
El SDI se asocia a mortalidad independientemente de la actividad (al menos cuando ésta se mide puntualmente) y, al igual que sucedía con la actividad, en un estudio aparece como el mejor factor predictor de muerte62.
Cabe señalar que cualquier magnitud del daño parece tener influencia en la mortalidad. En la cohorte de inicio del grupo GLADEL33 una puntuación de SDI igual o superior a 1 se asoció a una OR de mortalidad de 2,8. En cuanto a la tasa de aumento, por cada punto de aumento del SDI, el HR resultó de 3,65 en un estudio asiático15. Por otra parte, en un estudio europeo, un incremento del SDI de 2 o más entre el primer y el segundo año del diagnóstico suponía un RR de muerte de 7,7, el RR más alto de todos los factores estudiados9.
También parece importante la precocidad: cualquier daupervivencia a los 10 años baja del 90 al 75%63. Por dominios, el grupo británico liderado por Isenberg64 encontró que eran los subapartados de daño pulmonar o renal precoz (al año del diagnóstico) los que más fuertemente se asociaban a mortalidad.
Hay que resaltar también que, a diferencia del grado de actividad, el SDI no es un buen predictor de muerte a corto plazo37.
Por otra parte y merece destacarse, la ausencia de daño en los 5 primeros años de enfermedad (entendido como SDI = 0) se asoció a un valor predictivo positivo de supervivencia del 97% en un estudio europeo59. A los 10 años, RME era 1 o, lo que es lo mismo, la mortalidad era igual a la de la población de similar edad y sexo. En definitiva: si no ocasiona daño en los primeros 10 años, el LES aparece como una enfermedad que no aparenta comprometer la supervivencia del paciente.
Infección
Del 20 al 50% de los pacientes lúpicos mueren por infección o ésta participa en los eventos finales. La infección es la primera causa de muerte en algunas cohortes actuales, sobre todo en las de origen asiático15,37,65 y particularmente en el LES tardío15. En un estudio sobre una subcohorte de inicio del grupo de Toronto63, la infección resultó la primera causa de muerte sólo en el subgrupo con daño precoz. En los 2 estudios publicados por el grupo Eurolupus Proyect, con un seguimiento a 5 y 10 años, se pone de manifiesto que la infección permanece como una causa estable de muerte, comparable a la ocasionada por patología cardiovascular o por la actividad de la enfermedad66,67. Con todo esto en mente, cabría plantearse si los episodios infecciosos pueden ayudar a predecir mortalidad. En un estudio se concluye que el subgrupo de pacientes con infecciones de repetición (ajustando para intensidad de tratamiento inmunosupresor) tenía más mortalidad39. Incluso tras excluir los pacientes que murieron por infección, Halberg et al68 encuentran que la historia de infección grave predice mortalidad. En ese estudio, dos tercios de los pacientes que padecieron una infección grave estaban muertos a los 10 años. En otro estudio retrospectivo69, el RR de muerte por cada infección grave fue de 13. Se podría concluir que, de alguna manera, las infecciones graves o repetidas parecen comportarse como indicadores de gravedad.
Factores de riesgo cardiovascular y mortalidad
La mortalidad cardiovascular en el LES es claramente superior a la de la población general, al menos la derivada de la cardiopatía isquémica, con RME alrededor de 2, ratio que parece haber aumentado con el tiempo4,70. La mayoría de los estudios han encontrado un aumento de prevalencia de factores de riesgo cardiovascular clásicos en el LES, aunque éstos no explican completamente la magnitud de la enfermedad cardiovascular que se constata en estos pacientes42. Sin embargo, pocos estudios han analizado el impacto de los factores de riesgo cardiovascular en la mortalidad global del LES.
En un estudio ya antiguo, realizado en la base de datos ARAMIS, se concluyó que la hipertensión arterial sistólica a la entrada en la cohorte era el factor de riesgo de muerte más importante, particularmente analizando la mortalidad tardía71. Sin embargo, esto sólo sucedía en el análisis univariable, y estudios posteriores no han confirmado esta asociación16. Con todo, no deberíamos desdeñar por ello la hipertensión arterial como posible marcador de mortalidad.
En cuanto a la hiperlipemia, se comunica un aumento de su prevalencia en casi todas las grandes cohortes de LES, más constante en las americanas, y esta prevalencia parece incrementarse con el tiempo de permanencia en la cohorte. En un reciente estudio del grupo de Toronto, que contó con más de mil pacientes, el aumento de colesterol total (en la primera muestra disponible) se asoció a RR de mortalidad de 1,2, curiosamente sólo de mortalidad asociada a causa renal72. Esta asociación a mortalidad se mantenía también analizando solamente la subcohorte de inicio. Otros investigadores han encontrado resultados similares43.
No se dispone de estudios que hayan analizado el impacto de otros factores clásicos, como el tabaquismo y la diabetes, en la mortalidad del LES.
Gravedad de la enfermedad
Cualquier índice de gravedad bien construido tendrá necesariamente que asociarse a mortalidad. Aun con ello, no deja de resultar interesante disponer de algún índice que suministre información cuantitativa a este respecto y permita comparar las diferentes cohortes. Sólo 3 estudios, todos ellos caso-control, han usado una medida concreta de gravedad para predecir mortalidad. Ward73 estudió la mortalidad del LES durante el ingreso hospitalario mediante un índice creado ad hoc: el índice de comorbildad y factores de riesgo de muerte en LES. Este índice, derivado del índice de Charlson y validado por el propio autor, se construyó analizando datos administrativos de más de 10.000 hospitalizaciones. En ese estudio se pudo comprobar que la mortalidad aumentaba un 36% por cada punto que aumentaba el índice. En el estudio caso-control, ya citado, de Hernández-Cruz et al69 se usó el índice de Katz, un índice de gravedad sencillo que ha sido sometido a un cierto proceso de validación. Los autores estudiaron las autopsias de los pacientes lúpicos fallecidos durante un período de 34 años en un centro mexicano, y encontraron que un índice de gravedad mayor de 2,5 predecía mortalidad y que todos los pacientes con índice mayor de 10 habían muerto, frente a ninguno con menos de esa cifra.
En otro estudio se utilizó la definición categórica de gravedad del comité de directrices del ACR para clasificar el LES. Las curvas de supervivencia comenzaban a diferir, entre LES leves y graves, a partir de los 15 años del diagnóstico. De todos modos, la cohorte era demasiado pequeña como para acumular suficientes muertes precoces22. Y en cualquier caso, es de prever que un índice categórico ("gravedad sí/no") proporcione información más bien limitada para predecir mortalidad.
Tratamientos del lupus y mortalidad
La "intensidad" del tratamiento, definida de diversas formas, ha sido capaz de predecir mortalidad en diferentes cohortes.
Tanto la dosis promedio como la acumulada69 o la duración prolongada del tratamiento esteroideo74 se han asociado a la mortalidad del LES. El problema radica en que el fuerte paralelismo entre el tratamiento esteroideo y la gravedad de la enfermedad dificulta la separación de la mortalidad directamente atribuible al uso de glucocorticoides y limita su utilidad como predictor de mortalidad.
Los datos a largo plazo del estudio de tratamiento con ciclofosfamida (CFM), asociada o no a plasmaféresis, en la glomerulonefritis lúpica proliferativa difusa sugieren un efecto positivo de la CFM sobre la supervivencia. En su seguimiento a 10 años, los autores (del Lupus Nephritis Colaborative Study Group) concluyen que el 95 y el 76% de los pacientes que alcanzaron remisión completa y parcial, respectivamente, con CFM estaban vivos, frente a solamente el 46% de los que no consiguieron remisión75. Estas cifras de supervivencia para los pacientes que responden a CFM se asemejan a las propias del LES sin afectación renal. Sin embargo, los estudios comparando diferentes regímenes de inmunosupresión en la nefritis lúpica no han conseguido demostrar superioridad de uno sobre otro en cuanto a la supervivencia del paciente76.
Dado que los antipalúdicos reducen el riego de brote mayor y tienen un papel protector reconocido sobre el desarrollo de daño acumulado, se ha planteado la posibilidad de que sean capaces de mejorar la supervivencia del LES, como así lo sugieren varios estudios43,69. La cuestión de si la "confusión por indicación", derivada de la tendencia a tratar con antipalúdicos a los pacientes menos graves, explica o no su presunto papel protector de mortalidad está aún por resolver. Dos estudios observacionales han intentado obviar esta confusión y han aportado los mejores datos disponibles. Ruiz-Irastorza et al77, basándose en cohorte prospectiva, realizan un ajuste utilizando el propensity score y obtienen un HR de mortalidad de 0,13 favorable a los antipalúdicos. Este estudio, en el que también se tuvo en cuenta la variación en el tiempo de exposición a los antipalúdicos, se cuenta entre los pocos cuyas conclusiones han sugerido que un tratamiento global para el LES mejora la supervivencia a largo plazo. El estudio de casos y controles anidado sobre la cohorte de LUMINA obtuvo resultados equiparables78.
Factores ambientales: luz ultravioleta
En 2 estudios llevados a cabo en Estados Unidos se encontró un agrupamiento de la mortalidad por LES en áreas geográficas con mayor exposición a la radiación solar (como fuente de UVB)79,80. Sin embargo, este factor resulta difícil de separar de la pobreza, ya que las clases socialmente más desfavorecidas tienden a vivir en zonas más cálidas.
Falta de adaptación o actitudes inadecuadas frente a la enfermedad
Varios investigadores señalan que, como cabría esperar en cualquier enfermedad crónica, la falta de adherencia al tratamiento y a los regímenes de seguimiento establecidos tienen un impacto negativo en la supervivencia del paciente con LES. Este aspecto, también abordado de forma sistemática en LUMINA, no parece influir en la mortalidad precoz31.
Experiencia del centro sanitario o del médico
Es un hecho bien conocido que en diversos procesos médicos y quirúrgicos la mortalidad se relaciona directamente con el volumen de procedimientos practicados. No hay razones para pensar que el lupus vaya a ser excepción en esto. Varios estudios realizados por Michael Ward, en diferentes estados americanos, han demostrado que el grado de experiencia del centro hospitalario o del médico responsable es un factor fuertemente asociado a mortalidad. La menor mortalidad hospitalaria del LES en centros con experiencia resulta más evidente cuando la razón de la hospitalización es el propio LES. En uno de los estudios, la diferencia resultó notable en el subgrupo de pacientes con seguro público, con un OR a favor de los centros con experiencia nada menos que de 0,05, y esto con independencia de la gravedad de la enfermedad81. La experiencia del médico, cualquiera que sea su especialidad y con independencia del volumen de pacientes con LES tratados en el hospital, también se relacionó inversamente con la mortalidad en otro de los estudios de este autor82. Además se observó una relación lineal, y la mortalidad fue inversamente proporcional al número de pacientes por año hospitalizados por LES a cargo del médico en cuestión. Las diferencias resultaban ya patentes comparando 3 frente a 1 paciente/año, con una mortalidad un 43% menor a favor del médico más experto. Aunque estos resultados probablemente no sean directamente trasladables a nuestro medio, sí constatan que es más que probable que existan diferencias basadas en la experiencia.
Mortalidad durante la hospitalización: predictores al ingreso
Del 3 al 5% de los pacientes lúpicos que se hospitalizan mueren durante el ingreso, al menos en Estados Unidos.
Usando datos administrativos y una herramienta estadística novedosa (el análisis random forests), un estudio de los National Institutes of Health (NIH) sobre 3.839 hospitalizaciones por LES identificó como predictores de muerte más importantes la presencia de fallo respiratorio y un índice de comorbilidad del LES elevado, con RR de 12,3 y 11,9, respectivamente. Este índice de comorbilidad del LES, desarrollado por Ward y ya comentado previamente, es una suma ponderada de 14 procesos, incluyendo morbilidad por infecciones. También se asociaban a menor supervivencia las siguientes variables consideradas aisladamente: edad (RR de 8,5), sepsis (RR de 5,7), nefritis o insuficiencia renal crónica (RR de 3,8), trombopenia (RR de 3,8) o insuficiencia cardíaca (RR de 3)83. Las conclusiones de otro estudio reciente remarcan la importancia de la comorbilidad en la mortalidad hospitalaria del LES. Basándose en datos procedentes de la NIS (Nationwide Inpatient Sample), la base de datos de hospitalización más amplia de Estados Unidos, los autores analizaron más de 8.000 hospitalizaciones urgentes en las que constaba el LES como diagnóstico principal. La comorbilidad, entendida como número de diagnósticos, se asoció a mortalidad, pero el mejor predictor resultó ser el estatus socioeconómico desfavorable. Como cabría esperar, el aumento de la edad se asoció también con un mayor riesgo de muerte, con una OR de 1,03 por año28.
La historia de admisiones hospitalarias múltiples resultó un fuerte predictor de mortalidad en un estudio monocéntrico (OR de 12,4)84.
Varios investigadores han analizado, mediante estudios retrospectivos, la mortalidad de los pacientes lúpicos ingresados en unidades de medicina intensiva (UMI). La mortalidad de esta enfermedad en UMI, del 30 al 50%, no parece diferir de la asociada a otras patologías, si se ajusta para edad y gravedad. Para realizar el ajuste de gravedad se ha venido usando una de las escalas genéricas habituales en este tipo de unidades: la escala APACHE (Acute Physiology And Chronic Health). Aunque aplicable a una amplia gama de patologías en situación crítica, no se conoce su utilidad específica en el LES, ya que los escasos estudios de correlación con la mortalidad lúpica en UMI han arrojado resultados contradictorios85,86.
En un análisis multivarible, Hsu et al87 encuentran como factores de mal pronóstico al ingreso en UMI la hemorragia intracraneal o digestiva y la sepsis como causas de admisión en la unidad. El fallo renal también ha resultado marcador de mortalidad en el entorno UMI, al menos en un estudio. Particularmente ominosa fue su asociación a infec-ción88.
Análisis de subgrupos
Las manifestaciones del LES no se agrupan de forma aleatoria en cada paciente, y hay grupos que se repiten, razón por la cual cabe plantearse su posible impacto en la supervivencia. No ha habido demasiados intentos de analizar la mortalidad lúpica de este modo. Utilizando análisis exploratorio de factores, un grupo de investigadores de Hong Kong encontró diferencias en mortalidad entre los subgrupos resultantes. Se clasificó a los pacientes en 3 cluster: cluster 1, manifestaciones mucocutáneas y linfadenopatías; cluster 2, serositis, afectación renal, pulmonar o gastrointestinal, y cluster 3, artritis, lupus discoide, Raynaud, vasculitis cutánea y afectación neurológica. Los pacientes en cluster 2 tenían mayor mortalidad, si bien eran significativamente mayores y con menor duración de enfermedad que los clusters 1 y 3 (p < 0,001). Desconocemos el valor predictivo positivo de muerte que resultaría de ser clasificado en uno u otro cluster, y la utilidad que pueda tener una herramienta como esta prediciendo mortalidad en el paciente individual está por establecer89.
Predictores de mortalidad y momento evolutivo de la enfermedad
Desde el punto de vista del clínico es importante disponer, desde el primer momento que valoramos al paciente, de elementos que permitan aproximarnos a una predicción de mortalidad. Para ello, resulta interesante detenerse a examinar las aportaciones de los estudios que analizan los factores predictores de mortalidad presentes al inicio (a la entrada en la cohorte).
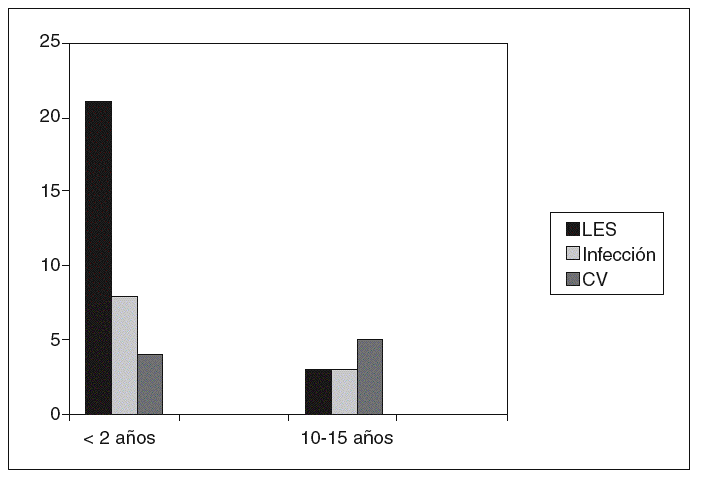
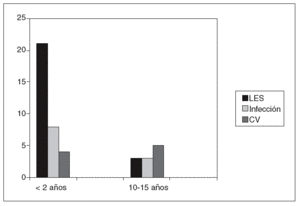
Si analizamos las causas de muerte en una cohorte de inicio nos encontramos con el conocido patrón bimodal de mortalidad, donde podemos comprobar cómo las causas de muerte varían según el tiempo de evolución de enfermedad (fig. 1). Resultaría pues interesante considerar separadamente los factores asociados a mortalidad precoz de los asociados a mortalidad tardía, sin olvidar que el apoyo en la literatura médica de este ejercicio es limitado y no exento de arbitrariedad a la hora de definir "precoz" o "tardío".
Figura 1 Causas de muerte en una cohorte de inicio de lupus eritematoso sistémico(LES). De Ward et al70.
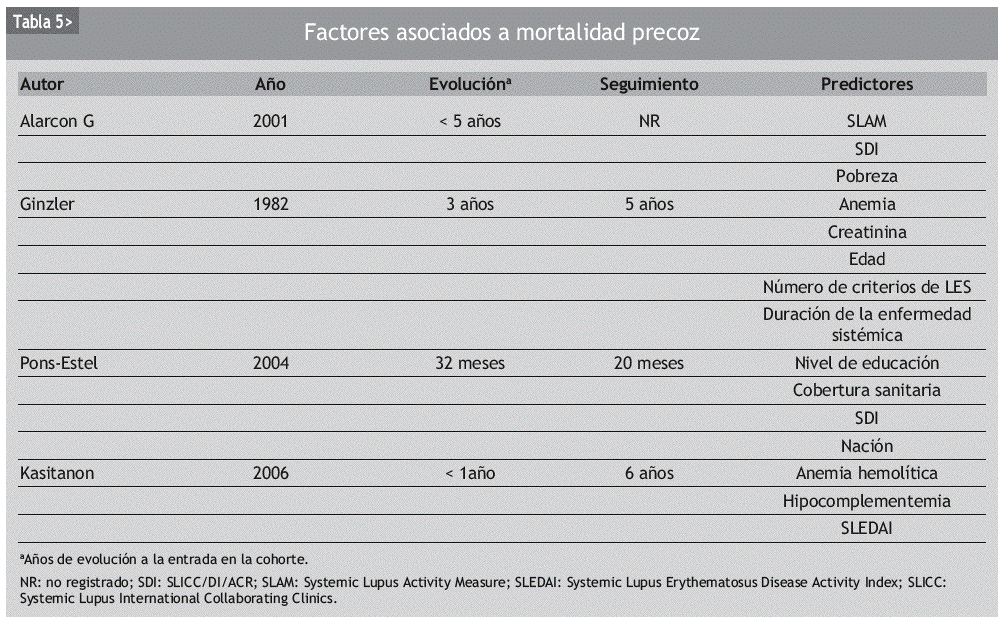
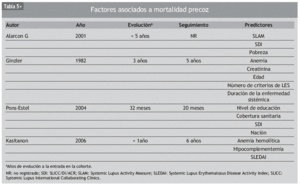
Para describir los factores asociados a mortalidad precoz, tendremos que fijar nuestra atención en cohortes de inicio o al menos de corta evolución de enfermedad, que hayan publicado sus resultados de seguimiento a "medio plazo" (suele hacerse a los 5 años de evolución). Debe contener además suficiente número de pacientes, dada la escasa mortalidad precoz que exhibe el LES en la actualidad. En la tabla 5 se exponen algunas de las cohortes más relevantes en este sentido. El nivel de actividad global, presencia de daño (SDI positivo), anemia y los factores socioeconómicos aparecen como los más constantes. En el estudio multicéntrico, ya antiguo, de Ginzler et al se concluyó que la duración de la enfermedad sistémica se asociaba a la mortalidad, un factor que aunque se nos antoja interesante no ha sido valorado en estudios posteriores26.
Hay que tener en cuenta, sin embargo, que el valor predictor de un factor puede cambiar con el tiempo (es decir, en un estudio, la variable predictora puede tener impacto sobre todo el período de observación o sobre sólo una parte de él). Por eso no es de extrañar que la capacidad predictora de mortalidad a largo plazo de una variable presente al inicio resulte con frecuencia limitada. Un buen ejemplo de esto lo proporcionan las conclusiones de un estudio canadiense, donde la presencia de proteinuria perdía significación hasta desaparecer como predictor de fallo renal y, por tanto, de mortalidad a los 6 años de la biopsia renal. En este estudio se empleó un modelo de regresión distinto del modelo de riesgos proporcionales de Cox, denominado MARS (Multi Adaptative Regression Splines), modelo que permite detectar cuándo el HR cambia en función del tiempo42.
Los factores presentes al inicio que se han asociado a mortalidad "tardía" (en torno a los 10 años de seguimiento) se refieren sobre todo a la presencia de afectación visceral mayor, especialmente nefropatía26,57,66, aunque, como es lógico, los datos proceden sobre todo de cohortes establecidas. El grupo de Toronto observa, en un estudio reciente, que los valores elevados de colesterol, en la primera determinación disponible, se asocian a mayor riesgo de mortalidad por causa renal a los 8 años de seguimiento72.
Factores protectores
Disponemos de pocos factores que puedan ser considerados protectores de mortalidad, entre otras razones porque han sido menos estudiados. Uno de ellos es el tiempo en remisión sin tratamiento, ya señalado por Alarcón Segovia hace más de 2 décadas90. La presencia de leucopenia también se ha asociado a menor mortalidad en varios estudios, con RR de hasta 0,5 en uno de ellos47. Como se ha comentado previamente, la glomerulonefritis lúpica sin daño renal podría constituir un factor protector de mortalidad. Otros candidatos a factor protector, aún no confirmados, serían: fotosensibilidad, artritis, lesiones cutáneas y el desarrollo de ciertos autoanticuerpos (Ro, RNP)9.
En cuanto al tratamiento, ya hemos discutido la posible capacidad de los antipalúdicos de mejorar la supervivencia de los pacientes lúpicos.
Estrategias sugeridas para reducir la mortalidad
Aunque, lamentablemente, no disponemos de pruebas suficientes, parece prudente emitir ciertas recomendaciones prácticas que creemos cuentan con un sustento medianamente razonable en la literatura especializada (tabla 6).
La importancia de realizar un diagnóstico precoz y actuar sin demora para evitar daño irreversible resulta especialmente trascendente en pacientes con glomerulonefritis lúpica, ya que el tratamiento agresivo precoz con el fin de reducir daño mejora sustancialmente la supervivencia.
La necesidad de implementar el uso generalizado de antipalúdicos se hace patente examinado los resultados de Eurolupus Project67. En esta gran cohorte europea, multicéntrica y multinacional, sólo el 34,8% de los pacientes realizaban tratamiento con antipalúdicos en el momento del estudio.
También deberíamos dirigir esfuerzos prioritarios a controlar la comorbilidad, especialmente los factores de riesgo vascular modificables y la infección. Etiquetar a un paciente lúpico, con o sin tratamiento inmunodepresor, como potencialmente inmunodeprimido, se nos antoja práctico y no precisamente exagerado.
Tampoco parece descabellado sugerir que la asistencia a estos pacientes se concentre, al menos en cada centro, en los servicios con mayor experiencia.
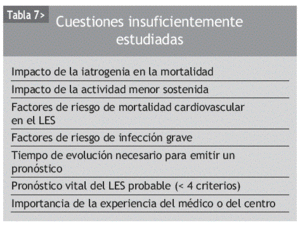
Cuestiones insuficientemente aclaradas y tareas por realizar
Algunas de las cuestiones donde parece más apremiante dirigir el foco de la investigación clínica, en lo que se refiere a factores asociados a mortalidad del LES, se exponen en la tabla 7, pero la gran asignatura pendiente quizá sea la predicción individualizada. Es obvio que la mayoría de los factores de riesgo tienen una capacidad limitada de predecir en el paciente individual. Cada paciente es un conjunto de variables interdependientes que modulan su riesgo de muerte. No disponemos de índices adecuados que suministren una información precisa e inteligible al clínico, que perfeccionen su intuición de la gravedad ante el caso concreto. Se hace necesario el desarrollo de una puntuación sencilla, fácilmente aplicable, que permita clasificar al paciente individual en función del riesgo o calcular su riesgo para un determinado período de tiempo. Dado que el valor predictivo de una variable cambia en presencia de otras, una buena estrategia sería emplear árboles, construidos mediante modelos de regresión, que permitan clasificar a los pacientes en subgrupos de riesgo homogéneo. Ahí es nada, el reto de desarrollar un instrumento así para una enfermedad tan polimorfa como el LES.