INTRODUCCIÓN
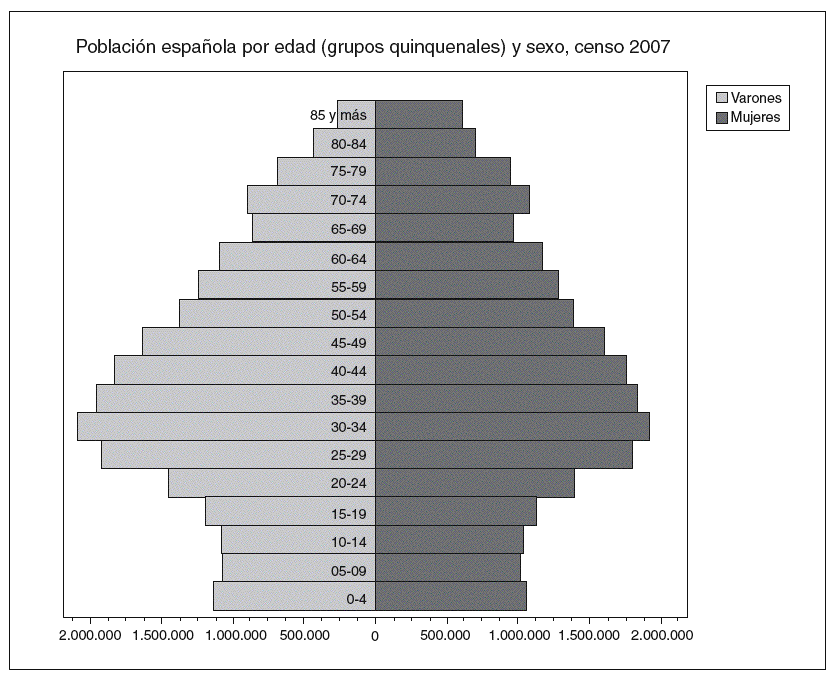
La transición demográfica (fig. 1) no es el único cambio sustancial experimentado en el terreno de la medicina a lo largo de los últimos años. La constante ha sido precisamente la confluencia de transiciones: social, tecnológica, de la demanda y, en particular, la transición epidemiológica. Esta última hace referencia al cambio observado en la prevalencia de enfermedades infecciosas, a primeros del siglo xx, frente al desplazamiento progresivo por las enfermedades crónicas.
Figura 1 Los datos del Instituto Nacional de Estadística correspondientes al último censo municipal arrojan la cifra de 7.528.879 personas mayores de 65 años, lo que supone el 16,68% de la población española.
El impacto sanitario derivado de esta transición epidemiológica es muy importante, e incluso podría decirse que el concepto de salud1,2 ha tenido que evolucionar y adaptarse a este cambio. Por lo tanto, estamos obligados a tener una visión integral y dinámica3,4 que exige el desarrollo de abordajes multidimensionales e integra estructuras y niveles de cuidados sociales y sanitarios.
Las enfermedades reumatológicas son paradigmáticas en este sentido, y su carácter crónico y las consecuencias funcionales que acarrean obligan a este abordaje multidisciplinar y coordinado. Muestra del gran impacto epidemiológico que representan estas enfermedades reumatológicas es el hecho de que la Organización Mundial de la Salud y las Naciones Unidas hayan definido el período 2000-2010 como la década de las enfermedades óseas y articulares, con la artrosis, la artritis reumatoide, la osteoporosis y la lumbalgia como las 4 entidades más relevantes5.
El individuo anciano a lo largo de su vida experimenta una serie de cambios fisiológicos en sus diferentes órganos y sistemas que, junto con la exposición a factores medioambientales, con los determinantes genéticos y con la exposición a la enfermedad, van a condicionar el proceso de envejecimiento6,7. De la interacción de estos factores se deduce la variabilidad individual en este proceso, obteniendo un espectro variado desde el envejecimiento satisfactorio al envejecimiento patológico8.
Con relación a las enfermedades reumatológicas podemos decir que la distribución de la edad avanzada entre los diagnósticos reumatológicos se concentra en el grupo de las enfermedades óseas metabólicas (osteoporosis, enfermedad de Paget), seguido por los trastornos degenerativos articulares y de columna (espondiloartritis, artritis de mano, rodilla, cadera y hernia discal) frente a las enfermedades inflamatorias de articulaciones y columna, enfermedades del tejido conectivo y reumatismos de partes blandas9.
La artritis reumatoide y el lupus eritematoso sistémico afectan predominantemente a la población adulta, pero ambas pueden aparecer también en el anciano. Conocemos la curva bimodal de incidencia de la artritis reumatoide, pero la coexistencia de otras patologías, la pérdida de especificidad de las pruebas serológicas y las manifestaciones atípicas de la enfermedad reumatológica en el anciano van a suponer el verdadero reto para el clínico.
En el individuo anciano, más que la enfermedad propiamente dicha importa mucho el terreno donde asienta, de aquí la importancia del concepto de reserva funcional orgánica, y así podemos comprender que ante un mismo agente nosológico la respuesta del individuo sea totalmente diversa.
Este concepto de reserva funcional tiene también trascendencia desde el punto de vista farmacológico. Los órganos involucrados en la determinación de los efectos farmacológicos son el conjunto cardiovascular que transporta y distribuye el fármaco, el riñón que participa mayoritariamente en la eliminación del medicamento y el cerebro que es el que manda.
En reumatología, como en geriatría, el objetivo del tratamiento no consiste en erradicar la enfermedad sino en el control de los síntomas (del dolor en particular), la prevención de la discapacidad y, finalmente, la mejora de la calidad de vida. Bellamy10 considera que la consecución de estos objetivos pasa por contemplar 6 aspectos clave: la valoración clínica, la valoración de la función de los órganos principales, las interacciones potenciales, la selección de las modalidades terapéuticas, la comunicación paciente-enfermo efectiva y el control de la respuesta terapéutica.
La práctica de la reumatología se caracteriza por un gran refinamiento de las habilidades exploratorias y de diagnóstico a la cabecera del enfermo, combinadas con un buen juicio clínico y adecuadas y oportunas intervenciones, más que intervenciones sofisticadas orientadas a la curación o al cuidado episódico11.
FARMACOLOGÍA GERIÁTRICA. CARACTERÍSTICAS FARMACOCINÉTICAS Y FARMACODINÁMICAS EN EL ANCIANO
La variabilidad de la respuesta a la intervención farmacológica viene condicionada por diversos factores genéticos, edad, enfermedades, interacciones, cumplimentación, etc., y los cambios del envejecimiento y la enfermedad tienen como consecuencia alteraciones en los perfiles farmacocinéticos y farmacodinámicos. Estos cambios fisiológicos producidos con el envejecimiento tienen un papel trascendental en el comportamiento de los distintos fármacos. A continuación resumimos las características farmacocinéticas más importantes en las personas mayores12-14.
Absorción y biodisponibilidad
La biodisponibilidad de cualquier fármaco depende de diversos factores, y puede definirse como el producto de la fracción de la dosis administrada que es absorbida a través de la mucosa gastrointestinal, la fracción de la dosis absorbida que pasa del tracto gastrointestinal al torrente sanguíneo hepatoportal sin metabolizar, y la disponibilidad de primer paso hepática.
Con relación a los cambios gastrointestinales debidos al envejecimiento, hemos de resaltar cambios en la secreción de ácido gástrico, que aparentemente disminuye en la población anciana hipoclorhidria secundaria a gastritis crónica atrófica hasta un 10% de ancianos caucasianos, aunque también hemos de considerar el alto porcentaje de pacientes ancianos que reciben inhibidores de la bomba de protones y anti-H2, y los fármacos que necesiten un medio ácido para su ionización tendrán dificultades en estos casos.
La motilidad intestinal (retraso en el vaciado gástrico, disminución del peristaltismo y retraso del tránsito colónico) también se ve afectada en el envejecimiento.
El transporte pasivo a través de la mucosa intestinal parece no alterarse en la mayoría de sustratos. El transporte activo de algunos nutrientes, como glucosa, calcio, vitamina B12 y leucina, en cambio, está alterado.
Estos cambios fisiológicos inciden de alguna manera en la biodisponibilidad, sobre todo para los fármacos con baja permeabilidad y baja solubilidad. Para los fármacos con alta permeabilidad la absorción estará limitada por el flujo y dependerá mayormente del flujo sanguíneo gastrointestinal, que está disminuido en el anciano.
Tras la absorción, en el tracto intestinal y en el hígado, algunos medicamentos experimentan el denominado metabolismo de primer paso. Es difícil diferenciar el rol de este proceso y el de la absorción, ya que uno y otro pueden compensarse. De esta manera, fármacos con escasa absorción pueden compensar su efecto gracias a un metabolismo de primer paso frenado que permita mayor disponibilidad de los metabolitos.
Hemos de tener en cuenta también en la población geriátrica las modificaciones cardiovasculares posprandiales, que desempeñan un papel importante en la biodisponibilidad de los medicamentos.
Volumen de distribución
La distribución de los fármacos depende de la composición corporal, de la unión a proteínas plasmáticas y del flujo sanguíneo a los diferentes órganos. Los efectos del envejecimiento en la unión proteica tienen una significancia mínima. Sabemos que en la población anciana hay un descenso de la concentración de albúmina sanguínea de alrededor del 10%. Este hecho condiciona que aumente la fracción libre plasmática de determinados fármacos (piroxicam, ahora categoría de diagnóstico hospitalario).
Además de los cambios en el transporte proteico en el anciano, hay que destacar los cambios en la composición corporal, que afectarán al volumen de distribución de algunos fármacos.
La grasa corporal aumenta entre el 20 y el 40%, y el agua corporal disminuye entre el 10 y el 15% en el anciano. Esto conlleva un incremento en la concentración de medicamentos hidrosolubles y una eliminación más lenta de los medicamentos liposolubles. Estos cambios en volumen de distribución y cambios fisiológicos en los compartimentos del organismo podrían requerir que dosis de carga parenteral de medicamentos altamente lipofílicos tuvieran que aumentarse entre un 10 y un 20%, así como que fármacos hidrosolubles tuvieran que disminuirse en esa misma proporción del 10 al 20%. Sin embargo, en la práctica clínica este ajuste de las dosis de carga no tiene importancia.
Metabolismo y envejecimiento hepático
El aclaramiento hepático está influido por el flujo hepático sanguíneo, el aclaramiento intrínseco y la unión proteica. El envejecimiento está asociado a una reducción del flujo sanguíneo de alrededor del 40%, y también se aprecia una reducción en la masa hepática de orden similar, contribuyendo estos cambios a una reducción en el aclaramiento.
Existe una gran corriente de investigación sobre el efecto de las enzimas hepáticas. El envejecimiento no se ha asociado con ninguna alteración del contenido de proteínas microsomales hepáticas ni con la actividad de determinadas enzimas. Sin embargo, mientras el aclaramiento de medicamentos vía fase II de metabolismo no se altera y a pesar de que la actividad de las enzimas de fase I no se cambia con el envejecimiento; la mayoría de fármacos metabolizados a través de la fase I tienen un aclaramiento reducido en este grupo de población (paradoja de la fase I y teoría de Schmuker sobre aporte de oxígeno dificultado por el engrosamiento y la defenestración del endotelio).
Envejecimiento renal y eliminación de fármacos
El cambio farmacocinético más significativo del envejecimiento es la disminución del filtrado glomerular, disminución que se cifra en 1 ml/min/año a partir de la edad adulta.
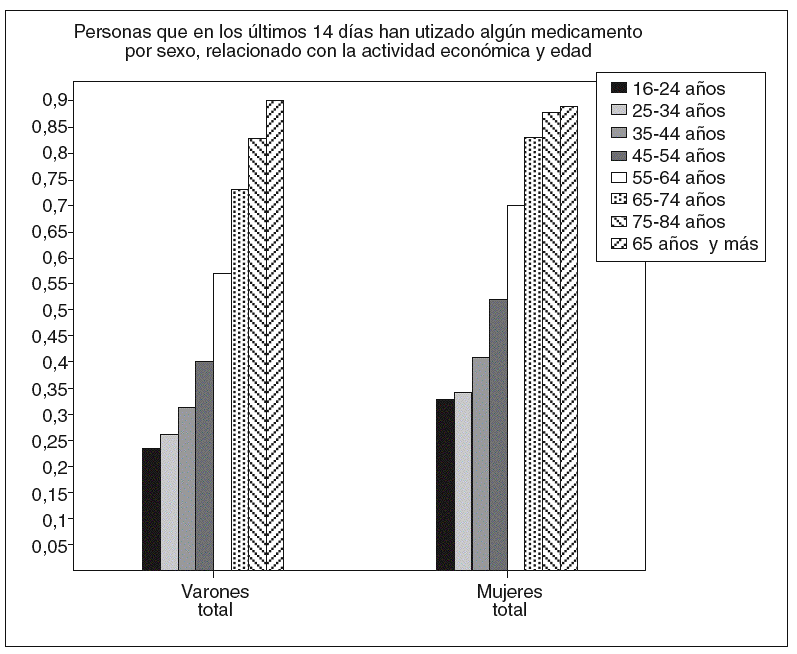
Sin embargo, cuando se estudió el efecto de esta alteración sobre 4 fármacos (atenolol, piracetam, hidroclorotiazida y triamtereno) no se apreciaron consecuencias clínicas. Existen por el contrario fármacos con un estrecho rango terapéutico (digoxina, litio y aminoglucósidos), y en estos casos, más que el efecto de su distribución y aclaramiento deberíamos considerar la comorbilidad y la polifarmacia (fig. 2) como factores más influyentes en las concentraciones finales del fármaco.
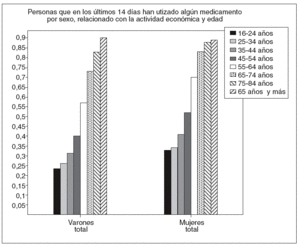
Figura 2 El importe de la prestación farmacéutica del Sistema Nacional de Salud en el año 2006 ascendió a 11.591 millones de euros, de los cuales un 77,38% fueron imputados a gasto de pensionistas (incluyendo minusválidos, enfermedad profesional, síndrome tóxico y accidentes de trabajo además de jubilados). Estos datos son similares a otros países donde el 16% de la población ocasiona también alrededor del 70% del gasto farmacéutico. En el gráfico puede comprobarse que prácticamente la totalidad de la población mayor de 75 años han utilizado algún fármaco en las dos últimas semanas.
Consideraciones farmacodinámicas
Los efectos de la edad sobre las acciones de los medicamentos en los receptores están poco investigados. Se dice que con el envejecimiento se produce una disminución tanto del número de receptores como de su sensibilidad a los medicamentos. En el terreno cardiovascular es donde se ha investigado más. Con el envejecimiento, en el sistema beta- adrenérgico se aprecia una disminución de la regulación de los receptores beta, con elevación de los valores plasmáticos de noradrenalina y una reducción de la respuesta del adenosinmonofosfato cíclico (AMPc) a la estimulación betaadrenérgica. Esto puede explicar una menor respuesta al efecto broncodilatador o taquicardizante de algunos de estos fármacos betaestimulantes. Los cambios farmacodinámicos de las benzodiacepinas en el anciano son de especial importancia. La EC50 para sedación del midazolam intravenoso se reduce en un 50% en las personas mayores.
FÁRMACOS ANTIRREUMÁTICOS
Cuando nos referimos a la intervención farmacológica en geriatría, una de las primeras consideraciones ha de ser la escasa evidencia científica disponible en nuestro grupo de población15,16. Ejemplo de ello sería que la edad media de los participantes en los estudios clínicos con antiinflamatorios no esteroideos (AINE) era de 61,9 años, a pesar de que los mayores de 65 años concurren en las tres quintas partes de la población con este tratamiento. La revisión realizada por Van Spall et al15 pone de manifiesto esta situación: la edad, como criterio de exclusión, estaba presente en el 72% de los estudios, y los mayores de 65 años estaban excluidos en el 38,5% de ellos.
Las justificaciones dadas por los investigadores sobre los bajos niveles de representatividad de los ancianos en estos estudios es inconsistente y muchas veces contradictoria.
Se postula con frecuencia la comorbilidad que podría interferir en los resultados o en cuanto a una limitación de la esperanza de vida que también afectaría a los resultados. Estos argumentos se observan con mayor frecuencia en los estudios clínicos de la empresa privada. El segundo argumento es la incapacidad para cumplir con la medición de resultados que no pueden dar consentimiento informado. La exclusión de la población anciana en los estudios realmente desplaza al colectivo probablemente más necesitado de investigación, al ser el colectivo donde mayor incidencia del problema hay, por lo que no se entiende desde un punto de vista estrictamente científico y quizá sí desde una perspectiva de ageísmo17,18. La edad cronológica se utiliza como variable proxy del deterioro cognitivo.
Una reflexión fundamental en el abordaje geriátrico es que el proceso asistencial debe ser multidimensional y dinámico. La intervención farmacológica debe apoyarse en otras intervenciones, es complementaria, y no hemos de perder la perspectiva de intervención sobre la persona enferma frente a la enfermedad.
La repercusión de la enfermedad sobre la dimensión funcional y social debe incorporarse en la planificación de los cuidados, y de ahí el carácter holístico y dinámico del que hablábamos. La participación de disciplinas paramédicas como la fisioterapia, la terapia ocupacional o el trabajo social son piezas fundamentales en el diseño y la aplicación de los planes terapéuticos.
Antes de avanzar en este apartado de farmacología de las enfermedades reumáticas quisiera resaltar la importancia del tratamiento sintomático del dolor. Este síntoma, altamente prevalente19 en la población geriátrica (67-80%), es cardinal en la enfermedad reumática; así pues, a la vez que actuamos farmacológicamente sobre la inflamación o intentando modular la respuesta inmune, debemos actuar eficazmente sobre este síntoma.
Las consecuencias del dolor en el anciano afectan el estado cognitivo, la conducta y el estado de humor, y reducen la independencia en las actividades básicas de la vida diaria. Un reto particular para el clínico es la valoración del dolor en personas con deterioro cognitivo. En el colectivo de personas mayores aplicaremos los principios de start low, go slow y mantendremos el abordaje escalonado de la OMS, teniendo en cuenta las consideraciones fisiológicas y farmacocinéticas pertinentes.
A continuación se mencionan algunas características de los fármacos más utilizados en el paciente reumatológico, destacando las posibles implicaciones para nuestro grupo de población20-24.
Ciclosporina
Es un inmunosupresor utilizado en la profilaxis de rechazo de trasplantes (uso autorizado a partir de 1983) y en enfermedades autoinmunes. La absorción se realiza en el intestino delgado, por lo que interrelaciona con alteraciones de la mucosa intestinal (estados de malabsorción), disfunción hepatobiliar, tiempo de vaciado gástrico, interacciones alimentarias con el fármaco y motilidad gastrointestinal. Se distribuye por la grasa, el hígado, el páncreas, los pulmones, los riñones, las glándulas suprarrenales, el bazo y los ganglios linfáticos. Tiene carácter hidrofóbico y un alto grado de unión a las proteínas plasmáticas, eritrocitos y lipoproteínas (hasta el 85-90%). La nefrotoxicidad de la ciclosporina se debe al potente efecto vasoconstrictor renal, aunque el mecanismo exacto se desconoce. La lesión renal no es reversible y los pacientes con síndrome nefrótico o con edad superior a los 65 años están en una situación de riesgo aumentada. Debe evitarse en pacientes que toman AINE o con función renal alterada.
Metotrexato
Fue desarrollado en 1948 para el tratamiento de la leucemia. Se absorbe rápidamente a dosis pequeñas, mientras que a dosis más elevadas se absorbe incompletamente25. Aproximadamente hasta el 90% del fármaco es excretado sin cambios por la orina, y el resto por la bilis, por lo que alteración en la función renal tendrá consecuencias de toxicidad. En algunos estudios se habla de un incremento de hepatotoxicidad relacionada con la edad, aunque se desconoce exactamente si está relacionada con insuficiencia renal asociada con la edad. Lo mismo ocurre con la toxicidad hematológica, que se relaciona también con la función renal. Por estos motivos el tratamiento con metotrexato está contraindicado en los pacientes con insuficiencia renal y obliga a una estrecha vigilancia hematológica y de función hepática. Hay interacciones con AINE, con el resultado de un aumento en la concentración en el suero del metotrexato. La administración de una dosis semanal se asocia a una menor incidencia de efectos secundarios hepáticos que la de dosis diarias.
Leflunomida
Fue desarrollada en 1985 para el tratamiento de la artritis reumatoide. Es un derivado isoxazólico con actividad inmunomoduladora que inhibe la síntesis de pirimidinas y que actualmente se utiliza como antirreumático de acción lenta. Tras la administración oral se metaboliza en un metabolito activo con 2 semanas de vida media; en el individuo sano se une a la albúmina en más de un 99,3%, y se elimina por vía renal y por vía biliar. Se desconoce el mecanismo de metabolización, aunque se cree que lo hace en la pared intestinal y en el hígado. Por este motivo, pacientes con antecedentes de hepatopatía no deberían recibir este tratamiento. En el anciano no se ajusta la dosis, pero puede necesitarse dado los efectos secundarios como alopecia, pérdida de peso o elevación de las enzimas hepáticas.
Ciclofosfamida
Es un fármaco antineoplásico alquilante del grupo de las mostazas nitrogenadas e inmunosupresor; los primeros estudios clínicos se publicaron a principios de la década de los cincuenta. Es inactivo hasta su metabolización hepática por el sistema de oxidasas. Este aspecto es importante, ya que su inducción por otros fármacos (como barbitúricos o corticoides) afectará a su metabolismo. La mayor parte de la ciclofosfamida se excreta por vía renal. Hay algunas pruebas que sugieren una mayor toxicidad dependiente de la dosis de este fármaco en el grupo de personas mayores. Por su alta toxicidad, el uso de este fármaco se reserva para casos de enfermedad muy grave.
Sulfasalazina
Fue creada en 1938 para el tratamiento de la "poliartritis reumática". Se considera un profármaco; se absorbe rápidamente en el colon y se metaboliza en el hígado, donde se realiza acetilación, hidroxilación y glucuronoconjugación (consideraciones respecto a acetiladores lentos o rápidos; los ancianos acetiladores lentos presentan vidas medias de eliminación más lentas que los acetiladores rápidos). Con una eficacia similar a la población más joven, las personas mayores suelen desarrollar efectos secundarios gastrointestinales, por lo que se recomienda preparados con cubierta entérica con biodisponibilidad del 66-93%.
Azatioprina
Introducida a finales de los años sesenta como fármaco para evitar el rechazo en sujetos trasplantados, presenta una absorción rápida tras la administración oral: alrededor del 50% del fármaco se excreta sin cambios por la orina, mientras que el resto es metabolizado; el sistema de las xantinooxidasas es uno de ellos, por lo que la interacción de otros fármacos en esta vía metabólica (alopurinol) puede aumentar la toxicidad. En estos pacientes la dosis debe reducirse hasta un 30%.
Hidroxicloroquina
La utilización de antimalariales en reumatología data de 1894. Algunas consideraciones farmacocinéticas para tener en cuenta con los antimalariales son, por ejemplo, la rapidez de absorción y el transporte plasmático unido a proteínas (albúmina) en un 40-50% de la dosis administrada. La eliminación es por vía renal (15-25% de hidroxicloroquina sin cambios) y tiene una larga vida media, por lo que en el anciano dada la disminución en el filtrado glomerular y la disminución de proteínas puede incurrir en un aumento de los valores plasmáticos de estos fármacos. Los efectos secundarios más graves se refieren a la aparición de retinopatía pigmentosa, y su diagnóstico se ve dificultado porque coincide clínicamente con patología senil como la degeneración macular. Por ello, el examen ocular se recomienda antes de iniciar el tratamiento y cada 6 meses.
Colchicina
Fue aislada en 1820, aunque sus efectos analgésicos sobre la gota se conocen desde hace dos mil años. De alta liposolubilidad, no se une a proteínas plasmáticas y se concentra en el hígado, el riñón y el bazo. Se metaboliza en el hígado y se excreta por la bilis, por las secreciones intestinales y un 20%, sin alteraciones, por la orina. Su administración debe reducirse en la insuficiencia renal. Las personas mayores son más susceptibles de desarrollar efectos secundarios gastrointestinales o de supresión en la médula ósea, por lo que las dosis deben reducirse.
Alopurinol
Metabolizado por las xantinooxidasas, se absorbe rápidamente por el tracto gastrointestinal y prácticamente no se une a las proteínas plasmáticas. El oxipurinol se excreta principalmente a través del riñón, por lo que debe reducirse en casos de insuficiencia renal para minimizar posibles efectos secundarios. Es importante destacar las interacciones farmacocinéticas existentes entre la mercaptopurina y la azatioprina, por lo que deben reducirse las dosis de estos fármacos en un 25% cuando se administran conjuntamente con el alopurinol. El alopurinol se ha relacionado con la producción de cataratas al actuar como fotosensibilizador con los rayos ultravioletas en las lentes del cristalino.
AINE
Los fármacos antiinflamatorios no esteroideos (AINE) constituyen uno de los grupos terapéuticos de mayor significancia en el manejo de los pacientes reumatológicos. Actúan inhibiendo la síntesis de prostaglandinas y leucotrienos y, en distinto grado, la respuesta oxidativa y la liberación de otros mediadores inflamatorios por los polimorfonucleares en la inflamación aguda y crónica. Actualmente se clasifican por su efecto sobre las enzimas COX-1 y COX-2; los AINE estándar se caracterizan por inhibir ambas COX-1 y COX-2. Los inhibidores selectivos de la COX-2 son el elecoxib, el etoricoxib y el parecoxib.
El conocimiento de los posibles efectos secundarios es importante para una mejor selección de nuestra intervención farmacológica, y los efectos gastrointestinales y cardiovasculares son los más remarcables. Se estima que las complicaciones gastrointestinales graves (perforación, hemorragia digestiva o estenosis pilórica) se presentan, en un año, en 13 de cada 1.000 personas con artritis reumatoide que toman AINE. La posibilidad del sangrado, en las personas con factores de riesgo y que toman AINE para controlar el dolor se multiplica por cinco. Entrelos factores de riesgo se consideran: edad > 65 años, antecedentes de enfermedad péptica gastroduodenal, dispepsia por AINE, asociación con esteroides u otros AINE, dosis máximas, tratamiento prolongado, anticoagulación o coagulopatía y enfermedad grave concomitante. Como factores de riesgo adicionales se considera la presencia de Helicobacter pylori, el abuso de alcohol y el tabaquismo. El riesgo suele ser dependiente de la dosis, aunque se ha graduado también el riesgo según los fármacos. Bajo riesgo: ibuprofeno; riesgo intermedio: diclofenato, naproxeno, ketoprofeno, piroxicam e indometacina; alto riesgo: azapropazona (no comercializado en España). A los COX-2 se les atribuye un perfil de efectos secundarios gastrointestinales más bajo, aunque existe controversia en los datos aportados por diferentes estudios.
Desde el punto de vista cardiovascular se considera (European Committee en Safety of Medicines, CSM) que el grupo de los COXIB puede causar un aumento en el riesgo de efectos trombóticos comparado con el placebo. Este riesgo puede aumentarse con la dosis y la duración del tratamiento, y varía según los factores cardiovasculares del sujeto. Está contraindicado en pacientes con cardiopatía isquémica, enfermedad cerebrovascular, arteriopatía periférica e insuficiencia cardíaca. En los pacientes con factores de riesgo cardiovascu lar como hipertensión arterial, diabetes mellitus, dislipemia, obesidad y tabaquismo se valorará individualmente su utilización, quedando contraindicada cuando exista un riesgo alto de eventos trombóticos cardio o cerebrovasculares. Para el grupo de AINE no pertenecientes a los COXIB no hay pruebas suficientes derivadas de estudios epidemiológicos para pensar que los AINE estándar protegen de episodios vasculares. Al contrario, actualmente se considera que todos los AINE aumentan el riesgo trombótico cuando se usan a altas dosis y a largo plazo, por lo que se recomienda la utilización de AINE el menor tiempo posible y a la menor dosis necesaria.
Además de los posibles efectos secundarios gastrointestinales y cardiovasculares, hemos de tener presente el riesgo de empeoramiento de la función renal, particularmente en el anciano, por lo que se requiertante resaltar las interacciones con otros fármacos utilizados en reumatología, como el metotrexato (reduce su eliminación) y la ciclosporina (aumenta el riesgo de nefrotoxicidad).
Glucocorticoides
La cortisona y la prednisona experimentan transformación hepática principalmente, y en el individuo anciano se han observado una serie de alteraciones farmacocinéticas (mayor concentración sérica a las 4 h después de la dosis, menor aclaramiento, una ratio de supresión de cortisol menor indicando una menor supresión adrenal) que pueden suponer un factor que debe considerarse para explicar la mayor incidencia de efectos secundarios observados en las personas mayores.
La absorción es rápida en el tracto gastrointestinal, con una unión reversible a las proteínas plasmáticas. La administración de altas dosis de glucocorticoides en pacientes con hipoalbuminemia condiciona mayores efectos secundarios en este grupo de población. Si el paciente toma medicamentos que inducen la actividad hepática, entonces la dosis de corticoides puede tener que aumentarse. Los principales efectos adversos (cataratas, glaucoma, osteoporosis, fragilidad cutánea, alteraciones de la memoria y alteración de la función inmunitaria) de los corticoides están principalmente relacionados con la dosis y con la duración. A corto plazo, aumento de peso, euforia, retención de líquidos, insomnio; las altas dosis a largo plazo se relacionan con psicosis, úlcera péptica, hipertensión, hiperglucemia, aterosclerosis e hiperlipemias. Por estos motivos, el axioma consiste en utilizar la mínima dosis de un agente de corta duración durante el menor tiempo posible, controlar estos posibles efectos secundarios e instaurar medidas preventivas si son necesarias.
AGENTES BIOLÓGICOS INMUNOMODULADORES
Los agentes biológicos son la nueva clase de fármacos modificadores de enfermedad y están destinados a actuar sobre las citocinas consideradas como factor fundamental en la respuesta inflamatoria. La inhibición del factor de necrosis tumoral (TNF), una citocina proinflamatoria, por el infliximab, el etanercept, el adalimumab y el bloqueo de la interleucina 1 mediante la anakinra han concentrado recientemente un gran interés por su supuesto protagonismo en la patogenia de la artritis reumatoide. Sin embargo, debe considerarse el perfil de seguridad de estos agentes, ya que han sido relacionados con infecciones graves, como sepsis y tuberculosis. En este sentido, se considera obligado eliminar en todo paciente que vaya a iniciar tratamiento anti-TNF la presencia de tuberculosis activa o de contacto reciente con enfermos con tuberculosis, así como investigar la posibilidad de infección tuberculosa latente26. La combinación de agentes bloqueadores del TNF y la anakinra está contraindicada por aumentar el riesgo de infección. Existen otros efectos adversos, como discrasias sanguínea, riesgo incrementado para linfomas, trastornos desmielinizantes del SNC, insuficiencia cardíaca y síndrome lúpico.
No hay suficiente experiencia de uso de estos agentes en el anciano, y se desconocen las características farmacocinéticas y farmacodinámicas; algunos autores han recomendado un control exhaustivo (radiología de tórax, derivado proteico purificado, hematología, función hepática, análisis de orina) cada 1-2 meses.
En estudios de revisión recientes, Fleischmann et al22,23,27 demuestran una eficacia similar entre estos agentes biológicos (infliximab, etanercept y adalimumab) y su utilización en la artritis reumatoide, la artritis psoriásica y la espondilitis anquilopoyética. El mismo autor describe un perfil de efectos adversos parecidos a los de la población adulta, por lo que sugiere un control menos intensivo. Sin embargo, estos mismos trabajos han sido criticados por tener una muestra de población anciana poco representativa por la ausencia de comorbilidad y polifarmacia.
IMPLICACIONES CLÍNICAS EN LA PRÁCTICA DIARIA. INTERACCIONES FARMACOLÓGICAS. ADHERENCIA AL TRATAMIENTO
Un reciente informe de la Organización Mundial de la Salud comunicaba que, además del beneficio en la salud producido por los nuevos desarrollos sanitarios, este progreso ha acarreado también una serie de riesgos derivados de las interacciones de tecnologías.
Se ha llegado a objetivar que en los hospitales de agudos de varios países europeos los episodios adversos sobre la salud de los pacientes ingresados alcanzaban hasta el 10% de los ingresados. Estos riesgos asistenciales han sido denominados por algunos autores como las enfermedades del progreso de la medicina e incluyen desde reacciones adversas medicamentosas a infecciones nosocomiales, complicaciones del curso clínico y errores diagnósticos y terapéuticos28-30.
Bajo el concepto de "riesgos asistenciales" se enumeran los efectos o sucesos adversos (evitables y no evitables) y los errores. Precisando el término de efecto adverso medicamentoso, entendemos por tal cualquier efecto nocivo e imprevisto de un fármaco que ocurre a las dosis habituales para prevención, diagnóstico o tratamiento o para modificación de una función fisiológica. Actualmente se prefiere utilizar el término "problema relacionado con la medicación" (PRM), que además de los efectos adversos incluye los episodios indeseados debidos a errores de medicación.
En este sentido, los efectos adversos relacionados con los medicamentos pueden contribuir hasta una quinta parte de todas las muertes hospitalarias de los pacientes ancianos ingresados. En el estudio de Gottlieb31, hasta en la mitad de los casos se prescribieron fármacos inadecuados o dosis o presentaciones inadecuadas. Este problema llevó a principios de los años noventa a desarrollar listados de fármacos inapropiados en este grupo de población, destacando los trabajos de Beers32, de MCleod33 y de Fick34. Fácilmente puede imaginarse el impacto de este problema35, y se ha calculado que en Estados Unidos hasta 100.000 muertes anuales son atribuibles a efectos adversos36.
Esta problemática de los efectos adversos medicamentosos supone hasta el 21,7% de los ingresos hospitalarios, hasta el 28% de las visitas en los servicios de urgencias, y lo que es más importante hasta un 70% de estos efectos adversos son potencialmente evitables.
Es importante destacar que los AINE van a ser el grupo farmacológico en nuestro medio con mayor porcentaje de efectos adversos: el 50% de los pacientes desarrollarán náusea o dispepsia, el 40% de los que consumen AINE presentan úlceras detectadas endoscópicamente (aunque el 85% de éstas no se manifiestan clínicamente). Sabemos además que el colectivo de mayores de 65 años (el 20% consumen AINE) son especialmente susceptibles no tan sólo por los cambios fisiológicos producidos por el envejecimiento, sino por la comorbilidad y la polifarmacia37,38.
La polifarmacia en población frágil como puede ser la institucionalizada es frecuente, con un promedio de hasta 8 fármacos, y puede ser más alta en las unidades de hospitalización de agudos. Merle et al39 comunican 6,3 ± 3,1 fármacos al ingreso.
Se han invocado diversos sistemas de clasificación de las reacciones adversas medicamentosas. Actualmente se mantiene la dicotomización entre reacciones tipo A dependientes de la dosis (cambios farmacocinéticos, interacciones fármaco-fármaco, fármaco-comida, fármaco-enfermedad) y las de tipo B, producidas por hipersensibilidad; éstas son menos frecuentes aunque más graves (reacciones alérgicas, citotóxicas, idiosincrásicas, etc.)40,41.
Los pacientes ancianos son más proclives a las reacciones tipo A no sólo por sus cambios fisiológicos, sino también porque hay interacciones fármaco-fármaco. Hasta el 46% de los casos del estudio PEER (Pharmaceutical Care of the Elderly in Europe Research Group) presentaban interacciones potenciales, muchas de ella no previstas, ya que los sanitarios desconocen la toma de otros medicamentos, y en algún estudio se observa que hasta en el 37% de los casos los médicos desconocen la medicación que están tomando sus pacientes42,43.
Además de las reacciones fármaco-fármaco, también tenemos las reacciones fármaco-enfermedad, estas últimas 2 o 3 veces más frecuentes que las reacciones fármaco-fármaco; en este sentido, tendríamos la administración de antagonistas del calcio en la insuficiencia cardíaca, los bloqueadores beta en la diabetes y el ácido acetilsalicílico en pacientes con úlcera péptica.
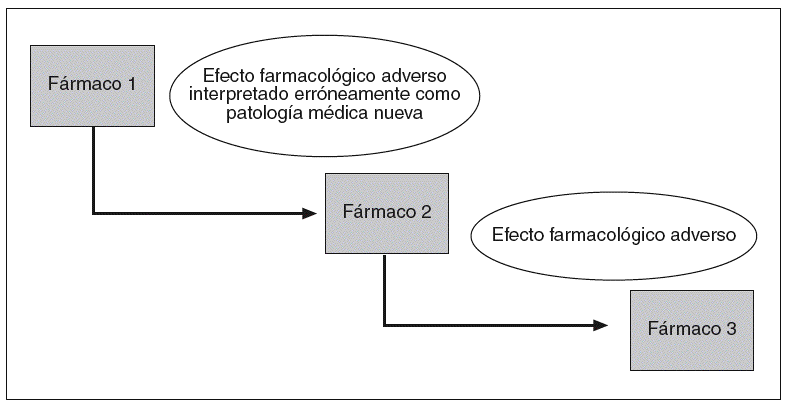
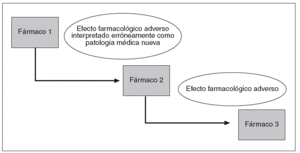
Mallet et al42 proponen un abordaje sencillo de este problema, y resumen 3 grandes categorías: la primera sería la de reacciones adversas por interacciones farmacológicas conocidas, y la segunda categoría acogería a los pacientes con polifarmacia y pluripatología (9 o más fármacos y 5 o más comorbilidades). La tercera categoría incluiría el clásico fenómeno de la "cascada prescriptora"44,45 (fig. 3) en el que un efecto adverso conlleva la prescripción de otro agente farmacológico que a su vez condicionará otro efecto adverso que incorporará un nuevo fármaco.
Figura 3 Cascada de prescripción. De Rochon y Gurwitz45.
Otro aspecto de enorme importancia en la prescripción farmacológica en geriatría (tabla 1) se refiere al tema de la adherencia al tratamiento. Se considera un factor determinante en muchas de las reacciones adversas. Pueden atribuirse a factores intrínsecos de las personas mayores, como déficit mnésicos, sensoriales y funcionales diversos que actuarán como favorecedores de este incumplimiento terapéutico. Aunque también existen razones no justificables. La magnitud del problema es importante, y se ha llegado a estimar que una tercera parte de las personas mayores ingresadas en una unidad de agudos hospitalaria no cumplían las indicaciones terapéuticas señaladas, adjudicando hasta un 11% de los casos como causa misma de la hospitalización (abandono de diuréticos y entradas en fallo cardíaco, antiarrítmicos y taquicardias, etc.). Para justificar estas cifras se han sugerido diversos factores, entre ellos el binomio hospital-primaria como fuentes de prescripción o la utilización de genéricos que permite a las oficinas de farmacia administrar un preparado equivalente en principio activo a otro, pero con distinto nombre comercial.
En este sentido también la Encuesta Nacional de Salud sugiere que, por lo general, las personas mayores suelen consumir los medicamentos aconsejados y recetados por un médico. Esto puede deberse a una mayor disciplina en la dispensación de las medicinas, o bien a la gratuidad de las recetas, que le permiten acceder a una amplia gama de productos. En este sentido, De Klerk46, en un estudio de adherencia al tratamiento en pacientes reumatológicos observó que la variabilidad en la adherencia estaba determinada por el tiempo del tratamiento y por los medicamentos usados, y que por métodos de regresión logística se podían identificar algunos factores en el sujeto (sexo, coping, percepción del estado de salud), pero no observó diferencias con la edad.
Como hemos podido observar en esta revisión, la prescripción de fármacos en el paciente geriátrico supone un gran reto para los profesionales de la salud. Las características específicas de este grupo de población polifarmacia, alta comorbilidad, cambios farmacocinéticas y farmacodinámicos y los consabidos problemas derivados de una mala prescripción hacen necesario prestar una atención muy especial a la indicación y control de los tratamientos farmacológicos. Esta complejidad no puede abordarse de otra forma que no sea mediante un proceso riguroso de valoración integral, trabajo en equipo multidisciplinar (médicos, enfermería, trabajo social, farmacéuticos, etc.) y coordinación entre los distintos niveles asistenciales.