INTRODUCCIÓN
Las miopatías son un grupo heterogéneo de procesos con un amplio abanico de factores etiológicos, entre los que se encuentran causas genéticas, inflamatorias-autoinmunes, endocrinológicas, metabólicas y tóxicas. En las miopatías, la aplicación de los criterios diagnósticos adecuados, precedidos de una correcta historia clínica y un examen físico, facilita el estudio del paciente.
El 45% de nuestro peso corporal total corresponde a tejido muscular esquelético, que se caracteriza por una intensa actividad metabólica proteica. La elevada exposición del músculo esquelético a las sustancias circulantes lo convierten en especialmente sensible a los efectos de los fármacos. Se ha implicado a numerosos fármacos como causa de miopatía tóxica, entre los que se encuentran las estatinas, los antipalúdicos, los corticoides, la colchicina, la penicilamina o la zidovudina, entre otros.
Desde un punto de vista clínico, la miopatía esteroidea (ME) ya se había descrito como una parte del cortejo sintomático del síndrome de Cushing1. Posteriormente, la ME fue rápidamente reconocida como un efecto secundario de la administración de corticoides tras su introducción en el arsenal terapéutico durante los años cincuenta del siglo xx.
FISIOPATOLOGÍA
La ME puede ocurrir con cualquiera de las preparaciones corticoideas. Sin embargo, aparece más frecuentemente con el uso de los potentes preparados fluorados, como la dexametasona y la triamcinolona, y no es tan frecuente con los esteroides no fluorados, como la prednisona o la hidrocortisona.
El mecanismo exacto de producción de la ME es desconocido, aunque se ha relacionado con una disminución de la síntesis proteica, el aumento de la degradación proteica, las alteraciones en el metabolismo de los hidratos de carbono o mitocondriales y electrolíticas o la disminución de la excitabilidad del sarcolema2.
Los corticoides tienen un efecto catabólico directo sobre el tejido muscular y dan lugar a la aparición de aminoácidos que servirán de sustratos para la gluconeogénesis. Los corticoides inhiben la síntesis proteica mayoritariamente a nivel de las fibras musculares tipo II, circunstancia que también se demuestra en la miopatía de origen alcohólico3. Se ha sugerido además que los esteroides inhiben el efecto antiapoptótico del factor de crecimiento similar a la insulina I (IGF-I), al reducir su expresión4, y contribuyen de esta forma a la apoptosis de los miocitos. Asimismo, los corticoides aumentan la actividad de la proteasa citoplasmática, lo que potencia la destrucción de las miofibrillas5.
La molécula de señal intracelular con actividad cinasa conocida como Akt1 podría desempeñar también un papel importante en el desarrollo de la respuesta atrófica e hipertrófica del músculo a los corticoides y al IGF-I, respectivamente. Los esteroides inducirían la supresión de Akt1 produciendo secundariamente el aumento de la ubiquitina-ligasa, que estimula la degradación de proteínas musculares, mientras que el IGF-I aumenta la actividad de la Akt1, que suprime la atrofia e induce hipertrofia muscular6.
Otra vía propuesta para explicar el desarrollo de la atrofia muscular que aparece en la ME es la de la glutamina sintetasa, enzima clave a través de la cual el músculo consigue obtener la demanda sistémica de aminoácidos de los hidratos de carbono, catabolizando la formación de glutamina a partir del glutamato y del amonio. La glutamina se emplea en la síntesis de glucosa en el hígado o directamente para la obtención de energía7. Si el exceso de corticoides circulantes da lugar a una disminución de la síntesis proteica, los valores de glutamina intramuscular se reducen, con el consiguiente aumento en la actividad de la glutamina sintetasa en el músculo esquelético que dará como resultado un intenso proceso de proteólisis.
Además, en la ME se ha observado un descenso significativo de la actividad de la glucógeno fosforilasa, efecto que además es más pronunciado en las fibras musculares tipo II. La concentración elevada de glucógeno en el músculo contribuiría a la atrofia muscular y a la debilidad. Sin embargo, no se ha podido confirmar hasta el momento una correlación entre el metabolismo del glucógeno muscular y los cambios histológicos miopáticos, por lo que no está claro si esto es la causa o una consecuencia de la ME8.
Estudios recientes sugieren que el estrés oxidativo contribuye al desarrollo de la ME y, efectivamente, los estudios en ratas muestran que los radicales hidroxilo pueden tener un papel en su patogenia9.
EPIDEMIOLOGÍA
No se conoce la incidencia exacta de la ME, en gran parte debido a que cada individuo presenta una sensibilidad diferente a la medicación. En los ancianos y en las personas con un estilo de vida sedentario se incrementa el riesgo de toxicidad muscular por corticoides10,11. Asimismo, las mujeres presentan un mayor riesgo de desarrollar debilidad muscular por el tratamiento con corticoides, en comparación con el sexo masculino, y no se conoce la razón exacta de tal diferencia2. Diversos autores han aportado cifras de incidencia de la ME tan dispares como del 7 al 60% y, a diferencia de lo que ocurre con la miopatía alcohólica, no existe ninguna relación entre la duración de la exposición o la dosis de esteroides y la aparición de la miopatía5.
La ME puede ocurrir cuando se emplean corticoides sistémicos por primera vez o en un individuo con terapia crónica en el que se aumenta su dosis habitual por reagudización de la enfermedad de base. Existe una gran variabilidad individual, y el inicio de los síntomas puede ocurrir a las pocas semanas o después de muchos meses de haber iniciado la terapia corticoidea. Lo mismo sucede con la dosis. Algunos pacientes desarrollan debilidad muscular con dosis bajas de esteroides en un corto período de tiempo, mientras que otros nunca desarrollan miopatía a pesar del uso de dosis altas durante meses o años.
En general, existen ciertas situaciones en las que con más o menos frecuencia se desarrolla ME en nuestros pacientes12: a) las dosis altas de corticoides (40-60 mg/día de prednisona) durante más de un mes producen casi siempre algún grado de debilidad muscular; b) el desarrollo de ME es infrecuente en pacientes tratados con dosis bajas (< 10 mg/día de prednisona o su equivalente), y c) cuanto más alta sea la dosis de corticoide, más rápidamente se iniciará la debilidad muscular.
La mayoría de los datos descritos en la literatura médica sobre la ME se refieren al tratamiento corticoideo sistémico oral y/o intravenoso. Sin embargo, también los corticoides inhalados aunque raramente se asocian a debilidad muscular utilizados a dosis altas pueden dar lugar a síntomas sistémicos, debido a que entre el 20 y el 40% de la medicación administrada por vía intranasal se absorbe de forma sistémica13. Incluso se ha descrito un caso de ME tras una inyección epidural de triamcinolona14.
MANIFESTACIONES CLÍNICAS
La forma clásica de ME se presenta de forma subaguda e insidiosa, con debilidad progresiva de la musculatura proximal, sobre todo de miembros inferiores, que se afectan antes y de forma más grave que los miembros superiores. La miopatía interfiere en las actividades de la vida diaria del paciente, el cual refiere típicamente dificultad para levantarse de la silla o para subir escaleras. Puede aparecer leve rigidez y limitación de la movilidad en las manos, así como mialgias. Habitualmente no se afectan la musculatura facial ni los esfínteres. Distintos estudios han descrito la afectación de la musculatura respiratoria en pacientes con cáncer y tratamiento con glucocorticoides que desarrollan ME15. Típicamente, los reflejos osteotendinosos y la sensibilidad son normales. También pueden estar presentes otras características típicas del síndrome de Cushing, como la cara de luna llena, la diabetes, la fragilidad cutánea o la osteoporosis12.
DIAGNÓSTICO
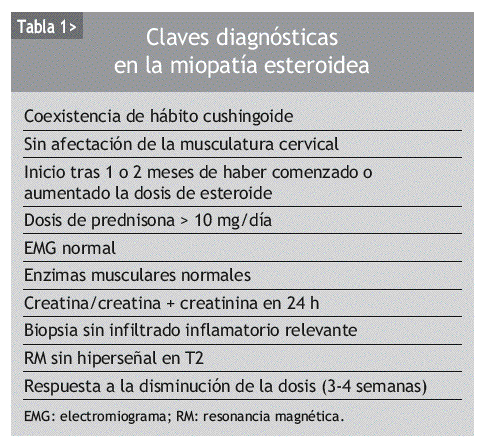
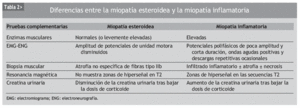
No existe una prueba diagnóstica definitiva para la ME clásica. Los valores séricos de las enzimas musculares típicamente son normales o levemente elevados. El electromiograma (EMG) suele ser normal, aunque puede mostrar baja amplitud de los potenciales de unidad motora. La biopsia muscular únicamente pone de manifiesto atrofia inespecífica de las fibras musculares tipo IIb, sin presencia de infiltrado inflamatorio ni de necrosis.
Por tanto, se puede afirmar que el diagnóstico de la ME clásica es un diagnóstico de exclusión, basado en la historia clínica y en la exposición del paciente a los corticoides, en ausencia de otras causas de miopatía. En general, el diagnóstico se confirma demostrando la mejoría de la debilidad a las 3-4 semanas de la reducción adecuada de la dosis de corticoides16. En la ME tampoco se encuentra mioglobinuria ni datos de rabdomiólisis, pero sí puede ayudar en el diagnóstico el incremento de la excreción urinaria de creatina, que puede preceder a la aparición de debilidad clínica (tabla 1).
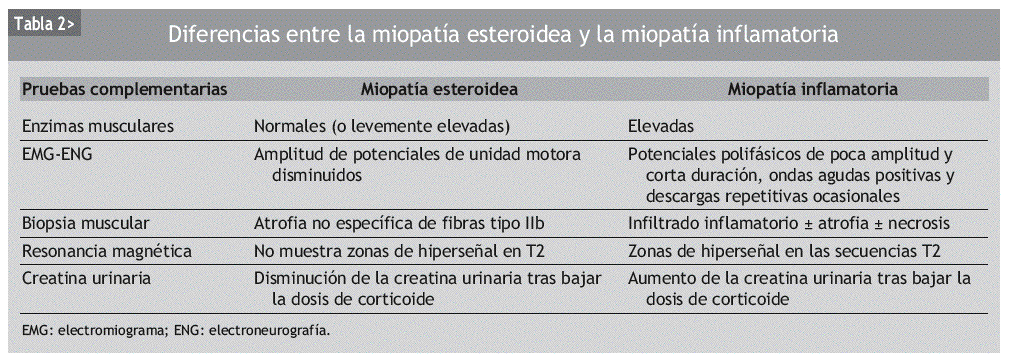
En algunas situaciones el diagnóstico diferencial resulta más complicado, por ejemplo, cuando se valora un paciente tratado con corticoides por una miopatía inflamatoria, como la dermatomiositis o la polimiositis, que desarrolla de nuevo debilidad muscular. En esta situación problemática hay que diferenciar si la exacerbación de la sintomatología de debilidad muscular se debe a una reagudización de la enfermedad de base o a una ME. Hay diversas premisas que son útiles para establecer un diagnóstico correcto: a) el inicio de la debilidad un mes o más después del inicio de la terapia corticoidea o del aumento de la dosis, junto con otros rasgos cushingoides y enzimas musculares normales, sugieren una ME; b) la "prueba definitiva" es la mejoría de la debilidad muscular tras la reducción adecuada de la dosis de corticoide, ya que, si se tratara de una reagudización de la enfermedad, los síntomas empeorarían tras la disminución del corticoide; c) aunque el incremento de la excreción urinaria de creatina aparece en ambas miopatías, esteroidea e inflamatoria, disminuye tras la retirada del corticoide en la ME, mientras que aumenta tras su reducción en la miopatía inflamatoria; d) el EMG y la biopsia muscular pueden ayudar en el diagnóstico diferencial de ambas entidades, aunque normalmente no será preciso realizar una nueva biopsia muscular17, y e) la resonancia magnética no muestra zonas de hiperseñal en las secuencias T2 en la ME, mientras que sí pueden aparecer zonas brillantes en la exacerbación de la miopatía inflamatoria (tabla 2).
Ya se ha comentado que en la ME las enzimas musculares se encuentran dentro de la normalidad o sobrepasando levemente el límite superior de la normalidad. Sin embargo, en la literatura médica se han descrito casos de pacientes con dermatomiositis que presentan clínica de debilidad y elevación enzimática debido a una ME que se resuelve tras la reducción de la dosis del esteroide18. Debido a esto, los autores sugieren que no se utilicen las enzimas musculares en el diagnóstico diferencial de las dos entidades.
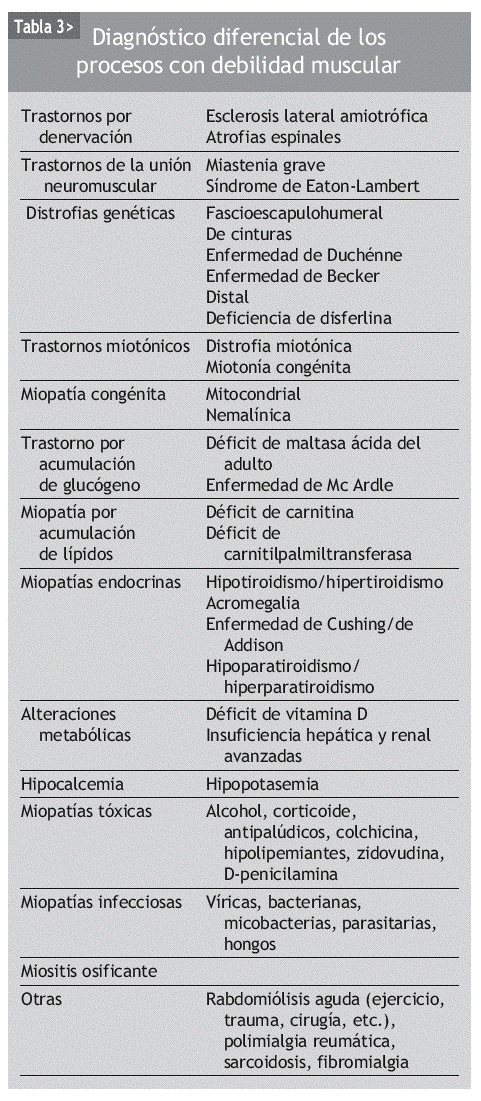
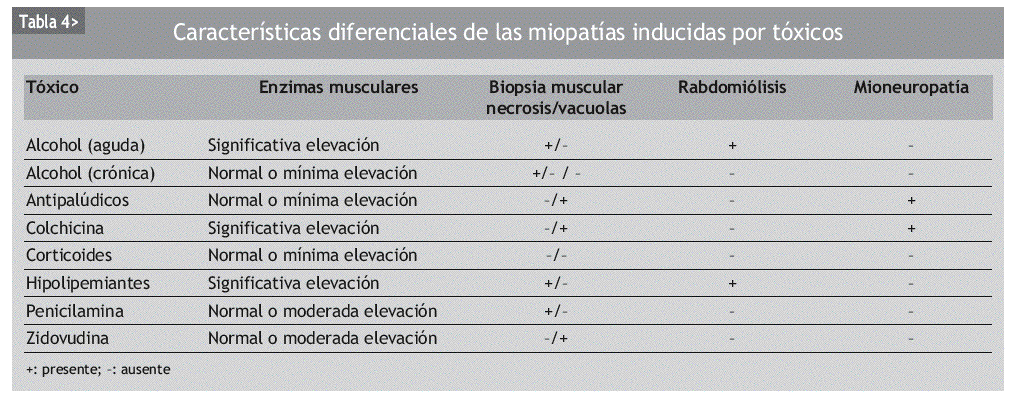
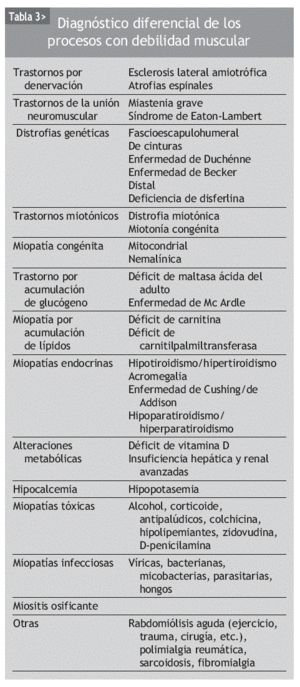
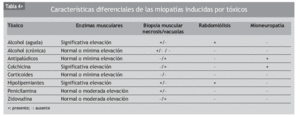
En el diagnóstico diferencial de la ME no hay que olvidar las miopatías de origen genético, inflamatorio, endocrino, metabólico y tóxico-farmacológico, las distrofias musculares, las neuropatías o las enfermedades de la unión neuromuscular, entre otras (tabla 3)19. En la tabla 4 se exponen las características diagnósticas diferenciales de la miopatía inducida por fármacos20.
PRONÓSTICO
La debilidad muscular comienza a mejorar de 3 a 4 semanas después de la reducción adecuada de la dosis de corticoide y, en general, el cuadro se resuelve en todos los pacientes, aunque algunos pueden tardar varios meses en recuperarse completamente. Si se está utilizando un esteroide fluorado, como la dexametasona, se puede optar por su sustitución por un corticoide no fluorado, como la prednisona, si la situación del paciente no permite la retirada del fármaco21. Siempre hay que intentar utilizar la mínima dosis efectiva y, si los síntomas persisten, se debe valorar la utilización de fármacos ahorradores de esteroides, como los inmunosupresores.
La osteoporosis es una comorbilidad que se asocia con frecuencia a la ME y puede deberse tanto al efecto del fármaco como a la reducción de la actividad física secundaria a la miopatía. Otras comorbilidades que también ocurren como consecuencia de la debilidad y la inmovilidad son las contracturas musculares, las úlceras por presión y la trombosis venosa profunda. No se ha descrito en la literatura médica una mayor mortalidad en estos pacientes.
TRATAMIENTO
Como ya se ha comentado, la mejor actitud terapéutica ante la sospecha de una ME es el descenso adecuado y progresivo de la dosis de corticoide.
Algunos autores sugieren que el ejercicio aeróbico y el entrenamiento físico pueden prevenir o reducir las consecuencias de la debilidad muscular. Aunque no hay recomendaciones definitivas en el tratamiento de la ME, parece razonable dirigir la terapia a limitar la inmovilización del paciente y sus consecuencias. Los ejercicios pasivos, activos-asistidos e incluso activos, según el grado de debilidad de cada paciente, ayudarán a prevenir las contracturas musculares y la atrofia muscular. La terapia ocupacional ayudará a obtener la máxima independencia del paciente en sus actividades de la vida diaria; un adecuado entrenamiento, así como el uso de ortesis y de equipamientos adaptados si son necesarios, mejorarán la calidad de vida del paciente2.
Se han propuesto diversos agentes, como los suplementos de potasio, la fenitoína21, la vitamina E y los aminoácidos22, como la carnitina, la creatina23 y la nicotina24, como potenciales tratamientos para la ME, y aunque ninguno ha demostrado un claro efecto preventivo o terapéutico de la debilidad muscular, los aminoácidos se han sugerido en diversos estudios como inmunomoduladores, agentes antioxidantes y promotores anabólicos en el tejido muscular, incluso en situaciones de hipercortisolemia. Incluso se han sugerido como agentes antimiopáticos en diversas situaciones de estrés.
MIOPATÍA ESTEROIDEA AGUDA
La ME comentada hasta el momento es la forma clásica de esta entidad. Sin embargo, en la literatura médica hay casos aislados de ME aguda en pacientes graves ingresados en la unidad de cuidados intensivos (UCI)25-27. Aunque es una situación infrecuente, los pacientes que requieren dosis elevadas de corticoides intravenosos y agentes bloqueadores neuromusculares, como el vecuronio (p. ej., en los estados asmáticos que requieren ventilación mecánica), pueden desarrollar una miopatía aguda necrosante, caracterizada por debilidad proximal y distal, grave y difusa. Se ha sugerido que la denervación farmacológica podría aumentar el número de receptores de corticoides en el músculo y, por lo tanto, incrementar su efecto tóxico.
A diferencia de la ME clásica, en la forma aguda se encuentra una marcada elevación de las enzimas musculares, un EMG con un patrón miopático y una biopsia muscular con necrosis difusa, vacuolización y atrofia de las fibras musculares tipo I y II, con pérdida selectiva de los filamentos gruesos de miosina, rasgo muy característico de esta entidad.
Por tanto, a los pacientes ingresados en la UCI, intubados por asma grave y que precisen dosis altas de corticoides junto con bloqueadores neuromusculares, se les deberían controlar los valores de enzimas musculares. Además, es siempre conveniente el uso de la mínima dosis eficaz de esteroide y durante el menor tiempo posible.