Introducción y aspectos históricos
Ya en 1997 se reconoció una nueva enfermedad cutánea fibrosante en pacientes con enfermedad renal grave, que fue publicada en 20001. En 2001 Cowper et al2 denominaron esta entidad con el término descriptivo dermopatía nefrogénica fibrosante (DNF) y describieron sus características clínicas y patológicas. El descubrimiento posterior de fibrosis en otros órganos en estos pacientes hizo sustituir la nomenclatura dermopatía nefrogénica fibrosante por fibrosis sistémica nefrogénica (FSN). La principal célula responsable de la fibrosis tisular se identificó como un fibrocito circulante, pero el desencadenante permanecía desconocido3. A principios de 2006, al asociar la exposición a contrastes radiológicos con gadolinio con el desarrollo de FSN, se produjo un importante cambio4. Seguidamente, numerosas publicaciones de series de casos y registros de pacientes verificaron la asociación epidemiológica entre la exposición a gadolinio y la FSN. La demostración de la presencia de gadolinio en los tejidos afectados confirmó la sospecha del papel desencadenante del gadolinio en el desarrollo de la enfermedad5.
Etiología
La exposición a contrastes radiológicos con gadolinio se ha asociado recientemente al desarrollo de FSN en pacientes con enfermedad renal subyacente, y parece ser el desencadenante del proceso fibrosante. El mecanismo por el que esto ocurre es desconocido, pero al parecer el proceso incluye una célula llamada fibrocito circulante que sería estimulada por el gadolinio.
Sin embargo, la aparición de FSN en los pacientes con enfermedad renal que se exponen a gadolinio es muy poco frecuente, por lo que es probable que para iniciar la fibrosis se requieran otros factores predisponentes. Una nefropatía avanzada es un requisito indispensable, mientras que otros factores como el daño vascular, un estado inflamatorio o una mezcla de cofactores —incluyendo un aumento de la concentración sérica de fosfato y calcio y una sobrecarga de hierro— aumentan el riesgo. La combinación de estos factores permite un exceso de gadolinio circulante, que se podría disociar de su quelante y abandonar la circulación para depositarse en los tejidos. El gadolinio en estos tejidos podría promover la fibrosis mediante la unión directa al colágeno o, después de ser fagocitado por los macrófagos, mediante la producción de radicales libres de oxígeno, citocinas y otros factores profibróticos que atraen los fibrocitos circulantes a los tejidos. Estos fibrocitos se diferenciarían entonces en células fusiformes similares al fibroblasto que sintetizan la matriz de tejido conectivo y otros factores de crecimiento y angiogénicos que a su vez estimulan la fibrosis tisular. La activación directa por el gadolinio de las transglutaminasas de estas células similares al fibroblasto en los tejidos podría también promover la fibrosis.
Factores del huésped: enfermedad renal
Todos los pacientes que han desarrollado FSN tienen una alteración subyacente de la función renal de intensidad y duración variables. La gran mayoría han recibido tratamiento con hemodiálisis, diálisis peritoneal o trasplante renal, pero ninguno de éstos es un requisito indispensable para el desarrollo de FSN.
Inicialmente esto llevó a sospechar de múltiples factores comunes en pacientes con insuficiencia renal como desencadenantes de la FSN: exposición a altas dosis de eritropoyetina, membranas de diálisis, estados de hipercoagulabilidad, varias formas de daño vascular, procedimientos de cirugía vascular y fallo hepático concomitante. Sin embargo, ninguno de estos factores se presentaba de forma uniforme en los pacientes, a excepción de la enfermedad renal subyacente.
Actualmente se cree que la disminución del filtrado glomerular en estos pacientes alargaría la vida media del gadolinio y permitiría su depósito en los tejidos.
Célula efectora: fibrocito circulante
Cowper y Bucala3 postularon que esta célula, implicada en la curación normal de las heridas y formación de cicatrices, podría ser la causante de la fibrosis aberrante en la FSN. Las muestras histopatológicas de los pacientes mostraban un patrón de fibrosis muy similar al observado en los estados proliferativos de la curación normal de las heridas. Esto sugirió el papel etiológico potencial del fibrocito circulante, una célula conectiva derivada de la médula ósea que se encuentra normalmente en la circulación periférica y migra a las zonas de inflamación tisular. Esta célula participa en la curación de las heridas mediante la secreción de citocinas, factores angiogénicos, factores de crecimiento y quimiocinas, que contribuyen a la formación de la matriz del tejido conectivo. Tiene un inmunofenotipo específico CD34 y procolágeno 1 positivos que la distingue de otros fibrocitos. El fibroblasto fusiforme, que es el tipo celular predominante en los tejidos con FSN, tiene un perfil CD34 y procolágeno 1 positivo que es idéntico al fibrocito circulante.
Factores predisponentes: daño vascular e inflamación
El daño vascular puede aumentar el riesgo de desarrollar FSN al permitir la interacción entre las plaquetas y las células endoteliales expuestas con la atracción de fibrocitos circulantes y la secreción de sustancias profibróticas.
El daño vascular es muy frecuente en los pacientes con enfermedad renal, y se presenta aun con mayor frecuencia en los pacientes con FSN. Se ha observado con frecuencia el antecedente de procedimientos quirúrgicos vasculares y cateterismos antes del desarrollo de FSN6, aunque no se sabe con certeza si son factores de riesgo independientes, ya que en estos procedimientos suelen administrarse contrastes radiológicos. También se ha relacionado con estados de hipercoagulabilidad.
Sin embargo, a pesar de esta asociación, estos factores por sí solos se consideran insuficientes para el desarrollo de FSN. Se ha sugerido que este estado de daño vascular presente en los pacientes con enfermedad renal sería un factor predisponente que favorecería el inicio del proceso fibrosante después de actuar el factor desencadenante.
Factor desencadenante: contraste con gadolinio
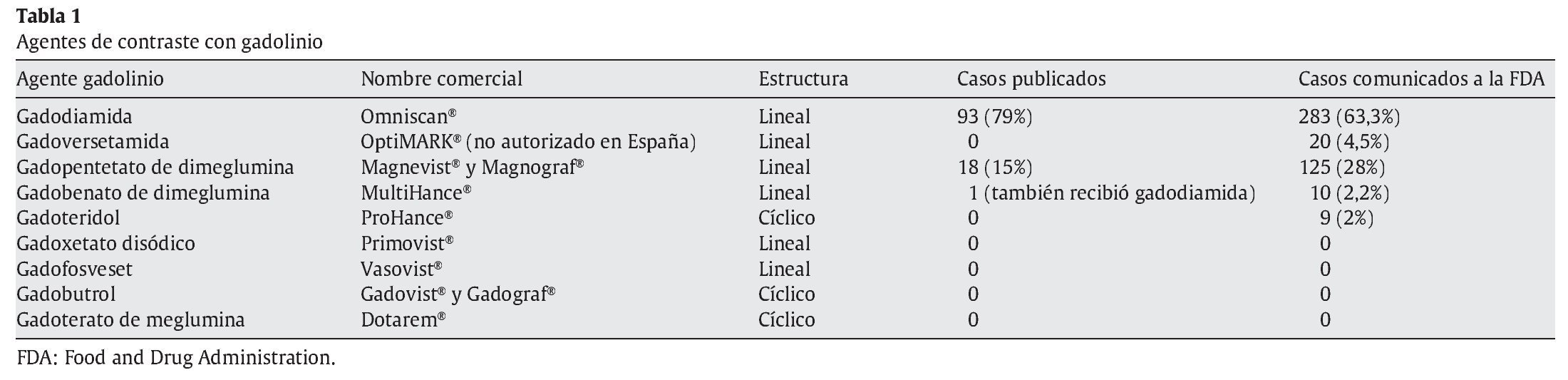
El gadolinio (Gd3+) es un elemento con fuertes propiedades paramagnéticas utilizado como contraste en resonancia magnética (RM). Para evitar su toxicidad se han diseñado diferentes quelantes hidrosolubles con alta afinidad por el gadolinio. Existen 9 agentes de contraste con gadolinio comercializados a escala mundial (tabla 1). Se ha administrado un contraste con gadolinio a más de 200 millones de personas y su perfil de seguridad es excelente en los pacientes con función renal normal.
En el artículo que inicialmente reconoció el gadolinio como posible desencadenante se observó que 5 pacientes con insuficiencia renal terminal que habían desarrollado FSN habían sido sometidos previamente a pruebas de imagen con gadolinio como contraste radiológico4. Seguidamente, varios centros confirmaron esta asociación entre la exposición a gadolinio y la FSN7-13. Se sugería que la FSN se desarrolla en pacientes con enfermedad renal avanzada que son expuestos a gadolinio y presentan otras enfermedades o procesos asociados. Como se ha visto anteriormente, el daño vascular y el estado inflamatorio parecen importantes para el desarrollo de FSN. Además, otros cofactores, como concentraciones séricas elevadas de calcio o fósforo, acidosis metabólica y quizá dosis elevadas de eritropoyetina, podrían aumentar el riesgo.
Más evidencias de la importancia del gadolinio como desencadenante de la FSN se obtuvieron al demostrar la presencia de éste en los tejidos de pacientes5. Estas muestras de tejidos de pacientes con FSN contenían concentraciones de 35 a 150 veces superiores que los tejidos de sujetos sanos expuestos a gadolinio14.
Otros factores de importancia en cuanto al gadolinio son el agente de contraste utilizado y su dosis. Así, en el registro internacional de FSN6 se ha observado que el 85% de los casos se relaciona con gadodiamida, mientras que el otro 15% con gadopentetato. Además, se ha visto que el riesgo se correlaciona significativamente con la dosis administrada. En casi todos los pacientes que han desarrollado FSN se han utilizado dosis elevadas o múltiples de contraste con gadolinio.
Frecuencia
La FSN es una enfermedad poco frecuente, y desde 1997 se han descrito varios centenares de casos en el registro internacional de FSN. Se realizó el seguimiento a una población de pacientes con insuficiencia renal terminal durante un período de 18 meses15, y la incidencia de FSN fue de 4,3 casos por 1.000 pacientes-año. Cada estudio radiológico tuvo un riesgo de 2,4% de desarrollar FSN.
En un estudio posterior se observó que la exposición al gadolinio se asociaba con un aumento del riesgo de desarrollar FSN con un odds ratio de 14,716.
La mortalidad a los 24 meses es del 48 y del 20% en los pacientes con y sin cambios cutáneos de FSN, respectivamente16. La FSN es una enfermedad muy limitante, y en pocas semanas muchos pacientes quedan relegados a una silla de ruedas debido a las contracturas articulares.
Esta enfermedad no muestra predilección por raza, sexo ni edad. Se ha descrito en pacientes desde los 8 a los 87 años en el momento del diagnóstico, con una media de 46,4 años. El desarrollo de FSN no se correlaciona con la duración de la insuficiencia renal, y se ha descrito un caso que se desarrolló después de sólo 5 días de hemodiálisis.
Clínica
La FSN ha sido objeto de una intensa investigación clínica y epidemiológica en los últimos años. Se ha intentado sin éxito definir criterios clínicos e histológicos específicos, y actualmente no existe ningún hallazgo aislado que sea completamente específico de esta enfermedad.
Curso clínico
El cuadro clínico se inicia típicamente con edema, eritema y en ocasiones calor en zonas distales de las extremidades (32%)17. Al resolverse, el edema deja placas firmes que pueden progresar a una induración mayor y al engrosamiento de la piel afectada. Algunos pacientes pueden presentar lesiones cutáneas profundas de forma relativamente temprana y rápida, y al contrario, pueden aparecer lesiones superficiales en pacientes con la enfermedad ya establecida. En algunos casos, la FSN progresa hasta una incapacidad física importante caracterizada por una falta prácticamente completa de movilidad en todas las articulaciones de las extremidades. Aunque en ocasiones la FSN se estabiliza, raramente remite espontáneamente. Sin embargo, la normalización de la función renal suele producir la estabilización o incluso la regresión de las lesiones.
Sintomatología
En la gran mayoría de los pacientes con FSN, la sintomatología cutánea es el hallazgo inicial de la enfermedad. El síntoma mas frecuentemente referido por los pacientes es dolor (52%)17, seguido por prurito (36%), rigidez o entumecimiento articular (34%), endurecimiento (30%) e hinchazón (25%) de manos y pies, parestesias (24%) y quemazón (16%). También se ha referido con menor frecuencia debilidad o calor local.
Distribución y morfología de las lesiones
En la mayoría de pacientes con FSN las lesiones más iniciales se presentan en las extremidades inferiores, seguidas por las extremidades superiores y el tronco. La afectación cutánea suele ser bilateral y simétrica. Las lesiones se localizan por orden decreciente en las extremidades inferiores (85%), las extremidades superiores (66%), el tronco (35%), las manos (34%), los pies (24%), los glúteos (9%) y la cara (3%). La induración se inicia de forma característica en zonas distales de las extremidades y se extiende gradualmente de forma proximal. La afectación de la cara y del cuello es tan poco frecuente que debe hacer considerar el diagnóstico de escleromixedema.
La morfología de las lesiones puede variar desde pápulas y placas sutiles y superficiales, hasta induración dérmica o subcutánea y contracturas articulares importantes. Las lesiones que se observan con mayor frecuencia son placas (58%), pápulas (32%) y nódulos (17%). Además, se ha descrito la presencia de máculas, vesículas, ampollas y úlceras que posteriormente progresan a placas en algunos pacientes. La mayoría de pacientes presentan lesiones superficiales poco evidentes inicialmente y, según avanza el cuadro, las pápulas coalescen en placas con un borde irregular distintivo que se ha descrito como digitiforme o ameboide, con áreas respetadas, e incluso pueden ser lesiones reticuladas.
También es variable la pigmentación de las lesiones. Con mayor frecuencia se observan lesiones hiperpigmentadas (41%) o eritematosas (39%), y raramente hipopigmentadas.
El aspecto de las lesiones varía según la profundidad de la fibrosis. Así, las lesiones más superficiales pueden mostrar cambios epidérmicos con descamación fina o más evidente. La mayoría de pacientes presentan lesiones induradas más profundas. La induración en estas lesiones suele ser muy importante. Las lesiones se han descrito como engrosadas, abultadas o abollonadas, leñosas o brillantes. La fibrosis puede provocar desaparición de los anejos cutáneos. Cuando hay una afectación dérmica extensa, la piel presenta un aspecto "en piel de naranja". La afectación de dermis profunda y subcutánea puede dar la apariencia de empedrado (típicamente en muslos) o en banda (depresiones lineales, típicamente en brazos o piernas).
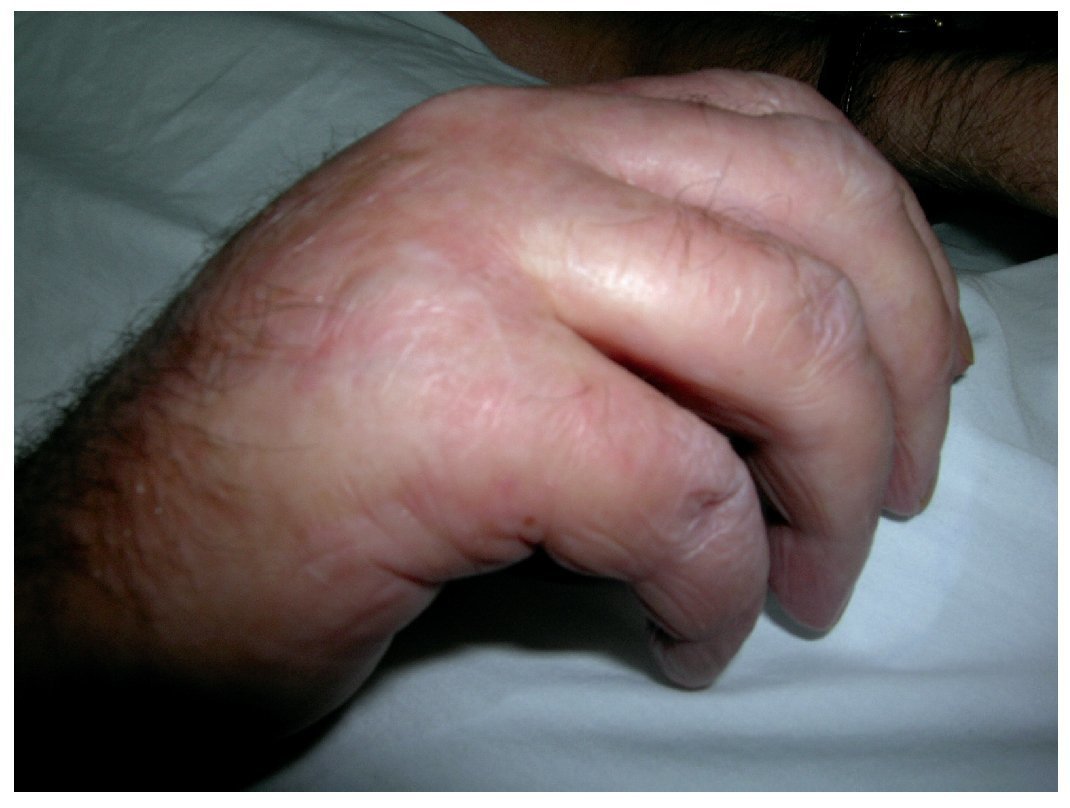
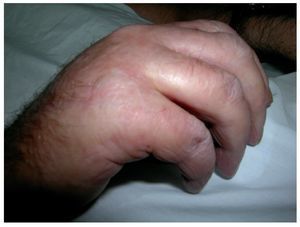
Muchos pacientes presentan una disminución de la movilidad (fig. 1) y contracturas articulares (50%) en las extremidades. La afectación puede progresar hasta una pérdida total del tejido subcutáneo, afectación del espesor total de la piel con fibrosis, contracturas importantes en todas las extremidades y pérdida total de la movilidad.
Figura 1. Esclerosis cutánea y edema en la mano derecha que limita la movilidad.
En el 75% de los pacientes se observa una afectación asintomática de las escleróticas. Los hallazgos más iniciales son telangiectasias abundantes, que pueden llegar a simular una conjuntivitis. Más adelante se observan placas amarillentas bilaterales.
Diagnóstico diferencial clínico
Múltiples enfermedades pueden presentar lesiones cutáneas muy similares a la FSN, pero el contexto clínico, los hallazgos histopatológicos y de laboratorio y ciertas características distintivas de las lesiones pueden diferenciarlas.
Las patologías que hay que considerar en el diagnóstico diferencial son: lipodermatoesclerosis, esclerodermia y morfea, escleromixedema, fascitis eosinofílica, síndrome eosinofilia-mialgia y enfermedad injerto contra huésped crónica.
Laboratorio: pruebas complementarias
No existe ningún hallazgo de laboratorio específico de FSN. Los pacientes con insuficiencia renal presentan múltiples alteraciones analíticas. Los hallazgos de laboratorio pueden ser útiles para diferenciar la FSN de otros procesos similares (tabla 2).
Anatomía patológica
La FSN se caracteriza por la fibrosis dérmica. De forma constante, se observa un aumento de células fusiformes en la dermis.
Los primeros hallazgos histopatológicos se dan antes de que haya un depósito significativo de colágeno. Existe un aumento de células fusiformes delgadas distribuidas entre haces de colágeno separados por edema2, y no se observan cambios inflamatorios. Los estudios inmunohistoquímicos revelan que estas células son CD34+ y muestran positividad citoplasmática local para procolágeno 1. Esta doble positividad es característica de los llamados "fibrocitos circulantes", células mesenquimales con origen en la médula ósea que participan normalmente en la reparación de las heridas.
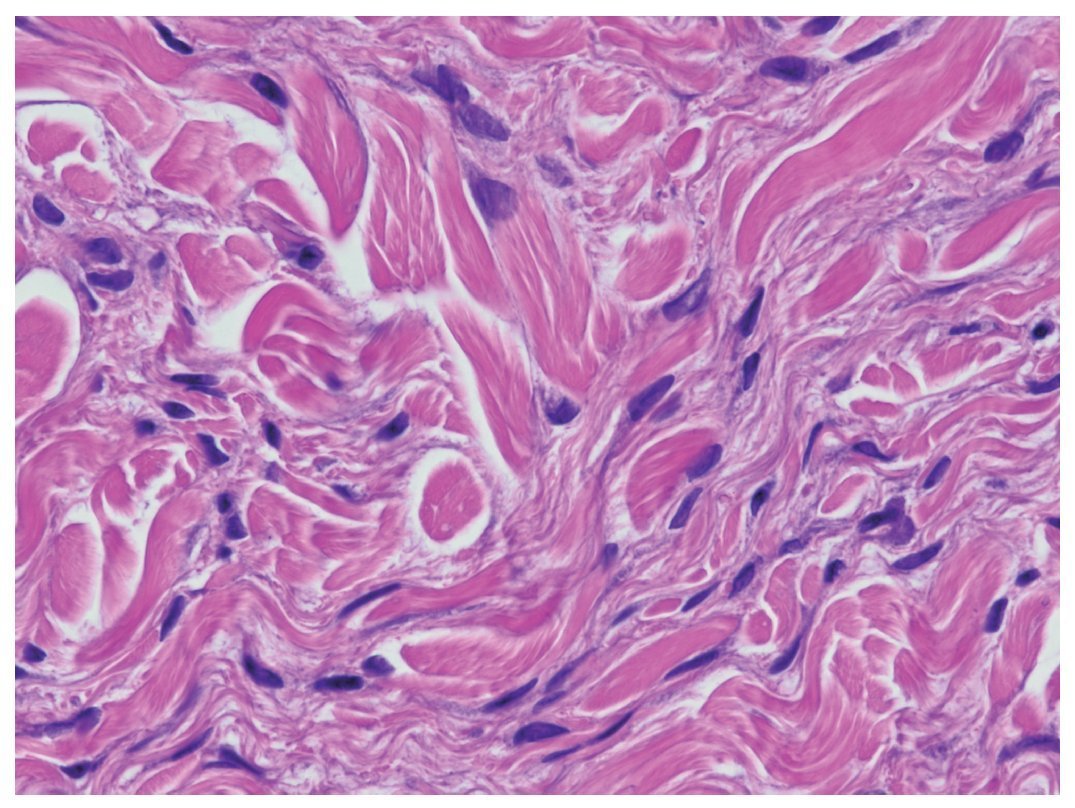
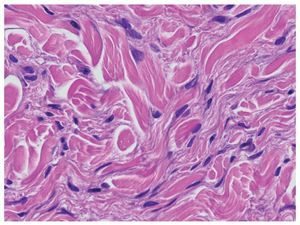
Con la progresión de la enfermedad las células fusiformes aumentan de tamaño, los haces de colágeno se engruesan y un material mixoide rellena los espacios entre éstos. La presencia de material mixoide es variable y puede consistir en depósitos de mucina y colágeno 1 inmaduro. La presencia de mucina no es necesaria para el diagnóstico de FSN. Se observan abundantes histiocitos (CD68+) en algunos casos, frecuentemente mezclados con células dendríticas factor XIIIa+. Generalmente las fibras elásticas se conservan en la FSN y son fácilmente identificables. Típicamente, y a diferencia de otras enfermedades esclerosantes como la morfea y la esclerodermia, se mantienen las hendiduras entre los haces individuales de colágeno engrosado (fig. 2).
Figura 2. Biopsia cutánea (hematoxilina-eosina, ×400). Células fusiformes con núcleos hipercromáticos entre haces de colágeno engrosados.
La dermis se puede afectar de forma focal o completa, y no suelen presentarse cambios en la epidermis. En casos evolucionados se puede observar pigmentación basal y acantosis, y a veces hay un aplanamiento de los procesos interpapilares y una pérdida de los anejos cutáneos. Los septos subcutáneos suelen estar engrosados. Biopsias muy profundas pueden mostrar la extensión del proceso fibrótico hasta la fascia y el músculo esquelético.
Diagnóstico diferencial histopatológico
Los procesos que hay que considerar en el diagnóstico diferencial son: escleromixedema, esclerodermia y morfea, fascitis eosinofílica y neoplasias de células fusiformes (melanoma, carcinoma y dermatofibrosarcoma protuberans).
Tratamiento
El tratamiento de la FSN continúa siendo un reto, y por desgracia no existe una terapia universalmente efectiva en estos pacientes. La mayoría de los datos de la literatura provienen de casos individuales y de pequeñas series de casos, generalmente estudios no controlados y retrospectivos. La comparación entre los diferentes casos es difícil, ya que no existe un sistema de estadificación de esta enfermedad, los pacientes se encuentran en diferentes momentos de la evolución en el inicio del tratamiento, y además presentan una función renal variable.
Es importante diagnosticar e iniciar el tratamiento en fases precoces de la enfermedad, ya que existen secuelas crónicas, como contracturas articulares y falta de movilidad, que no van a responder al tratamiento. Los síntomas de enfermedad activa, como edema y dolor, deben guiar el tratamiento.
Es imprescindible que todos los pacientes, independientemente de la actividad de la enfermedad, reciban tratamiento físico, fisioterapéutico y ocupacional para mantener la movilidad articular. También es esencial un tratamiento analgésico adecuado, debido al importante dolor que pueden padecer.
Recuperación de la función renal
La gran mayoría de casos publicados en que se ha observado una mejoría clínica se asocian con la recuperación de la función renal18,19. Esto se ha observado particularmente en pacientes con insuficiencia renal aguda recuperable. En los pacientes con FSN en que la insuficiencia renal no es recuperable, el trasplante es la mejor opción de tratamiento, aunque no en todos los casos se produce una mejoría de la FSN incluso después de alcanzar una función renal normal. El máximo beneficio se obtiene si el trasplante se realiza antes de que haya habido un depósito significativo de colágeno, generalmente durante el primer año desde la aparición de las lesiones de FSN.
Fotoféresis extracorpórea
Aparte del trasplante renal, la fotoféresis extracorpórea es el tratamiento con mayor experiencia. Al haber demostrado previamente su utilidad en otras enfermedades esclerosantes, como la esclerodermia o el escleromixedema, parece razonable suponer que vaya a ser útil en la FSN.
En 9 casos de FSN publicados en la literatura se ha observado una mejoría de las lesiones cutáneas en pacientes sin recuperación de la función renal20-25.
La fotoféresis extracorpórea es un tratamiento inmunomodulador basado en la exposición ex vivo de plasma rico en leucocitos a UVA tras la administración de un agente fotosensibilizante, generalmente 8-metoxipsoraleno (MOP). Los pacientes suelen tratarse en ciclos de 2-3 sesiones semanales cada 2-4 semanas. La duración y la respuesta al tratamiento suelen ser muy variables.
Otras modalidades de fototerapia
Encontramos un caso en la literatura con resolución completa de las lesiones cutáneas después de un tratamiento agresivo con radiación ultravioleta de longitud de onda A (UVA)26. Sin embargo, este caso es difícil de evaluar, pues la insuficiencia renal del paciente era aguda y transitoria y es posible que la mejoría clínica estuviera asociada a la recuperación de la función renal. Por otro lado, existen otros casos en que el tratamiento con psoraleno y luz ultravioleta (PUVA) no ha tenido éxito.
Hay otro caso publicado con buena respuesta a la terapia fotodinámica27, pero también es difícil de interpretar debido a que los autores no comentan suficientes datos sobre la función renal del paciente. La terapia fotodinámica ha tenido éxito en otras enfermedades fibrosantes como la morfea, por lo que sería interesante disponer de más estudios al respecto.
Plasmaféresis
Hasta la fecha los resultados publicados son contradictorios, y los casos en los que el tratamiento no ha tenido éxito superan a los que sí lo ha tenido. Además, en algunos de los casos en que se ha demostrado una mejoría también había mejorado la función renal.
Inmunoglobulinas intravenosas
Este tratamiento inmunomodulador, cuyo mecanismo de acción es poco conocido, se ha demostrado eficaz en varias enfermedades inmunológicas. En la FSN sólo existe un caso publicado en que se observó mejoría después de un primer ciclo de tratamiento, pero el paciente no continuó mejorando en los siguientes28. Además, una vez más no se comentan datos sobre la evolución de la función renal.
Inmunosupresores
Se han utilizado múltiples inmunosupresores con resultados variables pero en general poco prometedores. Se han utilizado corticoides tópicos, intralesionales y sistémicos con efectos positivos29, negativos y nulos.
También se han ensayado muchos otros fármacos inmunosupresores, como tacrolimus tópico, ciclofosfamida, ciclosporina, etanercept y metotrexato intralesional, sin demostrar su eficacia.
Existe algún caso de mejoría discreta con metotrexato oral30, pero con mala tolerancia al tratamiento. No existen suficientes datos para valorar la eficacia de la azatioprina31.
Tiosulfato sódico
El tiosulfato sódico es un fármaco con propiedades antioxidantes y quelantes. Se utiliza frecuentemente en el tratamiento de la calcifilaxis, y también como profilaxis de la toxicidad por cisplatino y carboplatino y en el tratamiento del envenenamiento por cianuro.
Se ha propuesto que en la FSN el tiosulfato sódico podría evitar el depósito de colágeno y la fibrosis inhibiendo el factor de transformación del crecimiento (TGF) β1. Además, podría actuar como quelante del gadolinio libre y evitar su depósito en los tejidos.
Recientemente, Yerram et al32 han publicado el caso de un paciente que presentó una mejoría importante en las lesiones cutáneas, en el dolor y en la movilidad articular después de sólo 1 mes de tratamiento. Aunque este resultado es anecdótico, se considera un tratamiento prometedor y, gracias a su baja toxicidad y a su experiencia de uso en la calcifilaxis, puede ser una buena opción terapéutica.
Pentoxifilina
La pentoxifilina es un fármaco inmunomodulador con efecto anti-factor de necrosis tumoral (TNF) que se ha utilizado en el tratamiento de otras enfermedades fibrosantes. Existen 2 casos anecdóticos con mejoría clínica, aunque estos hallazgos no han sido confirmados posteriormente en la literatura.
Talidomida
Es un agente inhibidor del TNF-β y antiangiogénico. En un modelo de fibrosis pulmonar inducida por bleomicina, la talidomida ha demostrado una disminución del TGF-β1. Gracias a estas propiedades antifibróticas, podría ser de utilidad en los pacientes con FSN.
Se han descrito 3 pacientes con FSN tratados con talidomida, aunque sin aportar datos sobre la dosis y la duración del tratamiento, ni sobre la evolución de la función renal. Los autores observaban "alguna mejora en la piel"33. Hay otros 2 casos publicados de pacientes que recibieron tratamiento con talidomida, pero no se menciona la respuesta a este tratamiento34.
Interferón intralesional
Se cree que el interferón-β reduce la fibrosis mediante la inhibición de la síntesis de colágeno y del TGF-β1. El TGF-β1 podría ser un mediador en la producción excesiva de colágeno en la FSN. En el único caso publicado de tratamiento con interferón intralesional en la FSN se ha observado una eficacia muy limitada35.
Calcipotriol tópico
Es un análogo de la vitamina D que se utiliza ampliamente en el tratamiento de la psoriasis. Se ha descrito mejoría en un paciente en hemodiálisis que fue tratado con calcipotriol tópico y medidas físicas. En 6 meses de tratamiento se observó una mejoría de las lesiones cutáneas y de las contracturas articulares hasta el punto que el paciente pudo dejar la silla de ruedas. No existe ningún estudio publicado sobre el uso de la asociación calcipotriol y betametasona, aunque teóricamente podría ser una buena opción en el tratamiento tópico.
Aunque este tratamiento podría ser un complemento para las lesiones cutáneas, es poco probable que tenga beneficios a nivel sistémico.
Conclusión
La identificación del gadolinio como principal causante de la FSN ha llevado a evitar este agente en los pacientes con riesgo de desarrollarla, y se prevé que esta medida disminuirá de forma importante su incidencia.
Mientras tanto, en los pacientes que presentan FSN el primer objetivo es la recuperación de la función renal normal mediante la resolución de la enfermedad de base o el trasplante renal cuando sea posible.
Además, es imprescindible el tratamiento fisioterápico y de control del dolor en todos los pacientes.
Como primera línea, según la opinión de los expertos, se puede considerar el tratamiento con fototerapia extracorpórea, tiosulfato sódico y pentoxifilina. Si no se obtiene mejoría con estos tratamientos, pueden ensayarse otros fármacos.
Aplicando los principios de tratamiento de otras enfermedades por depósito de metales, como la toxicidad por plomo o por aluminio, en que los agentes quelantes actualmente consiguen eliminar los metales depositados en los tejidos, parece razonable que el estudio de un agente quelante del gadolinio tiene potencialmente un efecto terapéutico en esta enfermedad.
Otros potenciales tratamientos futuros incluyen agentes inmunomoduladores dirigidos específicamente al proceso inflamatorio en la FSN.
Por último, el desarrollo de agentes de contraste radiológico más seguros y la evitación de los contrastes con gadolinio en pacientes con insuficiencia renal es la medida más eficaz para disminuir la morbilidad y la mortalidad asociadas a esta enfermedad.
Prevención
Diálisis después de la exposición a gadolinio en pacientes de riesgo
Los contrastes radiológicos basados en gadolinio se eliminan del cuerpo de forma casi exclusiva por vía renal, por lo que su vida media es muy prolongada en los pacientes con insuficiencia renal aguda y crónica. Estos pacientes tienen riesgo de desarrollar una FSN, y esto ha llevado a la recomendación de evitar estos contrastes en pacientes con enfermedad renal crónica en estadios IV y V, así como en pacientes con insuficiencia renal aguda. Desafortunadamente, hay situaciones clínicas en que es prácticamente imprescindible realizar una RM con contrastes de gadolinio.
Sin embargo, los contrastes con gadolinio se eliminan fácilmente con hemodiálisis. El 95% de la dosis administrada se elimina después de 2 sesiones de hemodiálisis. Al contrario, la diálisis peritoneal no es un método eficiente para eliminar el gadolinio. Este hecho ha llevado a los expertos a recomendar la hemodiálisis inmediatamente después de la administración de gadolinio en pacientes de riesgo de FSN y a repetirla el día siguiente36.
Aunque este procedimiento parece lógico y es más agresivo que la pauta habitual de hemodiálisis 3 veces por semana que la mayoría de pacientes llevaban cuando desarrollaron la enfermedad, actualmente no existe ningún dato que demuestre que reduce el riesgo de FSN. Así, aunque parece razonable una estrategia de hemodiálisis agresiva postexposición, probablemente la mejor pauta es tratar de evitar la administración de gadolinio en los pacientes de riesgo.
Pruebas complementarias sin gadolinio en pacientes de riesgo
En cada paciente de riesgo hay que valorar individualmente la necesidad de una exploración determinada. Puede ser útil consultar con el departamento de radiología para valorar el uso de otras pruebas alternativas que no precisen gadolinio y para evaluar el riesgobeneficio en cada paciente.
Recomendaciones de uso de gadolinio en pacientes con insuficiencia renal
De los diferentes agentes de contraste con gadolinio comercializados, existen importantes diferencias en cuanto a su asociación con el desarrollo de FSN.
La gran mayoría de los casos publicados se relacionan con gadodiamida (Omniscan®), mientras que sólo hay unos pocos casos relacionados con otro contraste. De los casos comunicados al registro internacional de FSN que tienen suficiente información disponible, el 95% han sido expuestos a un contraste con gadolinio en los 2 o 3 meses anteriores. De éstos, hay 160 casos asociados con gadodiamida, 73 con gadopentetato, 3 con gadoversetamida y otro caso con gadobenato, aunque este último estuvo expuesto también a gadodiamida6. En cuanto a los casos comunicados a la Food and Drug Administration (FDA), existen 283 asociados con gadodiamida, 125 con gadopententato, 20 con gadoversetamida, 10 con gadobenato y 9 con gadoteridol (tabla 1).
Los agentes de contraste con gadolinio se pueden dividir, según su estructura molecular, en 2 grandes grupos: cíclicos y lineales. Los complejos cíclicos presentan mayor estabilidad en la mayoría de situaciones, incluyendo la insuficiencia renal. Los complejos lineales o acíclicos son menos estables y son los que se han relacionado con la gran mayoría de casos de FSN.
Se precisan más datos para comprobar si la FSN se relaciona exclusivamente con la administración de ciertos tipos de contraste de gadolinio, o si se puede presentar aunque con menor probabilidad con todos los tipos. Sin embargo, si se considera que la exploración radiológica es absolutamente necesaria en un paciente con insuficiencia renal, se debe elegir un contraste del tipo cíclico.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), de forma coordinada con otras agencias reguladoras europeas, ha publicado las siguientes recomendaciones37:
Contrastes para RM con gadodiamida (Omniscan®):
- Su uso está contraindicado en pacientes con insuficiencia renal grave (tasa de filtración glomerular [TFG] < 30 ml/min/1,73 m2) y en pacientes sometidos —o que van a someterse- a trasplante hepático.
- En neonatos y en niños de hasta 1 año de edad sólo debe administrase tras una cuidadosa valoración, debido a la inmadurez de su función renal.
Contrastes para RM a base de otros quelatos de gadolinio diferentes a gadodiamida:
- La administración de estos contrastes en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2) sólo debe realizarse tras una cuidadosa valoración del balance beneficio-riesgo para cada paciente individual.
Correo electrónico:35844jmr@comb.cat
INFORMACIÓN DEL ARTÍCULO
Historia del artículo:
Recibido el 14 de mayo de 2009
Aceptado el 15 de mayo de 2009