Las infecciones son uno de los principales factores de morbimortalidad en los pacientes con enfermedades reumáticas inflamatorias, destacando por su prevalencia y gravedad la tuberculosis (TBC). A pesar de ello, y en términos generales, en los pacientes reumáticos tratados con glucocorticoides (GC) y/o inmunosupresores no biológicos no se suele tener en consideración la posibilidad de reactivación de una TBC latente. Esta falta de concienciación en los médicos que atienden a estos pacientes supone un problema para el control epidemiológico de la infección tuberculosa, al menos en países como el nuestro con una prevalencia no despreciable de esta enfermedad.
La evidencia disponible sugiere que la incidencia de TBC en los pacientes que reciben GC para el tratamiento de enfermedades reumáticas inflamatorias es superior a la de la población general, siendo por ejemplo en España de 4–6 veces mayor. Una manera de prevenir esta complicación sería seguir las recomendaciones de la American Thoracic Society y, en todo paciente que vaya a recibir dosis ≥15mg/d de prednisona o equivalente durante más de un mes, descartar previamente una infección tuberculosa latente. En presencia de una prueba de tuberculina y/o un test IGRA (Interferon Gamma Release Assays) positivo, y siempre y cuando se haya descartado la existencia de una TBC activa, se aconseja instaurar tratamiento profiláctico con isoniazida a dosis de 300mg/d durante 9 meses.
Infections are one of the main causes of morbidity and mortality in patients with rheumatic inflammatory disorders. Among these infections, tuberculosis (TB) is one of the most significant, due to its prevalence and severity. Nevertheless, in general terms, the possibility of reactivation of latent TB is not usually considered in rheumatic patients treated with glucocorticoids and/or non-biological immunosuppressive agents. This lack of awareness among physicians treating these patients is a problem for the epidemiological control of TB infection in countries such as Spain where the prevalence of the disease is not inconsiderable. The available evidence suggests that the incidence of TB in patients receiving glucocorticoids for inflammatory rheumatic diseases is higher than in the general population (for example, the incidence is between 4 and 6 times higher in Spain).
One approach to prevent this complication would be to follow the recommendations of the American Thoracic Society and rule out latent TB infection in all patients who are to receive ≥15mg/day of prednisone or equivalent for more than 1 month before the treatment is started. When the results of a tuberculin test and/or interferon gamma release assays (IGRA) are positive, prophylactic treatment with isoniazid at a dose of 300mg/day for 9 months is recommended, provided that active TB has been ruled out.
Las infecciones son uno de los principales factores de morbimortalidad en los pacientes con enfermedades reumáticas inflamatorias. Dentro de las infecciones merece especial consideración, por su prevalencia y gravedad, la tuberculosis (TBC). El uso en la última década de las terapias biológicas (fundamentalmente de los antagonistas del factor de necrosis tumoral alfa) ha incrementado aún más el riesgo de TBC en este colectivo de enfermos1,2. En la mayoría de los casos la enfermedad se produce como consecuencia de la reactivación de una infección latente, de ahí que su incidencia varíe considerablemente en función de la prevalencia de infección en el área estudiada. En España tenemos una incidencia cercana a 30–35 casos por 100.000 habitantes, lo que nos sitúa entre los peores lugares de Europa3,4.
La detección de infección tuberculosa latente es una parte fundamental del control epidemiológico de la TBC, al identificar personas con alto riesgo para desarrollar una TBC activa. El tratamiento de la TBC latente no solo evita la reactivación de la enfermedad, sino que impide su contagio a personas sensibles. En la actualidad, se prefiere utilizar la denominación tratamiento de TBC latente mejor que tratamiento preventivo o quimioprofilaxis, con el fin de promover un mayor entendimiento del concepto tanto en los pacientes como en los profesionales sanitarios que resulte en una aplicación generalizada de esta medida. A modo de ejemplo, a nivel nacional y desde el año 2002, se realiza sistemáticamente en todos los pacientes que van a iniciar un tratamiento biológico con antagonistas del factor de necrosis tumoral (TNF) alfa una evaluación previa dirigida a cribar la infección y la enfermedad tuberculosa5. La efectividad de esta estrategia de prevención se ha demostrado por la importante disminución de nuevos casos de TBC en el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas (BIOBADASER) desde la implantación de las recomendaciones oficiales: 117 casos/100.000 personas-año desde el 2002 contra 522 casos en la época previa6.
Sin embargo, y en términos generales, en los pacientes reumáticos tratados con glucocorticoides (GC) y/o inmunosupresores no biológicos no se suele tener en consideración la posibilidad de reactivación de una TBC latente. Esta falta de concienciación en los médicos que atienden a estos pacientes puede suponer un problema para el control epidemiológico de la infección tuberculosa, al menos en países como el nuestro, con una prevalencia no despreciable de esta enfermedad.
Riesgo de tuberculosis en pacientes con enfermedades reumáticas inflamatorias tratadas con glucorticoides: revisión de la literaturaMaterial y métodosCon el objetivo de analizar esta cuestión se realizó una revisión sistemática de la literatura en las siguientes bases de datos electrónicas hasta diciembre de 2009: MEDLINE (desde 1960), EMBASE (desde 1980) y Cochrane Library (Central). El criterio de selección fue cualquier estudio sobre la influencia del tratamiento con GC en la aparición de TBC que incluyera pacientes con enfermedad reumática inflamatoria. No se pusieron límites en cuanto a la fecha de publicación ni respecto al idioma de publicación. Se buscaron tanto términos MeSH como en formato texto libre; la estrategia de búsqueda se basó en la combinación de los siguientes términos: «steroid, glucocorticosteroid, prednisolone, prednisone, isoniazid, prophylaxis, prevention, tuberculosis, rheumatic disease, systemic rheumatic disease, systemic lupus erythematosus, rheumatoid arthritis, scleroderma, progressive systemic sclerosis, polymyositis/dermatomyositis, vasculitis, polymyalgia rheumatica, giant cell arteritis, and sarcoidosis».
No se evaluó información procedente de resúmenes presentados en congresos. El resultado de la búsqueda primeramente se depuró por título y resumen o por artículo entero en caso de que no tuviera resumen. Tras este proceso, los artículos restantes se analizaron en detalle. La revisión manual de las referencias incluidas en los estudios seleccionados permitió identificar otros trabajos adicionales de interés.
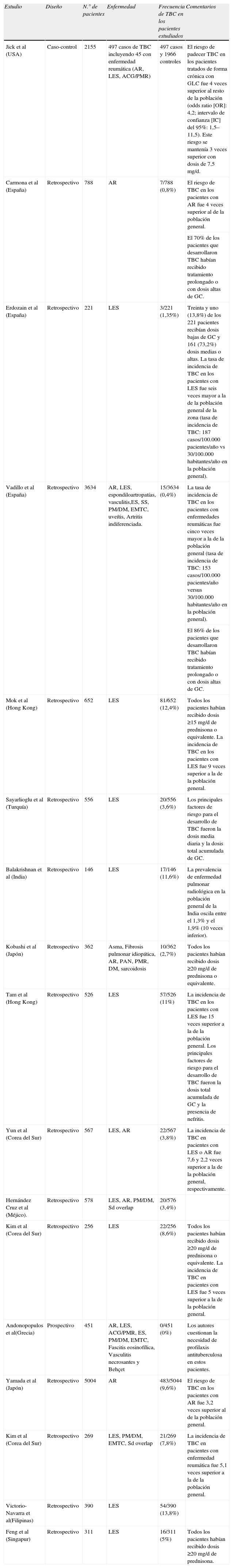
Análisis de la literaturaFinalmente la búsqueda bibliográfica identificó un total de 17 estudios seleccionados como relevantes que se incluyeron en esta revisión: 16 estudios de cohortes, 15 de ellos retrospectivos, y 1 estudio caso control7–23.
Las principales características de estos estudios se resumen en la tabla 1. La mayoría de ellos se realizaron en países con una incidencia moderada o alta de TBC (Hong Kong, India, Japón, Corea del Sur, Méjico, Turquía, Filipinas y Singapur)11–18,20–23, aunque también disponemos de datos de 5 estudios realizados en países con una menor incidencia de la enfermedad incluyendo España, Grecia, y Estados Unidos7–10,19. Al analizarlos en profundidad, además de las limitaciones propias de los estudios retrospectivos, se aprecia una gran variabilidad en cuanto a las dosis diaria y acumulada de GC recibida por los pacientes incluidos en la cohortes de revisión (la mayoría de los pacientes estudiados fueron tratados con dosis ≥15mg/d de prednisona o equivalente), el porcentaje de enfermos que habían recibido de forma previa o concomitante fármacos inmunosupresores (solo 12 de los trabajos incluyen esta información, siendo los inmunodepresores más utilizados la azatioprina, el metotrexato, la ciclofosfamida, la ciclosporina y los antipalúdicos), la duración del tratamiento esteroideo (en la mayoría de los 7 estudios que aportan esta información, la duración era superior a los 6 meses), y el periodo de seguimiento de las cohortes estudiadas (rango: 8 meses a 27 años). La edad media de las poblaciones también difiere, si bien en la mayoría predominaban las mujeres con edades comprendidas entre 25–50 años.
Estudios sobre la influencia del tratamiento con glucocorticoides en la aparición de tuberculosis en pacientes con enfermedades reumáticas autoinmunes
| Estudio | Diseño | N.° de pacientes | Enfermedad | Frecuencia de TBC en los pacientes estudiados | Comentarios |
| Jick et al (USA) | Caso-control | 2155 | 497 casos de TBC incluyendo 45 con enfermedad reumática (AR, LES, ACG/PMR) | 497 casos y 1966 controles | El riesgo de padecer TBC en los pacientes tratados de forma crónica con GLC fue 4 veces superior al resto de la población (odds ratio [OR]: 4,2; intervalo de confianza [IC] del 95%: 1,5–11,5). Este riesgo se mantenía 3 veces superior con dosis de 7,5mg/d. |
| Carmona et al (España) | Retrospectivo | 788 | AR | 7/788 (0,8%) | El riesgo de TBC en los pacientes con AR fue 4 veces superior al de la población general. |
| El 70% de los pacientes que desarrollaron TBC habían recibido tratamiento prolongado o con dosis altas de GC. | |||||
| Erdozain et al (España) | Retrospectivo | 221 | LES | 3/221 (1,35%) | Treinta y uno (13,8%) de los 221 pacientes recibían dosis bajas de GC y 161 (73,2%) dosis medias o altas. La tasa de incidencia de TBC en los pacientes con LES fue seis veces mayor a la de la población general de la zona (tasa de incidencia de TBC: 187 casos/100.000 pacientes/año vs 30/100.000 habitantes/año en la población general). |
| Vadillo et al (España) | Retrospectivo | 3634 | AR, LES, espondiloartropatías, vasculitis,ES, SS, PM/DM, EMTC, uveítis, Artritis indiferenciada. | 15/3634 (0,4%) | La tasa de incidencia de TBC en los pacientes con enfermedades reumáticas fue cinco veces mayor a la de la población general (tasa de incidencia de TBC: 153 casos/100.000 pacientes/año versus 30/100.000 habitantes/año en la población general). |
| El 86% de los pacientes que desarrollaron TBC habían recibido tratamiento prolongado o con dosis altas de GC. | |||||
| Mok et al (Hong Kong) | Retrospectivo | 652 | LES | 81/652 (12,4%) | Todos los pacientes habían recibido dosis ≥15mg/d de prednisona o equivalente. La incidencia de TBC en los pacientes con LES fue 9 veces superior a la de la población general. |
| Sayarlioglu et al (Turquía) | Retrospectivo | 556 | LES | 20/556 (3,6%) | Los principales factores de riesgo para el desarrollo de TBC fueron la dosis media diaria y la dosis total acumulada de GC. |
| Balakrishnan et al (India) | Retrospectivo | 146 | LES | 17/146 (11,6%) | La prevalencia de enfermedad pulmonar radiológica en la población general de la India oscila entre el 1,3% y el 1,9% (10 veces inferior). |
| Kobashi et al (Japón) | Retrospectivo | 362 | Asma, Fibrosis pulmonar idiopática, AR, PAN, PMR, DM, sarcoidosis | 10/362 (2,7%) | Todos los pacientes habían recibido dosis ≥20mg/d de prednisona o equivalente. |
| Tam et al (Hong Kong) | Retrospectivo | 526 | LES | 57/526 (11%) | La incidencia de TBC en los pacientes con LES fue 15 veces superior a la de la población general. Los principales factores de riesgo para el desarrollo de TBC fueron la dosis total acumulada de GC y la presencia de nefritis. |
| Yun et al (Corea del Sur) | Retrospectivo | 567 | LES, AR | 22/567 (3,8%) | La incidencia de TBC en pacientes con LES o AR fue 7,6 y 2,2 veces superior a la de la población general, respectivamente. |
| Hernández Cruz et al (Méjico). | Retrospectivo | 578 | LES, AR, PM/DM, Sd overlap | 20/576 (3,4%) | |
| Kim et al (Corea del Sur) | Retrospectivo | 256 | LES | 22/256 (8,6%) | Todos los pacientes habían recibido dosis ≥20mg/d de prednisona o equivalente. La incidencia de TBC en pacientes con LES fue 5 veces superior a la de la población general. |
| Andonopopulos et al(Grecia) | Prospectivo | 451 | AR, LES, ACG/PMR, ES, PM/DM, EMTC, Fascitis eosinofílica, Vasculitis necrosantes y Behçet | 0/451 (0%) | Los autores cuestionan la necesidad de profilaxis antituberculosa en estos pacientes. |
| Yamada et al (Japón) | Retrospectivo | 5004 | AR | 483/5044 (9,6%) | El riesgo de TBC en los pacientes con AR fue 3,2 veces superior al de la población general. |
| Kim et al (Corea del Sur) | Retrospectivo | 269 | LES, PM/DM, EMTC, Sd overlap | 21/269 (7,8%) | La incidencia de TBC en pacientes con enfermedad reumática fue 5,1 veces superior a la de la población general. |
| Victorio-Navarra et al(Filipinas) | Retrospectivo | 390 | LES | 54/390 (13,8%) | |
| Feng et al (Singapur) | Retrospectivo | 311 | LES | 16/311 (5%) | Todos los pacientes habían recibido dosis ≥20mg/d de prednisona. |
ACG: arteritis de células gigantes; AR: artritis reumatoide; DM: dermatomiositis; EMTC: enfermedad mixta del tejido conectivo; ES: esclerodermia; LES: lupus eritematoso sistémico; PM: polimiositis; PMR: polimialgia reumática.
De los 17 estudios incluidos en esta revisión, todos menos uno (el estudio realizado en Grecia), coinciden en documentar un riesgo aumentado de TBC en los pacientes que reciben GC para el tratamiento de enfermedades reumáticas. La frecuencia de TBC en las poblaciones estudiadas varió entre el 0–13,8% (tabla 1). En los países con una incidencia moderada o alta de la enfermedad, la frecuencia de aparición de TBC fue alta: 13,8% en Filipinas, 11–12,4% en Hong Kong, 11,6% en la India, 3,8–8,6% en Corea del Sur, 2,7–9,6% en Japón, 3,6% en Turquía y 3,4% en Méjico. De hecho, la incidencia de TBC en los pacientes con enfermedades reumáticas fue de 9–15 veces superior a la de la población general en Hong Kong, 10 veces más alta que la de la población general en la India, e igualmente mayor de lo esperado en Corea del Sur (2,2 veces superior a la de la población en los pacientes con artritis reumatoide y 5–7,6 veces superior en los afectos de lupus eritematoso sistémico). Por el contrario, en los países con una menor incidencia de TBC la frecuencia de desarrollo de la enfermedad fue baja, hecho previsible, puesto que la mayoría de los casos de TBC activa en los países desarrollados se deben a reactivaciones de una infección latente. A pesar de ello, los 3 estudios realizados en España8–10 aportan resultados preocupantes, puesto que coinciden al documentar una tasa de incidencia de TBC en los pacientes reumáticos tratados con GC de 4–6 veces superior a la de la población general (tasa de incidencia de 153–187 casos/100.000 pacientes-año vs 30–35 casos/100.000 habitantes/año en la población).
La mayoría de los casos de TBC descritos corresponden a pacientes afectos de lupus eritematoso sistémico o artritis reumatoide, aunque también hay casos de vasculitis sistémicas (arteritis de células gigantes/polimialgia reumática, poliarteritis nodosa y granulomatosis de Wegener), polimiositis/dermatomiositis y enfermedad mixta del tejido conectivo. Es importante destacar que un porcentaje elevado de los casos (hasta un 60% en algunas series) presentaba tuberculosis diseminada o extrapulmonar no diseminada. Las localizaciones extrapulmonares fueron muy variadas: linfática, pleural, peritoneal, meníngea, intestinal, paravertebral, ósea y genitourinaria.
A la hora de extraer conclusiones definitivas, hay que tener en cuenta que el riesgo incrementado de TBC en estos pacientes puede estar determinado no solo por el tratamiento esteroideo, sino también por la administración concomitante o previa de inmunosupresores y por un mayor o menor grado de inmunodeficiencia causado por la propia enfermedad reumática autoinmune de base. ¿Qué porcentaje de este riesgo se debe a los GC? Con la evidencia actual no es posible cuantificar de forma fiable el protagonismo de cada uno de estos factores aunque Jick et al, en un estudio de casos y controles realizado en Estados Unidos, cuantificaron por primera vez el problema de la TBC asociada al uso de GC obteniendo una odds ratio [OR] de 4,2 (intervalo de confianza [IC] 95%: 1,5–11,5)23,24. Otros datos que refuerzan el protagonismo de los GLC en el desarrollo de esta complicación son los casos de TBC descritos en enfermedades reumáticas tratadas exclusivamente con GLC, como la polimialgia reumática y la arteritis de células gigantes14–17, y algunos estudios que han demostrado también un riesgo aumentado de TBC en pacientes tratados de forma prolongada o con dosis altas de GC por enfermedades respiratorias como el asma o la fibrosis pulmonar idiopática que no implican inmunosupresión14,25,26, si bien este dato no ha sido corroborado en todos los trabajos que han analizado esta cuestión27,28.
Respecto al peso del tratamiento previo o concomitante con inmunosupresores en el desarrollo de esta complicación, Vadillo Font et al10 cuantificaron en una cohorte de enfermos con artritis reumatoide la incidencia de TBC según el fámaco utilizado. Así, la incidencia acumulada fue de 7.692 casos por 100.000 pacientes/año cuando se utilizó ciclofosfamida, 4.878 por 100.000 pacientes/año con antagonistas del TNF alfa, 2.703 por 100.000 pacientes/año con azatioprina y solo de 143 por 100.000 pacientes/año con metotrexato.
¿Cómo influyen los glucocorticoides en la respuesta inmune frente a la tuberculosis?El principal reservorio de Mycobacterium tuberculosis es el hombre enfermo. En la mayoría de casos, la TBC humana es el resultado de la inhalación de las gotas de Pflügge que albergan al bacilo. Al establecerse en los alvéolos pulmonares el bacilo es fagocitado por los macrófagos alveolares. Dado que el M. tuberculosis es un patógeno intracelular, el bacilo consigue evitar su destrucción impidiendo la unión del fagosoma y el lisosoma, y multiplicarse en el interior del macrófago hasta posteriormente destruirlo. Al igual que ocurre con otros patógenos intracelulares, el macrófago infectado secreta citocinas (entre ellas el TNF alfa) y quimiocinas que desencadenan un proceso inflamatorio local, y con ello una respuesta inespecífica de defensa que conduce a la formación del granuloma29–34. Si esta respuesta innata fracasa en la contención del bacilo, este consigue diseminarse sistémicamente, afectando prácticamente a todos los tejidos del huésped. En caso contrario, el crecimiento bacilar es detenido con la generación de una respuesta inmune basada en la formación de linfocitos T de tipo CD4 o helper mayoritariamente, pero también de linfocitos T CD8 y linfocitos B. La respuesta inmune protectora en la TBC está dominada por la inmunidad celular, con muy poca participación de los anticuerpos. Los linfocitos Th1 tienen un particular interés, puesto que migran hacia el foco de infección liberando citocinas activadoras de macrófagos, tales como el interferón (IFN) gamma y el TNF alfa, siendo los integrantes mayoritarios de los granulomas29–34. La activación de los macrófagos mediante el IFN gamma desencadena una acidificación y un incremento de los radicales de oxígeno y de nitrógeno en el interior del fagosoma que permite destruir un alto porcentaje de población bacilar. El porcentaje restante es capaz de adaptar su metabolismo para responder a esta situación de estrés y consigue sobrevivir en estado de latencia.
Los efectos de los GC sobre el sistema inmune son múltiples, complejos y no siempre bien conocidos. Los GC actúan sobre la inmunidad celular y humoral (tabla 2) induciendo una disminución en la síntesis de la mayoría de las citocinas conocidas, incluyendo el TNF alfa y el IFN gamma. Esto condiciona una alteración de la migración de los leucocitos desde el torrente sanguíneo a los tejidos inflamados, así como alteraciones en la presentación de antígenos, la activación de las células T (alteración en la producción de células T helper, con disminución de Th1 e incremento de Th2) y en la respuesta citotóxica35–38. Remarcar que la diseminación de M. tuberculosis es fundamentalmente consecuencia de un fallo en la formación o mantenimiento del granuloma, debido a que no hay producción de las citocinas (principalmente TNF alfa) y quimiocinas involucradas en este proceso. La producción de anticuerpos está afectada cuando se usan dosis de prednisona o equivalentes superiores a los 40mg/d38. Por otra parte, dosis de prednisona o equivalentes iguales o superiores a 15mg/d durante 2–4 semanas suprimen la reacción tuberculínica, mientras que dosis inferiores o intermitentes no interfieren con dicha prueba39. Esta dosis parece ser el dintel a partir del cual existe un mayor riesgo de TBC activa, aunque dicho riesgo no se había cuantificado de manera fiable hasta el estudio realizado por Jick et al7: la OR para el desarrollo de TBC con dosis de prednisona ≥15mg/d fue de 7,7, mientras que con dosis<15mg/d la OR fue de 2,8.
Efectos de los glucocorticoides sobre el sistema inmune
| Efecto sobre los linfocitos |
| Linfopenia reversible, depleción de CD4 (>50% de reducción) |
| Disminución de la proliferación y migración de linfocitos |
| Alteración en la citotoxicidad de la célula natural killer |
| Alteraciones relacionadas con fenómenos de hipersensibilidad |
| Disminución de la producción de citocinas producidas por los linfocitos (IL-2, IL-12, TNF alfa, IFN gamma) |
| Alteración en la producción de células T helper (disminución de Th1 e incremento de Th2) |
| Alteración en la función celular fagocítica y en la respuesta inmune celular |
| Efecto sobre los neutrófilos |
| Alteración en la fagocitosis, en la desgranulación y en la función oxidativa |
| Reducción de la producción de citocinas |
| Alteración en la producción de óxido nítrico |
| Disminución de la adherencia al endotelio, extravasación y quimiotaxis |
| Inhibición de la apoptosis |
| Efecto sobre los monocitos/macrófagos |
| Monocitopenia reversible (>40% de reducción) |
| Alteración en la fagocitosis y en la muerte oxidativa |
| Disminución de la quimiotaxis y migración a los sitios de infección |
| Alteración en la formación de óxido nítrico |
| Alteración en la maduración de monolitos y macrófagos |
| Inhibición de la producción de citocinas proinflamatorias (IL-1, IL-6 y TNF alfa) |
| Otros efectos sobre las células del sistema inmune |
| Disminución de las células alveolares dendríticas, de las células de la microglia del sistema nervioso central y de las células epidérmicas de Langerhans |
| Alteración en la capacidad de presentación del antígeno de las células dendríticas y de Langerhans (disminución de la expresión de CMH II en su superficie) |
| Disminución de la capacidad de regulación de las células de la microglia (alteración en la formación de óxido nítrico) |
| Otros efectos |
| Inhibición en la producción de prostaglandinas |
| Inhibición de la respuesta inflamatoria del huésped |
| Atenuación de la clínica y de los signos radiológicos de infección |
| Retraso potencial del diagnóstico |
Adaptada de Lionakis et al37.
CMH: complejo mayor de histocompatibilidad; IL: interleucina; TNF: factor de necrosis tumoral.
Según las recomendaciones de la American Thoracic Society40 en todo paciente que vaya a recibir dosis ≥15mg/d de prednisona o equivalente durante más de un mes se debe descartar previamente una infección tuberculosa latente. La intradermorreacción mediante la técnica de Mantoux es el procedimiento de elección para descartar esta posibilidad. En presencia de una prueba de tuberculina positiva, y siempre y cuando se haya descartado la existencia de una TBC activa, se aconseja instaurar tratamiento profiláctico con isoniazida a dosis de 300mg/d durante 9 meses.
La normativa sobre la prevención de la TBC elaborada por la Sociedad Española de Neumología y Cirugía Torácica41,42, no establece ningún punto de corte en cuanto a la dosis o duración del tratamiento esteroideo a partir del cual se deba realizar este despistaje (tabla 3). La guía de la British Thoracic Society no incluye recomendaciones específicas sobre cuándo hacer quimioprofilaxis en este grupo específico de enfermos43.
Indicaciones de quimioprofilaxis (tratamiento de la infección tuberculosa) según las recomendaciones de la Sociedad española de Neumología y Cirugía Torácica (SEPAR)41
| Quimioprofilaxis primaria (pacientes con prueba de la tuberculina negativa) |
| Sujetos no infectados (negativos para la tuberculina) pero con elevado riesgo de infección por haber tenido contacto con enfermos bacilíferos, principalmente en el caso de niños, adolescentes e inmunodeprimidos |
| Quimioprofilaxis secundaria o tratamiento de la infección tuberculosa latente (pacientes con prueba de la tuberculina positiva) |
| Indicaciones prioritarias. |
| Infectados por el VIH |
| Conversores tuberculínicos* |
| Miembros de microepidemias de cualquier edad |
| Silicosis. |
| Imágenes fibróticas residuales en la Rx de tórax no tratadas¿¿ |
| Menores de 35 años contactos de enfermos bacilíferos |
| Cualquier infectado menor de 20 años |
| Pacientes en lista de espera de trasplantes |
| Utilización de antagonistas del TNF alfa |
| Indicaciones a valorar individualmente |
| Mayores de 35 años contactos de enfermos bacilíferos |
| Toxicomanías, incluido alcoholismo |
| Diabéticos |
| Neoplasias |
| Tratamiento prolongado con glucocorticoides o inmunosupresores |
| Insuficiencia renal crónica. Hemodiálisis |
| Desnutrición: gastrectomía, síndromes de malabsorción y derivación intestinal |
| Riesgo profesional: docentes y guarderías, sanitarios, trabajadores con grupos de riesgo (prisiones, asilos, centros de toxicómanos, etc) |
| Riesgo social: asilos, reclusos, albergues, psiquiátricos, etc |
| Inmigrantes de bajo nivel económico |
A la hora de interpretar el resultado de la prueba de la tuberculina es importante destacar que, en los pacientes que siguen tratamiento inmunosupresor, se recomienda considerar como positiva una induración igual o superior a 5mm44. También se ha de tener en cuenta que existen falsos positivos producidos por la vacunación con BCG, y falsos negativos en situaciones de inmunodeficiencia, desnutrición o enfermedades graves. Estos factores concurren a menudo en los pacientes con enfermedad reumática inflamatoria crónica, de quienes se presume que presentan un determinado grado de inmunodeficiencia por la propia enfermedad de base, por el tratamiento o por los 2. La sensibilidad de la prueba de la tuberculina en este contexto se ve muy mermada. Para mejorar su rentabilidad en pacientes inmunodeprimidos, una opción es la realización de la prueba en 2 tiempos (repitiéndola 1 semana más tarde), para aprovechar así el efecto empuje (booster) de la primera prueba. El inconveniente más importante de esta práctica es el aumento de falsos positivos entre los pacientes vacunado con BCG, entre los que se duplican los positivos45. Otra opción más recomendable es complementar la prueba de la tuberculina con las nuevas técnicas diagnósticas de infección tuberculosa, basadas en la cuantificación de la respuesta inmunitaria celular específica contra M. tuberculosis. Estas técnicas, denominadas en su conjunto Interferon Gamma Release Assays (IGRA), se basan en el principio de que las células T sensibilizadas de los individuos infectados producen IFN gamma al reencontrarse con los antígenos de M. tuberculosis. Los IGRA tienen una buena capacidad para diferenciar a los pacientes con TBC latente de los falsos positivos producidos por la vacunación con BCG y permiten también identificar a gran parte de los falsos negativos45.
Como ya se ha comentado, antes de iniciar el tratamiento de la TBC latente es preciso descartar una TBC activa y, por lo tanto, se debe realizar una radiografía de tórax en todos los pacientes, aunque no tengan clínica respiratoria, con el fin de evitar el tratamiento de pacientes con TBC activa con monoterapia. Los pacientes con fibrosis por TBC residual en la radiografía de tórax deben tener 3 baciloscopias y cultivos para micobacterias negativos antes de indicar tratamiento para TBC latente44.
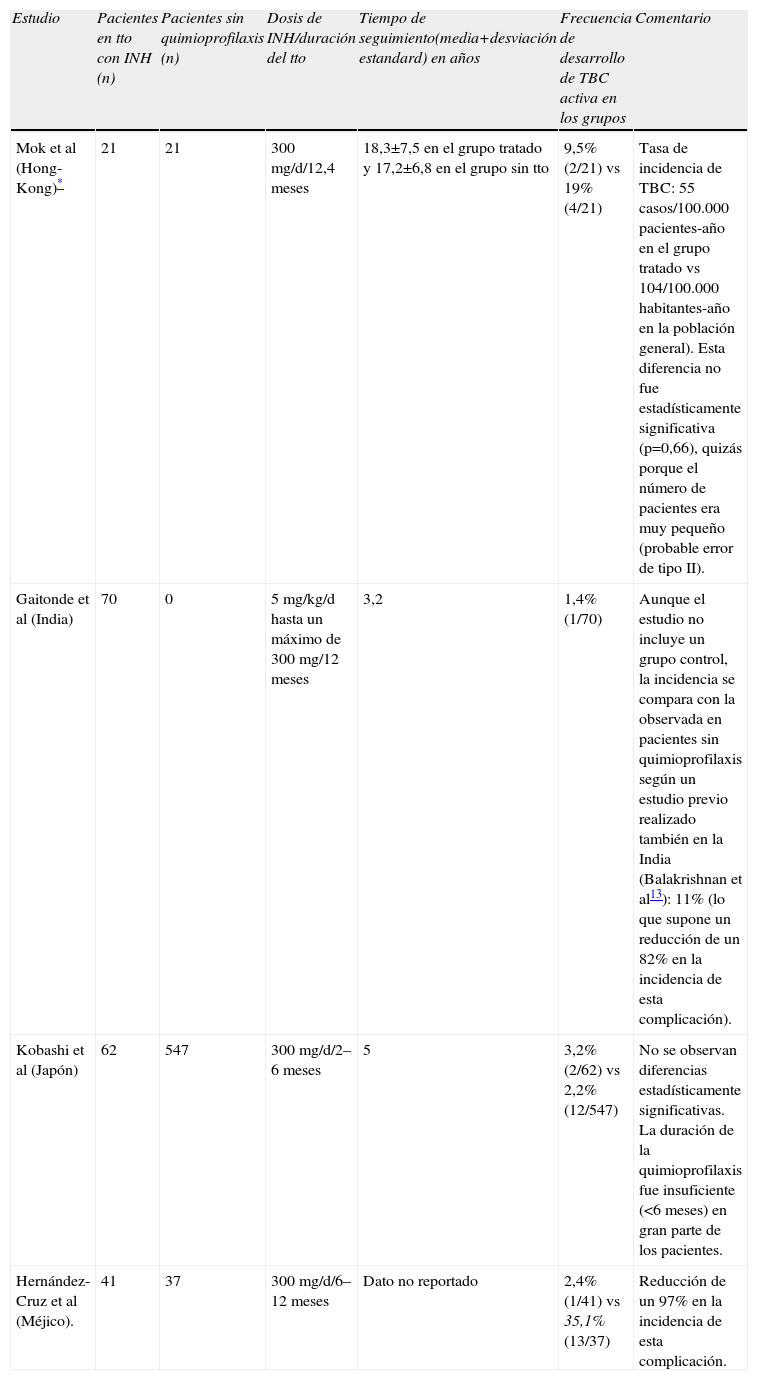
En la actualidad se dispone de evidencias clínicas suficientes para utilizar 5 posibles regímenes de tratamiento de la TB latente44: isoniacida diaria o bisemanal durante 9 meses; isoniacida diaria o bisemanal durante 6 meses; rifampicina diaria durante 4 meses; isoniacida más rifampicina diarias durante 3 meses, y rifampicina más piracinamida diarias durante 2 meses (o bisemanales durante 2 o 3 meses). De estos regímenes, el único contrastado específicamente en pacientes con enfermedad reumática inflamatoria tratados con GC es la isoniacida diaria durante un mínimo de 6 meses11,14,46,47. De los 4 estudios que han investigado su eficacia (tabla 4), en 2 se ha demostrado que la quimioprofilaxis con isoniacida reduce la incidencia de TBC entre un 82–97%46,47. Los principales efectos secundarios de la isoniazida son la hepatotoxicidad y las neuropatías periféricas. La administración de piridoxina (vitamina B6 a dosis de 10–25mg/d) disminuye el riesgo de toxicidad neurológica. La hepatotoxicidad no parece ser una complicación importante en estos pacientes, aunque su incidencia aumenta con la edad y la ingesta alcohólica6,11,14,46,47. Se recomienda detener el tratamiento con isoniazida en pacientes asintomáticos si las transaminasas superan en 5 veces los valores normales y en pacientes con sintomatología compatible con toxicidad por isoniazida si las transaminasas superan en 3 veces los valores normales44.
Estudios que han analizado la eficacia de la profilaxis con isoniazida (INH) para prevenir el desarrollo de tuberculosis activa en pacientes con enfermedades reumáticas inflamatorias tratados con glucocorticoides.
| Estudio | Pacientes en tto con INH (n) | Pacientes sin quimioprofilaxis (n) | Dosis de INH/duración del tto | Tiempo de seguimiento(media+desviación estandard) en años | Frecuencia de desarrollo de TBC activa en los grupos | Comentario |
| Mok et al (Hong-Kong)* | 21 | 21 | 300mg/d/12,4 meses | 18,3±7,5 en el grupo tratado y 17,2±6,8 en el grupo sin tto | 9,5% (2/21) vs 19% (4/21) | Tasa de incidencia de TBC: 55 casos/100.000 pacientes-año en el grupo tratado vs 104/100.000 habitantes-año en la población general). Esta diferencia no fue estadísticamente significativa (p=0,66), quizás porque el número de pacientes era muy pequeño (probable error de tipo II). |
| Gaitonde et al (India) | 70 | 0 | 5mg/kg/d hasta un máximo de 300mg/12 meses | 3,2 | 1,4% (1/70) | Aunque el estudio no incluye un grupo control, la incidencia se compara con la observada en pacientes sin quimioprofilaxis según un estudio previo realizado también en la India (Balakrishnan et al13): 11% (lo que supone un reducción de un 82% en la incidencia de esta complicación). |
| Kobashi et al (Japón) | 62 | 547 | 300mg/d/2–6 meses | 5 | 3,2% (2/62) vs 2,2% (12/547) | No se observan diferencias estadísticamente significativas. La duración de la quimioprofilaxis fue insuficiente (<6 meses) en gran parte de los pacientes. |
| Hernández-Cruz et al (Méjico). | 41 | 37 | 300mg/d/6–12 meses | Dato no reportado | 2,4% (1/41) vs 35,1% (13/37) | Reducción de un 97% en la incidencia de esta complicación. |
De un total de 652 pacientes afectos de LES, 76 desarrollan TBC activa que fue correctamente tratada. En 33 de estos 76 pacientes se administró posteriormente profilaxis con INH cuando necesitaban dosis de prednisona ≥15mg/día de prednisona por brote de actividad de su enfermedad, mientras que los 43 restantes no recibieron nunca quimioprofilaxis posterior. A partir de estos 76 pacientes, escogen 21 casos tratados con INH y 21 controles que no recibieron quimioprofilaxis apareados por número de brotes de actividad del lupus, dosis acumulada de glucocorticoides y localización de la infección tuberculosa inicial. Se analiza la eficacia de la INH en prevenir nuevas recurrencias de la TBC.
Finalmente, es importante recordar que, para conseguir el objetivo final de prevenir el desarrollo de TBC, es fundamental conseguir el buen cumplimiento del tratamiento prescrito. Los controles periódicos habrían de considerar específicamente este aspecto e incluir entrevista y determinación de metabolitos de isoniazida (o color si se trata de rifampicina) en orina.
ConclusionesLa evidencia disponible sugiere que los pacientes que reciben GC para el tratamiento de enfermedades reumáticas inflamatorias tienen un riesgo aumentado de desarrollar TBC en comparación con la población general7–23. Este aumento del riesgo se ha documentado fundamentalmente en países con una incidencia moderada o alta de TBC. España, a pesar de ser uno de los países más privilegiados del mundo en bienestar social y económico, tiene aún unas tasas de TBC que se sitúan por encima de las de muchos países menos afortunados. Por ello, los 3 estudios realizados en nuestro país para investigar esta cuestión8–10 coinciden al documentar una tasa de incidencia de TBC en los pacientes reumáticos tratados con GC de 4–6 veces superior a la de la población general.
El riesgo incrementado de TBC en estos enfermos parece estar determinado no solo por el tratamiento esteroideo, sino también por la administración concomitante o previa de inmunosupresores y por un mayor o menor grado de inmunodeficiencia causado por la propia enfermedad reumática autoinmune de base. ¿Qué porcentaje de este riesgo se debe a los GC? Con la evidencia actual no es posible cuantificar de forma fiable el protagonismo de cada uno de estos factores, aunque un estudio de casos y controles7 ha cuantificado el problema de la TBC asociada al uso de GC obteniendo una OR de 4,2. Otros datos que refuerzan el protagonismo de los GLC en el desarrollo de esta complicación son los casos de TBC descritos en enfermedades reumáticas tratadas exclusivamente con GLC, como la polimialgia reumática y la arteritis de células gigantes14–17, y algunos estudios que han demostrado también un riesgo aumentado de TBC en pacientes tratados con GC por enfermedades respiratorias que, como el asma o la fibrosis pulmonar idiopática, no implican inmunosupresión14,25,26.
Una manera de prevenir esta complicación sería seguir las recomendaciones de la American Thoracic Society40 y, en todo paciente que vaya a recibir dosis ≥15mg/d de prednisona o equivalente durante más de un mes, descartar previamente una infección tuberculosa latente. En presencia de una prueba de tuberculina y/o un test IGRA positivo, y siempre y cuando se haya descartado la existencia de una TBC activa, se aconseja instaurar tratamiento profiláctico con isoniazida a dosis de 300mg/d durante 9 meses.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.