La hiperglucemia inducida por corticoides es un problema frecuente que en la práctica clínica habitual puede generar ingresos hospitalarios, prolongación de los mismos y visitas urgentes reiteradas sin una adecuada solución del problema. Aún así, sigue siendo un problema infravalorado por lo que refiere tanto al diagnóstico como, sobre todo, al tratamiento. A ello contribuye la diversidad de preparados y pautas de administración de corticoides, pero sobre todo la escasa implicación por parte de los profesionales que prescriben los glucocorticoides y la ausencia de estudios clínicos y recomendaciones específicas para el diagnóstico y el tratamiento.
En este artículo revisamos la fisiopatología de la hiperglucemia inducida por glucocorticoides y proponemos unas estrategias para su manejo, basadas en la situación clínica y en el patrón de hiperglucemia previsible según el tipo y la pauta de glucocorticoides utilizados.
Steroid-induced hyperglycemia is a frequent problem in clinical practice that can generate or prolong hospital admissions and lead to repeat emergency visits without an adequate solution. However, steroid-induced hyperglycemia remains an underestimated problem in terms of both diagnosis and treatment. Factors contributing to this situation include the variety of corticosteroid preparations and regimens available and especially the lack of involvement by practitioners prescribing steroids and the absence of clinical studies and specific recommendations for diagnosis and treatment.
This article reviews the pathophysiology of glucocorticoid-induced hyperglycemia and proposes management strategies based on clinical status and the pattern of hyperglycemia expected according to the type and regimen of glucocorticoid used.
Los glucocorticoides son ampliamente utilizados en medicina y se dispone de multitud de compuestos con diferentes vías de administración, con diferente farmacocinética y farmacodinamia, así como diferentes pautas de dosificación, en muchas ocasiones dinámicas, dependiendo del proceso por el cual han sido indicados. Se utilizan tanto en hospitalización como en régimen ambulatorio, en situaciones agudas o crónicas y para múltiples procesos como enfermedades respiratorias, dermatológicas, reumatológicas, procesos neuroquirúrgicos, en la inducción de quimioterapia para neoplasias, en cuidados paliativos y en la prevención y rechazo del trasplante. En la población incluida en el Third National Health and Nutritional Examination Survey (NHANES-III), la prevalencia del uso de glucocorticoides en la población mayor de 60 años era del 1,7%, la duración media del tratamiento era de 45 meses y en el 80% el tratamiento se prolongó más de 1 mes1.
La hiperglucemia es uno de los efectos adversos más conocidos de los glucocorticoides sistémicos, afectando a la práctica totalidad de los pacientes con diabetes previa2,3 o precipitando la «diabetes esteroidea» en los pacientes sin diabetes previa. El riesgo de desarrollar «diabetes esteroidea» varía entre diferentes estudios, con odds ratio que oscilan entre 1,36 y 2,314–7. La prevalencia de la diabetes esteroidea también varía ampliamente en diferentes estudios observacionales, oscilando entre el 5% y más del 25%8,9, pero probablemente está infraestimada por los criterios diagnósticos utilizados. Las infiltraciones intraarticulares de glucocorticoides son ampliamente utilizadas en diversas patologías articulares inflamatorias y no inflamatorias; sin embargo, la información existente sobre los efectos de los mismos sobre el metabolismo hidrocarbonado es aún más escasa y dispar, tanto en lo que se refiere al grado de la alteración como a la duración de la misma10,11.
La edad y otros factores de riesgo bien establecidos de la diabetes tipo 2 son factores predisponentes para el desarrollo de diabetes esteroidea. No obstante, los principales factores de riesgo para la hiperglucemia inducida por glucocorticoides son la dosis y la duración del tratamiento con glucocorticoides4–7.
En la actualidad no disponemos de evidencia científica sobre las consecuencias de la hiperglucemia inducida por glucocorticoides y tampoco de estudios clínicos sobre los efectos de la prevención y corrección de la misma. Sin embargo, la hiperglucemia inducida por glucocorticoides constituye un problema importante en la práctica clínica por diversos motivos. En primer lugar, por su elevada prevalencia y por los problemas derivados de la propia hiperglucemia, que frecuentemente es severa y provoca ingresos hospitalarios, prolongación de los mismos o bien visitas urgentes reiteradas. En segundo lugar, por los posibles efectos deletéreos de la hiperglucemia sobre el pronóstico de la enfermedad para la que se han indicado los glucocorticoides y el aumento del riesgo de infección que supone la hiperglucemia mantenida12. Además, el control de la hiperglucemia transitoria en situaciones similares, tal como ocurre frecuentemente durante la hospitalización, se relaciona con una disminución de la mortalidad y de la tasa de complicaciones13–15.
Sorprende, por tanto, que un problema clínico como la hiperglucemia inducida por corticoides, tan frecuente en la práctica clínica, potencialmente perjudicial para los pacientes que lo padecen y que afecta a casi todas las especialidades, sea un área de la medicina infravalorada por la mayoría de profesionales, tanto por lo que refiere al diagnostico como al tratamiento. De ello da idea la escasa bibliografía existente sobre la prevalencia y la fisiopatología, pero sobre todo en lo que hace referencia al diagnóstico y el tratamiento. Además, en estos aspectos la información disponible proviene fundamentalmente de artículos de opinión en el contexto de revisiones del manejo de la hiperglucemia en la hospitalización16–19 y de dos revisiones recientes sobre la hiperglucemia inducida por glucocorticoides20,21.
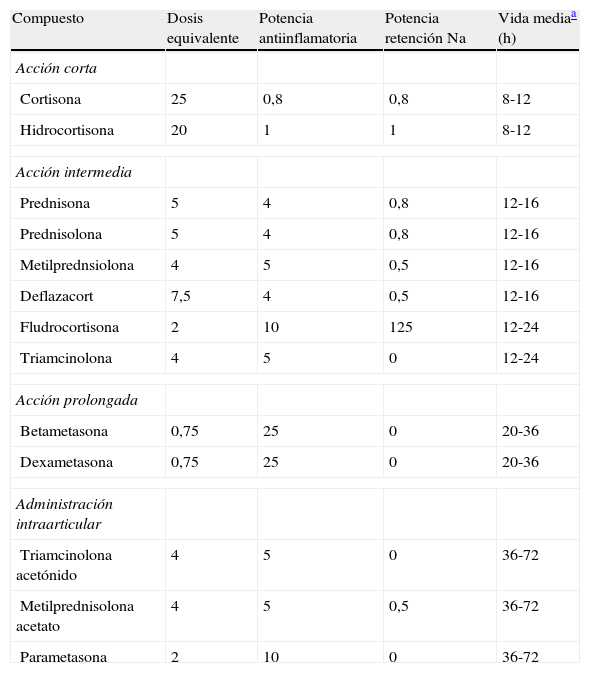
Fisiopatología de la hiperglucemia inducida por glucocorticoidesEn la actualidad se dispone de múltiples preparados con efecto glucocorticoide que se diferencian en la potencia glucocorticoidea y mineralcorticoidea, su farmacocinética y farmacodinamia, y también en la presentación farmacéutica para su administración oral, parenteral, intraarticular e inhalada. En la tabla 1 se resumen las características de los preparados de glucocorticoides más usados en la clínica. No se incluyen los glucocorticoides inhalados, ya que el efecto hiperglucemiante que producen, si existe, es clínicamente poco relevante22. El conocimiento de estas características, además de esencial para seleccionar el preparado y la dosificación más adecuados para la indicación terapéutica, es importante para la predicción de los potenciales efectos secundarios como la hiperglucemia.
Características de los distintos preparados glucocorticoideos sistémicos
| Compuesto | Dosis equivalente | Potencia antiinflamatoria | Potencia retención Na | Vida mediaa (h) |
| Acción corta | ||||
| Cortisona | 25 | 0,8 | 0,8 | 8-12 |
| Hidrocortisona | 20 | 1 | 1 | 8-12 |
| Acción intermedia | ||||
| Prednisona | 5 | 4 | 0,8 | 12-16 |
| Prednisolona | 5 | 4 | 0,8 | 12-16 |
| Metilprednsiolona | 4 | 5 | 0,5 | 12-16 |
| Deflazacort | 7,5 | 4 | 0,5 | 12-16 |
| Fludrocortisona | 2 | 10 | 125 | 12-24 |
| Triamcinolona | 4 | 5 | 0 | 12-24 |
| Acción prolongada | ||||
| Betametasona | 0,75 | 25 | 0 | 20-36 |
| Dexametasona | 0,75 | 25 | 0 | 20-36 |
| Administración intraarticular | ||||
| Triamcinolona acetónido | 4 | 5 | 0 | 36-72 |
| Metilprednisolona acetato | 4 | 5 | 0,5 | 36-72 |
| Parametasona | 2 | 10 | 0 | 36-72 |
El mecanismo predominante responsable de la hiperglucemia después de la administración de glucocorticoides es la reducción de la captación de glucosa por resistencia a la insulina hepática y periférica23,24. También existe inhibición de la secreción de la insulina que contribuye en mayor o menor medida a la hiperglucemia25,26. Ambos efectos son dosis-dependientes, es decir, a más dosis de glucocorticoide más resistencia a la insulina y mayor inhibición de la secreción de la misma. La incapacidad de la secreción de insulina para compensar la reducción de la sensibilidad a la insulina justifica la hiperglucemia desencadenada por los glucocorticoides en la práctica totalidad de pacientes con diabetes tipo 2 y el desarrollo de diabetes esteroidea en los pacientes sin diabetes previa. El grado de hiperglucemia se correlaciona con el grado de intolerancia a la glucosa preexistente, siendo habitualmente muy marcada entre los pacientes con diabetes previa, pero no suele existir cetosis.
La información sobre la duración de los efectos biológicos sobre el metabolismo de la glucosa ejercidos por los distintos preparados glucocorticoideos es escasa, y deriva de estudios con voluntarios sanos. El efecto hiperglucemiante de los glucocorticoides de acción intermedia (prednisona, metilprednisolona y deflazacort) tiene un pico a las 4-8h y una duración de 12-16h27. Los glucocorticoides de acción prolongada coma la dexametasona, tienen un efecto hiperglucemiante más prolongado, estimándose en unas 20h en voluntarios sanos28, pero en la práctica clínica parece ser superior y suele prolongarse hasta 24-36h.El efecto hiperglucemiante de los glucocorticoides administrados por vía intraarticular como la triamcinolona, en pacientes con diabetes se observa a partir de las 2h, con un pico de acción que va de las 2 a las 24h y una duración habitual de 2-3 días que puede prolongarse hasta los 5 días11. El grado de hiperglucemia inducido por la administración intraarticular de glucocorticoides parece ser menor e incluso puede ser inexistente en pacientes sin diabetes previa10,11. Este menor efecto hiperglucemiante puede estar en relación con la menor absorción y exposición sistémica a los glucocorticoides administrados por vía intraarticular.
El patrón de la hiperglucemia inducida por los glucocorticoides se caracteriza por una hiperglucemia postprandial muy marcada y un efecto escaso sobre la glucemia basal, especialmente en los pacientes no diabéticos y en aquellos con diabetes bien controlada. Este patrón de la hiperglucemia refleja la reducción del consumo de glucosa en el tejido muscular y adiposo inducido por los glucocorticoides y el escaso efecto sobre la gluconeogénesis, y varía ampliamente, dependiendo del tipo de glucocorticoide utilizado así como de la dosis y de la frecuencia de la administración. Los preparados de acción intermedia administrados en una sola dosis matutina magnifican este patrón, causando una hiperglucemia postprandial muy marcada, especialmente después de la comida, lo que determina hiperglucemias por la tarde y noche, mientras que la finalización del efecto hiperglucemiante durante el ayuno nocturno se refleja en la ausencia o mínima elevación de la glucemia basal. El conocimiento de este patrón de hiperglucemia es esencial para seleccionar medidas terapéuticas con efecto hipoglucemiante preferente por la tarde, para prevenir la hiperglucemia vespertina, y escaso o nulo en la madrugada, para evitar la hipoglucemia nocturna. Este patrón hiperglucemiante característico de los glucocorticoides queda amortiguado cuando los glucocorticoides de acción intermedia se administran en 2 o más dosis, cuando se usan glucocorticoides de acción prolongada o cuando la administración es intraarticular. En estos casos el efecto hiperglucemiante se mantiene las 24h y, aunque sigue siendo predominantemente postprandial, la caída de la glucemia durante el ayuno nocturno no es tan marcada. En consecuencia, el riesgo de hipoglucemia nocturna relacionada con el uso de fármacos hipoglucemiantes con efecto durante las 24h es menor.
Cribado, diagnóstico y objetivos de control de la hiperglucemia inducida por glucocorticoidesEl diagnóstico adecuado y precoz de la hiperglucemia inducida por glucocorticoides es esencial. Por un lado representa un problema perjudicial para los pacientes que la padecen en base a la extrapolación de la evidencia científica surgida de otras situaciones de hiperglucemia transitoria13–15, por la depleción de volumen secundaria a diuresis osmótica, y por el aumento de susceptibilidad a la infección de los pacientes con diabetes y mal control glucémico12,15. Además, disponemos de tratamientos seguros y eficaces para contrarrestarla.
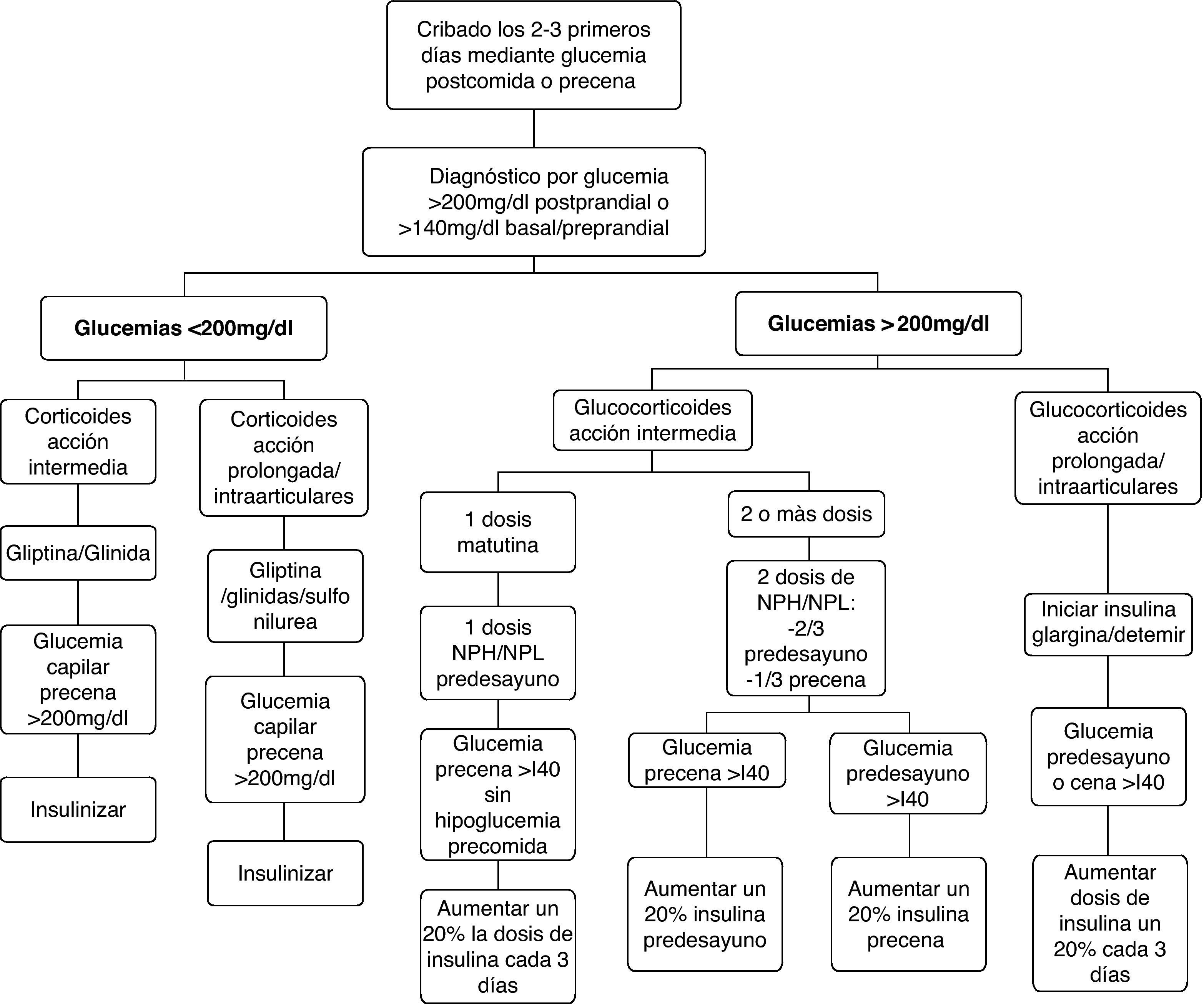
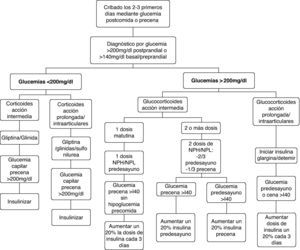
El diagnóstico de la diabetes esteroidea, como para la diabetes de otras etiologías, se establece según los criterios establecidos por los comités de expertos14,29,30 cuando la glucemia basal es superior a 126mg/dl, la glucemia en cualquier momento es mayor o igual a 200mg/dl, la HbA1c es >6,5% o la glucemia a las 2h de la sobrecarga oral de glucosa es >200mg/dl. Sin embargo, dada la fisiopatología y el patrón de la hiperglucemia inducida por glucocorticoides, podemos intuir que los criterios establecidos ofrecerán una baja sensibilidad diagnóstica en la mayoría de los pacientes con diabetes esteroidea. La determinación de la glucemia basal claramente infravalora la hiperglucemia inducida por glucocorticoides, sobre todo en aquellos casos de tratamientos con glucocorticoides de acción intermedia en monodosis matutina. El test de tolerancia oral a la glucosa tampoco parece el idóneo para el diagnóstico de la diabetes esteroidea ya que, además de las dificultades para su realización, al realizarse en ayunas también infravalorará la hiperglucemia predominantemente vespertina. La HbA1c puede ser un método adecuado para el diagnóstico en los pacientes con diabetes esteroidea de más de 2 meses de evolución, pero no útil para todas aquellas situaciones en las que se ha iniciado el tratamiento con glucocorticoides en los días previos. En estos casos, el resultado será falsamente negativo ya que el valor de la HbA1c estima la glucemia media de los últimos 2 meses. Por tanto, el criterio más útil para el diagnóstico de la diabetes esteroidea en la mayoría de los pacientes es la presencia de glucemias >200mg/dl. La glucemia que ofrece mayor sensibilidad para diagnosticar la hiperglucemia inducida por corticoides, especialmente cuando se administran los de acción intermedia en monodosis matutina, es la glucemia postprandial de la comida. La glucemia preprandial de la cena ofrece menor sensibilidad pero es más fácil de estandarizar. Consideramos, por tanto, que en todo paciente en el que se indique tratamiento con glucocorticoides en dosis medias-altas, debería monitorizarse la glucemia postprandial de la comida y, en su defecto, la preprandial de la cena durante los 2-3 primeros días de tratamiento. En los pacientes con diabetes previa o con factores de riesgo de diabetes tipo 2, el cribado debe realizarse incluso cuando se indiquen glucocorticoides a dosis bajas.
De forma similar a lo que sucede para el diagnóstico, no disponemos de estudios para establecer los objetivos terapéuticos en los pacientes con diabetes esteroidea. En este contexto, parece razonable establecer como objetivos los propuestos para otras situaciones de hiperglucemia transitoria como la hiperglucemia en el paciente no crítico durante la hospitalización13,14,19. Desde el punto de vista práctico, consideramos que el tratamiento de la hiperglucemia inducida por corticoides debe plantearse cuando los valores de glucemia capilar preprandiales son mayores de 140mg/dl y las postprandiales >200mg/dl. En el caso de tratamientos crónicos con glucocorticoides a dosis más o menos estables, los objetivos de control y la necesidad de tratamiento farmacológico se basarán en los objetivos de control recomendados para la mayoría de pacientes con diabetes mellitus: glucemia preprandial <130mg/dl, postprandial <180mg/dl y HbA1c <7%14.
Tratamiento de la hiperglucemia inducida por glucocorticoidesEn la actualidad no disponemos de evidencia científica sobre qué fármacos hipoglucemiantes y qué pautas de administración son más eficaces a la hora de conseguir un adecuado control glucémico y una menor tasa de complicaciones en los pacientes con hiperglucemia inducida por glucocorticoides. Por lo tanto, las recomendaciones propuestas en esta revisión se basan en la fisiopatología del proceso, el mecanismo y perfil de acción de los diferentes fármacos hipoglucemiantes y la experiencia clínica. Para ello es importante evaluar, en primer lugar, el grado de intolerancia a la glucosa preexistente y el tratamiento de la misma, y la situación clínica del paciente y el grado de hiperglucemia que presenta. En segundo lugar, es imprescindible determinar el tipo, la dosis y la frecuencia de la administración del glucocorticoide. Finalmente, es necesario conocer el mecanismo de acción, la farmacocinética y la farmacodinamia de los distintos fármacos hipoglucemiantes disponibles. Otro aspecto relevante, al afrontar el tratamiento de la hiperglucemia inducida por glucocorticoides, es diferenciar si el tratamiento con glucocorticoides será transitorio y de corta duración o indefinido y de larga duración. Todo ello condicionará tanto los objetivos como la selección y la pauta de administración de las medidas hipoglucemiantes.
Hiperglucemia por glucocorticoides transitoriosRepresentan una gran proporción de las indicaciones de los tratamientos con glucocorticoides. Se caracterizan por dosis altas iniciales y reducción progresiva de las mismas, según la respuesta obtenida y la evolución del proceso para el que se indicó, hasta la supresión. Este tipo de pautas de glucocorticoides se caracterizan por hiperglucemias moderadas-severas iniciales con cambios bruscos de la glucemia, en respuesta a los cambios de la dosis de glucocorticoides, y su carácter transitorio al volver la glucemia al estado inicial después de suspender el tratamiento con glucocorticoides. Por tanto, las medidas hipoglucemiantes ideales para tratar estas situaciones tienen que ser potentes, con inicio de acción inmediato y sin límite de acción hipoglucemiante, para contrarrestar la hiperglucemia habitualmente importante y de instauración rápida como lo es la hiperglucemia desencadenada por los glucocorticoides. También es importante que sean titulables y con suficiente flexibilidad para adaptar el efecto hipoglucemiante al patrón de hiperglucemia y los cambios de dosis de glucocorticoides.
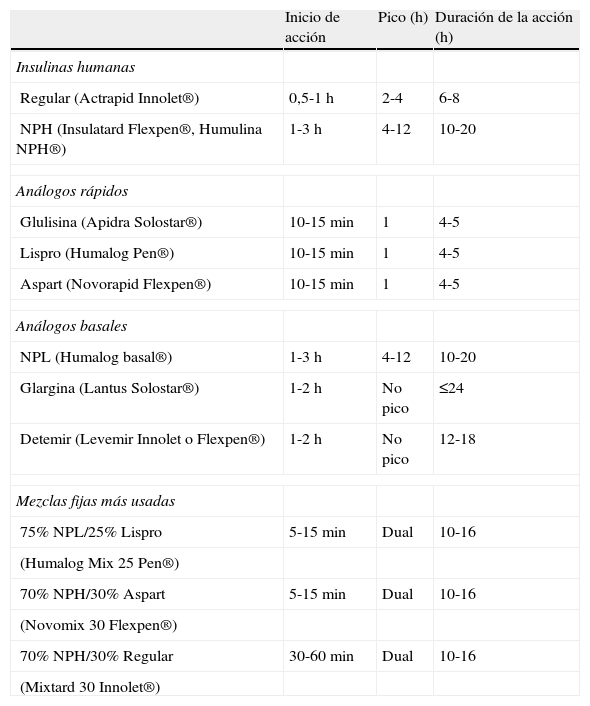
En general, la eficacia de los hipoglucemiantes orales en el tratamiento de la hiperglucemia inducida por glucocorticoides es limitada. Ello obedece tanto a la limitada potencia hipoglucemiante, que no permite corregir la hiperglucemia en muchas situaciones, como a la duración y al perfil hipoglucemiante a lo largo de las 24h. En general, el perfil de acción de los hipoglucemiantes orales a lo largo del día no suele coincidir con el patrón de hiperglucemia inducida por los glucocorticoides. Además, la mayoría de los hipoglucemiantes orales disponibles tienen un inicio de acción lento y/o una titulación muy limitada o nula, lo que les confiere escasa capacidad de adaptación a los importantes cambios en los requerimientos de acción hipoglucemiante que conllevan los cambios en las de dosis de glucocorticoides. También debemos tener en cuenta que muchas de las situaciones que requieren corticoides representan una contraindicación formal para la utilización de hipoglucemiantes orales. Por estos motivos, el uso de hipoglucemiantes orales quedará reservado para el tratamiento de hiperglucemias inducidas por glucocorticoides de carácter leve (glucemias <200mg/dl) en pacientes sin diabetes conocida o con diabetes conocida y adecuadamente controlada con medidas higiénico-dietéticas o hipoglucemiantes orales. En el resto de las situaciones, la insulina suele ser el tratamiento de elección por razones de eficacia y seguridad. Ofrece un inicio de acción inmediato, potencia hipoglucemiante ilimitada, fácil y rápida titulación de dosis, y los diferentes tipos de insulina disponibles (tabla 2) permiten confeccionar pautas de administración con efecto hipoglucemiante adecuado a los diferentes perfiles hiperglucemiantes inducidos por los glucocorticoides. Las pautas de manejo de la hiperglucemia inducida por corticoides que proponemos a continuación tienen en cuenta estos aspectos (fig. 1).
Características farmacocinéticas de los principales preparados de insulina
| Inicio de acción | Pico (h) | Duración de la acción (h) | |
| Insulinas humanas | |||
| Regular (Actrapid Innolet®) | 0,5-1 h | 2-4 | 6-8 |
| NPH (Insulatard Flexpen®, Humulina NPH®) | 1-3 h | 4-12 | 10-20 |
| Análogos rápidos | |||
| Glulisina (Apidra Solostar®) | 10-15 min | 1 | 4-5 |
| Lispro (Humalog Pen®) | 10-15 min | 1 | 4-5 |
| Aspart (Novorapid Flexpen®) | 10-15 min | 1 | 4-5 |
| Análogos basales | |||
| NPL (Humalog basal®) | 1-3 h | 4-12 | 10-20 |
| Glargina (Lantus Solostar®) | 1-2 h | No pico | ≤24 |
| Detemir (Levemir Innolet o Flexpen®) | 1-2 h | No pico | 12-18 |
| Mezclas fijas más usadas | |||
| 75% NPL/25% Lispro | 5-15 min | Dual | 10-16 |
| (Humalog Mix 25 Pen®) | |||
| 70% NPH/30% Aspart | 5-15 min | Dual | 10-16 |
| (Novomix 30 Flexpen®) | |||
| 70% NPH/30% Regular | 30-60 min | Dual | 10-16 |
| (Mixtard 30 Innolet®) | |||
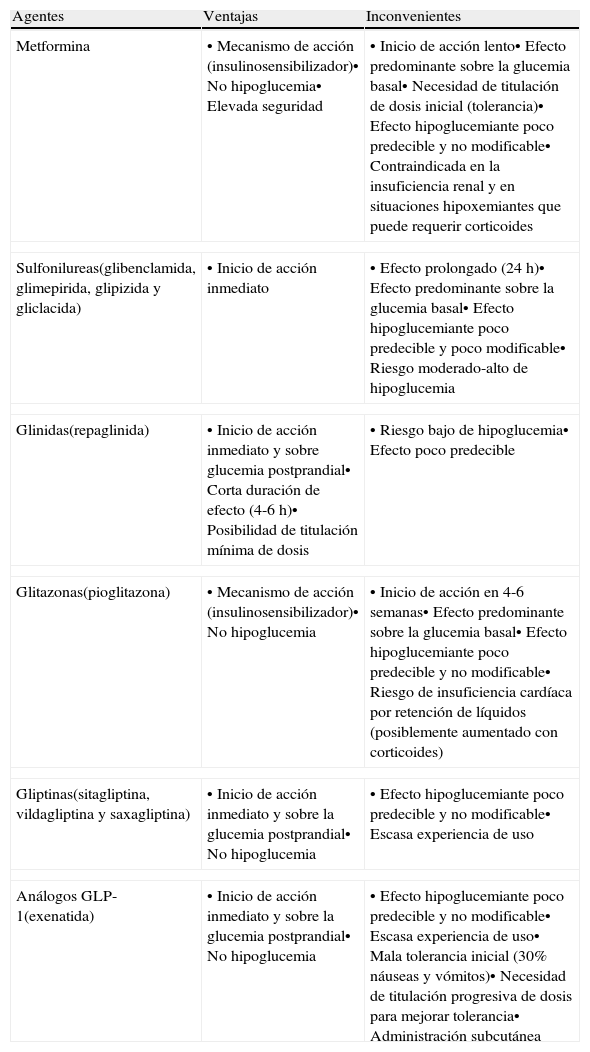
En los pacientes sin diabetes previa, cuando se administran glucocorticoides a dosis bajas y las glucemias preprandiales son <200mg/dl, se puede intentar el tratamiento con hipoglucemiantes orales. Al no disponer de estudios que comparen diferentes estrategias, la elección del hipoglucemiante oral dependerá del tipo y pauta de glucocorticoide iniciado y de las ventajas e inconvenientes potenciales de los hipoglucemiantes orales para el tratamiento de la hiperglucemia inducida por glucocorticoides (tabla 3).
Agentes hipoglucemiantes no insulínicos disponibles. Ventajas e inconvenientes en la hiperglucemia inducida por el tratamiento transitorio con glucocorticoides21
| Agentes | Ventajas | Inconvenientes |
| Metformina | • Mecanismo de acción (insulinosensibilizador)• No hipoglucemia• Elevada seguridad | • Inicio de acción lento• Efecto predominante sobre la glucemia basal• Necesidad de titulación de dosis inicial (tolerancia)• Efecto hipoglucemiante poco predecible y no modificable• Contraindicada en la insuficiencia renal y en situaciones hipoxemiantes que puede requerir corticoides |
| Sulfonilureas(glibenclamida, glimepirida, glipizida y gliclacida) | • Inicio de acción inmediato | • Efecto prolongado (24 h)• Efecto predominante sobre la glucemia basal• Efecto hipoglucemiante poco predecible y poco modificable• Riesgo moderado-alto de hipoglucemia |
| Glinidas(repaglinida) | • Inicio de acción inmediato y sobre glucemia postprandial• Corta duración de efecto (4-6 h)• Posibilidad de titulación mínima de dosis | • Riesgo bajo de hipoglucemia• Efecto poco predecible |
| Glitazonas(pioglitazona) | • Mecanismo de acción (insulinosensibilizador)• No hipoglucemia | • Inicio de acción en 4-6 semanas• Efecto predominante sobre la glucemia basal• Efecto hipoglucemiante poco predecible y no modificable• Riesgo de insuficiencia cardíaca por retención de líquidos (posiblemente aumentado con corticoides) |
| Gliptinas(sitagliptina, vildagliptina y saxagliptina) | • Inicio de acción inmediato y sobre la glucemia postprandial• No hipoglucemia | • Efecto hipoglucemiante poco predecible y no modificable• Escasa experiencia de uso |
| Análogos GLP-1(exenatida) | • Inicio de acción inmediato y sobre la glucemia postprandial• No hipoglucemia | • Efecto hipoglucemiante poco predecible y no modificable• Escasa experiencia de uso• Mala tolerancia inicial (30% náuseas y vómitos)• Necesidad de titulación progresiva de dosis para mejorar tolerancia• Administración subcutánea |
En los pacientes con glucocorticoides de acción intermedia en dosis matutina, los preparados con acción incretina y las glinidas son preferibles a las sulfonilureas por razones de seguridad, ya que el tratamiento con sulfonilureas conlleva un importante riesgo de hipoglucemia nocturna. Los fármacos con efecto incretina, sobre todo los inhibidores de la DPP-4 por su buena tolerancia y comodidad, son probablemente los de primera elección por su inicio de acción inmediato, efecto predominante sobre la glucemia postprandial y la ausencia de riesgo de hipoglucemia al ser su efecto hipoglucemiante glucosa-dependiente. Además, en una publicación reciente la perfusión intravenosa de exanetida previene la intolerancia a la glucosa inducida por altas dosis de prednisolona en sujetos sanos31. Las glinidas permiten una mínima titulación de dosis, tienen un inicio de acción inmediato y corta duración de efecto, lo que facilita la adaptación al perfil hiperglucemiante de los corticoides y reduce el riesgo de hipoglucemias en la madrugada, coincidiendo con la desaparición de la acción hiperglucemiante de los corticoides. El papel de la metformina y sobre todo de la pioglitazona en estas situaciones es muy limitado por su inicio de acción lento. Esta estrategia terapéutica también se puede aplicar en pacientes con diabetes tipo 2 bien controlada con medidas higiénico-dietéticas solas o con medidas higiénico-dietéticas e hipoglucemiantes orales. En estos casos se añadiría al tratamiento habitual el fármaco hipoglucemiante seleccionado, considerando aquellos con efecto sinérgico e indicación aceptada, durante el periodo de tratamiento con glucocorticoides.
En los casos que la hiperglucemia haya sido inducida por glucocorticoides de acción intermedia en 2 o más dosis diarias, preparados de larga duración como la dexametasona o por glucocorticoides intraarticulares, las sulfonilureas también podrían ser una opción terapéutica ya que, al mantenerse el efecto hiperglucemiante las 24h, el riesgo de hipoglucemia nocturna es menor. Sin embargo, el riesgo de hipoglucemia existe cuando se reducen las dosis y es muy elevado cuando se retira la dosis nocturna de glucocorticoides.
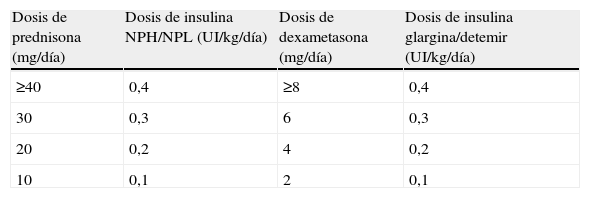
Pacientes con glucemias >200mg/dlÉsta será la situación con que nos encontraremos en la mayoría de ocasiones, tanto si se trata de una diabetes esteroidea como, sobre todo, si se trata de una descompensación hiperglucémica en pacientes con diabetes previa. En esta situación la insulina será el fármaco de elección. La dosis inicial o el incremento de la dosis de insulina la obtendremos a partir de dos variables que sabemos que aumentan la resistencia insulínica, como son el peso del paciente y la dosis de corticoides administrada20,21,32 (tabla 4). Posteriormente, la dosis de insulina se ajustará según las glucemias capilares, con incrementos/reducciones en torno al 20%. Los cambios en la dosificación de los glucocorticoides requieren ajustes paralelos y proporcionales de las dosis de insulina. En los pacientes ambulatorios es primordial instruir al paciente o familiares en el ajuste de la dosis de insulina según la glucemia y las modificaciones de la dosis de glucocorticoides. La elección del tipo y pauta de insulina vendrá determinado por la pauta hipoglucemiante previa del paciente y por el tipo y pauta de glucocorticoide instaurada (fig. 1, tabla 5).
Estimación de la dosis de inicio de insulina en situaciones de hiperglucemia inducida por glucocorticoides, según el preparado y la dosis de glucocorticoide21
| Dosis de prednisona (mg/día) | Dosis de insulina NPH/NPL (UI/kg/día) | Dosis de dexametasona (mg/día) | Dosis de insulina glargina/detemir (UI/kg/día) |
| ≥40 | 0,4 | ≥8 | 0,4 |
| 30 | 0,3 | 6 | 0,3 |
| 20 | 0,2 | 4 | 0,2 |
| 10 | 0,1 | 2 | 0,1 |
Adaptación del tratamiento en los pacientes tratados previamente con insulina, considerando la pauta de insulina habitual y la pauta de glucocorticoides
| Pauta de insulina habitual | 1 dosis matutina de glucocorticoide de acción intermedia | 2 dosis de glucocorticoide de acción intermedia | Glucocorticoides de acción prolongada/intraarticulares |
| Monodosis nocturna de insulina NPH/NPL/bifásica | Añadir el incremento de dosis estimado en 1 dosis de insulina NPH/NPL/bifásica predesayuno | Añadir el incremento de dosis estimado como insulina NPH/NPL/bifásica:• 2/3 predesayuno• 1/3 precena | Añadir el incremento de dosis estimado como insulina NPH/NPH/bifásica:• 2/3 predesayuno• 1/3 precena |
| Insulina basal (glargina/detemir) | Añadir el incremento de dosis estimado en 1 dosis de insulina NPH/NPL predesayuno | Añadir el incremento de dosis estimado como:• 2/3 insulina NPH/NPL predesayuno• 1/3 dosis insulina basal precena | Añadir el incremento de dosis estimado como insulina basal |
| 2 dosis de insulina (NPH/NPL/bifásicas) | Añadir el incremento de dosis estimado como insulina NPH/NPL/bifásica predesayuno | Añadir el incremento de dosis estimado como insulina NPH/NPL/bifásica:• 2/3 predesayuno• 1/3 precena | Añadir el incremento de dosis estimado como insulina NPH/NPL/bifásica:• 2/3 predesayuno• 1/3 precena |
| Pauta de insulina basal-bolus | Añadir el incremento de dosis estimado como bolus:• 20% desayuno• 40% almuerzo• 40% cena | Añadir el incremento de dosis estimado como:• 25% basal• 75% bolus (1/3 en cada comida) | Añadir el incremento de dosis estimado como:• 25% basal• 75% bolus (1/3 en cada comida) |
En los pacientes con glucocorticoides de acción intermedia en monodosis matutina y sin tratamiento previo con insulina, la dosis de insulina estimada se administrará en una única dosis de insulina NPH/NPL/bifásica (mezclas de insulinas de acción rápida e intermedia) antes del desayuno, manteniendo los hipoglucemiantes orales. Estos preparados de insulina son los de elección, ya que su perfil de acción hipoglucemiante (pico de acción a las 4-6h y duración del efecto de 12-15h) es el que mejor mimetiza el perfil de acción hiperglucemiante de los corticoides de acción intermedia20,21. El objetivo en la mayoría de pacientes será alcanzar y mantener glucemias precena <140mg/dl sin hipoglucemias prealmuerzo.
En los pacientes tratados con 2 o más dosis de glucocorticoides de acción intermedia, el total de la dosis de insulina estimada se repartirá como 2/3 antes del desayuno y 1/3 antes de la cena. Para la titulación de la dosis de la mañana se considerará la glucemia precena y para la titulación de la dosis de la noche la glucemia antes del desayuno. Las modificaciones de la dosis de glucocorticoide administrada por la mañana afectaran a la dosis de insulina antes del desayuno, y los cambios de la dosis de glucocorticoide de la noche a la insulina de antes de la cena.
Cuando se utilizan glucocorticoides de acción prolongada o intraarticulares, los análogos de insulina basal (glargina o detemir) serán el tratamiento hipoglucemiante de elección. Por la ausencia de pico de acción y la duración más prolongada, en comparación con las insulina intermedias, su perfil hipoglucemiante se adapta mejor al perfil de hiperglucemia de estos preparados de glucocorticoides y también se asocian con menor riesgo de hipoglucemia33,34. La dosis de insulina estimada se administrará en una dosis de insulina glargina o en 1 o 2 de insulina detemir. Para la titulación de la dosis debemos tener en cuenta la glucemia basal o la preprandial de la cena. En los pacientes con glucocorticoides administrados por vía intraarticular, la retirada de la insulina o la vuelta a las dosis previas se realizará 2-3 días después de la última infiltración.
En los pacientes tratados previamente con insulina, lo más práctico es modificar la pauta habitual. El incremento de la dosis habitual de insulina diaria se estimará considerando el peso corporal, el preparado y la dosis de glucocorticoide, como se indica en la tabla 4. El incremento de dosis calculado se sumará a la dosis total habitual del paciente, distribuyéndola en las distintas administraciones de insulina en función de la pauta de insulina habitual y la pauta de glucocorticoide, como se indica en la tabla 5.
Manejo de la hiperglucemia inducida por el tratamiento permanente con glucocorticoidesLa indicación del tratamiento con glucocorticoides de forma indefinida o por periodos muy prolongados es frecuente como tratamiento antiinflamatorio en procesos reumatológicos, renales y neurológicos, y como tratamiento inmunosupresor en los trasplantes de órganos. La pauta de administración más frecuente es la administración de glucocorticoides de acción intermedia en una sola dosis matutina, generalmente a dosis bajas y estables, y a menudo en asociación con otros fármacos inmunosupresores, que también afectan el metabolismo de los hidratos de carbono35,36. En este contexto, la hiperglucemia es menos prevalente, menos marcada y más estable. Estas características de la hiperglucemia junto a su carácter permanente o prolongado condicionan objetivos de control y un abordaje terapéutico distinto al planteado por los tratamientos con glucocorticoides transitorios. Los objetivos de control serán los recomendados para la mayoría de pacientes con diabetes mellitus: glucemia preprandial <130mg/dl, postprandial <180mg/dl y HbA1c <7%14. De forma similar a la establecida para la diabetes tipo 2, la introducción de las medidas terapéuticas deberá ser progresiva y aditiva. En la estrategia de selección de los fármacos hipoglucemiantes se deben priorizar aquellos con mecanismo de acción y perfil de acción más adecuado a la fisiopatología del proceso y el perfil de hiperglucemia, mientras que otras características como la rapidez de acción y la posibilidad de titular son menos relevantes que en la hiperglucemia transitoria por dosis altas de glucocorticoides. Por tanto, conjuntamente o después de las medidas higiénico-dietéticas, la metformina y, en caso de intolerancia o contraindicación, la pioglitazona son útiles y de primera elección en los tratamientos crónicos con dosis bajas de glucocorticoides de acción intermedia por la mañana. Las características consideradas para su selección incluyen su efecto insulinosensibilizador, que no aumentan el riesgo de hipoglucemia y, en el caso de la metformina, el bajo costo. En segunda línea, podemos indicar la pioglitazona, una sulfonilurea, una glinida, un inhibidor de la DPP4, exenatida o la insulinoterapia, valorando su perfil de acción, tolerancia, costos y el riesgo de hipoglucemia, especialmente durante la noche. A diferencia de la mayoría de pacientes con diabetes tipo 2, la pauta inicial de insulina suele ser la monodosis de insulina NPH/NPL antes del desayuno, manteniendo los insulinosensibilizadores y suspendiendo el resto de fármacos hipoglucemiantes orales. El tratamiento con insulina suele ser ineludible cuando la hiperglucemia es el resultado de los efectos combinados de la insulinorresistencia provocada por los glucocorticoides y la inhibición en la biosíntesis y liberación de la insulina35,36 inducida por inmunosupresores como la ciclosporina y el tacrolimus.
ConclusiónLa hiperglucemia inducida por glucocorticoides es un problema frecuente en la práctica clínica habitual, potencialmente perjudicial para los pacientes que lo padecen y que afecta a casi todas las especialidades. Sin embargo, es un área de la medicina sorprendentemente infravalorada por la mayoría de profesionales, tanto por lo que refiere al diagnóstico como, sobre todo, al tratamiento. De ello da idea la escasa bibliografía disponible y la ausencia de evidencia científica sobre las repercusiones clínicas de la diabetes esteroidea y las estrategias para el diagnóstico y tratamiento.
En espera de estudios de calidad que permitan establecer recomendaciones para el diagnóstico y tratamiento adecuados de la diabetes esteroidea, consideramos que la mejor estrategia es la que considera la fisiopatología del proceso, el conocimiento de los agentes hipoglucemiantes de que disponemos y la experiencia clínica. En todos los pacientes tratados con dosis medias-altas de glucocorticoides debería realizarse el cribado de la diabetes esteroidea y establecer pautas de tratamiento, esencialmente con insulina, que tengan en cuenta el grado y el patrón de hiperglucemia, así como el tipo, la dosis y la pauta de glucocorticoides utilizados. Posteriormente, el tratamiento hipoglucemiante debe ajustarse según las glucemias capilares, y de forma paralela y proporcional a los cambios de las dosis de glucocorticoides. En los pacientes ambulatorios es primordial instruir al paciente o familiares para que realicen estos ajustes.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses en relación al contenido del presente artículo.