El denosumab es un anticuerpo monoclonal IgG2 anti RANKL que impide el acoplamiento del RANKL con su receptor RANK, responsable de la activación del factor nuclear NF-κB en las células de estirpe osteoclástica. Como consecuencia se reduce la formación, la actividad y la supervivencia de los osteoclastos, inhibiendo la resorción ósea. La acción del denosumab en el remodelado óseo es rápida, sostenida y reversible. La dosis recomendada es de 60mg por vía subcutánea cada 6 meses. La reducción del riesgo relativo de nuevas fracturas vertebrales es del 68% (2,3 vs 7,2%, p<0,0001), del 20% (6,5 vs 8,0%) en las fracturas no vertebrales y del 40% (0,7 vs 1,2%) en las de cadera. A los 36 meses la densidad mineral ósea lumbar aumentó un 9,2%, y un 6,2% en la cadera total, en comparación con el placebo. Es un fármaco seguro, con un aumento de efectos cutaneos no graves. La frecuencia y la vía de administración suponen una posible acción en el cumplimiento del tratamiento.
Denosumab is a human monoclonal antibody IgG2 against RANKL that prevents the coupling of the RANKL with its receptor RANK on osteoclast and osteoclast precursors, which is essential for the formation, activity and survival of osteoclasts, disabling the bone resorption. The action of the Denosumab on bone remodeling is rapid, sustained and reversible. The recommended dose is of 60mg for subcutaneous route every 6 months. The reduction of the relative risk of new vertebral fractures is of 68% (2.3% vs 7.2%, p<0.0001), 20% (6.5% vs 8.0%) in non vertebral fractures and 40% (0.7% vs 1.2%) in the case of the of hip. At 36 months the lumbar bone mineral density increased 9.2% and 6.2% in the total hip, in comparison with the placebo. It is a safe drug with a low incident of cutaneous effects. The frequency and route of administration can be useful to improve the compliance of the osteoporosis treatment.
La osteoporosis es una enfermedad caracterizada por un aumento en la fragilidad y un mayor riesgo de fracturas1. Constituye un gran problema de salud por su magnitud y consecuencias. El 20% de los pacientes que presentan una fractura de cadera o vertebral fallecen en el transcurso de uno y cinco años, respectivamente, y solo el 30% de los pacientes que sufren una fractura de cadera serán independientes en su actividad física. En Europa se producen en un año 400.000 fracturas de cadera, 810.000 fracturas vertebrales y 330.000 de radio distal, con un coste global de 31 billones de euros, que en su mayoría corresponden a las fracturas de cadera que implican en todos los casos un ingreso hospitalario y la consiguiente cirugía2,3. En España se estima que la prevalencia de fracturas vertebrales osteoporóticas es del 24,6%, cifra que casi se duplica a partir de los 65 años4,5, y la incidencia de fractura de cadera oscila entre 5,17 y 6,94 por cada 1.000 habitantes y año, lo que significa que en nuestro país se producen un total de 63.000 fracturas de cadera en un año, lo que representa una sexta parte de todas las que se producen en Europa6,7.
El aumento progresivo de la incidencia de osteoporosis, paralelo al crecimiento y al envejecimiento demográfico, es una realidad mundial que hace necesario poner una especial atención en su prevención y en el tratamiento.
Actualmente disponemos de fármacos eficaces en prevenir la pérdida de densidad mineral ósea (DMO) y en la reducción de fracturas en los pacientes con osteoporosis, clasificados según su mecanismo de acción en:
- •
Anticatabólicos: estrógenos, calcitonina, bifosfonatos, SERMS.
- •
Anabólicos: PTH1-34, PTH 1-84.
- •
De acción dual: ranelato de estroncio8–18.
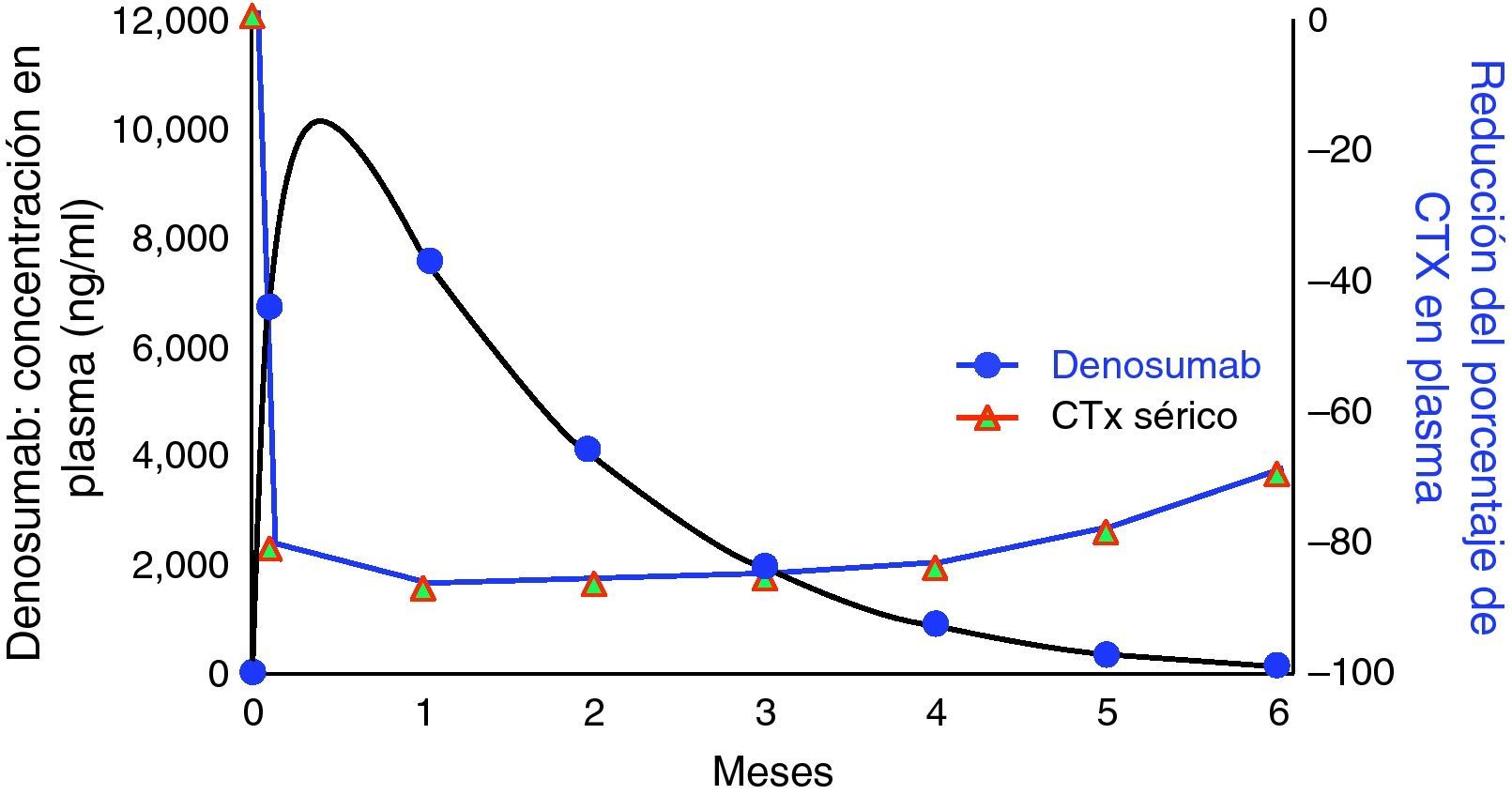
En un estudio en fase i realizado en mujeres posmenopáusicas sanas y utilizando el NTX (telopéptido amino terminal del colágeno de tipo i) urinario como marcador de resorción, se observó que la administración única de diferentes dosis de denosumab por vía subcutánea (s.c.) (0,01-3,0mg/kg) producía una reducción del marcador de forma dosis-dependiente a las 12h de su administración, y a los 3 meses la reducción alcanzaba el 84% con respecto al inicio; este efecto se mantiene durante un total de 6 meses, experimentando al final de este periodo la reversibilidad de su acción. En otro estudio en fase ii utilizando una dosis de 60mg se observó que a los 6 meses la concentración plasmática de denosumab se había reducido al 95% y el nivel del turnover óseo se fue recuperando (fig. 1). En este estudio se observa que la farmacocinética del denosumab no es lineal. Se observaron 3 fases:
- •
Una absorción prolongada a los 5-21 días tras su administración.
- •
Una vida media prolongada, de hasta 32 días.
- •
Una fase terminal rápida cuando la concentración es inferior a 1.000 ng/ml.
El mecanismo de absorción, biodisponibilidad y distribución no está bien definido, y se especula el mismo que otros anticuerpos monoclonales administrados por vía s.c.: una absorción por vía linfática, drenaje al sistema sanguíneo y biodisponibilidad entre el 50–100%. El aclaramiento se efectúa probablemente por el sistema reticuloendotelial, y no parece que sea excretado por el riñón24.
Estudios clínicosFase IICon el objetivo de valorar los cambios de DMO y la seguridad con distintas dosis de denosumab se diseñó un estudio aleatorizado, controlado y doble ciego de un año de duración y realizado en 412 posmenopáusicas con DMO baja (T=–1,8 a –4,0 DE). Se establecieron 9 grupos que recibieron durante 12 meses denosumab s.c.: cada 3 meses (dosis de 6, 14 y 30mg), cada 6 meses (dosis de 14, 60, 100 y 210mg), tratamiento no enmascarado con alendronato semanal (a dosis de 70mg) o placebo. A los 12 meses se observaron incrementos de la DMO lumbar (3,0-6,7%), cadera (1,9-3,6%) y tercio distal del radio (0,4-1,3%); los cambios del denosumab 30mg cada 3 meses fueron similares a la pauta de 60mg cada 6 meses. El grupo tratado con alendronato aumentó la DMO lumbar (4,6%) y de la cadera (2,1%), con disminución en el radio distal (–0,5%). Los marcadores del remodelado experimentaron un descenso rápido y dosis-dependiente que se mantuvo durante los 12 meses25. La prolongación del estudio a 2 años constató un progresivo aumento de la DMO, y durante este segundo año de tratamiento el denosumab mantuvo una reducción de los marcadores del turnover, del mismo modo que en el primer año26.
Posteriormente, Miller et al27, en una prolongación (24 meses) del estudio anterior, establecieron un diseño para valorar el efecto de discontinuar y reiniciar el tratamiento. Las mujeres que siguieron el tratamiento con denosumab (60mg cada 6 meses) continuaron incrementando la DMO y manteniendo bajos los marcadores del remodelado. El grupo que dejó el tratamiento durante 1 año experimentó un descenso de la DMO, que recuperó al reiniciar el mismo. Los autores remarcan la rápida acción del denosumab en la reducción de los marcadores de resorción ósea y en el incremento de la DMO, así como la eficacia a largo plazo y la reversibilidad de su acción.
Fase IIIComentaremos cuatro estudios en fase III que valoran la eficacia del denosumab.
- •
FREEDOM28. Es el estudio principal, en el que el objetivo primario fue valorar la eficacia del denosumab en comparación con el placebo en la reducción de las fracturas vertebrales en la osteoporosis posmenopáusica.
- •
DEFEND29. Estudio realizado en mujeres osteopénicas, con el objetivo de valorar la eficacia en la prevención de la pérdida de DMO.
- •
DECIDE30. Estudio comparativo con el alendronato para valorar la eficacia en la DMO en el cuello femoral total.
- •
STAND31. Para valorar la sustitución del alendronato por denosumab en la DMO de cadera total.
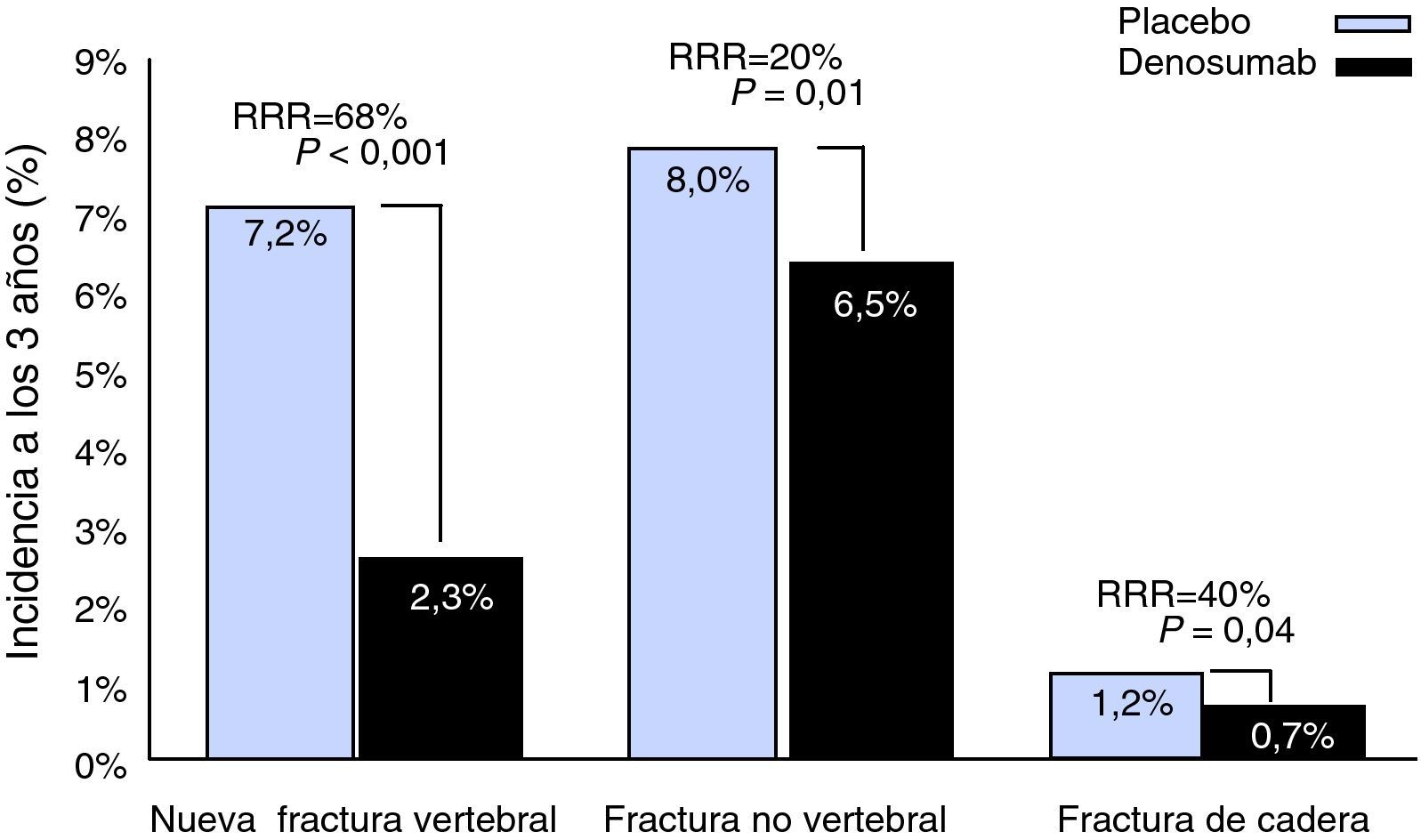
Estudio aleatorizado, controlado con placebo y a doble ciego, realizado en 7.868 mujeres (media de 72,3 años) con osteoporosis posmenopáusica (DXA [absorciometría de rayos X de energía dual] T –2,5 a –4,0 DE); el 23% presentaba al menos una fractura vertebral. El objetivo principal fue valorar la eficacia de 60mg de denosumab s.c. cada 6 meses en la reducción de las fracturas vertebrales a los 36 meses. Los objetivos secundarios incluyeron el tiempo en que se produce la primera fractura no vertebral y de cadera. La reducción del riesgo relativo de nuevas fracturas vertebrales fue del 68% (2,3 vs 7,2%, p<0,0001), del 20% (6,5 vs 8,0%) en las fracturas no vertebrales y del 40% (0,7 vs 1,2%) en las de cadera. A los 36 meses la DMO lumbar aumentó un 9,2%, y un 6,2% en la cadera total, en comparación con el placebo (fig. 2). Los niveles séricos del telopéptido-C se redujeron un 86% con respecto al placebo en el primer mes del tratamiento y un 72% a los 6 meses antes de iniciar la segunda dosis28.
DEFEND (DEnosumab FortifiEs boNe Density)Estudio en fase iii realizado en mujeres posmenopáusicas (n=332), edad media de 59,4 años y con osteopenia (T –1,0 a –2,5 DE). El objetivo principal fue observar los cambios porcentuales de DMO lumbar a los 2 años de tratamiento con denosumab 60mg s.c. o placebo. El grupo con tratamiento activo experimentó un aumento del 6,5%, mientras que el grupo placebo disminuyó en un 0,6%. Los efectos adversos fueron comparables en ambos grupos del estudio29.
DECIDE (Determining Efficacy: Comparison of Initiating Denosumab vs. AlEndronate)Estudio de no inferioridad que compara el denosumab 60mg s.c. con el alendronato semanal 70mg por vía oral. El diseño fue a doble ciego, estableciéndose dos grupos placebo, uno con falso alendronato y el otro con placebo inyectable s.c. La población del estudio estaba integrada por 1.189 mujeres posmenopáusicas, con una edad media de 64 años y una DMO de ≤2,0 DE. Los cambios en la DMO en la cadera total, objetivo principal, a los 12 meses fueron de 3,5 y 2,6% para el denosumab y el alendronato, respectivamente, diferencia que fue significativa (p<0,0001). En el cuello femoral, en el trocánter y en el antebrazo las diferencias fueron en el mismo sentido. El tratamiento con denosumab redujo más los marcadores de formación y de resorción ósea30.
STAND (Study of transitioning from Alendronate to Denosumab)Estudio controlado y a doble ciego de fase III para valorar el efecto del denosumab 60mg s.c./6 meses en la DMO del fémur total, en mujeres posmenopáusicas previamente tratadas con alendronato 70mg por vía oral semanal y comparar los resultados con las que siguieron con alendronato los 12 meses del estudio. Un total de 504 mujeres (edad media de 68 años y DMO (–2,0 a –4 DE) tratadas con alendronato (44±33 meses). A los 12 meses el grupo tratado con denosumab presentó un aumento de la DMO en el fémur total, significativamente superior a las que siguieron tratamiento con alendronato (1,90 vs 1,05%, p <0.0001)31.
SeguridadLa potencial interferencia en el sistema inmunitario de las terapias con anticuerpos monoclonales que actúan sobre moléculas diana integrantes de un proceso fisiopatológico ha requerido una especial atención en los posibles efectos en las infecciones y procesos neoplásicos. La acción del denosumab inhibiendo la acción del RANKL, que se expresa también en las células inmunitarias, ha determinado una especial atención de estos potenciales efectos secundarios. En el estudio de fase i no se encontraron efectos secundarios más incidentes que en el placebo: tan solo dos sujetos presentaron una leve reacción local cutánea en el punto de la punción. No hubo diferencias en cuanto a las infecciones ni en los parámetros biológicos de inmunidad22. En el estudio en fase ii de Miller et al27, con una duración de 4 años, no hubo diferencias en cuanto a los procesos neoplásicos ni con las infecciones con respecto al placebo (38 vs 33%); todas ellas fueron de tipo común, aunque 4 pacientes del grupo del denosumab requirieron hospitalización. En los parámetros bioquímicos se observó un discreto y transitorio descenso del calcio ajustado por la albúmina y aumento de la PTHi. No se encontraron anticuerpos contra la molécula de denosumab.
En el estudio principal FREEDOM, con el más alto número de pacientes, tampoco hubo diferencias en la incidencia de neoplasias (3,7 vs 3,2%), ni de infecciones, ni de acontecimientos graves. No apareció ningún caso de fracturas atípicas del fémur ni osteonecrosis de mandíbula. Hubo un aumento de reacción eccematosa (3,0 vs 1,7%) y de celulitis (0,3 vs 0,1)28.
Los otros tres estudios en fase iii son congruentes con estos resultados. La incidencia de rash y odinofagia reportada en el estudio DEFEND fue más frecuente en los pacientes en tratamiento con denosumab (8,5 y 9,1% vs 4,9 y 3,0%)29,30.
Estudios de calidad óseaEn un estudio realizado con tomografía cuantitativa computarizada (QTC) en pacientes tratadas con denosumab, la medición en el radio ultradistal mostró, con respecto al alendronato y el placebo, un aumento superior de la DMO, del contenido mineral óseo (CMO), del índice de torsión medido con el momento de inercia polar (PMI), así como del espesor de la cortical, lo que se propone como posible mecanismo del denosumab en la reducción del riesgo de fracturas32.
En el estudio histomorfométrico realizado con biopsias de cresta ilíaca apareadas en las pacientes del estudio FREEDOM (37 placebo y 31 denosumab a los 24 meses, y 25 placebo y 22 denosumab a los 36 meses), se observó en las mujeres tratadas con denosumab un descenso de los parámetros de resorción y formación ósea superiores al placebo, sin efectos deletéreos en la mineralización ni el depósito del hueso lamelar33.
Denosumab en la artritis reumatoideEl daño estructural articular y la osteoporosis generalizada están relacionados con un desacoplamiento del remodelado óseo, con aumento de la actividad osteoclástica y disminución de la formación ósea. Los pacientes con artritis reumatoide presentan valores altos de RANKL, y la acción del denosumab estaría indicada en contrarrestar esta osteopatía. Cohen et al34 realizaron un estudio multicéntrico en fase II para valorar la acción del denosumab en el daño estructural de las manos —con la DMO lumbar y de cadera como objetivos secundarios— en 227 pacientes con artritis reumatoide tratados con metotrexato. Se establecieron 3 grupos: control, denosumab 60mg y denosumab 180mg. Cada 6 meses, durante 1 año, se realizó una RM en las manos según el índice modificado de Sharp. A los 12 meses se observaron de una manera significativa menos erosiones en las pacientes tratadas con las dos dosis de denosumab que en el grupo placebo únicamente tratado con metotrexato. La DMO se incrementó en los grupos de denosumab, observándose descensos en la cadera en el grupo control.
Preferencia y satisfacciónEn un estudio comparativo para evaluar la adherencia, la preferencia y el grado de satisfacción del tratamiento con denosumab 60mg s.c. cada 6 meses durante un año con el alendronato 70mg semanal, la adherencia al tratamiento fue significativamente mayor con la administración s.c. del denosumab. Las pacientes mostraron más satisfacción con la frecuencia y la vía de administración del fármaco35.
ConclusionesEl denosumab, el primer anticuerpo monoclonal utilizado como antirresortivo, es una alternativa innovadora en el tratamiento de la osteoporosis. Presenta una acción rápida, sostenida y reversible que lo diferencia de los bifosfonatos, y su perfil de seguridad es comparable al placebo. Presenta una eficacia que abarca las fracturas vertebrales, de cadera y no vertebrales. La acción en la DMO y en el remodelado óseo es superior al alendronato. La reversibilidad de su acción y la frecuencia y vía de administración lo posicionan como un fármaco de primera línea en el tratamiento de la osteoporosis posmenopáusica.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.