La tuberculosis (TB) es una de las enfermedades infecciosas con mayor número de casos, sobre todo en países de baja renta. A pesar de tener un tratamiento eficaz, su control es difícil debido a las características de la bacteria y al mecanismo de transmisión de la enfermedad. El diagnóstico microbiológico establece la etiología y la confirmación de la enfermedad. Se basa en la microscopia con tinciones específicas, el cultivo de micobacterias, sobre todo en medios líquidos, y la amplificación génica cuando el grado de sospecha es moderado-alto. Es necesario identificar siempre los cultivos positivos, debido a que en los últimos años se observa un aumento de micobacterias no tuberculosas con tratamiento distinto a la TB. El tratamiento de los casos resistentes es complejo y con pocos fármacos alternativos. Por ello debe hacerse antibiograma sistemático de todos los pacientes con aislamientos positivos. Las pruebas de detección de mutaciones de resistencia adelantan la información de la resistencia de 3-4semanas a 2-3días. Están indicadas cuando se sospeche resistencia en pacientes previamente tratados, contactos de resistentes, fracasos clínicos, recidivas y originarios de países de alta prevalencia de TB.
Se necesitan nuevas pruebas diagnósticas que incidan en las limitaciones de las actuales, como son la sensibilidad y la lentitud en crecer de Mycobacterium tuberculosis.
Tuberculosis (TB) is one of the infectious diseases with a larger number of cases, especially in low-income countries. Despite having an effective treatment, its control is difficult due to the characteristics of the bacterium and the transmission mechanism of the disease. The microbiological diagnosis establishes the etiology and confirms the disease. It is based on specific staining microscopy, mycobacterial culture, especially liquid media, and gene amplification, when the suspicion is moderate to high. It is always necessary to identify positive cultures, since in the recent years an increase in non-tuberculous Mycobacteria (NMT), with different TB treatment, has been observed. The treatment of resistant cases is complicated and also limited due to the lack of alternative drugs. Therefore, systematic susceptibility testing should be performed on all patients with positive isolates. The screening of the mutations associated with resistance provides information in 2-3days instead of 3-4weeks. It is indicated in previously treated patients, contacts with resistant cases, in clinical failures or recurrences, and in patients originating from countries with a high incidence of TB.
New diagnostic tests are needed to improve the current limitations of these tests, such as the sensitivity and slow growth rate of Mycobacterium tuberculosis.
La tuberculosis (TB) es una de las enfermedades infecciosas con mayor número de casos responsabilidad de un único agente. Junto con la malaria y la infección por el VIH, está considerada una prioridad por la OMS. En 2012 se comunicaron 8,6millones de casos nuevos en el mundo, con 1,2millones de muertos, más del 95% en países de baja renta1. La transmisión aérea, la instauración progresiva de la clínica y la capacidad latente del bacilo de Koch son algunas de las causas que explican su difícil control. Factores como el VIH y la resistencia a los fármacos agravan la clínica y complican su manejo. Durante la década de 1980 hubo un aumento en la incidencia de casos debidos a la inmunodepresión por el VIH, llegando a ser VIH+ el 25-50% de los pacientes con TB. La introducción de los tratamientos antirretrovirales de alta eficacia disminuyó esta influencia y en 2012 se comunicó VIH+ en el 12,7% de los pacientes1.
La OMS y los programas nacionales de control recomiendan un tratamiento basado en la administración de 3 o 4fármacos durante 6meses, con curación teórica superior al 95%. Sin embargo, la aparición de resistencia a uno o más fármacos requiere modificaciones terapéuticas complejas por el escaso número de antibióticos alternativos, y conlleva mayor duración del tratamiento, más efectos adversos y menos garantías de curación. A pesar de que hace más de 50años que existen tratamientos eficaces, en 2012 se comunicaron 450.000casos de TB multirresistente (MDRTB), de los que el 9% fueron de resistencia extrema (XDRTB)1.
La distribución de casos de TB no es homogénea en todo el mundo, con incidencia mayor en los países de baja renta, indirectamente proporcional al desarrollo económico. Por este motivo, más del 80% de los casos se concentran en 20países, como China, India, Pakistán, la Federación Rusa y Sudáfrica, entre otros. En Estados Unidos y Europa Occidental la mayoría corresponden a pacientes inmigrantes de lugares con elevada incidencia. La incidencia en España durante 20122 ha sido de 13,10/100.000 habitantes, el 8,8% coinfectados por el VIH.
La TB se transmite por vía aérea y la fuente son pacientes con TB pulmonar. Tras la exposición y contagio ocurre una respuesta local de la inmunidad celular, que resulta en la formación de granulomas, en cuyo interior un número limitado de bacterias se mantienen latentes, en más del 90% de casos de forma indefinida. Esta situación se conoce como infección tuberculosa o tuberculosis latente (TBL). El 10% de estas personas desarrollaran la enfermedad tuberculosa en algún momento de su vida, la mitad durante los primeros 18meses, siendo en el resto impredecible. Existen 2billones de personas con TBL. El diagnóstico precoz y el control del tratamiento son 2 de los factores más importantes para disminuir la incidencia de TB.
El agente causalMycobacterium tuberculosis fue descubierto por Robert Koch en 1882. Pertenece al género Mycobacterium, que agrupa a más de 120especies, la mayoría de ellas ambientales y no patógenas, y a las que se conoce como micobacterias no tuberculosas (MNT). M.tuberculosis está integrado en el complejo M.tuberculosis (MTC), con otras 5 especies: M.bovis, M.africanum, M.caprae, M.microti y M.canetti3. M. tuberculosis es, con mucho, la más frecuente. M.bovis BCG es una variedad de M.bovis que en 1921 dio lugar a la vacuna BCG (bacilo de Calmette y Guerin), aún utilizada en algunos países. M.tuberculosis es un bacilo grampositivo, aerobio, con preferencia por tejidos bien oxigenados. Es un patógeno intracelular obligado y desencadena respuesta de la inmunidad celular. Aunque también afecta a animales domésticos o salvajes, los humanos son el hospedador preferente. Se divide lentamente, cada 18-20h, en comparación a los 20min de la mayoría de bacterias. La pared celular es rica en lípidos, con una capa característica de ácidos micólicos, que le confiere ácido-alcohol resistencia en las tinciones. Las 2 últimas propiedades, junto con la capacidad de entrar en metabolismo latente cuando se ve agredida, le confieren una especificidad que explica la clínica y la respuesta a las pruebas diagnósticas y al tratamiento. En la práctica diagnóstica, los integrantes de MTC son difícilmente diferenciables entre sí por características fenotípicas, por lo que se identifican como MTC sin diferenciar, aunque en más del 95% se trata de M.tuberculosis.
En 1998 se secuenció el genoma completo de M.tuberculosis, dando inicio a numerosas investigaciones. Entre otras cosas, han evidenciado la diversidad genética de M.tuberculosis4, con 6linajes, predominando cada uno de ellos en distintos lugares del mundo. Esta diversidad se traduciría también en características fenotípicas, con repercusiones clínicas y diagnósticas. Se han observado diferencias entre linajes en el tropismo por localizaciones y en la virulencia. Las cepas de las familias genéticas Beijin y W, predominantes en Asia, se asocian a mayor transmisión y virulencia.
Obtención de las muestrasLas muestras deben ser representativas de la localización. En las formas pulmonares son las secreciones respiratorias. La más habitual es el esputo. Para obtener el máximo rendimiento ha de ser de buena calidad. Los pacientes deben ser instruidos en la producción de secreciones profundas, con predominio de neutrófilos y sin saliva. En pacientes que no expectoran, el aspirado gástrico o el esputo inducido pueden ser alternativas, como sucede en menores de 12años. Las muestras por broncoscopio están indicadas cuando las anteriores no son posibles o cuando está indicado diagnosticar otras causas infecciosas. Un volumen de 3-10ml es adecuado para la mayoría de muestras respiratorias. Para el jugo gástrico puede bastar con 3-5ml. Debe procesarse con rapidez o neutralizar el pH ácido para evitar dañar a las micobacterias. En nuestra área geográfica la TB extrarrespiratoria supone alrededor del 15-20%2. Las localizaciones más frecuentes son la pleural y la ganglionar. En las adenitis, la muestra adecuada es la punción con aguja fina (PAAF) si fluctúan y son superficiales, o la biopsia. En la pleuritis tuberculosa la muestra más rentable es la biopsia, aunque la más usual es el líquido obtenido por toracocentesis. Entre 5 y 10ml serán suficientes. Idéntico volumen es adecuado para la ascitis tuberculosa. En otras serositis tuberculosas, como meningitis o artritis, en que el volumen de líquido difícilmente puede alcanzar 5-10ml, un mínimo de 1ml es necesario. Cuando los volúmenes son insuficientes es preferible obviar la microscopia. Aproximadamente el 10% de las TB extrapulmonares son esqueléticas, y de estas, el 50% en la columna vertebral5,6. El dolor es el síntoma más común (80% de los casos). El diagnóstico y tratamiento precoz son esenciales para el buen pronóstico funcional. La muestra adecuada puede obtenerse por biopsia o drenaje, a través de punción guiada por TAC o cirugía. Si las muestras son óptimas el rendimiento de punción o biopsia son equivalentes7,8. El hallazgo en la histología de inflamación granulomatosa con necrosis caseosa se considera diagnóstico y suficiente para iniciar el tratamiento5, aunque la confirmación microbiológica es el diagnóstico definitivo y permite, además, comprobar la sensibilidad a los fármacos. Una revisión reciente6 indica sensibilidad del 59,3% para el cultivo y del 45,2% para la baciloscopia, así como el hallazgo de cepas resistentes en el 58% de los pacientes, que estaría relacionado con la procedencia de los estudios analizados, en mayor proporción de países con elevada incidencia de TB y de resistencia. El cultivo de sangre es poco útil en pacientes no inmunodeprimidos, ya que el MTC es poco bacteriémico. Si se procesa, son suficientes 5-10ml de sangre total con heparina. No se realiza la microscopia, ya que los hematíes no permiten diferenciar bien los colorantes y la sensibilidad es muy baja. Las muestras de heces pueden ser útiles en formas diseminadas, aunque es frecuente que el cultivo se contamine con la elevada cantidad de flora intestinal. Las muestras deben obtenerse en recipientes estériles, adecuados al volumen y sin aditivos. Muestras sólidas como biopsias y tejidos deben mantenerse húmedas con agua destilada estéril. Es importante evitar introducir las muestras en formol, que inactiva totalmente la viabilidad de los microorganismos. Por este motivo es aconsejable usar recipientes separados para las muestras destinadas a estudio microbiológico y anatomopatológico. También es de suma importancia que el volumen sea adecuado, sobre todo en las muestras obtenidas de forma traumática y difícilmente repetibles. Un diagnóstico diferencial adecuado priorizará las pruebas. Atomizar las muestras para alcanzar más pruebas únicamente consigue disminuir la sensibilidad del diagnóstico real. Las muestras conservadas en parafina pueden ser utilizadas para amplificación génica, después de ser desparafinadas; la sensibilidad es menor que en las muestras frescas, por lo que deben usarse como último recurso.
Métodos diagnósticos establecidosEl diagnóstico de la TB se establece a partir de signos y síntomas clínicos de sospecha, pruebas de imagen y confirmación microbiológica. El diagnóstico microbiológico se basa en la utilización de la microscopia y el cultivo. En los últimos años se han incorporado técnicas de amplificación genética. Ningún método consigue el 100% de diagnósticos, por lo que el 10-15% de casos de TB pulmonar y hasta el 50% en algunas formas de TB extrapulmonar no tendrán confirmación microbiológica y se apoyarán en la clínica y en la respuesta al tratamiento. Aunque su sensibilidad no alcance el 100%, el cultivo se considera la prueba de referencia.
MicroscopiaEs la demostración de MTC por técnicas de tinción específica. La composición lipídica de la pared micobacteriana le permite retener los colorantes de tinción, resistiendo la acción de decolorantes como la combinación de un ácido (sulfúrico o nítrico) con alcohol. La ácido-alcohol resistencia diferencia específicamente a las micobacterias (bacilos ácido-alcohol resistentes [BAAR]) del resto de bacterias. La tinción más utilizada es la descrita por Zhiel y Neelsen, que tiñe las micobacterias de rojo sobre fondo azul, en contraposición a las demás bacterias, que se tiñen de azul. En los países de alta renta se usan ampliamente las tinciones basadas en colorantes fluorescentes, en que las micobacterias son luminosas sobre fondo oscuro. La más conocida es la tinción de auramina-rodamina. La sensibilidad de las tinciones fluorescentes es un 10% superior. Requieren mayor experiencia del observador y disponer de microscopio de fluorescencia. Recientemente se han diseñado microscopios basados en tecnología light-emitting diode (LED), más económicos y con menor mantenimiento, que permiten su instauración en países de baja renta.
La microscopia o baciloscopia es la prueba más rápida, posible en menos de 2h, y la más económica. En muchos países de baja renta es la única prueba diagnóstica. Su principal limitación es la sensibilidad. Requiere en la muestra 5.000-10.000bacterias/ml para ser positiva9. La sensibilidad está relacionada con la carga bacteriana en las lesiones. El retraso diagnóstico y la evolución de la enfermedad influyen sobre la carga bacteriana. Por este motivo, la sensibilidad de la tinción en países de incidencia elevada es mayor. En nuestro entorno, la sensibilidad en la TB pulmonar está alrededor del 55-60%. En la TB extrapulmonar varía según la localización. En formas ganglionares es similar a la TB pulmonar, siendo inferior al 15% en líquidos biológicos, como líquido pleural, articular, ascítico, peritoneal o LCR. En pacientes con TB e infección por VIH con inmunodepresión severa el rendimiento de la microscopia es menor.
La especificidad de la tinción es muy elevada si el observador tiene experiencia, ya que aunque algunas especies pueden ser parcialmente ácido-alcohol resistentes, como Nocardia o Rhodococcus, su incidencia es baja y no plantean dificultades de diagnóstico diferencial.
El resultado de la tinción se expresa en una escala de 0 a 4cruces, una aproximación semicuantitativa a la carga bacteriana. En la TB pulmonar la intensidad de la baciloscopia tiene un triple uso: diagnóstico y extensión de la TB, monitorización de la respuesta al tratamiento e indicador de contagiosidad del paciente. Dependiendo de la intensidad de la positividad al inicio del tratamiento, la negativización será más o menos rápida, generalmente durante el primer mes, aunque con intensidad 4+ y lesiones extensas puede requerir hasta 2meses o más, sin que signifique evolución inadecuada. No deben esperarse que baciloscopias intensamente positivas se negativicen en pocos días. Como recomendación general, las muestras para evaluar la negativización no deben cursarse con intervalos inferiores a una semana.
La tinción también evalúa la contagiosidad del paciente, y es uno de los criterios utilizados para cesar el aislamiento de los pacientes, estén o no ingresados. El riesgo de transmisión es muy reducido cuando la tinción se ha negativizado o después de 2-3semanas de tratamiento efectivo aunque persista positiva, con excepción de que se sospeche resistencia a fármacos del tratamiento. No obstante, este es un aspecto controvertido sobre el que no hay un acuerdo total.
CultivoEs la prueba diagnóstica más sensible y la considerada de referencia. El dintel de positividad está en 100-1.000bacterias/ml, de 50-100veces más sensible que la microscopia. Debido al crecimiento lento de las micobacterias, las muestra debe someterse a un proceso previo de eliminación de la flora bacteriana acompañante, conocido como descontaminación, especialmente importante en esputo, en el que siempre están presentes bacterias de la flora oral. La descontaminación se consigue sometiendo la muestra a pH intensamente alcalino con NaOH durante 20min, en los que la mayoría de bacterias presentes se lisarán. Transcurrido este tiempo, se revierte a pH neutro y se concentra. Las micobacterias sobreviven a la descontaminación gracias a la estructura de su pared bacteriana. Sin embargo, la descontaminación tampoco es inocua para ellas. Debe seguirse un especial cuidado en neutralizar el pH y en centrifugar la muestra en condiciones de refrigeración. Aun así, se calcula que hasta el 30% de las micobacterias en la muestra morirán, por lo que es conveniente evitar la descontaminación en muestras estériles. Este proceso confiere al cultivo una complejidad específica y exige condiciones de seguridad superiores a las necesarias para la mayoría de los microorganismos.
Los medios para cultivar micobacterias son específicos. Los más conocidos son los sólidos que incorporan huevo entre sus componentes, como el de Lowënstein-Jensen, diseñado durante el primer tercio del sigloxx. Con menor difusión también se utilizan otros sólidos, como Coletsos, Trudeau, Ogawa, etc. Entre los medios sólidos con agar y sin huevo los más usados son Middlebrook 7H10 y 7H11. Durante décadas no se han usado medios de cultivo líquidos, más sensibles que los sólidos, debido a la dificultad en interpretarlos macroscópicamente, ya que el MTC no enturbia los medios líquidos. En los últimos 25años se han desarrollado diferentes sistemas que permiten detectar el crecimiento de los cultivos líquidos. El primero fue el método radiométrico BACTEC 460TB (Becton Dickinson, MD, EE.UU.), basado en la utilización de medio líquido 12B que contiene ácido palmítico marcado con C14. En presencia de crecimiento se metaboliza este sustrato y las micobacterias liberan C14 como producto de excreción. El sistema dispone de un lector que detecta C14 cuando el crecimiento es precoz. Posteriormente se han desarrollo métodos más automáticos, basados en fluorescencia, que evitan los inconvenientes de la radiactividad. Estos incorporan en cada tubo de cultivo un marcador de fluorescencia sensible a cambios en la presión de oxígeno o en la concentración de CO2 en el recipiente del cultivo y que expresan crecimiento bacteriano. Los recipientes con las muestras se introducen en incubadoras a 35-37°C que monitorizan cada hora los sensores de cada cultivo a través de un láser, de forma que el equipo incubador indica la presencia de cultivos positivos, así como de los negativos que han cumplido el protocolo de incubación. Actualmente se dispone de 3sistemas fluorimétricos validados: BACTEC MGIT960 (Becton Dickinson, MD, EE.UU.), MB BacT (BioMerieux, Francia) y VersaTREK (Termo Fisher, MA, EE.UU.).
El rendimiento de los cultivos líquidos es superior a los sólidos, por lo que deben hacerse siempre.
El cultivo es positivo en alrededor del 85-90% de las TB pulmonares. En localizaciones extrapulmonares el rendimiento es más bajo, raramente superior al 50%, exceptuando la localización linfática o en órganos sólidos, similares a la pulmonar9.
Una limitación importante del cultivo es la lentitud del resultado, que puede requerir varias semanas. Las muestras en las que la tinción ha sido positiva suelen crecer en 3-12días, mientras que en las tinciones negativas puede tardar 15-30días. Los cultivos líquidos suelen positivizarse antes, en la franja inferior de estos intervalos. La sensibilidad de los cultivos líquidos es ligeramente superior a la de los sólidos, sobre todo en las muestras extrapulmonares y en el aislamiento de MNT. El protocolo de cultivo internacionalmente aceptado mantiene la incubación de los cultivos hasta 42días10,11.
Cuando los cultivos se positivizan es necesario identificar la especie de la micobacteria. En nuestro entorno, MTC supone alrededor del 80% de los aislamientos. No obstante, el aislamiento de MNT es creciente debido en parte a la mejora de las técnicas de laboratorio y también a la mayor proporción de pacientes susceptibles a estas infecciones, como son los pacientes inmunodeprimidos o con patología pulmonar crónica. Hasta hace unos años la identificación se apoyaba en características morfológicas y en lentas pruebas bioquímicas que requerían semanas. Actualmente la identificación se basa en pruebas más rápidas, muchas de ellas moleculares. La morfología macroscópica y microscópica de los cultivos orienta los sucesivos tests a utilizar. La identificación de MTC puede realizarse con diversas aproximaciones. Recientemente se ha introducido una prueba rápida de inmunocromatografía capaz de detectar el antígeno MPT64 de MTC12. A partir de un cultivo positivo puede confirmarse la identificación de MTC en 15min sin infraestructura ni equipos adicionales. Su límite de detección son 100.000bacterias/ml, por lo que la sensibilidad de la prueba es superior al 95% de los cultivos positivos. Existen varias presentaciones comerciales validadas (Becton Dickinson MGIT TBc Identification Test, MD, EE.UU., y SD Bioline TB Ag MTP64 Rapid, Standard Diagnostics, Corea del Sur). Asimismo, se han descrito numerosas opciones caseras o comerciales para identificar MTC sobre todo por PCR. La mayoría amplifican fragmentos de la secuencia de inserción IS6110. No suele ser necesario diferenciar las especies del complejo MTC dada la elevada proporción de casos en que corresponde a M.tuberculosis. No obstante, se requiere en algunas situaciones. Cuando se observa resistencia a la pirazinamida es importante descartar M.bovis, ya que la mayoría de las cepas son resistentes a este fármaco. También estaría indicado en pacientes sometidos a terapia antitumoral con BCG en neoplasias de vejiga y con sospecha de infección por M.bovis BCG o en pacientes de África del Oeste con sospecha de M.africanum. En estas situaciones puede utilizarse una técnica Line Probe Assay (LiPA) de diferenciación de las especies del complejo basada en amplificación por PCR de varias zonas genéticas, como son el gen 23S, la zona RD1 y diversos polimorfismos de GyrB13. En las técnicas de LiPA el producto de la amplificación se incuba sobre una tira de nitrocelulosa en la que están inmovilizadas diversas sondas que identifican de forma específica a cada una de las especies. El producto de amplificación hibrida con su sonda complementaria y el resultado puede evidenciarse con un revelado enzimático parecido a una técnica de EIA. Están disponibles versiones comercializadas de esta técnica, utilizadas ampliamente en laboratorios de muchos países para la identificación de especies de micobacterias14,15. La identificación de otras especies de micobacterias está fuera del propósito de esta revisión. Cabe comentar que se basa principalmente en métodos de LiPA de amplificación e hibridación reversa, como el descrito para MTC, y puede identificar alrededor de 35especies distintas con la aplicación secuencial de diversas modalidades de la prueba. En la identificación de especie la prueba de referencia actual es la secuenciación de genes que contienen zonas conservadas diferenciales de cada especie. Los genes más utilizados son 16S, 23S, rpoB y hsp6516. Actualmente la identificación de especies distintas a MTC puede realizarse en 4-7días en condiciones de rutina asistencial.
Detección genética directa en las muestrasSe basa en la amplificación de ácidos nucleicos de secuencias específicas de MTC, generalmente por PCR u otras técnicas de amplificación. La mayoría de técnicas amplifican ADN, y la diana genética más frecuente es la secuencia de inserción IS6110. El paso previo a la amplificación es la extracción de ADN del interior de las micobacterias. Este es un aspecto de suma importancia debido a la dificultad en romper la pared y separar los ácidos nucleicos del resto de componentes celulares, a diferencia de lo que ocurre con las restantes bacterias. Se utilizan técnicas manuales de extracción y también métodos automatizados o semiautomatizados. Los métodos manuales pueden conseguir una extracción más eficiente, aunque comportan manipulación y dedicación importante y el riesgo de contaminaciones cruzadas entre las muestras.
Se han descrito numerosos métodos caseros (home made) con variantes en las dianas elegidas (IS6110, HSP-65KD, rpoB), en el método de amplificación (heminested, nested, real time) o en el sistema de revelado o lectura (electroforesis de gel de agarosa, ELISA, real time). También están disponibles métodos comerciales validados, como son Amplified MT Direct Test MTD (GenProbe, CA, EE.UU.), Amplicor MT (Roche Molecular Diagnosis (CA, EE.UU.) y BD Probe TEC ET Assay (Becton Dickinson Biosciences, MD, EE.UU.). Los tests caseros se utilizaron ampliamente en la etapa de desarrollo de las técnicas y se usan aún en el ámbito de la investigación y en países de baja renta debido a su menor coste económico. Se acepta que los métodos caseros son más sensibles, por ser más adaptables a cada situación, pero también son más inconsistentes y variables. La convicción general es que debe tenderse a la utilización de métodos comerciales, que deben ser sencillos, robustos y con requerimiento de experiencia mínima17. En los estudios iniciales se estableció el límite de sensibilidad de las técnicas de amplificación en el genoma de 2-3bacterias en condiciones ideales. Sin embargo, en las muestras clínicas reales existen obstáculos a la extracción, como puede ser el moco y detritus celulares, así como sustancias tales como iones, proteínas o compuestos de mayor tamaño, que inhiben total o parcialmente la amplificación. Por este motivo, en la práctica difícilmente se consigue amplificar muestras con menos de 3.000-5.000bacterias/ml. Esta sensibilidad sitúa a las pruebas de amplificación en una posición intermedia entre la microscopia y el cultivo, con una rapidez parecida a la primera. En general, en las muestras con microscopia positiva la sensibilidad es del 97-98%, y en muestras con microscopia negativa, alrededor del 65-70%.
La especificidad de las pruebas de amplificación es elevada cuando el grado de sospecha clínica de TB también lo es. Sin embargo, disminuye cuando el grado de sospecha es bajo.
Las expectativas generadas sobre los métodos de amplificación hace 15años no se han cumplido. Es debido a principalmente a las siguientes causas:
- 1.
Sensibilidad inferior al cultivo, que sigue siendo la prueba de referencia, sobre todo en muestras con microscopia negativa.
- 2.
No sustituyen a ninguna de las pruebas establecidas.
- 3.
La manipulación comporta el riesgo de contaminaciones cruzadas entre las muestras, con la génesis de falsos positivos.
- 4.
Requieren instalaciones adecuadas que permitan separar físicamente las zonas de extracción de las de amplificación y revelado. Es frecuente que en países y áreas con mayor incidencia de TB se carezca de esta infraestructura, y a menudo tampoco puede garantizarse mantener la cadena de frío de los reactivos.
- 5.
El nivel de experiencia del personal técnico que realiza las técnicas debe ser elevado.
- 6.
No se ha establecido claramente el coste/beneficio de la implantación de estas pruebas.
Actualmente las indicaciones de las técnicas de amplificación serían las siguientes:
- 1.
Sospecha elevada o medianamente elevada de TB. Debe evitarse su utilización como prueba de cribado o como apoyo para descartar el diagnóstico.
- 2.
Confirmación de microscopia positiva.
En países con alta incidencia, la baciloscopia positiva es sinónimo de TB. En nuestro entorno geográfico está justificada la confirmación por la creciente incidencia de infecciones por MNT. El resultado comportará decisiones importantes respecto al aislamiento del paciente y a la pauta de tratamiento elegida.
Recientemente, en 2010, la OMS ha avalado la utilización del método GenXpert18 como técnica de diagnóstico de TB y de detección de resistencia a la rifampicina. Se describe más adelante en esta revisión.
Pruebas de sensibilidad a los fármacosLa TB es una de las pocas enfermedades infecciosas con un tratamiento claramente establecido a nivel mundial. La recomendación actual de la OMS para todos los países es la indicación de 4fármacos administrados en un periodo de 6meses, de acuerdo con el siguiente esquema: isoniazida (H), rifampicina (R), etambutol (E) y pirazinamida (Z) durante 2meses, y H más R en los 4meses restantes (2HREZ/4HR)1. Diversas sociedades científicas españolas recomiendan la misma pauta19.
Bases del tratamiento de la tuberculosisLa estreptomicina fue el primer fármaco antituberculoso eficaz que se utilizó en el tratamiento, en 1946. Poco tiempo después se observó que los pacientes experimentaban una mejoría inicial con una rápida recaída como consecuencia del desarrollo de resistencia al fármaco. M.tuberculosis presenta mutaciones espontáneas en los genes que regulan las dianas de los antibióticos. Estas mutaciones son cromosómicas e irreversibles. Se estima que una población de alrededor de 1×106 bacterias/ml puede generar una bacteria mutante frente a un fármaco. Por ello, si se administra un único fármaco es seguro que se desarrollará resistencia, debido a que la población de bacterias en las lesiones supera este número y que una vez el fármaco haya eliminado las susceptibles, la mutante la regenerará de nuevo. Si se administran 2fármacos de forma simultánea, será preciso que haya una población bacteriana alrededor de 1010 a 1012bacterias/ml para generar una mutante a ambos fármacos. Esta es una población elevada poco frecuente de alcanzar en las lesiones. Con la administración conjunta de 3fármacos se eleva hasta 1015 a 1018bacterias/ml el número necesario para generar una mutante a los 3fármacos. Es una población imposible de alcanzar. Por tanto, administrar 3fármacos eficaces es el objetivo. La pauta de 4fármacos se justifica por la posibilidad de contagio de una cepa resistente a uno de ellos.
Los fármacos actúan sobre dianas diferentes para evitar las resistencias cruzadas. Así R y estreptomicina (S) inciden sobre la síntesis de proteínas, aunque en distintos puntos de acción. H, E y Z bloquean diferentes pasos metabólicos de la síntesis de la pared bacteriana. De gran importancia es que los fármacos tengan actividad sobre distintos estados metabólicos de la bacteria, dada su facilidad para pasar a situación de latencia en la que es refractaria a la acción de los fármacos. A título de ejemplo, H tiene su máxima eficacia sobre la población en fase exponencial de crecimiento, mientras que Z actúa sobre la población semilatente. R tiene un espectro de acción amplio, desde la fase de crecimiento exponencial hasta la fase de crecimiento estacionario.
Concepto de resistencia a los fármacosLa resistencia a los fármacos antituberculosos es debida a mutaciones cromosómicas permanentes. Desde un punto de vista epidemiológico se distinguen 2tipos de resistencia: a)la observada en pacientes que han recibido tratamiento previo, en los que podría haberse generado debido a un uso, indicación u absorción inadecuados de los fármacos; b)la asociada a pacientes que no han recibido tratamiento antes y que podría ser debida al contagio de un paciente con TB resistente o ser generada en el propio paciente de forma espontánea. Las primeras pueden evitarse con un control adecuado del tratamiento. Las segundas deben detectarse lo antes posible1.
Respecto al número de fármacos afectados, distinguimos entre: a)monorresistencia: cuando afecta a un solo fármaco; los más frecuentes en nuestro entorno son H y S; b)polirresistencia: afecta a 2 o más fármacos, pero nunca simultáneamente a H y R; c)multirresistencia (MDR): afecta simultáneamente a R y a H, con o sin otras resistencias asociadas, y d)resistencia extrema (XDR): afecta R y a H, y además al menos a un fármaco inyectable y a las fluoroquinolonas1.
La resistencia MDR, y especialmente la XDR, representan un grave problema de tratamiento que con frecuencia no puede resolverse, sobre todo en países de alta incidencia y pocos recursos.
La distribución de la resistencia en el mundo es variable según los países, aunque podría superponerse a un mapa de desarrollo económico, con una relación inversamente proporcional. Globalmente son resistentes más del 10% de los casos nuevos, pero con amplias diferencias entre países, como Holanda y los Países Escandinavos, con menos del 1%, hasta porcentajes superiores a 15-30% en China, en India o en los Países Bálticos. Ochenta y siete países ya han comunicado al menos un caso de resistencia XDR. Aunque no se conocen con exactitud, el porcentaje de resistencia en España estaría alrededor del 8,3%, con el 1,3% de casos MDR. El 33,6% de los casos resistentes corresponderían a nacidos en otros países20. Los antibiogramas resistentes deben confirmarse repitiéndolos y, si está disponible, usar una técnica genética de detección de resistencia.
Detección fenotípica de resistencia. El antibiogramaDesde un punto de visto microbiológico, una cepa de MTC es resistente a un antibiótico cuando el 1% o más de la población bacteriana de un cultivo es capaz de crecer y multiplicarse en presencia de una concentración determinada de este fármaco. Para detectar la resistencia se establece la proporción de bacterias resistentes comparando el crecimiento de la cepa con antibiótico con una dilución 1/100 de la cepa sin antibiótico que actúa como control. Esta interpretación se conoce como método de las proporciones y las concentraciones críticas, y fue establecido por Cannetti y Grosset en 1963. Todos los sistemas de antibiograma desarrollados posteriormente se basan en este principio. Hasta la segunda mitad de la década de 1980 los antibiogramas se realizaron utilizando medio de cultivo sólido, siendo los más utilizados Löwenstein-Jensen y Middlebrook 7H10. La dificultad residía en preparar adecuadamente el inóculo de MTC para poder calcular la proporción de micobacterias resistentes. Estos métodos requerían además 4semanas de incubación antes de llegar a un resultado.
Actualmente se usan los mismos métodos semiautomatizados de los cultivos líquidos mencionados anteriormente, aplicándose idéntico principio de detección. Para cada antibiótico o cada concentración se utiliza un tubo (o botella, dependiendo del método) al que se añaden concentraciones prefijadas del antibiótico y un inóculo alrededor de 5×105bacterias/ml. Se utilizan tantos tubos como concentraciones de antibióticos a estudiar. También se incluye un tubo control, con un inóculo 100veces menor. El antibiograma se incuba entre 5 y 12días y se interpreta de acuerdo a algoritmos establecidos por el sistema. El antibiograma estándar incluye los 5fármacos considerados de primera línea (H, R, E, S y Z). Los 4primeros se analizan simultáneamente utilizando un control común. La Z únicamente es activa a pH ácido alrededor de 5, in vivo e in vitro, por lo que debe testarse en un medio de cultivo acidificado. Debido a que una proporción de cepas podrían tener dificultades de crecimiento en estas condiciones, el medio de cultivo se sitúa a pH6, incrementando hasta 4veces la concentración de antibiótico para compensar la proporción de este que será inactiva a este pH e incluyendo un control con un inóculo 10veces menor. Durante 20años el método más utilizado para la realización del antibiograma en medio líquido fue el sistema radiométrico BACTEC460TB, convirtiéndose en el método de referencia. Recientemente se ha retirado del mercado, siendo los métodos más utilizados BACTEC MGIT960, MBBacT y VersaTREK. Se han realizado numerosos estudios comparativos que concluyen que los 3sistemas son equivalentes entre sí y también respecto al radiométrico21,22. Como excepción, MBBacT no incorpora la tecnología para estudiar la sensibilidad a la Z.
La correlación entre los resultados del antibiograma y la clínica es muy alta, sobre todo para H y R, por lo que un resultado de resistencia implica una modificación del tratamiento. Actualmente el antibiograma incluye 2concentraciones fijas para 3 de los fármacos: H (0,1μg/ml, 1μg/ml), E (2,5μg /ml, 5μg /ml) y S (1μg/ml, 4μg/ml), y una para R (1μg/ml) y Z (100μg/ml). Según el sistema utilizado, pueden variar ligeramente. Se consideran resistencias de bajo nivel las que solo afectan a las concentraciones menores, y de alto nivel las que afectan a ambas. La implicación práctica del nivel de resistencia es que probablemente no sea necesario retirar los fármacos cuando es de bajo nivel, aunque sí deben añadirse otros. Tradicionalmente no se ha utilizado el concepto de concentración mínima inhibitoria (CMI) para el antibiograma de MTC, por lo que es muy importante que el resultado sea fiable. A nivel práctico, cuando los laboratorios detectan resistencia en el antibiograma se comprueba una segunda vez o se confirma con una prueba genética. La resistencia a la Z es poco frecuente, por lo que es usual en este caso descartar si se trata de M. bovis.
El antibiograma frente a fármacos de primera línea está plenamente estandarizado y validado. Por este motivo es realizado en muchos laboratorios que disponen de cultivos líquidos. Cuando se detecta resistencia, está indicado analizar la sensibilidad para fármacos de segunda línea. En este caso no hay protocolos unificados respecto al procedimiento ni tampoco referente a los fármacos y concentraciones a estudiar, aunque se han realizado algunas propuestas23. Es frecuente incluir gran parte de los siguientes: rifabutina, amikacina, tobramicina, kanamicina, capreomicina, etionamida, cicloserina, ofloxacino (u otras fluoroquinolonas como levofloxacino o moxifloxacino), clofazimina y linezolid. Es recomendable que los antibiogramas de segunda línea se realicen en laboratorios con experiencia. Asimismo, la interpretación debe hacerse con cautela.
El antibiograma de primera línea está indicado en todos los aislamientos de casos nuevos. Esta es la forma más frecuente de detectar resistencias de bajo nivel o monorresistencias que no se han evidenciado durante la primera fase del tratamiento. Si no se hubiera realizado, es imprescindible ante fracasos clínicos del tratamiento, recidivas o persistencia de la baciloscopia positiva sin disminuir su intensidad al final de la primera fase del tratamiento o pacientes contactos de casos con resistencia probada.
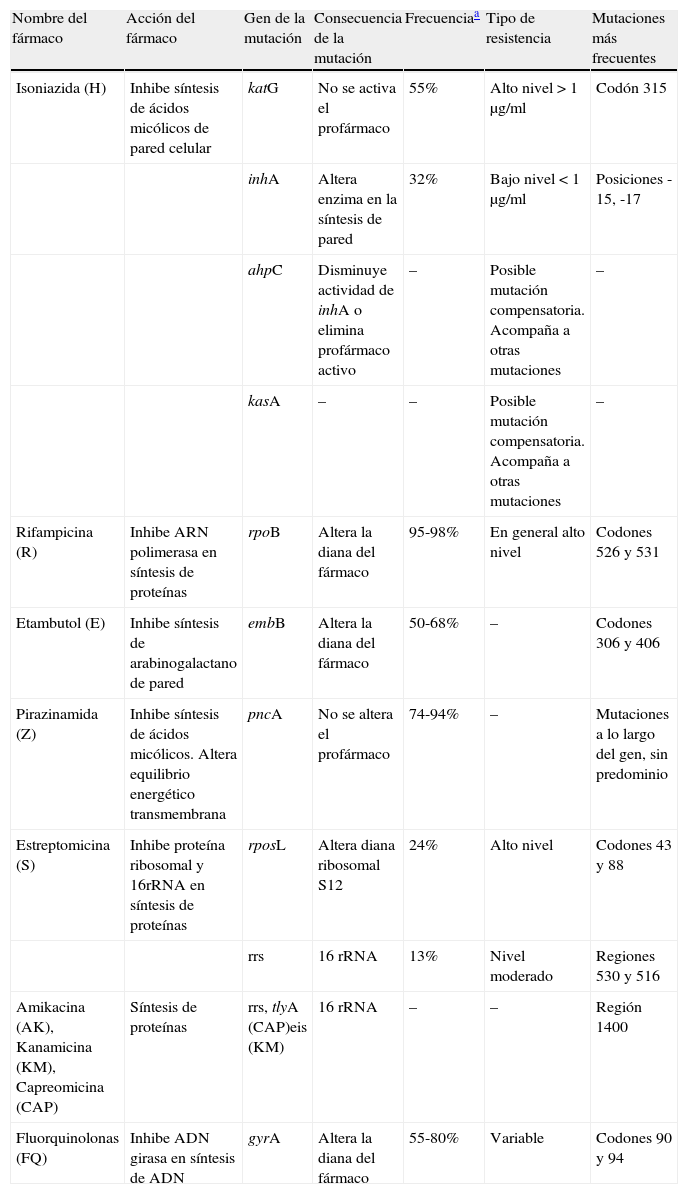
Detección genotípica de resistenciaLa lentitud del antibiograma ha estimulado en los últimos años el desarrollo de métodos rápidos de detección molecular de la resistencia. Se basan en la premisa de que el mecanismo principal de resistencia a los fármacos son mutaciones cromosómicas irreversibles, por lo que detectando las mutaciones se diagnostica la resistencia. Las principales mutaciones de resistencia a los fármacos se describen en la tabla 1. La ventaja más importante de los métodos genéticos de detección de resistencias es la rapidez. En condiciones de rutina asistencial permite obtener resultados en 2-3días. Cuando se aplica sobre cultivos positivos, la sensibilidad es cercana al 100% para detectar las mutaciones incluidas en el diseño de la técnica. También puede utilizarse directamente sobre muestras clínicas. La sensibilidad dependerá de la concentración de bacterias en la muestra, siendo mayor en las muestras con microscopia positiva intensa y menor en las muestras con baciloscopia negativa. Existen numerosos métodos comerciales y caseros para detectar las mutaciones de resistencia, sobre todo las relacionadas con H y con R. Los más usados son los métodos de LiPA, basados en los mismos principios descritos para los test de identificación de especies: amplificación por PCR de los genes diana, hibridación del amplificado con diversas sondas inmovilizadas sobre un soporte de nitrocelulosa y revelado colorimétrico que indica la hibridación específica en forma de franjas transversales sobre la tira de nitrocelulosa. Esta tecnología ha sido recomendada por la OMS para ser utilizada por los programas nacionales de TB. Hasta el momento existen 3presentaciones comerciales. InnoLiPA Rif TB (Biomerieux, Francia) está diseñado para detectar el 95-98% de las mutaciones de resistencia a R, y un metaanálisis reciente24 indica sensibilidad global del 80-100%. GenoType MTBDRplus (HAIN, Alemania) permite la detección del 95-98% de mutaciones de resistencia a la R y también las asociadas a los genes katG e inhA de resistencia a la H, que cubren el 85-87% de las resistencias a este fármaco. Este método ha demostrado una sensibilidad del 84% para detectar resistencia a H y del 98% para la resistencia de R. La especificidad en ambos casos es cercana al 100%. Recientemente el mismo fabricante ha diseñado un nuevo kit, MTBDRsl, para estudiar las mutaciones de otros fármacos. Permite detectar aminoglucósidos de segunda línea, etambutol y quinolonas. Funciona bastante bien para detectar resistencias a amikacina y quinolonas. Capreomicina y kanamicina comparten el mismo mecanismo de resistencia que amikacina, aunque el método es menos eficaz para estos fármacos. Esto último es extensible también para etambutol25.
Mecanismo de acción y mutaciones de resistencia más conocidos de los fármacos antituberculosos
| Nombre del fármaco | Acción del fármaco | Gen de la mutación | Consecuencia de la mutación | Frecuenciaa | Tipo de resistencia | Mutaciones más frecuentes |
| Isoniazida (H) | Inhibe síntesis de ácidos micólicos de pared celular | katG | No se activa el profármaco | 55% | Alto nivel >1μg/ml | Codón 315 |
| inhA | Altera enzima en la síntesis de pared | 32% | Bajo nivel <1μg/ml | Posiciones -15, -17 | ||
| ahpC | Disminuye actividad de inhA o elimina profármaco activo | – | Posible mutación compensatoria. Acompaña a otras mutaciones | – | ||
| kasA | – | – | Posible mutación compensatoria. Acompaña a otras mutaciones | – | ||
| Rifampicina (R) | Inhibe ARN polimerasa en síntesis de proteínas | rpoB | Altera la diana del fármaco | 95-98% | En general alto nivel | Codones 526 y 531 |
| Etambutol (E) | Inhibe síntesis de arabinogalactano de pared | embB | Altera la diana del fármaco | 50-68% | – | Codones 306 y 406 |
| Pirazinamida (Z) | Inhibe síntesis de ácidos micólicos. Altera equilibrio energético transmembrana | pncA | No se altera el profármaco | 74-94% | – | Mutaciones a lo largo del gen, sin predominio |
| Estreptomicina (S) | Inhibe proteína ribosomal y 16rRNA en síntesis de proteínas | rposL | Altera diana ribosomal S12 | 24% | Alto nivel | Codones 43 y 88 |
| rrs | 16 rRNA | 13% | Nivel moderado | Regiones 530 y 516 | ||
| Amikacina (AK), Kanamicina (KM), Capreomicina (CAP) | Síntesis de proteínas | rrs, tlyA (CAP)eis (KM) | 16 rRNA | – | – | Región 1400 |
| Fluorquinolonas (FQ) | Inhibe ADN girasa en síntesis de ADN | gyrA | Altera la diana del fármaco | 55-80% | Variable | Codones 90 y 94 |
Recientemente ha aparecido en el mercado el sistema GenXpert dirigido a detectar la resistencia a la R, considerada como marcador de TB multirresistente26. En 2010 la OMS avaló su utilización en el diagnóstico de la TB y en la detección de resistencia a la R. En 2años, dos tercios de los países con más TB del mundo ya lo adoptaron en sus programas de control de TB18. GenXpert es una plataforma integrada que puede usarse con manipulación y experiencia mínimas. A diferencia del resto de métodos, el kit consiste en un cartucho cerrado en el que se introduce la muestra, tratada previamente para el cultivo, o directamente después de diluirla con un tampón. El cartucho incluye todos los reactivos necesarios para lisar las bacterias, extraer y purificar el ADN, amplificar los fragmentos diana, con una técnica de PCR a tiempo real que incorpora sondas específicas que cubren toda la zona de mutaciones de resistencia de R en el gen rpoB. El cartucho es introducido en el equipo, que controla la secuencia de acciones que ocurren en su interior. El resultado, presentado a través del software informático, indica presencia o ausencia de ADN de MTC y también si se detectan o no mutaciones de resistencia a la R. Este sistema, también aplicado a otros microorganismos como gripe, estreptococos grupo B o Staphylococcus aureus resistente a la meticilina, ha supuesto un cambio muy importante en la utilización de las pruebas de amplificación genética en el diagnóstico de la TB, ya que la ha hecho accesible a entornos de laboratorio que no pueden acceder a otros métodos. En un estudio de la Foundation for Innovative New Diagnostics (FIND)27 se observó una sensibilidad del 98% para casos con microscopia positiva y del 72% para microscopia negativa. El rendimiento aumenta si se estudian 3muestras en lugar de una (72% una muestra respecto al 90,2% con 3). El aspecto más problemático de este método es el coste económico. FIND negoció con el fabricante un precio reducido para los 145países con más incidencia, que actualmente se sitúa alrededor de los 10dólares. El coste en nuestro entorno está en el orden de 60-65€.
En nuestro entorno la detección de mutaciones de resistencia en pacientes con TB estaría indicada en las situaciones siguientes: TB previa, sobre todo si es reciente, ser contacto de pacientes con resistencia, ser originario de un país con tasa de resistencia superior al nuestro, y fracaso en el tratamiento. Puede realizarse cuando el cultivo es positivo o a partir de muestras con microscopia positiva. Cuando el grado de sospecha sea muy elevado, está indicado realizarla sobre muestras con microscopia negativa. La detección precoz de resistencia permite iniciar el tratamiento adecuado desde el inicio y reducir la morbilidad, la mortalidad y la transmisión a otras personas del círculo del paciente.
Métodos diagnósticos futurosExiste la percepción de que los métodos clásicos de tinción y cultivo no pueden progresar más allá de su situación actual25–27, mientras que las técnicas de amplificación genética tendrían aún recorrido, sobre todo mejorando la extracción de ácidos nucleicos de la célula bacteriana, disminuyendo las contaminaciones cruzadas y simplificando la técnica. Parte de estas mejoras las están aportando los métodos con presentaciones compactas e integradas, como GenXpert. Otra opción interesante es la técnica LAMP (loop mediated isothermal amplification), desarrollada en 200129. Se basa en la amplificación isotérmica de 6regiones genéticas utilizando diversos iniciadores. La detección es visual, por la observación de un precipitado blanco de pirofosfato, generado como subproducto durante la amplificación. Se han diseñado variantes para detección fluorescente. Como infraestructura podría requerir únicamente un baño maría o un bloque térmico. Su sensibilidad sería adecuada para muestras con microscopia positiva (>97%), aunque discreta para muestras con microscopia negativa (alrededor de 48%).
Aun siendo una técnica basada en metodología de cultivo, merece ser comentado el método MODS (microscopic observation drug susceptibility assay). Se basa en un cultivo en medio líquido 7H9 monitorizado a través de observación microscópica (microscopio invertido) observando la formación de cuerdas, que son visibles antes que las colonias, en una media de 8días. Tecnológicamente es barato y aplicable a países de alta incidencia y bajos recursos30. Su futuro pasa por encontrar un sistema de lectura que permita evitar el microscopio y el tiempo que consume, sobre todo pensando en el procesamiento de un elevado número de muestras.
Una variante muy interesante de la amplificación son los biochips de microarrays de ADN, basados en obtener en una única reacción la amplificación de numerosos genes, identificando o detectando mutaciones de resistencia. Se han desarrollado diversos intentos, pero después de una década no han cuajado, sobre todo debido a limitaciones con la sensibilidad31,32.
Otra limitación importante en el diagnóstico convencional es la ausencia de una muestra universal, como pudiera ser suero u orina, independiente de variaciones y fácil de obtener. Un esfuerzo en este sentido es la detección de lipoarabinomanano (LAM) de la pared micobacteriana en orina, por técnica de inmunocromatografía33. Podría detectarse en dos tercios de los pacientes y sería más sensible en pacientes inmunodeprimidos, por lo que podría ser como un marcador de diseminación en pacientes con estado inmunitario deficiente. Otra potencialidad interesante es la detección de antígenos volátiles de la bacteria en el aliento34, o presentes en las muestras, utilizando detectores químicos, lo que se ha llamado narices electrónicas35. Aunque necesitan más desarrollo, abren nuevas vías en la búsqueda de métodos diagnósticos, por lo que se inicia un periodo científicamente muy interesante. No obstante, en la práctica actual del día a día es necesario optimizar y rentabilizar al máximo las pruebas diagnósticas, tanto desde la oferta de los laboratorios (tabla 2) como desde la clínica en obtener muestras adecuadas y compartir información relevante (tabla 3).
Prestaciones que pueden ofrecer los laboratorios de microbiología en relación a la tuberculosis
| Prestación | Comentarios |
| Observación microscópica | Ofrecer a todas las muestras (excepto sangre, ya que los hematíes dificultan una tinción adecuada)Nunca realizar microscopia como única técnica, es poco sensibleProporcionar respuesta en las primeras 24h. Implicaciones en el diagnóstico y la prevención de la transmisión. Si no es posible, máximo a las 48h |
| Cultivo | Todo tipo de muestra es cultivable. Sobre todo incluir cultivos líquidos. Complementar con sólidos aumenta la sensibilidad. El protocolo de incubación dura 42días |
| Identificación | Mínimo el complejo M. tuberculosis. Si es posible, las micobacterias no tuberculosas (MNT) más frecuentes |
| Amplificación génica (por PCR o similar) | Indicado si el grado de sospecha es moderado-alto. Usar junto a microscopia y cultivo, nunca exclusivamente. Utilizar métodos comerciales, son más robustos |
| Antibiograma de primera línea | Realizar en todos los pacientes con cultivo positivo. Utilizar un sistema semiautomatizado con medio de cultivo líquido. Si se detectan resistencias, repetir para confirmar y/o usar un método de detección de mutaciones de resistencias |
| Antibiograma de segunda línea | No está al alcance muchos laboratorios. Si no es posible, debe utilizarse un laboratorio de referencia |
| Detección de mutaciones de resistencia | Indicado en pacientes con tratamiento previo, fracasos clínicos, recidivas recientes, contactos de pacientes resistentes, originarios de países con mayor frecuencia de resistencias. Usar métodos comerciales: GenXpert y/o métodos de LiPA |
| Pruebas IGRA | Quantiferon o Spot TB en pacientes que se beneficiaran de tratamiento según resultado: contactos de pacientes, inmunosupresión de la inmunidad celular, tratamiento con anti-TNF |
| Información de resultados | A través del sistema informático. Comunicación personalizada de la microscopia positiva |
| Declaración de casos | Registro y declaración de casos con muestras positivas (microscopia y/o cultivo) |
Requerimientos para obtener el máximo rendimiento de las pruebas de microbiología en relación a la tuberculosis
| Actividad | Comentarios |
| Muestras adecuadas | Representativas del lugar de la infección. Cantidad adecuada. Transporte rápido con mínimo de aditivos |
| Diagnóstico | Diagnóstico diferencial lo más exacto posible. Dividir las muestras excesivamente para satisfacer muchas pruebas disminuye la sensibilidad |
| Comunicación | Comunicar y comentar los casos más probables para dirigir y optimizar la rentabilidad de las pruebas. Preferentemente antes de obtenerlas |
El diagnóstico de la tuberculosis latente (TBL) o infección tuberculosa está indicado fundamentalmente en 3situaciones: el estudio de contactos de pacientes con TB, en pacientes con inmunosupresión severa y en pacientes de patologías que requieren tratamiento con fármacos con actividad anti-TNF. Los 2 últimos grupos son tributarios de quimioprofilaxis. Se dispone de 2tipos de test: la prueba de tuberculina (PT) y las técnicas de detección de producción de interferón gamma (IGRA). Estas últimas han aparecido durante la reciente década. Hay 2métodos comercializados: Quantiferon TB Gold in Tube (Celestis, Australia) y T Spot TB (Oxford Immunotec, Reino Unido). Ambas detectan la producción de interferón gamma por parte de los linfocitos después de ser estimulados con antígenos específicos de M.tuberculosis, como son ESAT-6, CFP-10 y TB7.7, sin que existan reacciones cruzadas con M.bovis BCG ni con las otras micobacterias36. Las 2ventajas más importantes respecto a la PT son que no están influidas por la vacunación BCG y que son más sensibles en pacientes inmunodeprimidos. Quantiferon TB se basa en una técnica de ELISA y T Spot TB es la técnica de ELISPOT, por lo que la primera es sensiblemente más asequible a la mayoría de laboratorios de microbiología. La sensibilidad en el diagnóstico de la TBL es desconocida por la inexistencia de una prueba gold standard con la que comparar. Por este motivo es difícil saber su sensibilidad respecto a la PT. En 2005, los CDC de Estados Unidos recomendaron la realización de IGRA en lugar de PT37. En 2006 el National Institute of Health and Clinical Excelence, de Gran Bretaña, recomendó utilizar las pruebas de forma secuencial, primero PT y después IGRA. En España se ha recomendado también la utilización secuencial, realizando inicialmente la PT. Si es positiva y el paciente está vacunado o se desconoce, se recomienda la prueba IGRA. Si es negativa y el paciente está inmunodeprimido, se indica IGRA, por su mayor sensibilidad en este colectivo19. No está muy clara en la literatura la interpretación de las discrepancias entre la PT y las pruebas IGRA.
IGRA no pueden diferenciar entre TBL y enfermedad TB. Puede tener cierto valor de descarte una prueba negativa en países de baja incidencia y en inmunocompetentes. No obstante, la sensibilidad en los casos de TB es de alrededor del 85% (ligeramente superior para T Spot TB)38. Algunos autores han sugerido que los casos con IGRA positivos tendrían más probabilidad de progresar a enfermedad tuberculosa28.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.