INTRODUCCIÓN
La osteoporosis es una enfermedad generalizada del esqueleto caracterizada por una pérdida de la masa ósea y una alteración de la microarquitectura del hueso, así como, posiblemente, otras alteraciones cualitativas adicionales, todo lo cual aumenta la fragilidad del hueso y predispone a las fracturas1.
Hasta hace unos años se tendía a reservar el diagnóstico de osteoporosis para las situaciones en que las fracturas ya estaban presentes. Sin embargo, un grupo de expertos de la Organización Mundial de la Salud (OMS) propuso hace algunos años unos criterios diagnósticos basados en la determinación de la densidad mineral ósea (DMO). Las mujeres de raza blanca posmenopáusicas con valores de densidad ósea inferiores a la media juvenil en más de 2,5 desviaciones estándar (DE) (T < 2,5 DE) deben diagnosticarse de osteoporosis aunque no tengan fracturas. Cuando la densidad ósea se encuentra entre 1 y 2,5 DE, se habla de osteopenia2. En los varones, en las mujeres blancas premenopáusicas y en las mujeres de otras razas no existen aún criterios definidos, pero para los primeros se aceptan de momento criterios equivalentes a los de las mujeres.
La osteoporosis es una enfermedad plurietiológica, en cuya determinación el peso de los factores causales es muy variable. Como ocurre en otros procesos en que se da este mismo fenómeno, con frecuencia nos referimos a ellos con el nombre de "factores de riesgo". La lista de factores de riesgo de la osteoporosis es larga (se han descrito unos 80), y cada uno de ellos tiene un peso relativamente pequeño en el desarrollo de la enfermedad. Son excepción a esta regla el envejecimiento y la menopausia, que tienen un gran peso, y lo pueden ser ocasionalmente otros factores, como la ingesta de esteroides (tabla 1)3.
A partir de la introducción del tratamiento antirretroviral de gran actividad (TARGA), la infección por el virus de la inmunodeficiencia humana (VIH-1) se ha transformado en una enfermedad crónica con una aceptable calidad de vida4. Sin embargo, al aumentar la edad y el número de pacientes que sobreviven, han comenzado a observarse una serie de complicaciones, entre las que se encuentra la osteo porosis. Las causas que determinan la aparición de este trastorno son múltiples. Algunas guardan relación con la propia infección por el VIH-1 y otras con el tratamiento que reciben estos pacientes5-10. A continuación se revisa la información disponible actualmente sobre la osteoporosis en los pacientes con infección por el VIH-1 y sus implicaciones en la práctica clínica.
PREVALENCIA DE OSTEOPENIA Y OSTEOPOROSIS
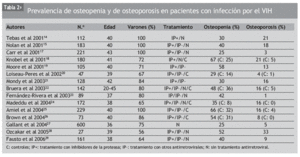
En los estudios iniciales, realizados antes de la introducción del TARGA, no se observaron alteraciones significativas del metabolismo mineral en los pacientes con infección por el VIH-111-13. Sin embargo, con posterioridad se han llevado a cabo numerosos estudios que demuestran que los pacientes con infección por el VIH-1 presentan una menor masa ósea que las personas no infectadas, tanto en la columna lumbar (CL) como en la cadera (CD), y la prevalencia de osteopenia y osteoporosis también es mayor14-40. En general se trata de estudios muy heterogéneos, realizados con distinto número de pacientes, en su mayoría varones y con una media de edad cercana a los 40 años. Además, los pacientes analizados presentaban distinta gravedad, y la mayoría de ellos estaban recibiendo tratamiento antirretroviral que incluía fármacos inhibidores de la proteasa (IP) (tabla 2)14-29. Por ejemplo, en España, Knobel et al18 analizaron a 80 pacientes con el VIH-1 (72% varones) de unos 40 años de edad que seguían distintas pautas de tratamiento y a 100 personas sanas, comprobando que el 67% de los pacientes presentaban osteopenia y el 21% osteoporosis, mientras que en el grupo control la prevalencia de osteopenia y de osteoporosis fue del 25 y del 5%, respectivamente. Sin embargo, en el Gilead Study27, que incluyó a más de 600 pacientes, en su mayoría varones con una media de edad de 36 años, la prevalencia de osteopenia fue del 30% y la de osteoporosis, del 5%. En cualquier caso, la prevalencia de osteopenia y de osteoporosis es superior a la de las personas sanas de la misma edad40.
La osteoporosis es una enfermedad propia de las personas de edad avanzada que afecta especialmente a las mujeres. Sin embargo, hasta hace pocos años no se ha dispuesto de estudios realizados entre la población femenina con infección por el VIH-130-35. Huang et al31 observaron un descenso del 9% en la DMO de la CL en 28 enfermas jóvenes (38 ± 5 años). Dolan et al32 comprobaron en otro grupo de mujeres seropositivas premenopáusicas de alrededor de 40 años, que la prevalencia de osteopenia y de osteoporosis era mayor que la de las mujeres no infectadas. Concretamente el 54% de ellas presentaban osteopenia y el 10% osteoporosis, frente al 30 y al 5% del grupo control, respectivamente. Otros autores33 han señalado cifras similares de osteopenia (62%) y osteoporosis (14%) en mujeres jóvenes (37 años), incluso antes de la introducción del TARGA, y recientemente Arnsten et al34 han descrito la existencia de una disminución de la masa ósea en mujeres perimenopáusicas.
Finalmente, en un estudio realizado en mujeres posmenopáusicas (56 ± 1 años), la DMO fue significativamente menor en las pacientes seropositivas, y la prevalencia de osteoporosis fue mayor tanto en la CL (42 frente al 23%) como en la CD (10 frente al 1%)35.
Otro grupo de pacientes con infección por el VIH-1 que potencialmente tienen un alto riesgo de desarrollar osteoporosis es el de los niños. La masa ósea que posee una persona en un momento concreto de su vida depende de la que llegó a tener al completar su desarrollo y de las pérdidas experimentadas posteriormente. Durante la infancia y la adolescencia es cuando se desarrolla la masa ósea, por lo que la posible repercusión de la infección por el VIH-1 sobre el esqueleto podría ser aún mayor que en los adultos36. De hecho, en los escasos estudios llevados a cabo se ha comprobado que la DMO está claramente reducida en los niños con infección por el VIH-1, y se han encontrado con frecuencia valores medios de la Z (número de desviaciones estándar en relación con las personas de la misma edad) por debajo de 137-39.
CONSECUENCIAS CLINICAS DE LA OSTEOPOROSIS EN LOS PACIENTES CON INFECCION POR EL VIH-1
El aspecto clínico fundamental de la osteoporosis consiste en la predisposición al desarrollo de fracturas. Las fracturas osteoporóticas son, por definición, patológicas, es decir, inapropiadas para el traumatismo que las provoca. En su desarrollo intervienen fundamentalmente 2 factores: la fragilidad ósea y el traumatismo. La fragilidad, a su vez, guarda relación con la cantidad y la calidad del hueso. Cuanto menor sea la masa ósea, más frágil será el hueso (en líneas generales se acepta que por cada desviación estándar que descienda la masa ósea, el riesgo de padecer una fractura osteoporótica se multiplica por 2). Sin embargo, a pesar de que se han comunicado algunos casos de fracturas osteoporóticas en enfermos seropositivos41-43, no parece que la prevalencia e incidencia de fracturas esté aumentada en esta población6,9,10. No obstante, hay que tener presente que todavía no se dispone de estudios suficientemente amplios y con un adecuado seguimiento que permitan afirmarlo de forma definitiva. El más extenso es un estudio retrospectivo realizado en 55 clínicas de Estados Unidos44 que englobó a más de 8.000 pacientes, en su mayoría varones, entre los que se identificaron 55 pacientes con fracturas atraumáticas (fundamentalmente vertebrales). Los datos de las fracturas se recogieron por la codificación de las historias clínicas y preguntando a los médicos encargados de la atención de los pacientes, por lo que la prevalencia real podría ser bastante mayor44. En cualquier caso, conviene recordar que los pacientes con infección por el VIH-1 son todavía relativamente jóvenes, por lo que cabe la posibilidad de que en un futuro, al aumentar la edad de estas personas y en el caso de las mujeres al alcanzar la menopausia aumente también la incidencia de fracturas osteoporóticas, lo que sin duda repercutiría sobre su calidad de vida6-10.
PATOGENIA
Durante el período de crecimiento, el esqueleto experimenta una serie de cambios que conducen a un aumento progresivo del grosor y de la longitud de los huesos (modelación ósea). Además, una vez finalizado el desarrollo, el esqueleto no permanece inerte, sino que se sigue renovando, aunque sin cambiar apreciablemente de forma ni de tamaño. Este proceso continuo de renovación se conoce con el nombre de "remodelación ósea", y se lleva a cabo mediante la destrucción por los osteoclastos de pequeñas unidades microscópicas de tejido, dispersas por el esqueleto, denominadas unidades de remodelación ósea (URO), que posteriormente son sustituidas por tejido nuevo formado por los osteoblastos45. A este respecto, debe recordarse que son los trastornos del fenómeno de la remodelación los que están en la base de las distintas osteopatías metabólicas, incluida la osteoporosis46. A partir de los 40 años de edad hay un pequeño balance negativo en cada unidad (la destrucción supera a la formación), que explica la pérdida fisiológica de masa ósea que se produce con la edad (0,5-1% anual). Esta pérdida se ve intensificada en 2 situaciones. La primera, cuando se acentúa el equilibrio negativo (como ocurre, p. ej., cuando se administran corticoides). La segunda, cuando aumenta el número de URO (puesto que la puesta en marcha de cada una de ellas supone la pérdida de hueso que determina el equilibrio negativo), lo que se suele describir como aumento del recambio o turnover óseo. Ambas circunstancias (acentuación del balance negativo y aumento del número de URO) parecen darse en los pacientes con infección por el VIH-1, lo que favorecería la pérdida de hueso en estos pacientes.
El recambio óseo puede medirse de forma directa mediante histomorfometría a partir de la biopsia ósea47. Se trata de un proceso cruento y tedioso, por lo que se ha utilizado en muy pocas ocasiones en los pacientes con infección por el VIH-1. De hecho, el único trabajo consistente publicado hasta la fecha es el realizado en Barcelona por Serrano et al12 en 22 pacientes seropositivos no tratados que presentaban una DMO normal. No se observaron trastornos en la mineralización en estos enfermos y, curiosamente, tanto los parámetros de formación como de resorción estaban disminuidos, y guardaban relación con el número de linfocitos CD4. En un segundo estudio31, llevado a cabo tan sólo en 7 pacientes que tenían una baja ósea baja y seguían tratamiento antirretroviral, los resultados fueron más heterogéneos.
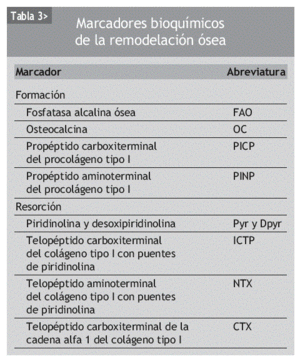
También se puede valorar el turnover óseo de forma indirecta, mediante la determinación de una serie de sustancias en la sangre o en la orina conocidas con el nombre de marcadores bioquímicos de la remodelación, cuya concentración o actividad reflejan la formación o resorción óseas (tabla 3). Existen numerosos trabajos que han valorado el comportamiento de los marcadores de la remodelación en los pacientes con infección por el VIH-1. En ellos se observa que, en general, los marcadores de formación se encuentran disminuidos, mientras que los de resorción están aumentados11,12,21-29,31,34,36,37,48,49. Además, en la mayoría de los estudios se observa que estos trastornos se hacen más evidentes conforme avanza la gravedad de la infección12,24,25,29,36,38,50.
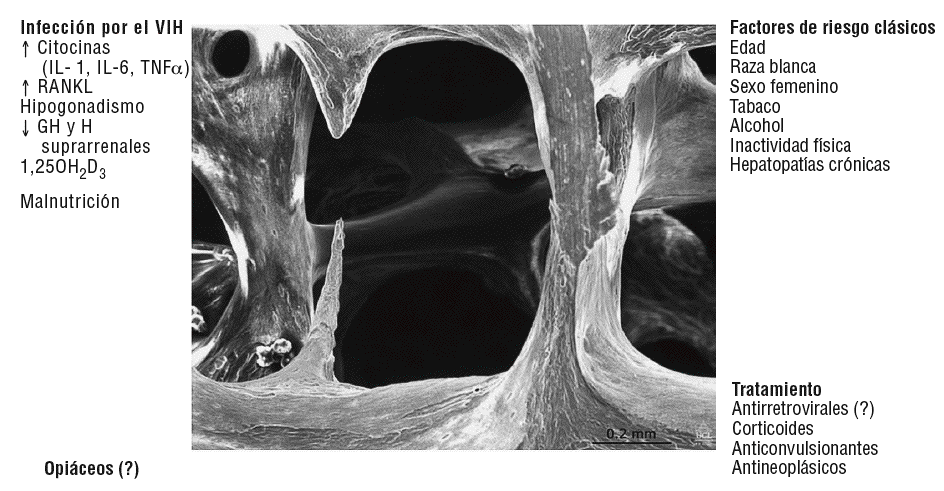
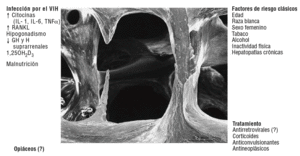
El aumento de los marcadores de resorción suele traducir un aumento del número de URO, y la disminución de los marcadores de formación en relación con el aumento de los de resorción, una acentuación del equilibrio negativo. Ambos hechos podrían desempeñar un importante papel en la patogenia de la pérdida de masa ósea que presentan estos enfermos. Las causas que determinan la aparición de estos defectos pueden ser numerosas y guardan relación con la propia enfermedad o con el tratamiento que reciben estos pacientes (fig. 1).
Figura 1 Factores que pueden contribuir a disminuir la densidad mineral ósea en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH). GH: hormona de crecimiento: RANKL: ligando del receptor activador del receptor del factor nuclear KB.
Influencia de la infección por el VIH-1
No parece que el VIH-1 sea capaz de actuar directamente sobre las células óseas51-53. Sin embargo, el VIH-1 puede influir indirectamente sobre el proceso de la remodelación mediante diversos mecanismos. El aumento en la resorción ósea que presentan los pacientes con infección por el VIH-1 podría guardar relación con el aumento en la liberación de citocinas proinflamatorias. La activación linfocitaria provocada por la infección del VIH-1 determina la liberación de algunas citocinas, como la interleucina (IL) 1, la IL-6 o el factor de necrosis tumoral alfa (TNF-*), que aumentan la actividad osteoclástica54. Los pacientes con enfermedad avanzada presentan valores más elevados de TNF-*55-57, y en algunos estudios se ha comprobado que los marcadores de resorción se correlacionan con los valores del TNF-*25,49.
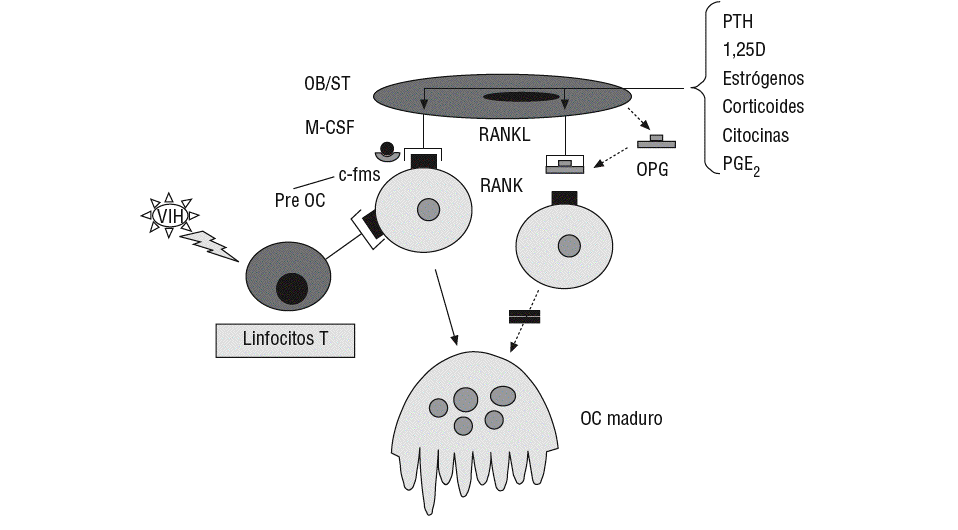
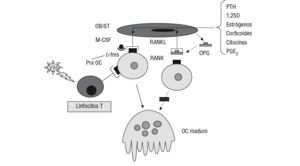
Además del efecto sobre la secreción de citocinas, el VIH-1 estimula la liberación de RANKL (receptor-activador del factor nuclear KB [NFKB]). Desde hace unos años se sabe que en la formación de los osteoclastos intervienen células inmaduras de estirpe osteoblástica, las cuales poseen en su membrana una proteína (RANKL, o ligando del RANK) capaz de unirse a un receptor de la familia del TNF (RANK) presente en los preosteoclastos y osteoclastos, células B y T58,59. Una vez unido a su receptor, el RANKL estimula la diferenciación y la fusión de las células precursoras de los osteoclastos, activa los osteoclastos maduros y prolonga su vida al inhibir la apoptosis. Junto al M-CSF (factor estimulador de las colonias de macrófagos), citocina que también es producida por los osteoblastos y que se une al receptor c-fms presente en los precursores de los osteoclastos, el RANKL es la señal más poderosa en la inducción de la cascada de acontecimientos intracelulares involucrados en la osteoclastogénesis.
Por otra parte, las mismas células inmaduras de estirpe osteoblástica que expresan en su superficie el RANKL, producen y segregan una proteína denominada osteoprotegerina (OPG), con afinidad por éste. Se trata también de una proteína de la familia de los receptores del TNF (TNFR) que carece de dominio transmebrana y, por ello, es secretada al exterior. La unión de la OPG al RANKL impide su acceso al RANK, y por tanto la diferenciación y la activación osteoclástica. Este sistema desempeña por tanto un papel fundamental en la regulación del proceso de la remodelación ósea (fig. 2)58,59. Pero además, los linfocitos T activados también expresan el RANKL, por lo que cabe la posibilidad de que este mecanismo desempeñe un importante papel en la pérdida de masa ósea que padecen los pacientes con infección por el VIH-1. En algunos estudios se ha comprobado que los pacientes seropositivos presentan un incremento en la concentración sérica de RANKL y OPG9,32,60, y Fakruddin et al61 demostraron que al incubar las células T de personas sanas con la proteína gp120 del VIH-1 aumentaba la secreción in vitro de RANKL. En este mismo trabajo se observó que tanto el RANKL como la proteína gp120 favorecían la diferenciación osteoclástica de las células mononucleares de sangre periférica procedentes de donantes sanos y de algunas líneas celulares monocitarias murinas61.
Figura 2 Sistema RANK/RANKL/OPG. c-fms: receptor del M-CSF; M-CSF: factor estimulador de las colonias de macrófagos; OB/ST: preosteoblastos y células del estroma medular; OC: osteoclasto; OPG: osteoprotegerina; PGE2: prostaglandina E2; Pre OC: preosteoclastos; PTH: hormona paratiroidea; VIH: virus de la inmunodeficiencia humana; 1,25D: calcitriol.
Además de los efectos sobre las células óseas y accesorias que hemos comentado, la infección por el VIH-1 puede también ejercer un efecto indirecto sobre algunos de los factores que regulan el proceso de la remodelación ósea45,46,54. Al margen de la inactividad física que con relativa frecuencia presentan estos enfermos, y que lógicamente puede colaborar en el desarrollo de osteoporosis62, la infección por el VIH-1 se acompaña de una serie de trastornos en algunas de las hormonas que regulan este proceso, como ocurre por ejemplo con las hormonas sexuales63. Hasta el 20-30% de estos pacientes presentan hipogonadismo63,64. Se ha señalado que el 70% de los varones infectados por el VIH-1 refieren disminución de la libido y el 30% impotencia65, mientras que en las mujeres la edad de la menopausia se acorta en unos 5 años66. Además, en las mujeres seropositivas la DMO guarda una relación directa con los valores de estrógenos e inversa con el tiempo trascurrido desde la menopausia31,35,64.
También se han descrito trastornos en la secreción de la hormona de crecimiento (GH) y de las hormonas suprarrenales31,65,67-70.
Por otra parte, con frecuencia se observan alteraciones en el metabolismo de las denominadas hormonas calciotropas, fundamentalmente de la vitamina D5,8,9,71-73. Los pacientes con infección por el VIH-1 presentan concentraciones reducidas del metabolito activo de esta hormona, el 1,25(OH)2D3 o calcitriol5,24,74. Sin embargo, las concentraciones de 25OHD y de la proteína transportadora (DBP) suelen ser normales, lo que hablaría a favor de la existencia de una inhibición de la *1-hidroxilación, que se ha puesto en relación con un aumento en las concentraciones de fosfato, de TNF-* o a la existencia de una resistencia parcial a la acción de la hormona paratiroidea (PTH)24,55,75,76. Además, el TNF-* disminuye el número de receptores del calcitriol en las células osteoblásticas, lo que podría contribuir a reducir el efecto biológico de la vitamina D en estos pacientes77.
También son posibles otros efectos. La malnutrición, frecuente en estos pacientes, es un conocido factor de riesgo de osteoporosis3. Se ha comprobado que la DMO está especialmente reducida en los pacientes con síndrome de emaciación31,50. Además, en diversos trabajos se ha observado que la DMO guarda relación con la masa magra y con el peso de los pacientes, tanto el que tenían en el momento de realizarse la densitometría como con el más bajo que tuvieron a lo largo de su evolución16,25,29,34,35,49,70. También conviene recordar que otros factores clásicos de riesgo de osteoporosis consumo de tabaco y alcohol o algunas enfermedades, como las hepatopatías crónicas son más frecuentes en los pacientes infectados por el VIH-1 que en la población general10.
Finalmente, como es bien conocido, en nuestro medio la mayoría de los pacientes seropositivos son o han sido usuarios de drogas por vía parenteral. Hace más de 10 años que se describió la existencia de una disminución en la masa ósea en los heroinómanos VIH-1 negativos78. Por otra parte, se ha descrito la existencia de un aumento en la incidencia de fracturas entre ancianas que recibieron tratamiento analgésico con opiáceos durante 5 años44. Finalmente, en el estudio de Arnsten et al34, realizado en casi 500 mujeres que en su inmensa mayoría consumían o habían consumido drogas (cocaína, crack y heroína) y la mitad de las cuales eran VIH-1 positivas, se observó que el consumo de opiáceos se asociaba a una menor masa ósea tanto en la columna como en la CD.
Las causas que pueden contribuir a deteriorar la masa ósea en los heroinómanos son varias79. El uso de heroína se ha asociado a una mayor frecuencia de hipogonadismo e insuficiencia suprarrenal de origen central, así como a una menor respuesta en la secreción de GH80,81. Pero además, la heroína podría actuar directamente sobre los osteoblastos. Rico et al82 describieron en 1990 la existencia de una disminución en las concentraciones de osteocalcina en heroinómanas embarazadas, y otros autores83 observaron que la adición de opiáceos frenaba in vitro la proliferación osteoblástica. Por otra parte, nuestro grupo describió la presencia de los 3 tipos de receptores opiáceos (mu, delta y kappa) en células osteoblásticas humanas, comprobando que, al añadir concentraciones elevadas de morfina o de un agonista delta (DAMGO), se producía una inhibición en la síntesis de osteocalcina que revertía al incubar las células con naloxona84.
Influencia del tratamiento
El tratamiento que reciben estos pacientes también puede contribuir a la pérdida de hueso5,8,9,10. Ya hemos comentado que, en los primeros estudios, antes de la introducción del TARGA, no se observaron grandes alteraciones en la DMO en los pacientes con infección por el VIH-111-13. Ello planteó la posibilidad de que los nuevos esquemas terapéuticos fueran perjudiciales para el esqueleto. Carr et al17 observaron la existencia de una relación entre la presencia de osteopenia y lactacidemia que, para estos autores, podría ser secundaria a la toxicidad mitocondrial producida por los análogos de los nucleósidos. Tebas et al14 señalaron que los pacientes que recibían tratamiento con IP tenían una menor masa ósea que los que no recibían estos fármacos. Otros autores describieron resultados similares, así como una mayor alteración en los marcadores de la remodelación ósea en los pacientes tratados con IP16,23,24. También se ha señalado que los pacientes que desarrollan lipodistrofia presentan una pérdida de hueso mayor que los que no desarrollan esta complicación, probablemente debido a la mayor infiltración grasa de la médula ósea38,70. Sin embargo, estos hallazgos no se pudieron confirmar en posteriores estudios15,18,20,25,26,29,32,34,35,39, en los que además se señaló que la disminución de la masa ósea observada en los pacientes seropositivos guardaba fundamentalmente relación con los clásicos factores de riesgo de osteoporosis, como el peso, el índice de masa corporal, los antecedentes de tratamiento esteroideo o la presencia de hipogonadismo. Finalmente, tampoco se han observado cambios significativos en la evolución de la masa ósea en pacientes tratados con antirretrovirales21,23,27.
Por otra parte, los estudios diseñados para valorar la respuesta in vitro de las células frente a los distintos antirretrovirales han aportado resultados poco homogéneos e incluso contradictorios61,85,86. Por lo tanto, no está suficientemente aclarado el posible mecanismo de acción ni los efectos de los distintos antirretrovirales sobre el metabolismo óseo. Cabe incluso la posibilidad de que los posibles efectos adversos de estos fármacos se vean compensados por los efectos beneficiosos relacionados con la mejoría inmunológica que provocan en los pacientes con infección por el VIH-121,87. De hecho, en algunos estudios se ha señalado la existencia de una relación entre la pérdida de hueso y la gravedad de la infección, valorada a través de la clasificación de los Centers for Disease Control estadounidenses, del número de linfocitos CD4 o de la carga viral12,29,34. En definitiva, a pesar de que en algún estudio se planteó la posibilidad de que el TARGA y más concretamente los fármacos del grupo de los IP pudiera potenciar la pérdida de masa ósea, en el momento actual parece aceptarse que el tratamiento antirretroviral no resulta especialmente perjudicial para el esqueleto9.
Por último, además de los antirretrovirales, los pacientes con infección por el VIH-1 pueden recibir otros fármacos para el tratamiento de procesos asociados que pueden ser perjudiciales para el hueso7,8,10. Es bien sabido que el tratamiento prolongado con corticoides es una de las causas más frecuente de osteoporosis secundaria en nuestro medio3,46,88. Pero además, estos pacientes reciben en ocasiones otros compuestos, como los fármacos anticonvulsionantes, los antineoplásicos o la pentamidina, que pueden favorecer también la pérdida de masa ósea3,10,46,89.
CONDUCTA ANTE LA SOSPECHA DE OSTEOPOROSIS
El reconocimiento de la osteoporosis como una de las secuelas tardías que puede aparecer en los pacientes con infección por el VIH-1 obliga a plantearse el diagnóstico precoz de esta enfermedad, con objeto de adoptar las oportunas medidas preventivas y terapéuticas. Por ello, parece razonable realizar una detallada historia clínica a los pacientes con infección por el VIH-1 que incluya los clásicos factores de riesgo de osteoporosis, prestando especial atención al tratamiento recibido (corticoides, TARGA, etc.) y a la evolución de la enfermedad. Además de las pruebas analíticas rutinarias debe realizarse una densitometría ósea siempre que existan datos de hipogonadismo, tratamiento esteroideo crónico o antecedentes de fracturas osteoporóticas8,9. Se debe insistir en las medidas generales recomendadas al conjunto de la población: ejercicio físico, ingesta adecuada de calcio y de vitamina D, y corregir los factores de riesgo (alcohol, tabaco, deficiencias nutricionales)3. En los pacientes diagnosticados de osteoporosis que presenten hipogonadismo podría estar indicado el tratamiento hormonal sustitutivo. En los demás casos pueden utilizarse los bisfosfonatos1,6,8,9,10. Estos fármacos son bien tolerados, pueden administrarse de forma intermitente (semanal, mensual), no parecen interaccionar con los antirretrovirales, y han demostrado su utilidad en la prevención y en el tratamiento de la oscute;a experiencia suficiente sobre el tratamiento farmacológico de la osteoporosis en los pacientes con infección por el VIH-1. Así, algunos autores han señalado un descenso en los marcadores de resorción tras la administración de la hormona liberadora de la hormona del crecimiento en pacientes con infección por el VIH-191. Otros han comprobado que el tratamiento con testosterona es capaz de mejorar la densidad mineral ósea en varones eugonadales con síndrome de emaciación50. También existen algunos trabajos, en general con un escaso número de pacientes, en los que se ha observado que el tratamiento con alendronato semanal junto con calcio y vitamina D consigue mejorar la masa ósea en la CL y en la CD92-94. Además, se está a la espera de conocer los resultados de un ensayo clínico llevado a cabo en un amplio número de pacientes seropositivos tratados con alendronato (Adult AIDS Clinical Trials Group 5163)9, lo que sin duda aportará nuevas evidencias acerca de la posible eficacia del tratamiento antiosteoporótico en estos pacientes.