El síndrome de dolor regional complejo (SDRC) es un proceso doloroso, clasificado en dos tipos, según no se haya detectado ninguna lesión nerviosa (tipo I) o dicha lesión nerviosa esté presente (tipo II). Habitualmente aparece tras un evento nocivo (traumatismo o cirugía), aunque a veces aparece espontáneamente, y parece que factores genéticos podrían predisponer a padecer de SDRC. Diferentes conceptos etiopatogénicos se han propuesto para explicar la aparición de este síndrome, como una inflamación neurogénica, una disfunción simpática y cambios en la plasticidad del SNC. El diagnóstico es básicamente clínico, con la aparición de síntomas y signos asociados a las alteraciones autonómicas, motoras y sensoriales. El dolor es un síntoma común y precoz, como el edema distal, la sudoración, las alteraciones de la temperatura y de la coloración de la piel, la hiperalgesia, la debilidad muscular, y la atrofia cutánea y muscular en fases crónicas. El tratamiento debe ser multidisciplinar, incluyendo tratamientos no farmacológicos (fisioterapia, terapia ocupacional, terapia psicológica), tratamientos farmacológicos (analgésicos, glucocorticoides, limpiadores de radicales libres, calcitonina, bifosfonados) y tratamientos invasivos (bloqueos simpáticos, neuroestimuladores medulares).
Complex regional pain syndrome (CRPS) is a painful disorder, classified in two types depending on whether no nerve lesion has been detected (type I) or whether a nerve lesion is present (type II). CRPS usually develops after a noxious event (trauma injury or surgery), but can sometimes appear spontaneously, and genetic factors may predispose to CRPS. Several etiopathogenic concepts have been proposed, such as neurogenic inflammation, pathological sympathetic activation and neuroplastic changes in the central nervous system. Diagnosis is mainly based on clinical symptoms and signs, such as autonomic, motor and sensory disturbances. The most common and early symptom is pain, as well as distal edema, sweating, disturbances of skin temperature and color, hyperalgesia, motor weakness and, in chronic phases, skin and muscle atrophy. Therapy should be based on a multidisciplinary approach, including non-pharmacological therapies (physiotherapy, occupational therapy, psychological therapy), pharmacological treatments (analgesics, steroids, free radical scavengers, calcitonin, bisphosphonates), and invasive interventions (sympathetic nerve blockade, spinal cord stimulators).
El síndrome de dolor regional complejo (SDRC) es un término relativamente nuevo, introducido en 1994 por la International Association for the Study of Pain (IASP) para englobar una serie de patologías que parecen tener un mecanismo fisiopatológico común y características clínicas similares. La primera descripción de este síndrome parece deberse a Hunter en 1766. En 1864, Silas Weir denominó «causalgia» a un síndrome doloroso que observó en soldados que habían sufrido lesiones en el sistema nervioso periférico y que presentaban característicamente dolor quemante asociado a cambios tróficos en la extremidad afectada1. En 1900 Paul Sudeck describió la «atrofia ósea aguda inflamatoria» o atrofia de Sudeck, en la que observó que existían asociados unos síntomas inflamatorios que se extendían más allá de la región inicialmente lesionada. Leriche postuló la alteración del sistema nervioso simpático en este síndrome e introdujo el tratamiento con simpatectomía quirúrgica durante la Primera Guerra Mundial. En los años cincuenta del pasado siglo Evans introdujo el término «distrofia simpática refleja», y Bonica desarrolló de forma exitosa en su tratamiento las técnicas de bloqueo simpático periférico.
La IASP en una conferencia de consenso en 1994 quiso evitar la dispersión de nomenclaturas según la localización, la etiología o la fase evolutiva de los síntomas, por lo que definió el SDRC clasificándolo en tipo I y tipo II según hubiera asociada o no una lesión nerviosa previa2. El SDRC tipo I, que se correspondería al antiguo término «distrofia simpática refleja», se define como un síndrome doloroso desencadenado después de un evento nocivo, con dolor espontáneo y alodinia/hiperalgesia que sobrepasa la zona de distribución de un territorio nervioso periférico y que es desproporcionado al evento desencadenante, acompañado de edema o alteración del flujo sanguíneo cutáneo o alteraciones sudomotoras, sin que haya una lesión nerviosa evidente u otras patologías que pudieran asociar dichas alteraciones. El SDRC tipo II, que se correspondería con lo que llamábamos «causalgia», tiene las mismas características, pero en él existe una lesión nerviosa total o parcial previa y evidente.
EpidemiologíaLa prevalencia del SDRC tras una fractura previa oscila entre el 0,03 y el 37%, según diferentes estudios retrospectivos3–5. En un estudio de 2007 realizado en los Países Bajos se encontró una incidencia de 26,2casos/100.000habitantes/año6. Otro estudio epidemiológico en un condado de Estados Unidos reveló una incidencia de 5,46casos/100.000habitantes/año y una prevalencia calculada de 20,57casos/100.000habitantes3. Afecta más a mujeres, en una proporción 2-3:1, con un pico máximo entre la quinta y la séptima décadas de vida, y aparece predominantemente en las extremidades superiores3,6.
La mayoría de los pacientes han sufrido previamente un evento traumático, aunque en un 5-10% aparece espontáneamente sin evidencia de lesión previa. Hasta en el 40% de casos se asocia una fractura o cirugía previa, como por ejemplo la descompresión del nervio mediano, que se asocia al 30% de casos de SDRC. También puede aparecer tras lesiones radiculares (9%), lesiones de la médula espinal (6%) o en mínimos traumatismos, como esguinces (10%).
No se ha visto correlación entre la gravedad de la lesión inicial y la severidad de los síntomas de SDRC, y varios estudios abogan por factores psicológicos y factores genéticos que puedan predisponer a sufrir este síndrome. En un estudio de Geertzen et al.7 se observó que el 80% de pacientes habían sufrido «eventos estresantes» en los 2 meses previos o en el mes posterior al desarrollo del SDRC, respecto al 20% en el grupo control. Sin embargo, no se ha podido identificar ningún factor psicológico predisponente, excepto rasgos ansiosos de personalidad8. Parece que puede haber una predisposición familiar para sufrir el SDRC9, y que posibles factores genéticos podrían asociarse a la aparición de este síndrome. Sin embargo, los estudios no son concluyentes todavía. Los pacientes con SDRC tendrían una mayor tendencia a sufrir inflamación neurogénica, con un mayor edema por extravasación plasmática inducida por la sustancia P y una mayor vasodilatación neurogénica respecto a pacientes control. No se han encontrado correlación entre la aparición de SDRC y polimorfismos genéticos de sustancias mediadoras de inflamación, aunque se ha encontrado una asociación con el gen HLA II DR15 y el DQ1, pero su significación es todavía discutida10.
FisiopatologiaEn la aparición y la perpetuación de SDRC parece que están implicadas diferentes alteraciones, como la inflamación neurogénica asociada a una actividad neuronal anormal, la disfunción autonómica y los cambios de neuroplasticidad en el SNC10.
La inflamación que se produce en el SDRC ha sido descrita desde antiguo, pero al no observarse un aumento de los marcadores inflamatorios típicos se cree que el origen sería neurogénico. Las fibras nerviosas C tendrían además de una actividad aferente, conduciendo el estímulo, una actividad eferente neurosecretora, de manera que al activarse estas fibras de manera retrógrada liberarían neuropéptidos inflamatorios como la sustancia P o el calcitonin-gen-related peptide (CGRP), con la aparición de edema, vasodilatación, eritema o hipertermia10. Diferentes estudios avalan esta facilitación de la inflamación neurogénica en el SDRC, observándose un aumento de las concentraciones plasmáticas de sustancia P o de CGRP ante una estimulación eléctrica en pacientes con SDRC respecto a los controles11. El aumento de la concentración de CGRP también se asocia a la presencia de alteraciones autonómicas, como la hiperhidrosis o el mayor crecimiento del vello en la zona afectada de SDRC, y la sustancia P se ha asociado a la regulación de la actividad de los osteoclastos y la osteoporosis localizada asociada. Otros neuropéptidos como la endotelina-1 se han encontrado en mayor concentración en la zona afectada que en la contralateral, mientras que la concentración de óxido nítrico se ha encontrado disminuida. El mecanismo por el que se produciría esta activación de las fibras C es discutido, aunque parece que la liberación de citocinas proinflamatorias como las interleucinas o el factor de necrosis tumoral alfa (TNF-α) tras un traumatismo podría facilitar la síntesis y la liberación de neuropéptidos en las fibras C terminales.
La disfunción autonómica también es evidente en el SDRC, aunque es variable según la fase evolutiva del síndrome. La inhibición inicial del sistema nervioso simpático (SNS) y sus neuronas vasoconstrictoras induciría vasodilatación del territorio afectado. En las fases de cronificación se produciría vasoconstricción y disminución de la temperatura. No queda claro cómo se conectan el SNS eferente y el sistema nervioso aferente nociceptivo, pero ello explicaría la persistencia del dolor. En pacientes con SDRC se ha observado un aumento de la densidad de α-adrenorreceptores en la epidermis, y la activación de estos receptores produciría un aumento de la liberación de noradrenalina, lo que conllevaría una hiperestimulación de las aferencias primarias. En diferentes estudios se ha observado que la activación de neuronas simpáticas cutáneas induce dolor e hiperalgesia, incluso en pacientes simpatectomizados; cuando se estimula el tronco simpático afectado puede recurrir el dolor, y si se inyecta noradrenalina a nivel de las sinapsis cutáneas se provoca dolor. Las alteraciones simpáticas conllevarían una alteración de la distribución del flujo sanguíneo, con vasodilatación inicial inducida por liberación de acetilcolina y posteriormente empeoramiento de la función endotelial por denervación vascular, con hipoxemia y acidosis asociadas, y aparición o mantenimiento del dolor y la hiperalgesia12.
Las alteraciones sensoriales y motoras asociadas al SDRC y que se extienden más allá de un territorio nervioso, como la paresia, las distonías o las mioclonías, implican una alteración del SNC. En estudios con resonancia magnética (RM) en pacientes con SDRC se ha observado que la representación de la zona afectada en el córtex somatosensorial es mucho menor en el lado de la lesión que en el contralateral, y que esta reorganización se correlaciona con la severidad del dolor y la hiperalgesia presentes en cada paciente13. Los pacientes con SDRC también presentan un aumento de la activación de áreas cerebrales relacionadas con el procesamiento afectivo-emocional del dolor y de áreas motoras. La reorganización y la sensibilización central, y también las alteraciones de la plasticidad neuronal, explicarían las alteraciones sensoriales complejas y la cronificación del dolor.
Manifestaciones clínicasHabitualmente el SDRC presenta diferentes síntomas y signos, que pueden variar entre individuos y también en el mismo individuo según la fase evolutiva en la que se encuentre. Esta variedad de síntomas se asocian siempre a alteraciones autonómicas, sensoriales y motoras.
Alteraciones autonómicas- •
Edema distal, que suele aparecer hasta en el 80% de los casos. Suele ser de aparición precoz, en forma de edema blando y congestivo. En fases avanzadas puede hacerse más duro y asociarse a limitación de la movilidad.
- •
Cambios de la temperatura cutánea en la zona afectada. La mayoría de estudios consideran significativa la diferencia de 1¿C de temperatura entre la zona afectada y la contralateral. Habitualmente la zona lesionada presenta una mayor temperatura, pero hasta el 40% de casos pueden presentar una disminución progresiva de la temperatura cutánea.
- •
Cambios de coloración cutánea. Habitualmente en las primeras fases se suele observar una piel hiperémica, rojiza, pero posteriormente puede pasar a ser pálida o incluso presentar livideces en fases más crónicas.
- •
Fenómenos sudomotores, como hiperhidrosis, también pueden aparecer hasta en el 50% de los pacientes.
- •
Afectación del vello y de las uñas de la extremidad, que se hacen más fuertes y visibles.
- •
Atrofia cutánea y muscular, con retracción de los compartimentos aponeuróticos de musculatura intrínseca y extrínseca, que suele aparecer en fases avanzadas de la enfermedad.
- •
Atrofia ósea, con osteoporosis, que puede aparecer en estadios precoces, quizá relacionándose más con el traumatismo inicial o la inmovilización de la extremidad.
• Dolor: es el síntoma clave y aparece en más del 90% de pacientes con SDRC. En el 75% aparece dolor espontáneo, con intensidad fluctuante, aunque puede empeorar con el ejercicio o la movilización, y también con la inmovilización forzada, así como con los cambios de temperatura o con las situaciones en que aumente la ansiedad del paciente. Generalmente lo describen como un dolor quemante, punzante o urente, localizado más en estructuras profundas, como músculo o hueso (68%), que en la piel (32%), y que sobrepasa el territorio de inervación de un único nervio.
• Hiperalgesia—aparición de un dolor severo ante un leve estímulo doloroso— y alodinia —aparición de dolor ante estímulos no dolorosos como el simple roce cutáneo— son también síntomas frecuentes asociados al SDRC.
Alteraciones motoras- •
Debilidad muscular: está presente en la mayoría de pacientes, con pérdida de fuerza e incapacidad para realizar movimientos complejos, como el movimiento de pinza. En los estadios iniciales el edema y el dolor pueden dificultar en gran medida la movilidad, y en fases más avanzadas puede aparecer atrofia, fibrosis y contracturas musculares que restrinjan aún más la movilización.
- •
Temblor esencial en la extremidad afectada: puede aparecer hasta en un 50% de pacientes.
- •
Mioclonías y distonía: aparecen asociados sobre todo en pacientes con SDRC tipo II, hasta en un 30% de casos.
Clásicamente se considera que pueden existir tres fases clínicas en el desarrollo evolutivo del SDRC (tabla 1):
- •
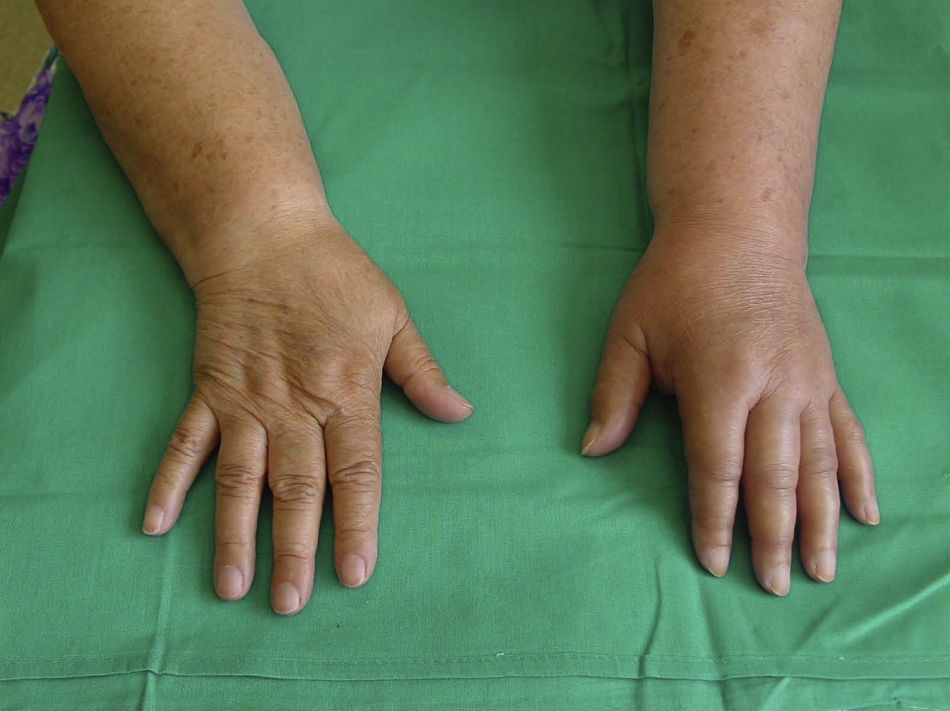
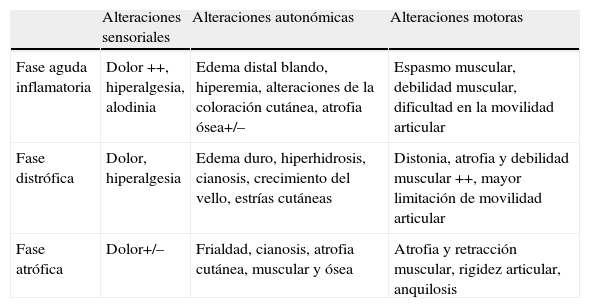
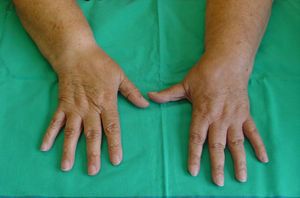
Fase aguda o inflamatoria. Es la fase inicial en la que el dolor es el síntoma más característico. Se acompaña de hiperalgesia, hiperestesia, edema, alteraciones de la coloración con hiperemia y espasmo muscular. La piel suele estar caliente, seca y enrojecida, y se afecta sobre todo la zona distal. Con el tiempo la lesión se va extendiendo a zonas más proximales, aparecen alteraciones tróficas y sudomotoras, con aparición de piel sudada, fría y cianótica (fig. 1).
- •
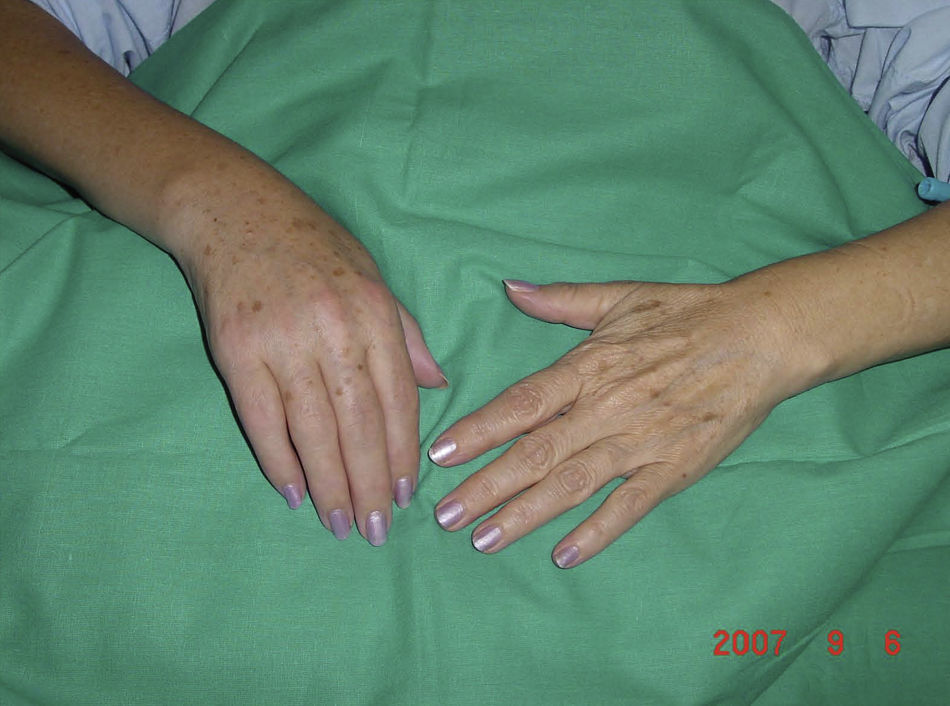
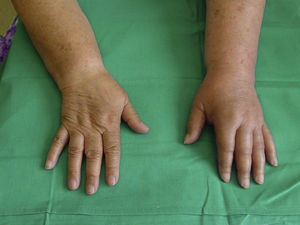
Fase distrófica. Predominan los trastornos vasomotores y vegetativos con hiperhidrosis, frialdad, crecimiento del vello y estrías cutáneas, edema duro y profundo, cianosis, atrofia muscular y ósea. Persiste el dolor y la rigidez articular, con mayor dificultad de movilidad articular (fig. 2).
- •
Fase atrófica. Puede disminuir el dolor y los síntomas y signos vegetativos, predominando la atrofia cutánea, muscular y ósea, con retracción muscular, rigidez articular y anquilosis.
Fases evolutivas de síndrome de dolor regional complejo (SDRC) y manifestaciones clínicas
| Alteraciones sensoriales | Alteraciones autonómicas | Alteraciones motoras | |
| Fase aguda inflamatoria | Dolor ++, hiperalgesia, alodinia | Edema distal blando, hiperemia, alteraciones de la coloración cutánea, atrofia ósea+/– | Espasmo muscular, debilidad muscular, dificultad en la movilidad articular |
| Fase distrófica | Dolor, hiperalgesia | Edema duro, hiperhidrosis, cianosis, crecimiento del vello, estrías cutáneas | Distonia, atrofia y debilidad muscular++, mayor limitación de movilidad articular |
| Fase atrófica | Dolor+/– | Frialdad, cianosis, atrofia cutánea, muscular y ósea | Atrofia y retracción muscular, rigidez articular, anquilosis |
Según la localización de la lesión, veremos diferentes síntomas y signos de forma más evidente. Cuando se afectan las articulaciones proximales y profundas se observaran menos síntomas vasomotores y una mayor impotencia funcional articular. Por ejemplo, en articulaciones de cadera o de hombro observamos impotencia funcional y posiciones antiálgicas, como flexión de cadera o aducción del hombro. La afectación de regiones distales muestra más fenómenos vasomotores y tróficos iniciales.
DiagnósticoEl diagnóstico de SDRC es básicamente clínico. La IASP publicó una revisión de los criterios diagnósticos clínicos en 2007 denominados «criterios de Budapest» (tabla 2), que aunque todavía no están validados, parece que tienen una sensibilidad del 85% y una especificad del 69%14. Se debe cumplir que haya un dolor regional, que sobrepasa un dermatoma o un territorio nervioso único, continuo o evocado, de una intensidad y/o duración desproporcionada al traumatismo o lesión que lo haya podido provocar, y que se asocia a una serie de síntomas y signos por alteraciones sensoriales, motoras, vasomotoras, sudomotoras y tróficas. Los síntomas y signos pueden ser variables según la fase evolutiva del síndrome.
Criterios diagnósticos de síndrome de dolor regional complejo (SDRC) de la IASP (criterios de Budapest 2007)
| 1. Dolor continuo, desproporcionado para el evento que lo pudo provocar |
| 2. Síntomas (debe cumplir un mínimo de un síntoma en tres de las cuatro categorías)• Sensorial: hiperestesia y/o alodinia• Vasomotor: asimetría de la temperatura cutánea y/o asimetría del color cutáneo y/o cambios de color cutáneo• Sudomotor: edema y/o cambios de sudoración y/o sudoración asimétrica• Motor: disminución del rango de movilidad y/o disfunción motora (temblor, distonía, debilidad) y/o cambios tróficos (en la piel, el vello, las uñas) |
| 3. Signos (debe cumplir un mínimo de un signo en dos o más de las cuatro categorías)• Sensorial: evidencia de hiperalgesia (a la punción) y/alodinia (al tacto/térmica/presión profunda/movimiento articular)• Vasomotor: evidencia de asimetría de la temperatura cutánea >1°C y/o asimetría del color cutáneo y/o cambios de color cutáneo• Sudomotor: evidencia de edema y/o cambios de sudoración y/o sudoración asimétrica• Motor: evidencia de disminución del rango de movilidad y/o disfunción motora (temblor, distonía, debilidad) y/o cambios tróficos (en la piel, el vello, las uñas) |
| 4. Descartar otras patologías que puedan explicar los síntomas y signos previos |
Se deben descartar otras enfermedades que puedan explicar dichos síntomas y signos, como pueden ser enfermedades reumáticas, artritis, infecciones posquirúrgicas, celulitis, neuritis o neuralgias, trombosis o síndrome compartimental. Aunque nos debemos basar en la anamnesis y la exploración física para el diagnóstico del SDRC existen pruebas complementarias que nos pueden ayudad a confirmar alteraciones del flujo sanguíneo, de la mineralización ósea o de la temperatura.
La radiografía simple puede mostrar signos de osteoporosis evolutiva asociada a fenómenos de reabsorción ósea. La gammagrafía ósea nos puede mostrar alteraciones por hipervascularización. Otras pruebas útiles podrían ser la resonancia Magnética, la termografía, la tonodensitometría o la fluxometria cutánea2.
TratamientoEl tratamiento del SDRC requiere un abordaje multidisciplinar que además del control del dolor esté encaminado a la recuperación funcional del miembro afectado. Se han postulado muchos tratamientos tanto farmacológicos como no farmacológicos en base a los mecanismos fisiopatológicos del síndrome, aunque existen pocos estudios fiables y controlados que hayan dado evidencia de eficacia.
Es importante instaurar medidas de prevención tras un traumatismo o una cirugía de extremidad, intentando hacer inmovilizaciones lo más breves posibles y en una posición adecuada, instaurar una movilización precoz de la extremidad y las articulaciones adyacentes y tratar el dolor de manera pronta y eficaz.
Tratamiento rehabilitadorEl tratamiento rehabilitador precoz es básico para intentar evitar la atrofia y las contracturas musculares, que en casos extremos pueden ser irreversibles, aunque requiere de la participación activa del paciente y esta no siempre es posible por el dolor severo y las alteraciones psicológicas asociadas.
La fisioterapia puede disminuir el dolor y mejorar la movilidad de la extremidad, aunque la intensidad del tratamiento varía en función de la severidad del síndrome. El drenaje linfático puede mejorar el edema. La estimulación eléctrica transcutánea (TENS) puede mejorar el dolor, aunque su uso no es recomendable en pacientes con hiperalgesia o alodinia severa. Los tratamientos de terapia ocupacional también pueden mejorar la función y la coordinación de la extremidad.
En algunos estudios se sugiere que la terapia del espejo podría tener un papel en el tratamiento del SDRC. El paciente realiza sus ejercicios ante un espejo frente a él, perpendicular a su línea media, que solo le permite observar la extremidad no afectada durante el tratamiento; esto crea una sensación de normalidad de la extremidad afectada, probablemente por activación del córtex frontal, y una mejoría del dolor, sobre todo en fases agudas de la enfermedad15.
Tratamiento farmacológico- •
AINE. Representan la primera línea de tratamiento, sobre todo en las fases iniciales y en unidades no especializadas, aunque su eficacia no está demostrada específicamente para el SDRC, ni están indicados en el tratamiento del dolor neuropático. En las fases iniciales pueden estar indicados para el tratamiento de la inflamación.
- •
Opiáceos. Tanto los opiáceos menores (tramadol) como los mayores (morfina, oxicodona, fentanilo, hidromorfona, buprenorfina) tiene su lugar en el dolor moderado-severo de difícil control, y han demostrado eficacia en el dolor neuropático.
- •
Adyuvantes: antiepilépticos tricíclicos (amitriptilina) y antidepresivos (gabapentina, pregabalina). No existen estudios controlados en SDRC tipo I con este tipo de fármacos, pero sí han demostrado eficacia en el tratamiento del dolor neuropático. Actúan sobre las vías inhibitorias del dolor y sobre la plasticidad neuronal, y están indicados en fases agudas con lesión nerviosa o actividad ectópica nerviosa o en fases crónicas.
- •
Ketamina. Es un anestésico con efecto analgésico y sobre receptores NMDA, que actúa a nivel central sobre la sensibilización y la plasticidad neuronal. Su uso en el tratamiento del dolor neuropático establecido es controvertido y limitado por sus efectos secundarios. Se utiliza en unidades especializadas, en perfusiones a dosis bajas de 10 a 30mg/día, y en estudios a corto plazo mejora el dolor en SDRC con escasos efectos secundarios16, pero no hay estudios a largo plazo que demuestren su eficacia o seguridad.
- •
Glucocorticoides. En diversos estudios los glucocorticoides han demostrado eficacia en el tratamiento del SDRC, principalmente en las fases iniciales, cuando se asocia edema e hipertermia. Actúan inhibiendo la expresión de citocinas proinflamatorias y neuropéptidos en las terminales nerviosas, y la liberación de mediadores como las prostaglandinas. Su uso a largo plazo sería controvertido por los efectos secundarios sistémicos.
- •
Limpiadores de radicales libres. Algunos fármacos con acción sobre radicales libres han demostrado cierta eficacia en la prevención y el tratamiento del SDRC, aunque en fases agudas y con una afectación moderada. La vitamina C a dosis de 500mg/día ha demostrado eficacia en la prevención del SDRC en pacientes que sufrieron fractura de muñeca17, así como la N-acetilcisteína, 600mg/día18. El dimetil sulfóxido en crema al 50% parece que en las fases agudas puede mejorar el dolor y la inflamación de la extremidad10.
- •
Calcitonina. Algunos estudios controlados han demostrado eficacia de la calcitonina en la mejoría del dolor en SDRC, pero no se ha demostrado que mejoren las alteraciones osteoporóticas19.
- •
Bifosfonatos. Estudios controlados han demostrado eficacia en la mejoría del dolor, el edema y la movilidad20.
- •
Vasodilatadores. Aunque, por su mecanismo fisiopatológico, en el tratamiento del SDRC se han utilizado frecuentemente fármacos como el verapamilo, no se ha demostrado su eficacia en estudios controlados.
- •
Anestésicos tópicos: lidocaína. En crema o en parches de absorción transdérmica al 5%, pueden estar indicados en caso de alodinia y/o de hiperalgesia.
El uso de bloqueos nerviosos simpáticos está ampliamente extendido, sobre todo en las fases agudas y asociado al tratamiento rehabilitador. Los bloqueos nerviosos mejoran el dolor a corto plazo y la movilidad articular, y su efectividad es mayor cuando se realizan en los primeros estadios de la enfermedad21, aunque hay pocos estudios potentes fiables, y los escasos estudios controlados no han podido demostrar su eficacia a largo plazo22.
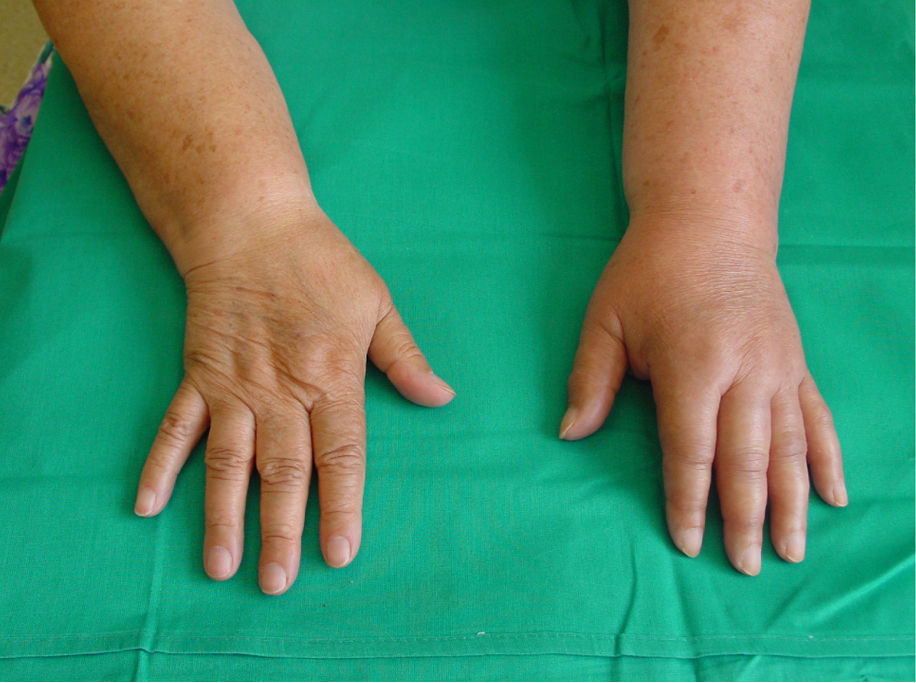
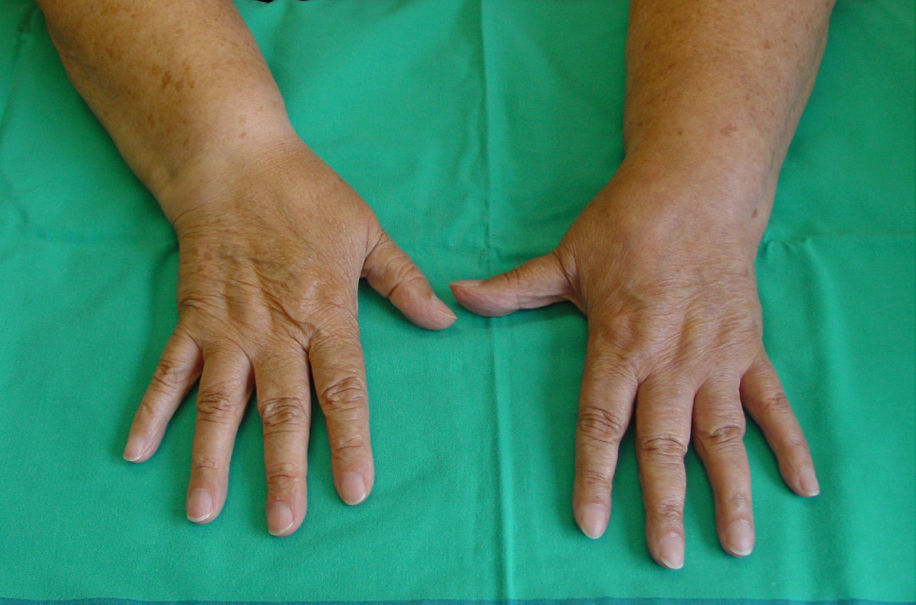
Las técnicas más utilizadas son el bloqueo del plexo braquial, habitualmente por vía axilar, o el bloqueo del ganglio estrellado, en casos de afectación de la extremidad superior, y el bloqueo epidural o el bloqueo simpático lumbar en caso de afectación de la extremidad inferior, administrando anestésico local en dosis única o en perfusión continua a través de un catéter. Estarían indicados en los casos en que se observan síntomas y signos de afectación simpática junto a dolor intenso. El bloqueo proporciona un periodo libre de dolor que permite mejorar la movilidad de la extremidad, lo que posibilita la realización de un tratamiento de fisioterapia intensiva, sobre todo cuando utilizamos técnicas continuas, con perfusión de anestésico local a través de catéter axilar o epidural lumbar (figs. 3 y 4).
La realización de bloqueo regional intravenoso con fármacos simpaticolíticos como la guanetidina o la reserpina, asociados habitualmente a anestésicos locales, está actualmente en desuso, ya que hay resultados controvertidos en diferentes estudios y no se ha demostrado su eficacia. Además es una técnica dolorosa inicialmente, que requiere colocación de un manguito de presión y expresión de la extremidad, por lo que los pacientes con dolor severo no la suelen tolerar. Un estudio controlado de 201123 en que se realizaba bloqueo regional intravenoso con kerolaco y lidocaína, en solo 12 pacientes afectados de SDRC en la extremidad inferior, no evidenció mejoría del dolor a largo plazo ni mejoría de signos inflamatorios como el edema.
SimpatectomíaAlgunos estudios no controlados han demostrado mejoría inicial del dolor tras simpatectomía percutánea, por técnicas de radiofrecuencia o neurólisis24 o quirúrgica, pero existe un alto riesgo de que se produzca recurrencia entre los 6 meses y 2 años, con neuralgia y dolor post-simpatectomía (hasta el 10% en algún estudio).
Neuroestimulación eléctrica medularLa colocación de un neuroestimulador medular a nivel epidural cervical o lumbar para la estimulación de cordones posteriores medulares puede ser una opción en dolor severo invalidante en casos de SDRC que no han respondido a otros tratamientos. Un estudio de 36 casos mostraba eficacia en reducir el dolor y mejoría de la calidad de vida tanto a corto como a largo plazo25.
Perfusiones intratecalesEl implante de un reservorio para perfusión de fármacos por vía intratecal es una técnica admitida en el dolor crónico, pero debe reservarse para pacientes con dolor severo e invalidante en los que han fracasado otros tratamientos. Previamente se hará una prueba, con administración de un bolo del fármaco elegido, y si el test es positivo, con mejoría del dolor y sin que parezcan efectos secundarios importantes, se procede al implante del catéter intratecal conectado al reservorio interno. Los fármacos más utilizados son la morfina, la clonidina, los anestésicos locales como la bupivacaína, o el baclofeno en casos de espasticidad y distonía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.