El Síndrome de Parsonage-Turner (SPT) o Plexitis Braquial, es una neuritis principalmente del tronco superior del plexo braquial, siendo bilateral en un 25% de los casos. Presenta una incidencia de 1,5 casos/100.000 habitantes, sobre todo en varones y durante la 3.a–5.a décadas de la vida. La forma típica es de origen desconocido (aunque se ha descrito asociación con factores desencadenantes y coexiste en ocasiones con procesos inmunes). Consta de varias fases. Fase de neuritis con dolor agudo y súbito en hombro irradiado a la extremidad, fase de parálisis y amioatrofia (deltoides, supraespinoso, infraespinoso, y/o serrato anterior sobre todo) y fase de recuperación que suele durar entre 6 meses y 1 año, sin secuelas, aunque en ocasiones pueden presentar algún déficit motor permanente. En raras ocasiones afecta a la musculatura de mano y dedos. Es una enfermedad rara pero es necesario tenerla en cuenta en cuadros de dolor en región proximal de miembros superiores cuando se asocian síntomas o signos neuromusculares. Se han descrito cambios en la resonancia magnética que pueden ayudar al diagnóstico, como la aparición de señales hiperintensas en supra e infraespinoso, que se interpretan como derivados del edema muscular secundario a la denervación. Tradicionalmente se describe un pronóstico, por lo general, favorable con una recuperación del 75% de los pacientes a los dos años del debut. El tratamiento es sintomático con analgésicos y con medidas físicas y rehabilitadoras.
Brachial plexus neuropathy or Parsonage-Turner Syndrome (PTS) is a form of neuritis that affects mainly the shoulder girdle and upper arm. The syndrome is bilateral in 25% of patients. The incidence is 1.5/100,000 inhabitants with a peak rate between the third and fifth decades of life and a slight predominance in males. The typical form of PTS is of unknown cause (although triggering factors have been described and the syndrome sometimes coexists with immune processes). There are several phases. The neuritis phase is characterized by sudden and severe shoulder and upper arm pain, paralysis and amyotrophy (especially the supraspinatus, infraspinatus, serratus anterior, and deltoid muscles) and a recovery phase, lasting between 6 and 12 months, without sequelae, although muscular wasting and weakness may sometimes be permanent. On rare occasions, the muscles of the hands and fingers can be affected.
PTS is a rare disease but should be considered when there is pain in the upper extremity or cervical spine or there are neuromuscular signs and symptoms. Magnetic resonance imaging can reveal muscle changes associated with PTS: high signal intensity in the muscles of the shoulder girdle with atrophy, compatible with muscle edema associated with denervation. Prognosis is generally favorable, with about 75% of patients showing complete recovery within 2 years. Treatment is symptomatic and is based on analgesic drugs and physical therapy.
La neuritis braquial o neuralgia amiotrófica, denominada en la actualidad como Síndrome de Parsonage-Turner (SPT), fue descrita inicialmente por Feinberg en 1897 en un caso asociado a influenza, posteriormente tomó varios nombres: parálisis del serrato mayor1, neuritis localizada del hombro2, o radiculitis braquial aguda3. Fueron Parsonage y Turner quienes describieron en 19484 en 136 soldados y posteriormente en 82 pacientes5 el cuadro clínico bajo el término «Neuralgia amioatrófica del Hombro». Se trata de un síndrome clínico de presentación infrecuente y de etiología desconocida. El paciente consulta típicamente por omalgia aguda y de rápida aparición que puede llegar a durar hasta de 2 semanas, seguido de debilidad y pérdida de masa muscular en hombro y zona proximal del brazo (parálisis fláccida) con escasa participación sensitiva y cediendo el dolor cuando se desarrolla la parálisis4. Se han descrito cuadros de amiotrofia neurálgica o del plexo braquial con carácter hereditario y transmisión autonómica dominante afectando al cromosoma 17 (17p25)6. También se ha descrito un síndrome similar afectando a la cintura pélvica7.
Es necesario hacer el diagnostico diferencial con otras patologías que afectan tanto a la cintura escapular como a los miembros superiores:
- •
Causas de dolor agudo, como afectación de los rotadores, capsulitas adhesiva, artritis, osteopatías, neuralgia cervicobraquial, afectación por el VVZ.
- •
Causas de paresia y amioatrofia: mielo-radiculopatías compresivas discogénicas, tumores espinales o del plexo, síndrome de Pancoast, síndromes del desfiladero torácico, disección de las arterias cervicales, poliomielitis anterior, ELA.
El plexo braquial está constituido por la unión de los ramos ventrales de las raíces nerviosas C5-C8, y de la primera raíz torácica T1. Se extiende hacia abajo y lateralmente a cada lado desde la cuarta vértebra cervical hasta la primera vértebra torácica. El plexo se divide en tres troncos:
- •
el tronco superior, que procede de la unión de las raíces C5 y C6.
- •
el tronco medio, constituido por la raíz C7.
- •
el tronco inferior, procedente de las raíces C8 y T1.
Los ramos del plexo braquial se dividen en dos grupos en función de si su origen es por encima o por debajo de la clavícula:
- •
los ramos supraclaviculares comprenden: el nervio dorsal de la escápula, el torácico largo, el supraescapular, el nervio del músculo subclavio, el colateral para el nervio frénico, y los nervios para los escalenos y el largo del cuello.
- •
los ramos infraclaviculares son: el pectoral externo, el pectoral interno, los subescapulares superior e inferior, el toracodorsal, el axilar, el musculocutáneo, el cutáneo externo del antebrazo, la raíz externa del mediano, la raíz interna del mediano, el braquial cutáneo interno, el accesorio del braquial cutáneo interno, el cubital y el radial.
El plexo braquial se encarga de brindar y recibir toda la inervación motora y sensitiva del miembro superior, excepto una zona adyacente al hombro cuya sensibilidad corresponde al plexo cervical por medio de los nervios supraclavicular y supraacromial, y otra zona en la parte interna del brazo que corresponde al nervio intercostobraquial, rama del segundo nervio intercostal.
EtiologíaLa causa exacta del proceso es desconocida hasta la fecha. La hipótesis actual es que los episodios están causados por una respuesta mediada por mecanismos inmunitarios al plexo braquial. Se han propuesto una serie de factores precipitantes que pueden contribuir al desarrollo de la plexitis y se han encontrado en aproximadamente el 30–85% de los casos precediendo al debut del dolor2–4,8–10. Los factores más frecuentemente referidos son de 4 tipos:
- •
Infecciones, tanto bacterianas (Borrelia), como virales (CMV, gripe, VIH). De hecho Tsairis registró en su estudio que en el 25% de los pacientes el inicio de los síntomas venía precedido por una infección viral sistémica9. Es más, se han descrito agregación epidemiológica de casos de neuralgia amiotrófica en asociación con enfermedad febril o infección viral en la República Checa22, y en nativos americanos del suroeste de Estados Unidos23.
- •
Existen registros previos que muestran asociación de la neuralgia amiotrófica con intervenciones quirúrgicas recientes, o partos2,4,9,20,24. En 1994 Malamut25 describió en 6 pacientes operados esta dolencia. Sin embargo la explicación de su relación con la cirugía es puramente especulativa: se considera la posibilidad de que el estrés quirúrgico active algún virus que afecte a las raíces nerviosas, pero no existe estudio serológico ni viral que lo confirme20.
- •
Se ha intentado relacionar con situaciones de postinmunización (vacunas), y de autoinmunidad (PAN, LES, arteritis de células gigantes, sueroterapia, inyecciones subcutáneas de alergenos)2–4,8–13.
- •
Por último se ha especulado acerca de la posible asociación con los traumatismos, o el ejercicio físico extenuante.
No obstante el papel de todos estos factores permanece en el ámbito de la hipótesis puesto que no han podido ser comprobados.
La secuencia fisiopatológica podría estar relacionada con la aparición de edema perineural de forma similar al producido en los cuadros de urticaria, o por la especial «atracción» de linfocitos circulantes sensibilizados hacia los nervios del plexo braquial. Se ha encontrado activación del complemento en la fase aguda del cuadro.
EpidemiologíaEn la población de Estados Unidos, Beghi et al describieron una incidencia de 1,64 por 100.00014, en un estudio que utilizaba la base de datos de la clínica Mayo. En el Reino Unido la incidencia de la neuritis braquial es aproximadamente 3 por 100.000 personas y año26. Sin embargo es posible que su incidencia real sea superior, teniendo en cuenta que se trata de una entidad frecuentemente infradiagnosticada27. Tiene una distribución preferente entre la tercera y quinta décadas de la vida, con una edad media al debut de 38 años, y predominio masculino, con una ratio hombre-mujer de 4,1/1,749,4,15.
Descripción clínicaLos pacientes refieren dolor local a nivel del hombro como síntoma más habitual4,5,8,9. Es con frecuencia de inicio súbito y a menudo severo pudiendo despertar al paciente durante el descanso nocturno. Empeora progresivamente en horas o días, siendo su duración más habitual de pocas horas a tres semanas, y suele desaparecer igualmente de forma repentina, aunque en ocasiones persiste un leve dolor residual. No se exacerba por la tos o la movilización del raquis cervical, pero sí por los movimientos del miembro superior y a la presión de las masas musculares.
El dolor se distribuye a través de la escápula al acromion, e irradia por la cara externa del brazo y del cuello, rara vez es distal al codo. No hay una correlación exacta de la localización del dolor y la posterior distribución de la paresia, sin embargo el dolor que se irradia por debajo del codo se asocia a la afectación del bíceps o tríceps, y si se irradia al cuello afecta al esternocleidomastoideo o al trapecio. El tiempo que transcurre hasta la aparición de la paresia es altamente variable, y ésta persiste una vez desaparece el dolor, siendo en un 25% de los casos bilateral11. La parálisis es fláccida, parcheada, y usualmente progresiva, afecta sobre todo a la elevación del hombro y abducción del miembro superior. Se trata de una afectación de tipo motoneurona inferior, con reflejos hipoactivos y ocasionalmente fasciculaciones5,8,9.
En función de la localización anatómica de la lesión se han descrito varios patrones de paresia, dependiendo de si están afectados solo nervios periféricos, raíces, o una combinación de ambos. El patrón más frecuentemente descrito corresponde a la afectación de varios nervios periféricos, entre los que se encuentran el supraescapular, axilar, torácico largo, y musculocutáneo5,8,9. Cuando se afecta el nervio frénico se produce una parálisis diafragmática con disnea16. Respecto a las raíces nerviosas, las que mas frecuentemente se afectan son la C5 y C6, que corresponden al tronco superior del plexo braquial.
Atendiendo al músculo afectado, el que se describe con más frecuencia ha sido el deltoides, seguido del supraespinoso, infraespinoso, serrato mayor, bíceps, tríceps y extensores del carpo y dedos4,5,16,17. Normalmente se trata de un proceso ipsilateral, aunque se describe afectación bilateral, pero asimétrica en cuanto a los músculos y al grado de afectación. Al inicio del cuadro, muchos pacientes refieren hipoestesia localizada, aunque la afectación sensitiva es discreta siendo la zona más afecta la correspondiente al área de distribución del nervio circunflejo.
DiagnósticoEl SPT tiene un diagnóstico inicialmente clínico, apoyado por la exploración física, y el examen electromiográfico. La sospecha clínica se basa en el patrón de dolor severo de inicio súbito, seguido de atrofia y debilidad con recuperación lenta28. Los estudios de laboratorio suelen resultar normales y están indicados solo si se sospecha una enfermedad sistémica subyacente29. Asimismo la radiografía convencional del hombro no mostrará alteraciones relevantes, pero puede estar indicada para descartar patología específica osteo-articular.
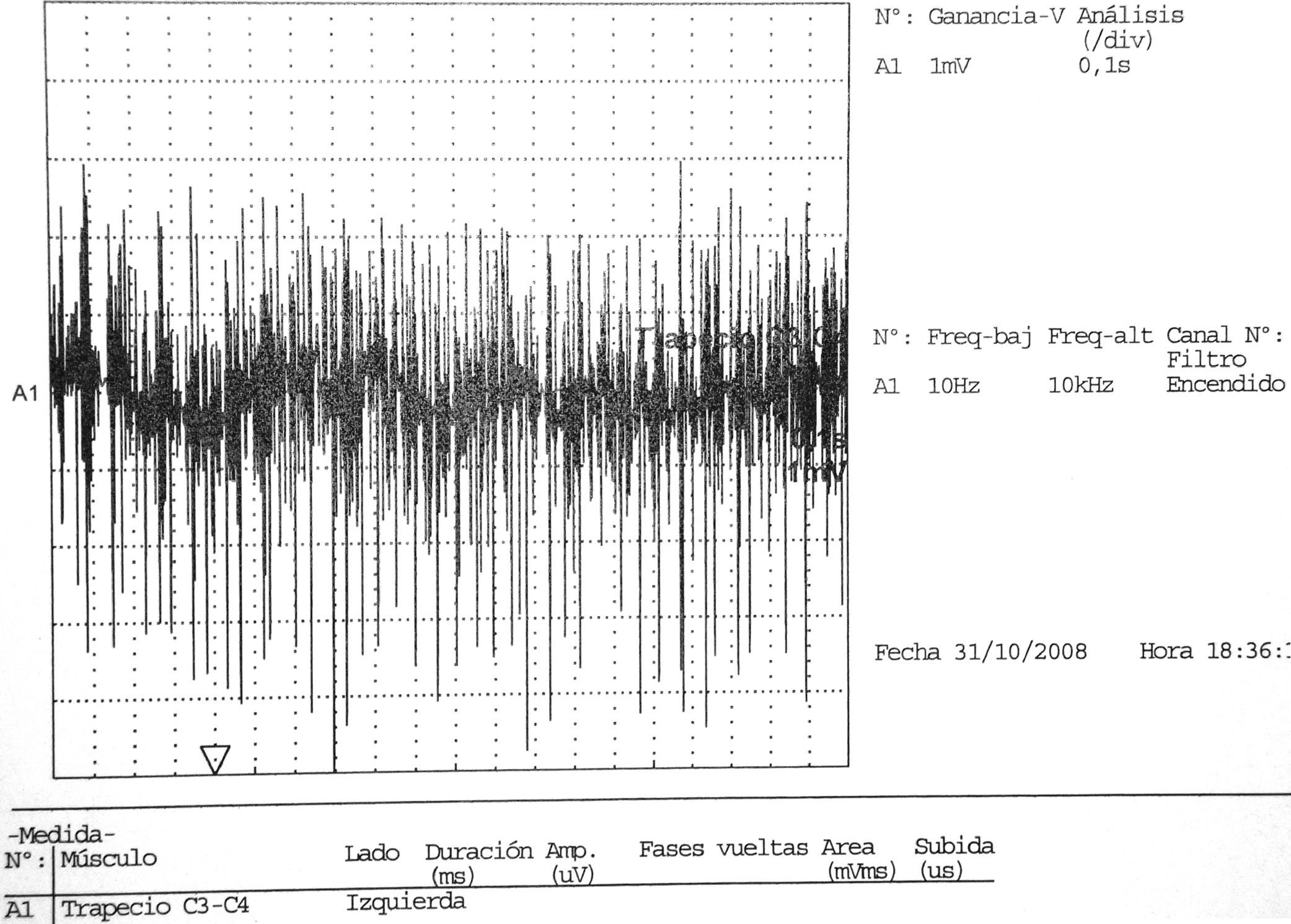
Los estudios de conducción nerviosa se consideran de apoyo y sirven para excluir mononeuropatías más frecuentes, mientras que el electromiograma (EMG) es importante para documentar la denervación. El patrón de denervación puede revelar tanto afectación de un nervio específico, como una afectación parcheada de todo el plexo. El EMG realizado al menos 3 o 4 semanas tras el inicio de los síntomas es útil para aportar el patrón específico de afectación muscular, y por lo tanto ayuda a identificar la localización hipotética de la lesión neurológica30. Asimismo determina la extensión de la denervación, una posible afectación subclínica contralateral31, y permite excluir una lesión traumática o compresiva. El nervio que se afecta con mayor frecuencia es el supraescapular (fig. 1), rama del tronco superior del plexo braquial14, si bien otros autores como Preston y colegas32 sostienen que son el torácico largo y los interóseos anteriores los más afectados, pero se puede encontrar implicación hasta de nervios craneales33. El hallazgo típico es una denervación aguda derivada de una neuropatía axonal30, (fig. 2, tablas 2 y 3). En algunos registros infrecuentes se ha encontrado evidencia de bloqueo proximal de la conducción nerviosa sugiriendo desmielinización focal proximal34. Las siguientes características son muy sugestivas de SPT30:
- •
Discrepancia en cuanto a la denervación entre músculos inervados por el mismo nervio.
- •
Distribución parcheada de la denervación para músculos inervados por diferentes nervios o por un tronco nervioso del plexo braquial.
- •
Disociación entre los potenciales de acción de un nervio y la denervación muscular que depende del mismo nervio.
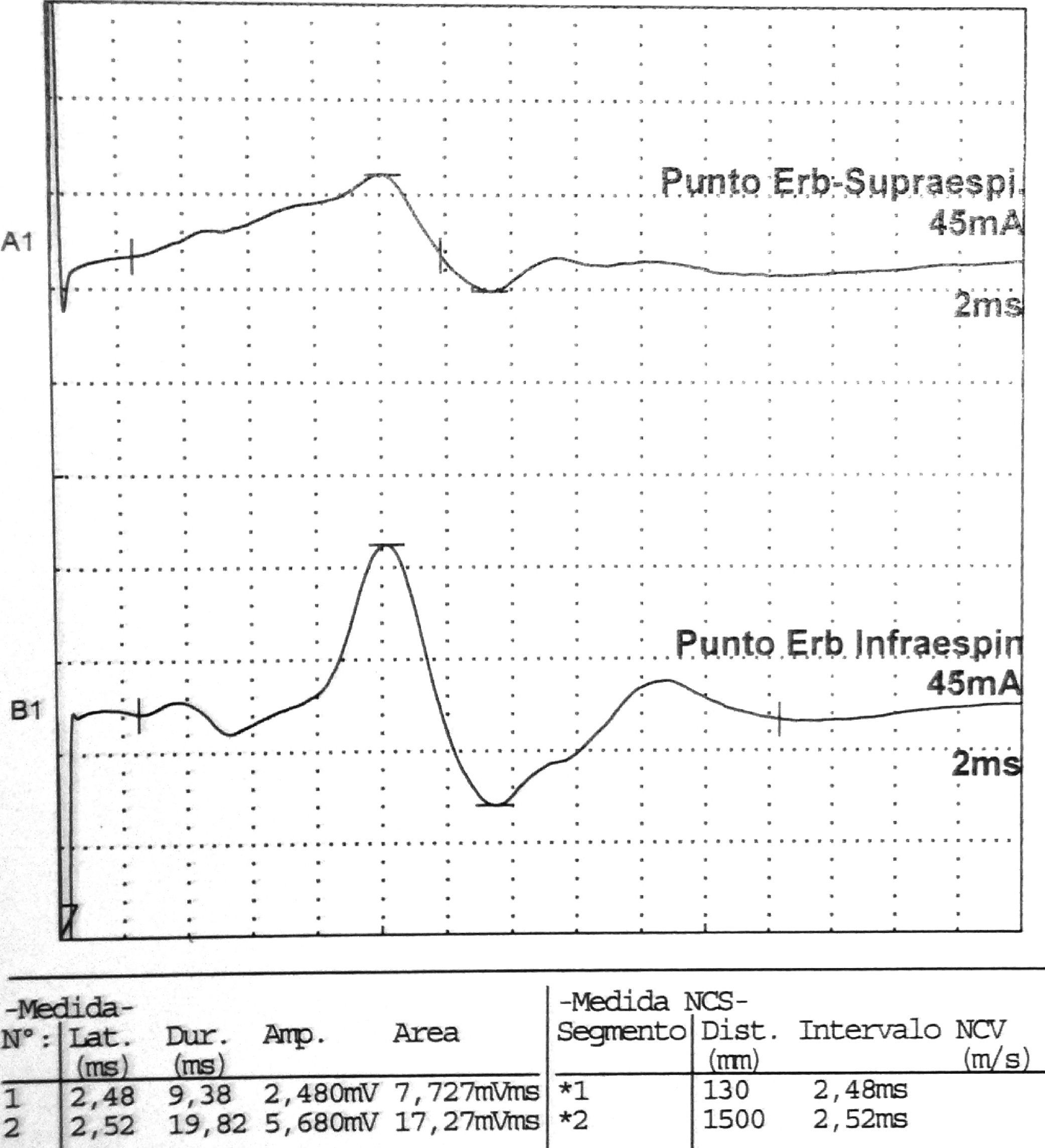
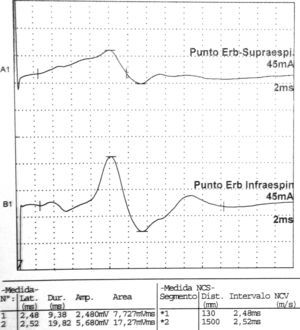
Datos correspondientes a un varón de 38 años con dificultad de abducción del MSI y escapula alata con axonotmesis de nervios de cintura escapular. Electroneurografía motora del n. supraescapular con marcada reducción en la amplitud de las respuestas obtenidas tras la estimulación. La EMG de aguja que se realizó mostró intensos signos de denervación activa (sugerente de neuropatía axonal) en la musculatura dependiente del supraescapular: supraespinoso e infraespinoso.
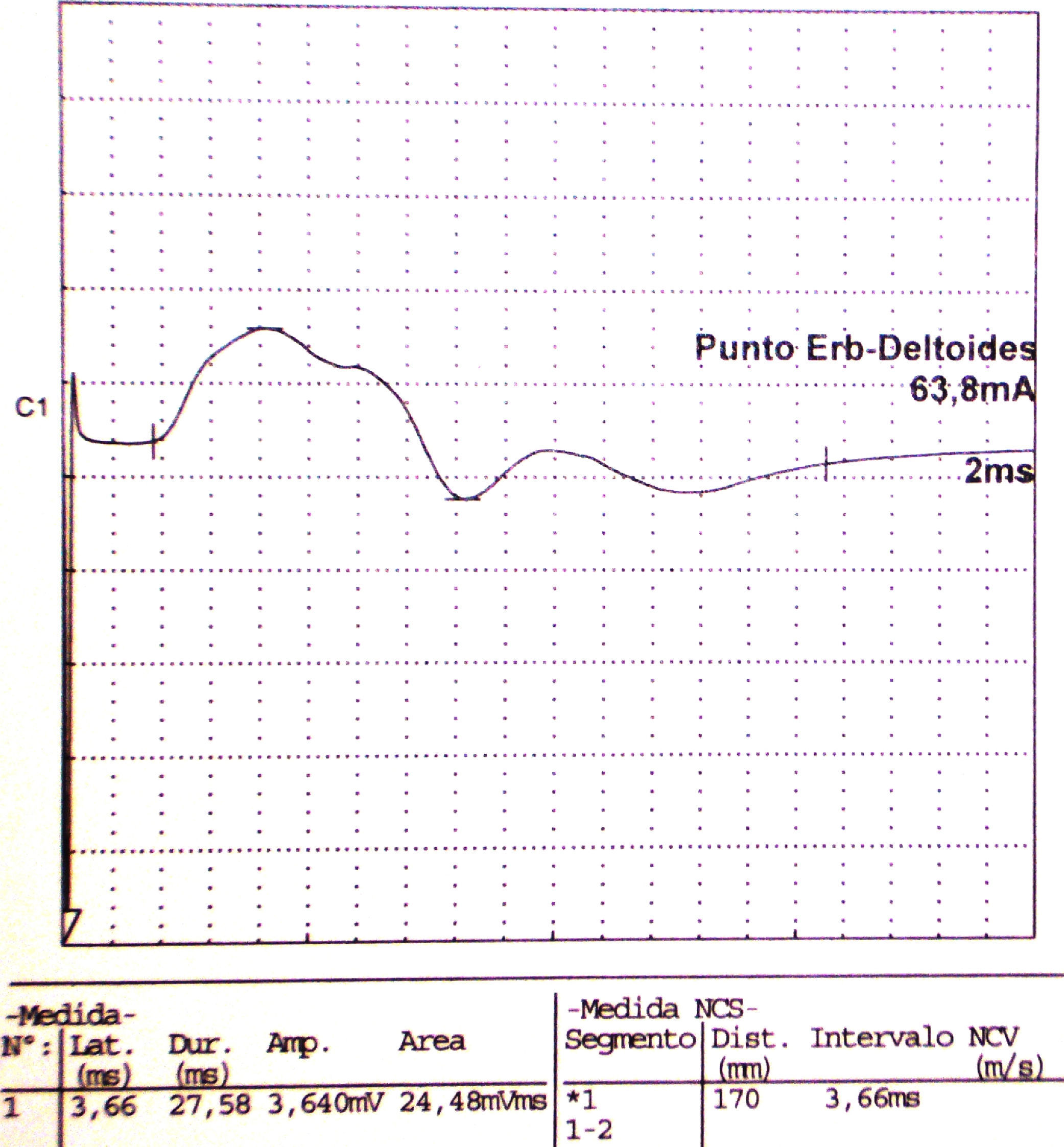
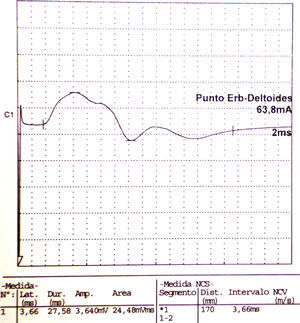
Electroneurografía motora del n. axilar del mismo paciente con reducción en la amplitud de las respuestas obtenidas tras la estimulación. La EMG de aguja que se realizó mostró intensos signos de denervación activa (sugerente de neuropatía axonal) en la musculatura dependiente de este nervio: deltoides.
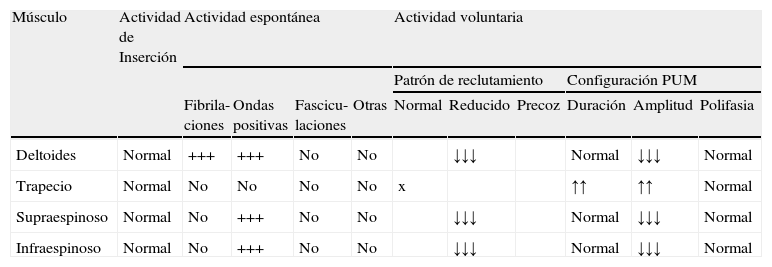
Hallazgos electromiográficos
| Músculo | Actividad de Inserción | Actividad espontánea | Actividad voluntaria | ||||||||
| Patrón de reclutamiento | Configuración PUM | ||||||||||
| Fibrila-ciones | Ondas positivas | Fascicu-laciones | Otras | Normal | Reducido | Precoz | Duración | Amplitud | Polifasia | ||
| Deltoides | Normal | +++ | +++ | No | No | ↓↓↓ | Normal | ↓↓↓ | Normal | ||
| Trapecio | Normal | No | No | No | No | x | ↑↑ | ↑↑ | Normal | ||
| Supraespinoso | Normal | No | +++ | No | No | ↓↓↓ | Normal | ↓↓↓ | Normal | ||
| Infraespinoso | Normal | No | +++ | No | No | ↓↓↓ | Normal | ↓↓↓ | Normal | ||
↓ Ligeramente reducido.
↓↓ moderadamente reducido.
↓↓↓ intensamente reducido NV no valorable.Datos correspondientes a un varón de 38 años con dificultad de abducción del MSI y escapula alata con axonotmesis de nervios de cintura escapular. La Electromiografía presenta intensos signos de denervación activa en deltoides, infra y supraespinoso. Éstos no presentan aún hallazgos de reinervación.
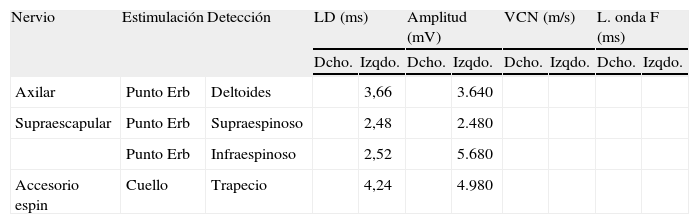
Electroneurografía motora
| Nervio | Estimulación | Detección | LD (ms) | Amplitud (mV) | VCN (m/s) | L. onda F (ms) | ||||
| Dcho. | Izqdo. | Dcho. | Izqdo. | Dcho. | Izqdo. | Dcho. | Izqdo. | |||
| Axilar | Punto Erb | Deltoides | 3,66 | 3.640 | ||||||
| Supraescapular | Punto Erb | Supraespinoso | 2,48 | 2.480 | ||||||
| Punto Erb | Infraespinoso | 2,52 | 5.680 | |||||||
| Accesorio espin | Cuello | Trapecio | 4,24 | 4.980 | ||||||
NR: no respuesta.
La Neurografia está caracterizada por marcada reducción en la amplitud de las respuestas obtenidas al estimular todos los nervios reseñados (indicativo de daño axonal).
En ocasiones, músculos no afectados clínicamente pueden mostrar anomalías en el EMG, esto ocurre hasta del 30% al 50% de los casos30. Durante la fase de recuperación se detectan potenciales gigantes polifásicos21 (fig. 3).
En cuanto a la resonancia magnética nuclear (RMN), su uso ha mejorado la evaluación neuroradiológica de muchas enfermedades, incluidas aquellas que afectan al sistema nervioso periférico, como el SPT. En este caso, la RMN de columna cervical y plexo braquial sirve para descartar cualquier proceso patológico local. Se aprecian típicamente señales hiperintensas en T2 en los músculos del hombro antes de la instauración de la atrofia muscular, y pueden aparecer varios días tras la aparición de los síntomas, así como persistir meses21 hasta la instauración de la atrofia muscular. Aunque estas imágenes no son específicas de este proceso30.
En un estudio publicado en 2006 por Scalf et al35 en el que se revisan 26 RMN de pacientes diagnosticados de síndrome de SPT por la clínica y el EMG, se encuentra que en el 85% de los casos se afecta el lado derecho, pero sin existir correlación estadísticamente significativa entre el lado afecto y el brazo dominante del paciente. Asimismo muestra como la mayoría de los pacientes, el 85%, tiene afectación de más de un músculo, y el 65% de 3 o más músculos, siendo los más frecuentes el supra e infraespinoso. Esto último concuerda con la afectación del nervio supraescapular en el EMG, dado que inerva a ambos músculos. De hecho, en un artículo publicado por Gaskin y Helms también en 200636 se pone de manifiesto como de 27 pacientes con SPT a los que se le realizan 30 estudios con RMN (2 pacientes presentaban afectación bilateral), el 97% tiene afectación del nervio supraescapular, el 50% de forma exclusiva, presentando el resto además compromiso de otros nervios del plexo braquial, entre ellos el axilar, y el subescapular. No existe ninguna imagen específica para este proceso, solo edema muscular, seguido de atrofia. El estudio de Scalf concluye que la RMN es una importante herramienta diagnóstica para el SPT, puesto que excluye las causas más frecuentes de dolor de hombro, como la patología del manguito de los rotadores, inpingement, o desgarro del labrum glenoideo. Además la RMN aventaja a otras exploraciones complementarias, dado que excluye anomalías estructurales que pueden causar cambios similares de denervación en la musculatura del manguito. Otro aporte interesante de la RMN es la secuencia temporal de las imágenes, que nos puede ofrecer información del estado evolutivo del proceso. En la fase aguda la intensidad de señal a nivel de la musculatura puede ser normal. El cambio más tempranamente detectable en los músculos denervados es un aumento difuso de la intensidad de señal en T2 debido al edema, lo cual puede ocurrir sin cambios de señal en la secuencia T1. Sin embargo Wessig et al37 sostienen que el aumento de la intensidad de señal T2 es probablemente debido al incremento de volumen de la sangre capilar en los músculos parcialmente denervados. En las fases subaguda y crónica, las anomalías en T2 persisten y aparece la atrofia muscular, que se manifiesta por disminución de la masa muscular, y aumento de la intensidad de señal lineal intramuscular en T1 debido a la infiltración grasa. Estos cambios pueden revertir a la normalidad en varios meses tras la fase crónica. Habitualmente no se dispone de RMN de seguimiento, debido a que en la mayoría de los pacientes el proceso se resuelve sin secuelas, y no precisan más estudios radiológicos. De los 26 pacientes del estudio de Scalf35 el único en que se realizó una RMN de control mostraba normalización completa de las imágenes a los 8 meses.
Sin embargo la RMN tiene algunas limitaciones para el diagnóstico de SPT. No existe un referente de imagen que se pueda considerar estándar36, sino que el diagnóstico se hace por la identificación del aumento de intensidad de señal de T2 en el músculo, que es compatible con la afectación de nervios del plexo braquial, así que otras causas potenciales de aumento anómalo de la señal de T2 como traumatismo, o atrapamiento de nervio periférico, deben ser excluidas. Otra limitación es la posible aparición de falsos negativos cuando la RMN se realiza muy precozmente (antes de la instauración del edema muscular). Del mismo modo también puede presentarse como un falso positivo muy difícil de descartar, la neuropatía compresiva del nervio supraescapular38 por un ganglión que se descomprime espontáneamente, dejando visible solamente el edema y la atrofia del supra e infrespinoso. No obstante, cuando esto ocurre, se asocia en un 100% de los casos a rotura del labrum posterior, y además los síntomas comienzan de forma insidiosa.
En definitiva, no existe ninguna exploración complementaria específica para el diagnóstico de SPT. Tanto la RMN como el EMG deben ser interpretados en el contexto de la historia clínica, teniendo precaución de excluir antecedentes de traumatismo, y situaciones de sobrecarga física.
Diagnóstico diferencialEl SPT es, a menudo, confundido clínicamente con otras entidades más comunes y mejor conocidas. Al inicio del cuadro, el dolor agudo en torno al hombro puede conducir a errores diagnósticos, ya que puede tener lugar en muchas otras patologías locales30, como:
- •
desgarros del manguito de los rotadores.
- •
capsulitis adhesiva glenohumeral.
- •
tendinitis calcificante.
- •
artritis de hombro.
- •
afectación ósea local.
- •
cervicobraquialgia.
- •
herpes Zóster.
Con la progresiva afectación muscular, y la aparición de debilidad muscular e incluso parálisis, otras patologías de la segunda motoneurona entran en el diagnóstico diferencial:
- •
radiculopatía compresiva.
- •
tumores de médula espinal o plexo braquial.
- •
tumores infiltrantes de la raiz nerviosa o del plexo braquial como el tumor de Pancoast.
- •
neuralgia del supraescapular, gran torácico, o síndrome de la abertura torácica superior.
- •
lesiones nerviosas traumático-compresivas.
- •
disección de arteria cervical.
- •
poliomielitis previa.
- •
ELA.
Su diagnóstico debe tenerse en cuenta, de un modo general, en aquellos pacientes con omalgia sin historia previa de traumatismo (tabla 1), y si bien se considera que el traumatismo es la causa más común de plexopatía braquial, Moghekar et al39 encuentran en una serie de 203 pacientes, que la neuralgia amiotrófica fue la principal causa.
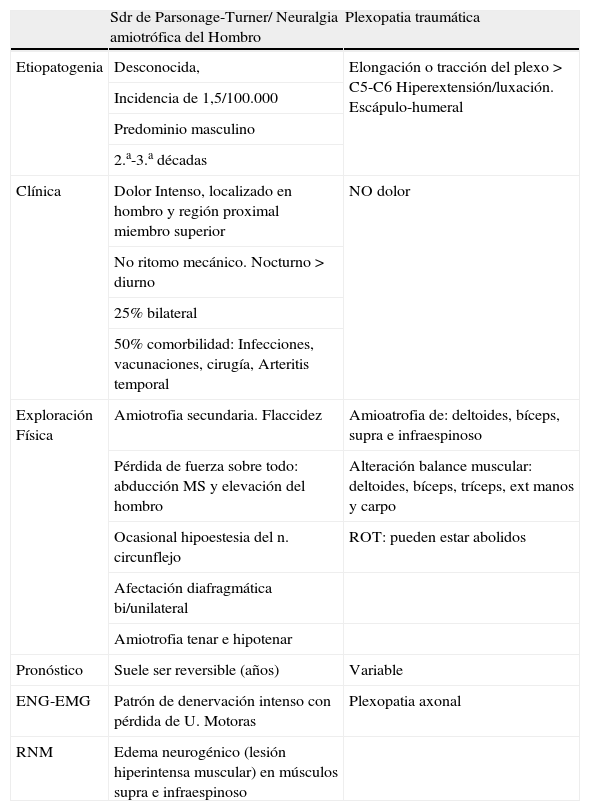
Diagnóstico diferencial Síndrome Parsonage-Turner/plexopatía braquial traumática
| Sdr de Parsonage-Turner/ Neuralgia amiotrófica del Hombro | Plexopatia traumática | |
| Etiopatogenia | Desconocida, | Elongación o tracción del plexo > C5-C6 Hiperextensión/luxación. Escápulo-humeral |
| Incidencia de 1,5/100.000 | ||
| Predominio masculino | ||
| 2.a-3.a décadas | ||
| Clínica | Dolor Intenso, localizado en hombro y región proximal miembro superior | NO dolor |
| No ritomo mecánico. Nocturno > diurno | ||
| 25% bilateral | ||
| 50% comorbilidad: Infecciones, vacunaciones, cirugía, Arteritis temporal | ||
| Exploración Física | Amiotrofia secundaria. Flaccidez | Amioatrofia de: deltoides, bíceps, supra e infraespinoso |
| Pérdida de fuerza sobre todo: abducción MS y elevación del hombro | Alteración balance muscular: deltoides, bíceps, tríceps, ext manos y carpo | |
| Ocasional hipoestesia del n. circunflejo | ROT: pueden estar abolidos | |
| Afectación diafragmática bi/unilateral | ||
| Amiotrofia tenar e hipotenar | ||
| Pronóstico | Suele ser reversible (años) | Variable |
| ENG-EMG | Patrón de denervación intenso con pérdida de U. Motoras | Plexopatia axonal |
| RNM | Edema neurogénico (lesión hiperintensa muscular) en músculos supra e infraespinoso |
Desde un punto de vista clínico, el comienzo súbito del dolor seguido de una rápida mejoría o resolución, a medida que tiene lugar la debilidad y la parálisis, constituyen el patrón característico del SPT30, a diferencia de la radiculopatía cervical, por ejemplo, en la que el dolor, la debilidad, y la hipoestesia tienden a ocurrir simultáneamente.
TratamientoNo existe un tratamiento específico para el SPT40, pero existe unanimidad en cuanto a que este debe ser conservador y no quirúrgico. Los objetivos terapéuticos son reducir el dolor, prevenir la restricción de la movilidad, y recuperar la fuerza muscular33,41. En cuanto al primero de los objetivos, durante las primeras semanas de evolución los analgésicos de primer escalón de la O.M.S. pueden no ser suficientes para el control del dolor, por lo que algunos pacientes llegan a requerir opioides. Existe algún caso en el que se ha usado gabapentina a dosis de 1.800mg/día42 por su utilidad en el dolor de características neuropáticas, obteniéndose un rápido alivio del mismo. Sin embargo no existe evidencia científica al respecto.
En las fases iniciales se ha recomendado tratamiento con corticoides e inmunoglobulinas, basándose en la hipótesis neuroalérgica del síndrome43, con el objeto de prevenir la debilidad muscular, pero la eficacia de estas medidas no ha sido probada. En una reciente revisión Cochrane27 sobre el tratamiento para la amiotrofia neurálgica se identifican sólo 3 estudios observacionales que contengan más de 10 casos con tratamiento.
El primero de ellos es una serie de casos consecutivos de 99 pacientes (70 hombres), en el que Tsairis et al9 mencionan a 15 pacientes tratados con corticosteroides (10 con prednisolona oral, y 5 con hormona adrenocorticotrópica intramuscular), 15 pacientes tratados con inyecciones de cortisona en el hombro, y 22 pacientes tratados con fisioterapia. Las prescripciones de esteroides fueron «en dosis moderadas en la fase inicial de la enfermedad» y se proporcionó fisioterapia «durante períodos prolongados», sin proporcionar detalles adicionales del tratamiento. Los autores sostienen que el tratamiento inicial con corticosteroides sistémicos no parece alterar el curso de la enfermedad, aunque algunos pacientes informaron alivio del dolor. Así mismo, 8 de los 15 pacientes que recibieron inyecciones en el hombro informaron alivio del dolor. La fisioterapia no pareció acelerar la recuperación.
El segundo estudio, de van Alfen et al44 describe a 41 pacientes tratados con corticosteroides en una serie de 246 pacientes; se brindan detalles clínicos para 29 pacientes (16 hombres). El tiempo mediano transcurrido hasta el inicio del tratamiento fue de 13 días. En 18 pacientes, se utilizó el mismo esquema terapéutico consistente en un curso de 2 semanas de prednisolona oral, 60mg diarios en la primera semana y reducción con 10mg por día en la segunda semana; en los otros pacientes, variaron la dosis y la duración. Cuatro de 20 pacientes (20%) manifestaron subjetivamente que el tratamiento había tenido una influencia positiva en sus síntomas. El tiempo mediano transcurrido hasta obtener una disminución del dolor fue de 5 días en comparación con 20 días en el grupo sin tratar. En el 8% (3/37) de los pacientes tratados, se documentó una recuperación total en un plazo de un mes desde la aparición, en comparación con el 5% (11/203) de los pacientes en el grupo sin tratar. Tras un seguimiento medio de 1,3 años, solo el tiempo transcurrido hasta el inicio de la recuperación de la paresia fue significativamente más corto desde el punto de vista estadístico en los pacientes tratados. El 31% (8/26) presentó efectos secundarios, 4 de ellos suspendieron el tratamiento por este motivo.
El tercer estudio de van Eijk et al45 consiste en un análisis retrospectivo de 50 pacientes diagnosticados de SPT (24% neuralgia amiotrófica hereditaria) tratados con prednisona oral en un plazo de un mes desde la aparición en comparación con una cohorte histórica de 203 pacientes sin tratar (19,2% neuralgia amiotrófica hereditaria). Se encontró un tiempo mediano más corto transcurrido hasta el alivio del dolor en el grupo tratado (12,5 días) en comparación con los pacientes sin tratar (20,5 días), y más pacientes recuperaron la fuerza en el primer mes (18% versus 6,3%) en el grupo tratado. Después de un año, se encontró recuperación total en el 12% de los pacientes tratados y en solo el 1% de los controles, mientras que una recuperación buena (pero no completa) también fue más frecuente en el grupo tratado (44% versus 10,7%). El 20% de los pacientes presentaron efectos secundarios de la prednisona oral, que no les obligaron a interrumpir el tratamiento. Se concluye que la prednisona oral parece ser eficaz cuando se inicia en la fase aguda del SPT.
Tras la fase aguda, el tratamiento es fundamentalmente rehabilitador, con los objetivos de mantener la movilidad articular completa y estimular la contracción muscular. Los ejercicios de movilidad activa y pasiva deben comenzarse tan pronto como se haya conseguido el adecuado control del dolor. Ejercicios de fortalecimiento de la musculatura del manguito de los rotadores, y de estabilización escapular pueden estar indicados29. Asimismo, modalidades de tratamiento pasivo como calor, frío, o estimulación nerviosa transcutánea (TENS), pueden resultar útiles como coadyuvantes para el tratamiento del dolor.
En los casos excepcionales en los que no se consigue una buena recuperación física al cabo del segundo año, puede considerase la opción de la cirugía, con el objeto de mejorar la abducción del hombro29. Se han comunicado algunos casos de injerto de nervio, transferencia de tendón46, así como fijación quirúrgica de la escápula al tórax47.
PronósticoLos datos publicados a este respecto en la literatura científica son variables. Tradicionalmente se ha defendido que el SPT tiene un buen pronóstico a largo plazo, y que la debilidad comienza a desaparecer al mes del debut en la mayoría de los casos, con una recuperación completa a los dos años del 75% de los casos9, y del 90% a los tres años48. Sin embargo el tiempo hasta alcanzar la recuperación completa es variable, habiéndose considerado predictores de lentitud en la recuperación38:
- •
la intensidad y duración del dolor.
- •
el número de nervios afectados.
- •
el nivel de compromiso del plexo braquial.
- •
enfermedad bilateral.
- •
afectación de nervios inferiores del plexo braquial.
Existen otros registros que ofrecen resultados más desfavorables en cuanto al pronóstico. En la publicación de Van Alfen de 200644, en la que se revisan 199 pacientes con SPT, existe un subgrupo de 39 pacientes a los que se les realiza un seguimiento mínimo de tres años, demostrándose que más allá de este periodo de tiempo el 69,4% de los pacientes aún presentan paresia leve, un 13,9% paresia moderada, y un 2,8% paresia severa. Asimismo se documenta una tasa de recurrencias de la enfermedad del 26% durante un seguimiento medio de 6 años, frente a la ratio de 1–% descrita clásicamente17–19,33,49. El tiempo medio hasta la recurrencia fue de unos dos años. Estos datos, por tanto, contrastan con el supuesto pronóstico favorable registrado previamente en la literatura, si bien, esta discrepancia puede ser explicada al menos parcialmente, por las diferencias existentes en cuanto a la definición de recuperación empleada entre los diferentes registros.
ConclusionesEl dolor de hombro es un frecuente motivo de consulta médica, no solo en la práctica clínica desarrollada por reumatólogos, traumatólogos, y rehabilitadores, sino también para internistas, neurólogos, médicos de atención primaria, y de urgencias. En su diagnóstico diferencial deben incluirse otros procesos además de aquellos que afectan exclusivamente a la articulación glenohumeral y estructuras músculo-tendinosas relacionadas. Es precisamente en los pacientes con omalgia sin historia previa de traumatismo donde adquiere especial consideración el SPT o neuralgia amiotrófica, entidad clínica dolorosa de origen no traumático que afecta a la cintura escapular de forma uni o bilateral. Los pacientes con SPT se presentan típicamente con dolor de inicio súbito a nivel del hombro. Clínicamente establecer un diagnóstico puede ser difícil, ya que los síntomas no son en absoluto específicos, y pueden emular otras patologías locales tanto del hombro (desgarro del labrum con bursitis asociada, rotura del manguito de los rotadores, impingement, y capsulitis adhesiva) como de la columna cervical (radiculopatía compresiva, tumores de médula espinal…). De ahí que se trate de una enfermedad frecuentemente infradiagnosticada, y no solo eso, sino que en muchos de los enfermos en los que se identifica el cuadro clínico, se produce un retraso diagnóstico considerable, con un tiempo medio hasta el mismo de 10,5 semanas44.
No existen pruebas complementarias específicas que permitan confirmar el diagnóstico de la neuralgia amiotrófica, por lo que este está basado sobre todo en la historia clínica y en la exploración física. Ello exige que haya que prestar especial atención a la modalidad del dolor, atendiendo a si este presenta características y distribución neuropáticas. No obstante, tanto el electromiograma, como la RMN proporcionan valiosa información que ha de interpretarse adecuadamente en el contexto clínico del paciente. El EMG muestra típicamente una denervación aguda derivada de una neuropatía axonal, y en la RMN aparecen precozmente señales hiperintensas en T2 en los músculos del hombro antes de que se desarrolle la atrofia. Posteriormente se manifiesta un aumento de la intensidad de señal lineal intramuscular en T1 debido a la infiltración grasa. Sin embargo ninguno de estos hallazgos son patognomónicos para el SPT. La reciente aplicación de la RMN tiene ventajas para el proceso diagnóstico, ya que excluye anomalías estructurales que pueden causar cambios similares de denervación en la musculatura del manguito, y además, la secuencia temporal de las imágenes, nos puede ofrecer información del estado evolutivo del proceso.
En cuanto al tratamiento, tradicionalmente se ha defendido que en la fase aguda este debe ser sintomático, llegando muchos pacientes a precisar opioides por la intensidad del dolor. Una vez conseguido el adecuado control analgésico se recomienda iniciar tratamiento rehabilitador para mantener la movilidad articular y recuperar la fuerza muscular. Sin embargo publicaciones más recientes, como la de van Eijk (2009) defienden el empleo de tratamiento corticoideo en la fase precoz, alegando que en su grupo de 50 pacientes tratados con prednisona se obtiene un tiempo mediano más corto transcurrido hasta el alivio del dolor, más pacientes recuperaron la fuerza en el primer mes, y un mayor número de pacientes con recuperación total tras el primer año. Basándonos en estos datos, una identificación precoz del proceso puede ser esencial, ya que parece que el tratamiento temprano con prednisona oral puede tener una influencia positiva sobre el dolor, y acelerar la recuperación en algunos pacientes, si bien son necesarios estudios controlados, aleatorizados que evalúen el tratamiento inmunomodulador para el SPT.
Por último, es necesario enfatizar sobre la necesidad de tener presente esta patología en el diagnóstico diferencial de la omalgia, ya que recientes registros como el de van Alfen 2006, revelan un pronóstico menos optimista de lo recogido previamente en la literatura, con un tercio de los pacientes presentando dolor crónico, y 2 tercios déficit funcional persistente más allá de los tres años de seguimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.