En la actualidad, los tratamientos disponibles para el lupus eritematoso sistémico no consiguen controlar todas las manifestaciones de la enfermedad ni prevenir sus brotes. Aunque la mayoría de los tratamientos biológicos estudiados se dirigen contra el linfocito B, también se han explorado otras dianas terapéuticas. Los agentes anti-factor de necrosis tumoral alfa no solo han mostrado resultados dispares, sino que se han relacionado con la generación de anticuerpos antinucleares y anti-ADNn. Se han investigado también agentes anti-interleucina 10 y anti-interleucina 6, con resultados esperanzadores, así como el abatacept, con uso aprobado para la artritis reumatoide, pero que no ha demostrado eficacia en estudios controlados con placebo.
Current treatment options for systemic lupus erythematosus (SLE) fail to control all the manifestations of the disease or fully prevent flares. The most extensively studied biological therapies are directed against B cells, although other biological targets have also been explored. Biological agents against tumor necrosis factor-alfa differ in their efficacy and have been associated with the generation of antinuclear and anti-dsDNA antibodies. Anti-interleukin-10 and anti-interleukin-6 agents have also been studied, with encouraging results. Abatacept, which has been approved in rheumatoid arthritis, has not shown efficacy in placebo-controlled clinical trials.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica que afecta preferentemente a mujeres en edad fértil. Se desconoce su causa, aunque muy probablemente es la interrelación entre factores genéticos poligénicos y determinados agentes ambientales la responsable del desencadenamiento de la enfermedad. Los tratamientos disponibles en la actualidad no son capaces de controlar uniformemente las diferentes manifestaciones de la enfermedad en todos los pacientes ni de prevenir brotes futuros. En los últimos años se están produciendo grandes avances en el desarrollo de terapias biológicas en el LES. Aunque los más estudiados han sido los agentes biológicos dirigidos contra la diferenciación y la proliferación de los linfocitos B, se han explorado otras dianas terapéuticas, como el factor de necrosis tumoral alfa (TNFα), la interleucina (IL)-6 o las señales de co-estimulación entre el linfocito T y la célula presentadora de antígeno, entre otras.
Terapia dirigida contra el TNFαEl TNFα juega un papel dual en la patogenia del LES. Por una parte, la presencia de TNFα es fundamental para eliminar los antígenos liberados desde el núcleo en el proceso de apoptosis celular sin generar una respuesta inflamatoria e inmune que genere anticuerpos anti-ADN nativo (ADNn) o antinucleosoma. En este sentido, la inhibición del TNFα conduce con frecuencia a la aparición de anticuerpos antinucleares (ANA) y anti-ADNn. Por otra parte, el TNFα es una citocina proinflamatoria que interviene directamente en la agresión al órgano diana y su inhibición podría resultar beneficiosa para controlar el proceso inflamatorio.
Los datos sobre la eficacia de la terapia anti-TNFα y sobre su seguridad en el paciente con lupus se reducen a pequeñas series de casos y a casos clínicos, la mayoría utilizando infliximab. Aringer et al1 trataron 6 pacientes con nefritis lúpica y/o artritis refractaria al tratamiento convencional con 4 perfusiones de infliximab a una dosis de 5mg/kg, añadidas a azatioprina o a metotrexato. Los autores comunicaron una reducción significativa de la proteinuria y la remisión temporal de la artritis. En cuanto a su seguridad, 3 pacientes presentaron infecciones de tracto urinario. Como era de esperar, los niveles de anticuerpos anti ADNn y anticardiolipina aumentaron en 4 pacientes, aunque en ningún caso se asoció este empeoramiento serológico a un brote de la enfermedad o a fenómenos trombóticos. En cambio, Katz et al2 comunicaron que, de 9 pacientes con poliartritis tratados con infliximab, solo un tercio mejoró, mientras que dos tercios experimentaron reacciones a la perfusión. La principal preocupación sobre el uso de terapias anti-TNFα en el lupus se relaciona con el desarrollo potencial de autoanticuerpos o de un lupus inducido por fármaco, complicaciones bien caracterizadas durante el uso de infliximab en otras patologías como la artritis reumatoide, la espondilitis anquilosante o la enfermedad de Crohn. De hecho, hasta dos tercios de los pacientes en los que se administra terapia anti-TNFα pueden desarrollar anticuerpos antinucleares. La incidencia de aparición de anticuerpos anti ADNn es menor, oscilando de un 9 a un 54% de los casos3. Afortunadamente, la aparición de un lupus inducido por anti-TNFα es un acontecimiento bastante infrecuente, habiéndose calculado su incidencia entre el 0,5 y el 1%, independientemente del tipo de agente anti-TNFα utilizado. Habitualmente estos casos de lupus inducido por agente anti-TNFα no son graves y revierten con la suspensión del fármaco. Ocasionalmente pueden producirse casos de nefritis4–6. Se está llevando a cabo actualmente un estudio con infliximab en el tratamiento de la nefritis membranosa lúpica activa asociado a azatioprina, y en otro estudio se está evaluando el etanercept en tratamiento de la nefritis lúpica combinado con el tratamiento convencional7,8.
Agentes anti-interleucina 10Se ha observado correlación entre la actividad del LES y los niveles circulantes de interleucina 109. Se ha comunicado los resultados de un ensayo abierto en 6 pacientes con LES y resistencia al tratamiento con corticoides, poniéndose de manifiesto una mejoría de la actividad de la enfermedad, que se mantuvo hasta 6 meses después de la administración de un anticuerpo monoclonal anti-interleucina 10 de origen murino durante 21 días. Desgraciadamente, el anticuerpo murino utilizado se ha mostrado muy inmunogénico y todos los individuos tratados desarrollaron anticuerpos contra el mismo10.
AbataceptLa activación de los linfocitos T vírgenes exige la interacción entre la molécula CD28 sobre el linfocito T y sus ligandos B7.1 (CD80) y B7.2 (CD86) expresados por las células presentadoras de antígeno. Esta interacción conduce a la producción de IL-2 y a la proliferación dependiente de antígeno del linfocito T. Tras la activación del linfocito T, se expresa en su superficie otro receptor, el antígeno asociado a linfocito T citotóxico 4 (CTLA4), que se une a las moléculas B7 con una mayor afinidad que CD28. Así, la expresión de CTLA4 actúa como un regulador de la proliferación dependiente de antígeno del linfocito T, controlando su proliferación para que no resulte excesiva mediante una señalización intracelular negativa11.
El abatacept es una proteína de fusión recombinante formada por CTLA4 y la región Fc de la IgG1 humana. De hecho, funciona como un receptor soluble y reduce la producción de citocinas proinflamatorias segregadas por los linfocitos T activados. También reduce la producción de anticuerpos dependientes de linfocitos T. El abatacept se ha aprobado para su utilización en artritis reumatoide tras demostrar su eficacia frente a placebo tanto en artritis reumatoide refractaria a metotrexato como a agentes anti-TNFα12,13.
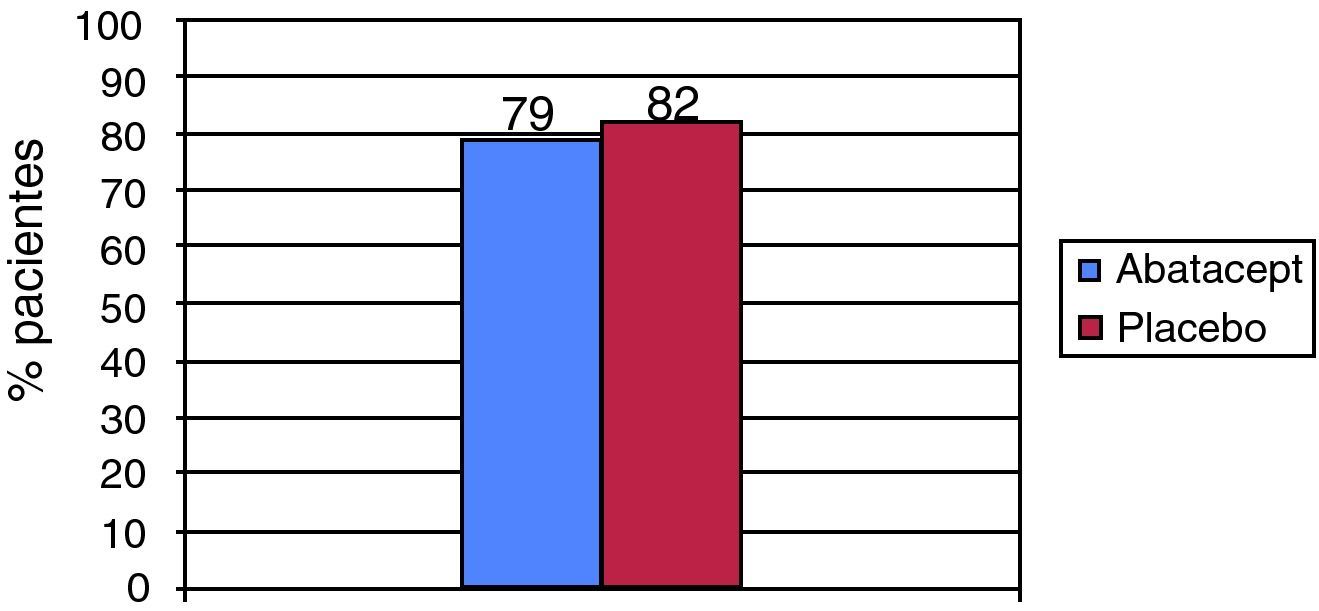
Se ha realizado un ensayo clínico fase II, aleatorizado, doble-ciego, controlado con placebo de abatacept en individuos con LES activo con poliartritis, serositis o lesiones discoides14. Ciento dieciocho pacientes fueron asignados a abatacept o a placebo. El abatacept se utilizó añadido a un protocolo predefinido de tratamiento con glucocorticoides. La dosis utilizada de abatacept fue de 10mg/kg en los días 1, 15 y 29 y, posteriormente, cada 4 semanas. El criterio de valoración principal del estudio fue el porcentaje de pacientes con un nuevo brote y el seguimiento fue de un año. El estudio no mostró diferencias estadísticamente significativas entre abatacept y placebo, con un porcentaje de pacientes con un nuevo brote tras un año de seguimiento cercano al 80% en ambos grupos (fig. 1).
Ensayo clínico doble-ciego de abatacept frente a placebo en pacientes con lupus eritematoso sistémico y actividad a nivel de articulaciones, piel o serosas. No existieron diferencias estadísticamente significativas con respecto al porcentaje de pacientes que habían experimentado un nuevo brote al año de seguimiento.
La IL-6 interviene en la diferenciación de fibroblastos a células plasmáticas maduras así como en la diferenciación de los linfocitos T a células efectoras. Es un factor de crecimiento para las células miofasciales y los queratinocitos epidémicos así como una potente citocina proinflamatoria que produce fiebre, anemia, cansancio y elevación de los reactantes de fase aguda15. En los pacientes con LES se ha observado un aumento de los niveles séricos de IL-6, y que estos niveles se asocian con la actividad de la enfermedad y con la presencia de anticuerpos anti ADNn9,16. La IL-6 estimula la proliferación de células miofasciales en la nefritis lúpica, y sus niveles en orina se correlacionan con la actividad de la glomerulonefritis proliferativa17.
El tocilizumab es un anticuerpo monoclonal humanizado dirigido contra el receptor soluble y de membrana de IL-6, y tras su unión suprime las señales biológicas mediadas por el receptor de IL-6. Se ha estudiado en un pequeño grupo de 14 pacientes con LES con actividad leve o moderada, observándose una reducción de los reactantes de fase aguda y del número de linfocitos activados18. En otro estudio abierto con escalada de dosis se incluyeron 16 pacientes con LES que fueron tratados con tres dosificaciones distintas intravenosas de tocilizumab (2, 4 y 8mg/kg) cada dos semanas durante 12 semanas. Se observó una mejoría en los índices de actividad de la enfermedad, así como una disminución de los anticuerpos anti-ADNn19. En cuanto a su seguridad, se observó una disminución en el número de neutrófilos circulantes relacionada con la dosis.
ConclusionesEn el tratamiento del LES, las terapias dirigidas contra la diferenciación y la proliferación del linfocito B son las más estudiadas, aunque se han investigado otras dianas terapéuticas. Los agentes anti TNFα se han implicado en la producción de ANA y de lupus inducido por fármacos en un pequeño porcentaje de pacientes. En la actualidad se continúa explorando sus mecanismos de acción y sus posibles aplicaciones terapéuticas en el LES. Los resultados obtenidos en el ensayo llevado a cabo con abatacept no parecen aconsejar su uso para el control de brotes de la enfermedad. La correlación de actividad con niveles elevados de interleucina 6 y 10 sugieren la utilidad del bloqueo de dichas citocinas en el LES, aunque son necesarios más estudios que avalen su uso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.