Si bien se ha estudiado el vínculo entre los trastornos de estado de ánimo y el consumo de alcohol, tanto en humanos como en animales, todavía no es del todo claro cómo se da esta relación, y menos aún durante la adolescencia. La administración de reserpina, un depletor de monoaminas, es un modelo ampliamente utilizado en roedores adultos para inducir comportamientos asociados a depresión, pero se desconoce su utilidad en otras etapas del desarrollo. En este trabajo validamos este modelo en ratas adolescentes y posteriormente estudiamos el consumo de alcohol en estos animales, así como su modulación por antidepresivos. En el experimento1 se administró reserpina (0.0 o 1.0mg/kg, durante 4días, IP) a ratas Wistar machos de 30días. El consumo de alcohol fue evaluado luego de observar comportamientos asociados a depresión e indagar indicadores neuroendocrinos de esta patología. En el experimento2 los animales recibieron reserpina, seguida por el antidepresivo fluoxetina (0.0 o 10.0mg/kg, durante 4días, IG), y luego se evaluó el consumo de alcohol. Los resultados mostraron que la reserpina aumentó significativamente los comportamientos asociados a depresión y alteró los niveles de dopamina en la corteza insular y de hormonas tiroideas en sangre. En la prueba de consumo de alcohol los animales deprimidos, pero no los controles, mostraron un incremento en el consumo a través de los días. El segundo experimento replicó parcialmente este perfil, y no se observó un efecto significativo del antidepresivo en el consumo de alcohol. Los resultados indican que la reserpina es útil para modelar en ratas adolescentes comportamientos asociados a depresión. Se encontró una relación entre este estado y el consumo de alcohol, que no se pudo revertir con antidepresivos.
The relationship between mood disorders and alcohol consumption has been studied in humans and animals, although it is still not fully clear how this relationship unfolds, much less during adolescence. The administration of reserpine —a monoamine depletor— is an approach traditionally used in adult rodents to induce depression-associated behaviours, but its usefulness in other developmental stages is still unknown. In this study, this model was evaluated in adolescent rats in order to study alcohol consumption, as well as its modulation by antidepressants in these animals. In Experiment1, 30day-old male Wistar rats were treated with reserpine (0.0 or 1.0mg/kg, for 4days, IP). Alcohol consumption was tested after observing depression-associated behaviours and assessing neuroendocrine indicators of this pathology. In Experiment2, the rats were administered reserpine followed by an antidepressant (fluoxetine, 0.0 or 10.0mg/kg, for 4days, IG). Alcohol consumption was then tested. The results showed that reserpine significantly increased depression-associated behaviours and altered insular dopamine and thyroid hormone levels. Alcohol consumption tests showed that reserpine-treated animals —but not control animals— increased their consumption throughout the days. The second experiment partially replicated this profile, and no significant effect of antidepressants was observed in alcohol consumption. The results show that reserpine is instrumental in modelling depression-associated behaviours in adolescent rats. A relationship was found between this condition and alcohol intake, which could not be reversed by antidepressants.
La depresión es un trastorno del estado de ánimo de elevada prevalencia que acarrea consecuencias negativas para el bienestar y el desarrollo de los individuos. La mitad de las causas de discapacidad en humanos están dadas por trastornos psiquiátricos, donde la depresión unipolar es responsable del 35% de los casos (Suarez-Escudero, 2014). Los adolescentes están entre los grupos etarios más afectados por la enfermedad: un reciente trabajo realizado en Estados Unidos arrojó que el 11.4% de la población entre 12 a 17años había padecido al menos un episodio depresivo mayor en los últimos 12meses (Center for Behavioral Health Statistics and Quality, 2015).
La adolescencia es una etapa de la vida caracterizada por marcados cambios psicosociales y neurobiológicos. Es también durante esta etapa que se inicia y, en algunos casos, escala el consumo de alcohol (Balogun, Koyanagi, Stickley, Gilmour y Shibuya, 2014; Huang, Ho,Wang, Lo y Lam, 2016; Sanchez-Queija, Moreno, Rivera y Ramos, 2015). Este consumo tiene consecuencias adversas inmediatas (e.g., problemas académicos, accidentes, involucramiento en relaciones sexuales no deseadas; Isorna, Fariña, Sierra y Vallejo-Medina, 2015; Pilatti, Read, Vera, Caneto, Garimaldi y Kahler, 2014), y otras que solo se observan a mediano plazo. Se ha observado una relación inversa entre la edad de inicio de consumo de alcohol y el desarrollo de problemas con la droga en la edad adulta: aquellos adolescentes con un inicio temprano al consumo de alcohol tienen, en la adultez, más posibilidades de exhibir abuso y dependencia al alcohol que aquellos que exhiben un inicio más demorado (Guttmannova et al., 2011). En otras palabras, la iniciación adolescente con alcohol es un factor de vulnerabilidad para la ingesta posterior de esta droga; este efecto se conoce como iniciación o debut temprano (Fabio, Nizhniko, Spear y Pautassi, 2014; Pautassi, 2013).
Es muy importante, por lo tanto, estudiar los factores que facilitan el contacto de los adolescentes con el alcohol. Interesantemente, el trastorno depresivo exhibe comorbilidad, entre otros, con alteraciones cognitivas, de relacionamiento social y con los trastornos por consumo de alcohol (Casas y Guardia, 2002; Chamberlain y Sahakian, 2004, 2006; Fouls, Adamson, Boden, Williman y Mulder, 2015; Gómez-Restrepo et al., 2004; Mustaca y Kamenetzky, 2006; Sher, 2004). Una hipótesis de larga data, tradicionalmente conocida como hipótesis de reducción de tensión (Conger, 1956), sugiere que la ingesta de alcohol mitiga estados psicológicos adversos y que este efecto promueve la ingesta de alcohol en el futuro (Huot, Thrivikraman, Meaney y Plotsky, 2001). Bajo este marco, es posible hipotetizar que la depresión adolescente podría predisponer —por mecanismos de reforzamiento negativo— el inicio o la escalada en el consumo de alcohol durante esta etapa del desarrollo (González-Forteza, Hermosillo de la Torre, Vacio-Muro, Peralta y Wagner, 2015). Sin embargo, los datos epidemiológicos son poco concluyentes y es aún incierto cómo estos factores (depresión y consumo de alcohol) interactúan en la población general y en la subpoblación adolescente.
Los modelos animales se presentan como alternativas para el estudio de esta psicopatología (Cassano y Argibay, 2009; Czéh, Fuchs, Wiborg y Simon, 2016; Deussing, 2006; Frey et al., 2006; Kato, Kasahara, Kubota-Sakashita, Kato y Nakajima, 2016; Machado-Vieira, Kapczinski y Soares, 2004; Nestler y Hyman, 2010). Es cuestionable si se puede hablar de depresión en modelos animales, por lo que resulta más prudente referirnos a comportamientos asociados a depresión. Estos comportamientos pueden ser modelados mediante la administración de la droga reserpina, un depletor de monoaminas (e.g., serotonina y dopamina) en el sistema nervioso central. La administración, tanto aguda como crónica, de esta droga produce en roedores sintomatología análoga a la que experimentan humanos con depresión (Escorihuela y Fernández-Terual, 1998; Li et al., 2016; Minor y Hanff, 2015; Mohamed, 2016; Ozerov, Bagmetova, Chernysheva y Tyurenkov, 2016; Socała et al., 2016). Si bien el modelo tiene algunos cuestionamientos, es uno de los modelos de depresión (inducida farmacológicamente) más usado y tiene varias ventajas con relación a otros modelos (para una descripción de las mismas, véase Czéh et al., 2016). Sin embargo, no se han estudiado los comportamientos asociados a depresión inducidos por la reserpina en ratas adolescentes —periodo que en las ratas va desde los 28 a los 42días de vida (Spear, 2000)—, ni cómo este estado predispone al consumo de alcohol en esta etapa del desarrollo, preguntas que este trabajo se dedicará a analizar.
Los neurotransmisores monoaminérgicos están implicados en la depresión y la manía. Particularmente la dopamina se ve disminuida en la primera y aumentada en la segunda (Diehl y Gershon, 1992), particularmente en áreas del sistema nervioso central implicadas en el procesamiento emocional, como la ínsula (Salgado-Pineda, Delaveau, Olivier y Nieoullon, 2005; Simmons et al., 2012). Esto ha motivado el uso terapéutico de drogas que aumentan los niveles de monoaminas, como la fluoxetina (Torrens, 2001; Ponce, Jiménez-Arriero y Rubio, 2003). Si bien la depresión no se puede diagnosticar en base a alteraciones biológicas, en este trastorno se observaron alteraciones a nivel endocrino y se encontraron tanto hipo como hipertiroidismo (Radanović-Grgurić et al., 2003).
El objetivo principal de este trabajo fue describir el consumo de alcohol en ratas adolescentes tratadas con reserpina. En el experimento1 se hizo un tratamiento crónico de reserpina durante 4días y su efecto se confirmó a través de pruebas comportamentales y mediante la medición de niveles de dopamina y de hormonas tiroideas. Esperábamos observar mayor consumo y preferencia de alcohol luego de este tratamiento. En un segundo experimento se intentó revertir el efecto de reserpina sobre el consumo de alcohol a través de la administración de un fármaco que aumenta los niveles de dichos neurotransmisores, como es la fluoxetina.
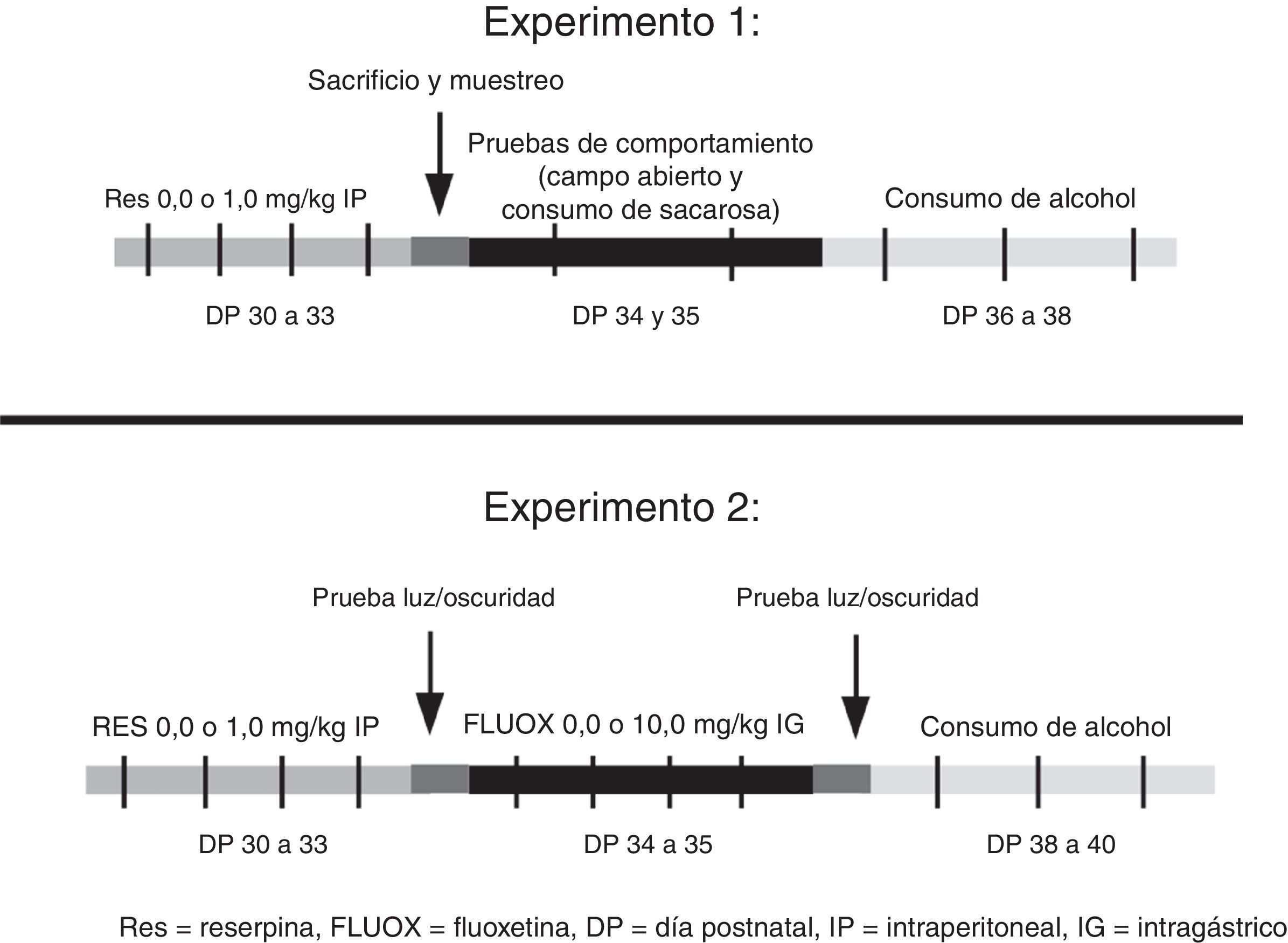
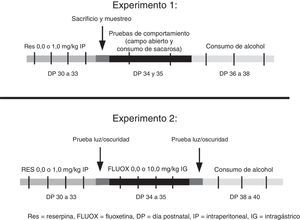
Materiales y métodosDiseño experimentalLa figura 1 presenta un esquema del diseño experimental empleado en cada uno de los experimentos. En el experimento1 se administró reserpina (RES, 1.0mg/kg, IP, de Freitas et al., 2016) o vehículo (VEH) a dos grupos de 25ratas Wistar macho adolescentes, durante los días posnatales (DP) 30 a 33. Luego del tratamiento los animales fueron evaluados en las pruebas de campo abierto y de consumo de sacarosa. Posteriormente, 10 animales de cada grupo fueron sacrificados. Se extrajo la región insular para medir los niveles de dopamina allí presentes. Paralelamente, se obtuvo sangre para medir hormonas tiroideas. El resto de los animales fueron sometidos a una prueba de consumo de alcohol de doble botella de 3días de duración.
Un segundo experimento intentó revertir los comportamientos asociados a la depresión, inducidos por reserpina. El mismo empleó un diseño factorial2 (tratamiento diario con RES [1.0g/kg] o VEH durante los DP 30-33)×2 (tratamiento con fluoxetina [FLUOX, 10.0mg/kg, IG, Dulawa, Holick, Gundersen y Hen, 2004] o VEH durante los DP 34 a 37). Cada uno de los grupos derivados del diseño (RES-VEH, RES-FLUOX, VEH-FLUOX, VEH-VEH) estuvo compuesto por 12animales y se evaluó en una prueba de luz/oscuridad antes y después de la administración del antidepresivo. El propósito de esta evaluación fue confirmar el efecto facilitador de la reserpina sobre los comportamientos asociados a la depresión, y analizar si este efecto se podía revertir con fluoxetina. Luego todos los animales fueron sometidos a una prueba de consumo de alcohol de doble botella.
Los tratamientos y las pruebas fueron realizados en el período 30-40DP porque este representa (Spear, 2000) la ventana temporal de la adolescencia en la rata. Algunos autores extienden este período hasta los 50-60días, pero en general las posturas más conservadoras señalan que la adolescencia en la rata empieza una semana luego del destete (esto es, al día 28 de vida) y se extiende hasta el día 42 de vida aproximadamente (Spear, 2000).
Animales y tratamiento farmacológicoSe empleó un total de 98 ratas macho Wistar adolescentes derivadas de 22 camadas criadas en los bioterios del Instituto de Investigación Médica Mercedes y Martín Ferreyra (INIMEC-CONICET, Córdoba, Argentina). La reserpina (Sigma-Aldrich, EE.UU.) se vehiculizó en solución fisiológica y se administró de manera intraperitoneal a un volumen de 0.01ml por gramo de peso corporal (0.01ml/g), en tanto que la fluoxetina (Fluoxet, Eurofarma, Uruguay) se disolvió en agua corriente y se administró intragástricamente a un volumen de 0.05ml/g.
El protocolo experimental fue aprobado por la Comisión de Ética en Uso de Animales de la Facultad de Veterinaria de Universidad de la República (CEUA-FVet-UdelaR, Exp n.° 111130-001565-13 y 111130-000658-13).
Pruebas de comportamientoEl efecto de RES y su posible reversión por FLUOX se evaluó a través de tres pruebas de comportamiento:
Campo abierto (experimento 1)Se aplicó el DP 34. El aparato (ITTCOMM, Córdoba, Argentina) consta de una caja de acrílico de 80×80cm con sensores fotoeléctricos que permiten registrar la distancia recorrida por el animal en centímetros. Los animales permanecieron 10min en la caja. Se consideró como indicador de estado de ánimo depresivo que los dosificados con reserpina recorrieran menos distancia que los controles (Angrini, Leslie y Shephard, 1998).
Prueba de consumo de sacarosa (experimento 1)Se aplicó el DP35. La prueba se aplicó en cajas independientes, los animales permanecieron 22h sin líquidos para luego ofrecerles dos botellas con agua y una solución azucarada (sacarosa 5%). Se registraron los mililitros consumidos de ambas soluciones y se calculó el porcentaje de preferencia por la sacarosa. El menor consumo de líquidos totales y de solución azucarada es usualmente considerado un comportamiento asociado a la depresión (Brenes, Rodríguez, Villagra y Fornaguera, 2006).
Caja de luz/oscuridad (experimento 2)Los comportamientos asociados a la depresión se analizaron, en el experimento2, mediante una prueba alternativa al campo abierto. El propósito fue proveer información convergente de diversas pruebas que den cuenta del estado inducido por reserpina. La prueba de luz/oscuridad se aplicó dos veces, para analizar los comportamientos asociados a la administración de reserpina (DP34) y para evaluar el efecto de la fluoxetina (DP38). Los animales permanecieron 5min en una caja con un espacio blanco y otro negro (24.5×25×25cm) comunicados entre sí por una hendidura, donde la porción blanca estaba iluminada con una luz de intensidad 400lux. Esta prueba se aprovecha de la aversión innata que muestran los roedores por los espacios abiertos y blancos (Fernández et al., 2016). Se midió la cantidad de veces que pasaron de un espacio al otro y el tiempo (segundos) en la caja blanca. Con estas medidas se generó un cociente dividiendo el tiempo en blanco sobre transferencias+1 que demuestra el tiempo que estuvo activo (cuanto más alto el cociente, menos movilidad). El cociente brinda un valor de la principal variable dependiente (tiempo pasado en la zona ansiógena) pero penalizado por la cantidad de actividad, ya que es probable que parte del tiempo pasado en el espacio blanco obedezca simplemente a un alto nivel de actividad (el +1 es por la eventualidad de que algún animal no haya realizado transferencias).
Medición de dopamina en la ínsulaEl DP 34, 24h luego de la última administración de reserpina, un subgrupo de animales de cada grupo experimental se sacrificaron por decapitación. Inmediatamente se obtuvo el encéfalo y se disecó la ínsula por la técnica descrita en Aleksandrov y Fedorova (2003) para el análisis de dopamina por HPLC. La ínsula fue congelada y mantenida en frízer a −80°C. El día de la extracción y medición del contenido de dopamina, los tejidos fueron descongelados, pesados e inmediatamente sonicados en 1ml de ácido perclórico 0.1M. Posteriormente fueron centrifugados a 15000g max, por 15min, el sobrenadante rico en dopamina se conservó. Las muestras fueron inyectadas en un sistema de HPLC (PM-80 BAS, West Lafayette, IN, EE.UU.) con una columna C18 con un detector electroquímico (LC-4C BAS) a un flujo de 1.0ml/min y una fase móvil compuesta de ácido acético 0.15M, octil sulfato de sodio 0.6M, acetonitrilo al 4% y tetrahidrofurano al 1.6%, a pH3 (Abin-Carriquiry et al., 2008). La medición se llevó acabo en el Laboratorio de Neuroquímica del Instituto de Investigaciones Biológicas Clemente Estable, Montevideo, Uruguay.
Medición de hormonas tiroideasEn el mismo proceso de extracción de las ínsulas se obtuvo sangre (1.5ml/animal) para medir los niveles de hormonas tiroideas (t3 y t4). El suero se obtuvo por centrifugación de la sangre durante 20min a 2000rpm. Este fue incubado con las hormonas marcadas para luego ser cuantificadas en un contador gamma. Para esto, se utilizaron kits comerciales (laboratorio Siemens) de fase sólida para RIA y se obtuvieron los niveles de hormona en nanogramos por decilitro (Damian y Ungerfeld, 2011). Las mediciones se realizaron en el Laboratorio de Técnicas Nucleares de la Facultad de Veterinaria (UdelaR), Montevideo, Uruguay.
Prueba de consumo de alcoholLos animales se evaluaron en una prueba de consumo de alcohol (3%) de 3días. En el experimento1 la misma se aplicó del DP 36 al 38, mientras que en el experimento2 se aplicó entre los DP 38 y 40. Los animales permanecieron en sus cajas 22h con comida pero sin líquidos, luego fueron pesados y puestos en cajas individuales sin comida donde durante 2h se les ofrecía agua y alcohol (3%) en tubos que cada día eran cambiados de orden y se registraba el volumen (ml) consumido de cada solución. Se usó una baja concentración de alcohol para que no hubiera evitación del sabor. Posteriormente se calcularon los gramos por kilo de alcohol, el porcentaje de preferencia entre alcohol y agua y los mililitros totales de líquido consumido por cada 100g de peso corporal (ml/100g). Este protocolo ha sido utilizado en numerosas oportunidades en nuestro laboratorio (e.g., Acevedo, Molina, Nizhnikov, Spear y Pautassi, 2010).
Análisis estadísticoLas variables registradas se analizaron de forma independiente mediante ANOVA factorial (variables registradas durante las pruebas de comportamiento y variables neuroendocrinas) o de medidas repetidas (variables registradas durante las pruebas de consumo de alcohol de ambos experimentos, sobre las pruebas de campo abierto y sobre las medidas de luz y oscuridad del experimento2). Los efectos significativos principales y las interacciones significativas se analizaron mediante la prueba post hoc de Fisher, en el caso de efectos principales o de interacciones entre factores «entre» grupos. En tanto, se usaron comparaciones planeadas ortogonales para analizar los efectos principales o interacciones significativas que involucraran medidas repetidas. Este procedimiento se realizó ya que se reconoce que no hay una prueba post hoc que maneje adecuadamente el error tipoi en interacciones entre factores y dentro de los grupos (Winer, 1991). Cuando la intención fue comparar grupos se utilizó test de t para grupos independientes. Los valores de p<.05 se consideraron estadísticamente significativos. El alfa fue de 0.05 y los resultados se expresan como media±SEM.
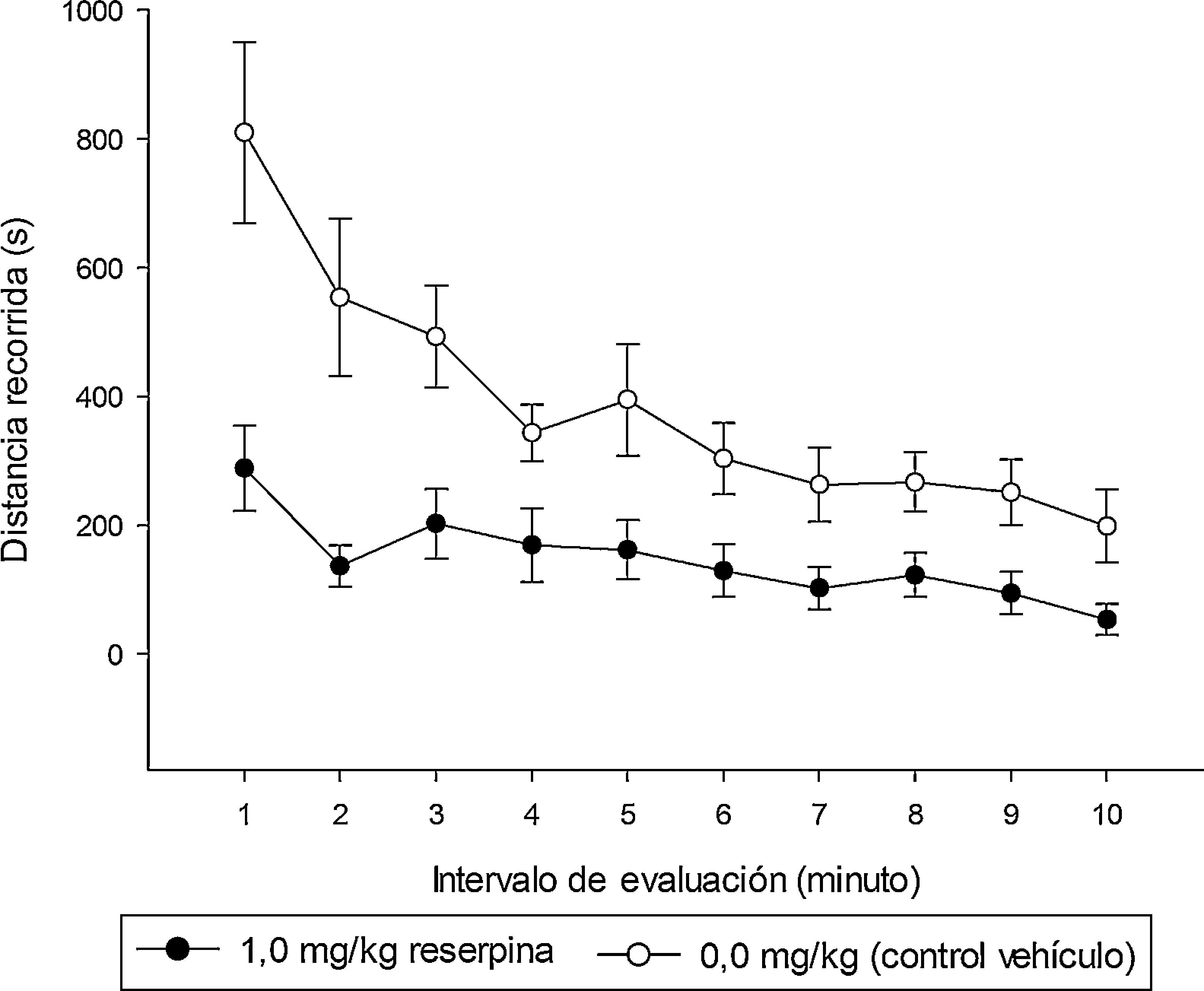
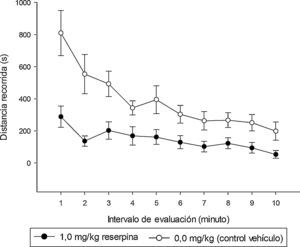
ResultadosExperimento 1Prueba de campo abierto y prueba de consumo de sacarosaEl ANOVA de medidas repetidas para la prueba de campo abierto (factor de medidas repetidas: minutos 1 a 10 de evaluación) indicó efectos principales de reserpina [F(1.27)=14.71, p<.001] y de minuto [F(9.243)=11.39, p<.001], así como una interacción significativa intervalo por minuto [F(9.243)=3.20, p<.005]. Como se observa en la figura 2, los animales dosificados con reserpina exhibieron significativamente menos distancia recorrida (medida en centímetros) que el grupo control, un efecto que fue significativamente más importante durante la primera mitad de la evaluación. Los animales dosificados con reserpina consumieron menos de la solución azucarada (t(14)=×−8.87, p<.05), si bien este efecto no fue específico, ya que los mismos también consumieron menos agua (t(14)=−3.6, p<.05) y menos líquido total (t(14)=−10.37, p<.05). Estos resultados se presentan en la tabla 1.
Distancia recorrida (centímetros) en cada uno de los 10min de la prueba de campo abierto, en animales tratados con reserpina (1.0mg/kg, puntos negros) y en controles tratados con vehículo (puntos vacíos). Los animales dosificados con reserpina exhibieron significativamente menos distancia recorrida que el grupo control, particularmente durante la parte inicial de la evaluación. Los puntos muestran las medias y las barras los errores estándar para cada minuto de la prueba.
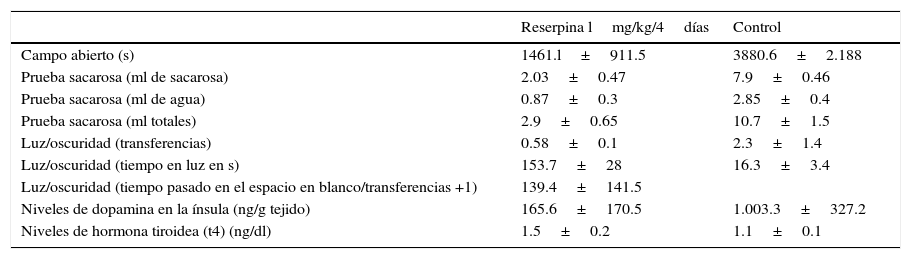
Variables medidas en el modelo de depresión
| Reserpina lmg/kg/4días | Control | |
|---|---|---|
| Campo abierto (s) | 1461.l±911.5 | 3880.6±2.188 |
| Prueba sacarosa (ml de sacarosa) | 2.03±0.47 | 7.9±0.46 |
| Prueba sacarosa (ml de agua) | 0.87±0.3 | 2.85±0.4 |
| Prueba sacarosa (ml totales) | 2.9±0.65 | 10.7±1.5 |
| Luz/oscuridad (transferencias) | 0.58±0.1 | 2.3±1.4 |
| Luz/oscuridad (tiempo en luz en s) | 153.7±28 | 16.3±3.4 |
| Luz/oscuridad (tiempo pasado en el espacio en blanco/transferencias +1) | 139.4±141.5 | |
| Niveles de dopamina en la ínsula (ng/g tejido) | 165.6±170.5 | 1.003.3±327.2 |
| Niveles de hormona tiroidea (t4) (ng/dl) | 1.5±0.2 | 1.1±0.1 |
Medias y errores para variables comportamentales y neuroendocrinas estudiadas en animales tratados con reserpina y controles. Para todas las variables se encontraron diferencias significativas (p<.05) entre grupos.
Los niveles de dopamina en la ínsula (véase tabla 1) fueron significativamente menores [t(11)=−7.9, p<.05] en los animales deprimidos que en los controles. Estos resultados son consistentes con los obtenidos en las pruebas de comportamiento y acompañan el efecto de la reserpina como droga depresora, y a su vez depletora de dopamina.
Los resultados de radioinmunoanálisis arrojaron que los niveles de hormona t3 no se vieron afectados por el tratamiento con reserpina, mientras que los niveles de la hormona t4 fueron significativamente mayores en el grupo RES [t(30)=5.8, p<.05; véase tabla 1 por medias y EE].
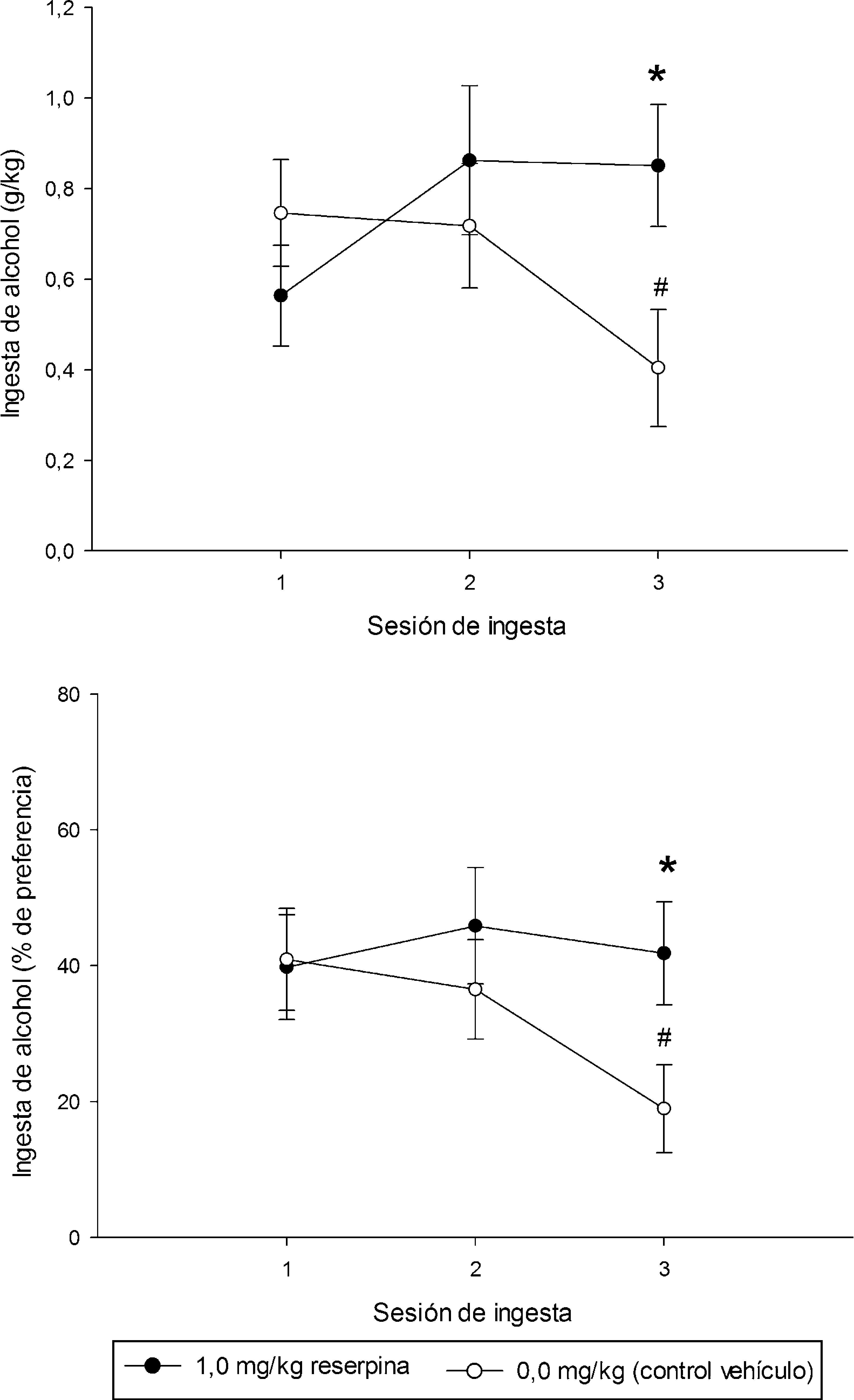
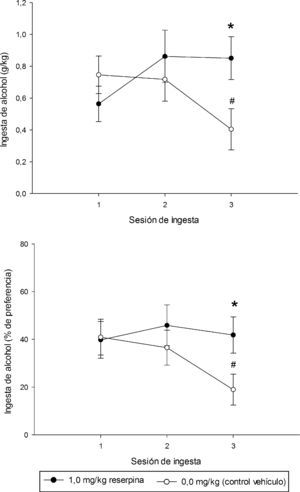
Prueba de consumo de alcoholLos pesos corporales, medidos luego del tratamiento con reserpina, difirieron significativamente entre los grupos (RES=105.1±6.1 vs VEH=137.1±3.0, p<.05). La figura 3 ilustra el consumo de alcohol registrado en los grupos RES y VEH. El ANOVA para g/kg de alcohol consumido indicó una interacción significativa entre grupo (i.e, RES o VEH) y medida, F(2.54)=3.64, p<.05. Las pruebas a posteriori indicaron que los grupos RES y VEH consumieron niveles de etanol (g/kg) similares en las sesiones1 y 2. En la sesión3, en tanto, el grupo RES exhibió significativamente más consumo de alcohol que su control. Asimismo, el consumo de alcohol en el día3 en el grupo control fue significativamente menor que el consumo exhibido por dicho grupo el día1 (p<.05). Esto sugiere una caída significativa en el consumo (g/kg) a lo largo de los días en el grupo control, pero no en el experimental. El perfil para el porcentaje de preferencia fue similar al observado para g/kg (véase fig. 2, panel inferior). Sin embargo el ANOVA para el porcentaje de preferencia no indicó efectos principales significativos ni interacciones significativas. Guiados por nuestras hipótesis a priori, sin embargo, realizamos comparaciones planeadas y estas indicaron un porcentaje de preferencia significativamente mayor en animales RES que en VEH en la sesión3, así como una caída significativa en el nivel de preferencia por la droga en el grupo VEH, entre las sesiones1 a3. El ANOVA para volumen total de líquido consumido (ml/100) indicó que los animales deprimidos tomaron significativamente menos líquido que sus pares controles (F(1.27)=12.5, p=.001).
Consumo de alcohol (g/kg y % de preferencia) registrado en los grupos tratados crónicamente con reserpina (1.0mg/kg, RES, puntos negros) y en grupos control tratados con vehículo (VEH, puntos vacíos), en función del día de evaluación del Experimento 1. Los puntos muestran las medias y las barras los errores estándar.
Para confirmar el efecto de la reserpina sobre los comportamientos asociados con depresión, se aplicó a todos los animales la prueba de luz/oscuridad, antes y después de la administración del antidepresivo (DP34 y 38). El análisis de varianza de medidas repetidas mostró un efecto significativo, depresor, de la reserpina [F(1.41)=22.23, p<.05] sobre la variable tiempo pasado en el espacio en blanco/transferencias +1 (ver tabla 1). Específicamente, los animales a los que se administró reserpina exhibieron valores significativamente más elevados de este índice que los tratados con vehículo. Este efecto se mantuvo estable durante ambas mediciones y no fue revertido por la administración de fluoxetina.
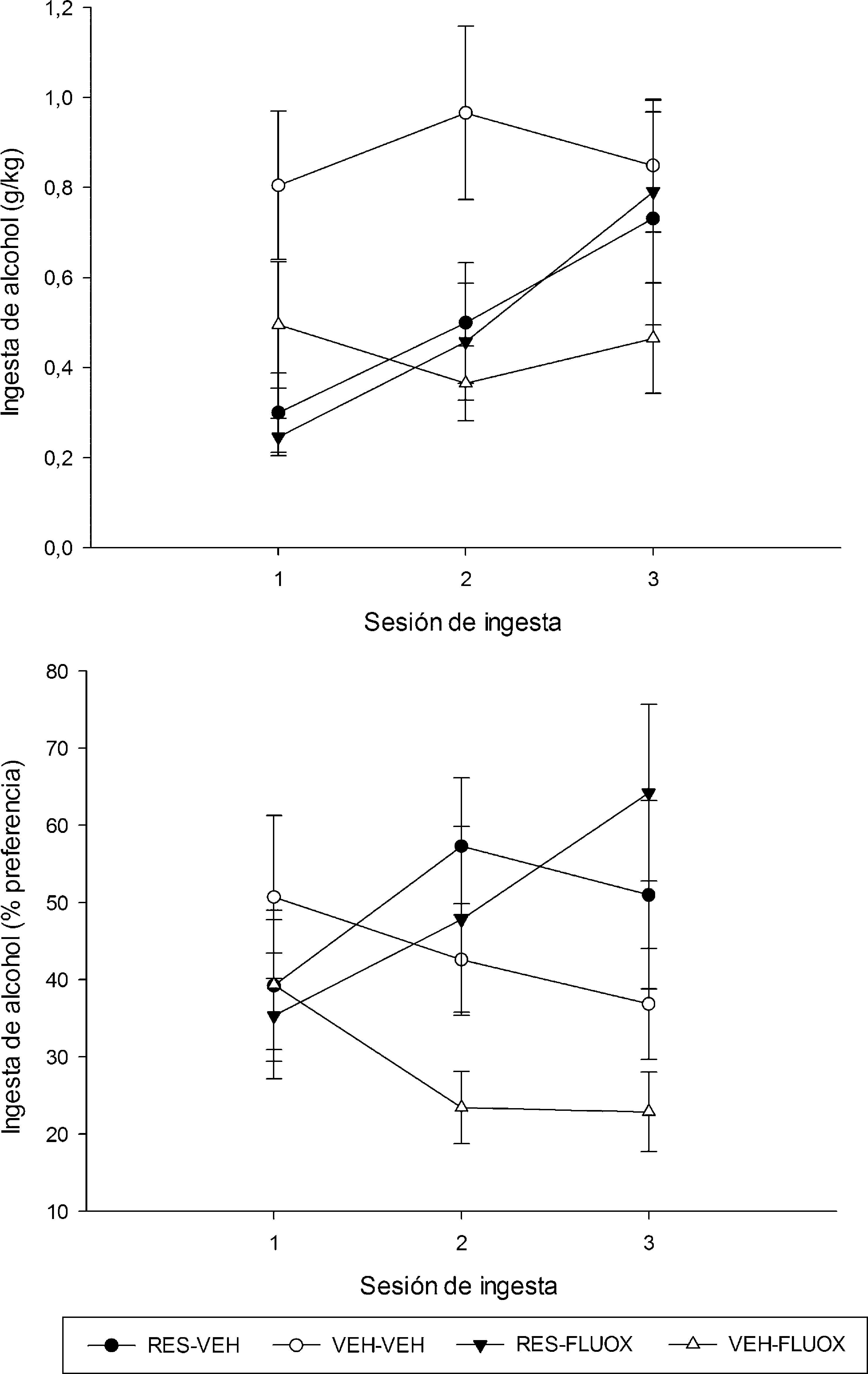
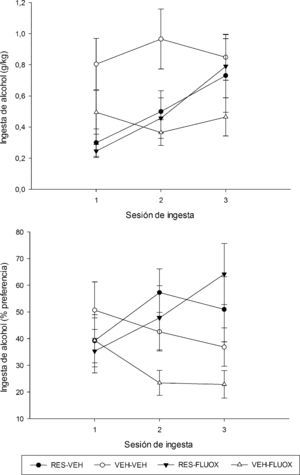
Prueba de consumo de alcoholEn este experimento también hubo diferencias significativas entre los pesos de los grupos luego del tratamiento con reserpina (RES=78.1±3.7 vs VEH=110.7±3.6, p<.05). Como puede observarse en la figura 4, los resultados replican sustancialmente lo observado en el experimento1. Al inicio de la evaluación los grupos exhibieron similar predilección por el alcohol, pero a medida que la misma progresó aquellos tratados con reserpina —pero no los tratados con vehículo— incrementaron dicha predilección. EL ANOVA confirmó estas impresiones e indicó un efecto principal de reserpina, F(1.41)=4.54, p<.05 y una interacción significativa reserpina×día, F(2.82)=5.44, p<.05. De acuerdo con las comparaciones a posteriori realizadas, los animales tratados con reserpina exhibieron significativamente más preferencia por etanol durante las sesiones2 y3, en comparación con los sujetos tratados con vehículo. Este efecto no fue alterado por la administración de fluoxetina.
Consumo de alcohol registrado en los grupos tratados crónicamente con reserpina (1.0mg/kg, RES) o vehículo (VEH), y con fluoxetina (10mg/kg, FLUOX) o su vehículo (VEH). Se grafican los g/kg consumidos y el % de preferencia por el alcohol registrado en los grupos RES-VEH (puntos negros), VEH-VEH (puntos vacíos), RES-FLUOX (triángulos negros) y VEH-FLUOX (triángulos vacíos), en función del día de evaluación del experimento2. Los puntos muestran las medias; las barras, los errores estándar.
El análisis para g/kg de alcohol consumido indicó un efecto principal de días de evaluación, F(2.82)=3.34, p<.05, así como interacciones significativas RES×días de evaluación y RES×FLUOX [F(2.82)=3.19, p<.05 y F(1.41)=4.35, p<.001]. Los análisis a posterior indicaron que los grupos RES exhibieron un aumento progresivo en consumo de alcohol a lo largo de los días, en tanto que los grupos VEH permanecieron estables a lo largo del tiempo, si bien los animales VEH exhibieron mayor consumo absoluto de alcohol (g/kg) que los RES en el primer día de evaluación. La exploración de la interacción significativa FLUOX×RES indicó que, en el promedio general de los tres días de evaluación, la administración de FLUOX no alteró los niveles de consumo absoluto en los animales RES pero indujo una significativa y drástica caída del consumo en el grupo VEH.
DiscusiónSe ha observado una relación entre la depresión y el consumo de alcohol en humanos (Horwitz y Raskin, 1991; Gómez-Restrepo et al., 2004; Suarez-Escudero, 2014) y se han encontrado algunas particularidades, como que esta relación es más notoria en las mujeres o que en cuadros depresivos no se consume alcohol más frecuentemente sino en mayor volumen (Graham, Massak, Demers y Rehm, 2007). En este contexto han surgido varios intentos explicativos para esta relación, y la teoría de la automedicación es una de las más conocidas (Horwitz y Raskin, 1991), también aplicada para el estudio del consumo de alcohol en adolescentes deprimidos (Deykin, Levy y Wells, 1987; Windle y Davies, 1999).
En este trabajo pudimos acceder, a través de un modelo animal, a novedosa información. En primer lugar confirmamos que la reserpina induce comportamientos asociados a depresión y generalizamos este hallazgo a animales adolescentes. De esta manera —y en conjunto con trabajos previos— el trabajo sugiere que, luego de un tratamiento con reserpina, adultos (Minor y Hanff, 2015; Ozerov et al., 2016; Socała et al., 2016) y adolescentes son igualmente sensibles a la inducción de comportamientos asociados a la depresión. Pudimos reproducir a nivel comportamental (menos movilidad en la prueba de campo abierto y menor respuesta ansiosa en la caja de luz/oscuridad) y neuroendocrinos (hipertiroidismo y bajos niveles de dopamina en la ínsula) las variaciones observadas en humanos; así, este resulta ser el primer modelo de inducción de comportamientos depresivos por administración de reserpina en ratas adolescentes, en nuestro conocimiento. Esto sienta las bases para evaluar, por ejemplo, cómo otros eventos (e.g., estresores ambientales) exacerban estos cuadros depresivos en los adolescentes. Se ha sugerido que los adolescentes serían más sensibles que los adultos a los efectos del estrés y a las interacciones alcohol-estrés (Fernández et al., 2016).
Por otro lado, vimos una asociación positiva entre el estado de ánimo y el consumo de alcohol, dado que los animales que exhibieron comportamientos asociados a depresión tomaron más alcohol a lo largo de las sesiones, a diferencia de los controles, que disminuyeron su consumo a lo largo de los días de evaluación. También se pudo ver que el mayor consumo de alcohol estuvo relacionado con signos de hipertiroidismo y con bajos niveles dopaminérgicos en la ínsula. Los animales tratados con reserpina exhibieron un decremento en el consumo de sacarosa, pero también en el consumo de agua. Es probable que esta baja generalizada indique un estadio de anhedonia. Esto es, por supuesto, solo una hipótesis. Más allá de esta limitación, los resultados indican que la depresión es un factor que puede ayudar a iniciar o escalar el consumo de alcohol en adolescentes. El inicio temprano al consumo de alcohol, a su vez, es un factor de riesgo para la aparición de abuso y dependencia a esta droga (Fabio et al., 2014) y para la manifestación de una diversidad de síntomas psicopatológicos (Carbia, Corral, García-Moreno, Cadaveira y Caamaño-Isorna, 2016).
Numerosos trabajos han asociado los niveles de dopamina en el encéfalo, particularmente la vía mesolímbica, con el consumo de drogas. Los niveles de dicho neurotransmisor monoaminérgico estarían asociados con el consumo de drogas de abuso, dada su función activadora en el sistema de recompensa (Rezvani et al., 1997; Volkow, Wang, Fowler, Tomasi y Telang, 2011). Sin embargo, hay hallazgos controversiales acerca de la relación entre los niveles del neurotransmisor y el consumo de alcohol (Rezvani et al., 1997; Dyr, McBridea, Lumenga, Lia y Murphy, 1993). Algunos trabajos sostienen que no existe relación significativa entre ambos fenómenos (Linseman, 1990), otros dicen lo contrario (Volkow et al., 2011), y otros, que los niveles de dopamina y sus receptores forman parte de una triada de vulnerabilidad al consumo de esta droga (Bowirrat y Oscar-Berman, 2005; Leamya, Connora, Voiseyc, Youngc y Gullo, 2016). Nosotros pudimos ver que los niveles de dopamina en la ínsula están asociados con el consumo de alcohol, donde los bajos niveles del neurotransmisor se asociaron a mayor consumo de esta droga. Esto es algo novedoso en el trabajo con modelos animales de trastornos de estado de ánimo y suma a la discusión sobre el rol de la dopamina en el consumo de alcohol.
Otro aspecto relevante y novedoso fue la relación entre el hipertiroidismo y el consumo de alcohol. Existen pocas publicaciones que indaguen sobre el tema, y más que nada estudian cómo el consumo de alcohol impacta a nivel glandular (Roosing, Cushing, Voigt, Wicklund y Daling, 2000), aunque existen algunos reportes experimentales que muestran como disminuye el consumo de alcohol en animales a los que se les administra tiroides desecado por vía intragástrica (Niubó, Rodríguez, Gorguet y Cardona, 1999) o que observan un aumento en el consumo de alcohol en ratas a las que se les indujo hipotiroidismo (Hillbom, 1971). Estos trabajos hipotetizan que los bajos niveles de hormonas tiroideas se asocian a menor consumo de alcohol, llamativamente lo opuesto a lo que nosotros encontramos experimentalmente. En nuestro trabajo, los animales hipertiroideos tendieron a aumentar el consumo de alcohol. Si bien la depresión está más asociada con el hipotiroidismo, también existen depresiones simultáneas al hipertiroidismo (Radanović-Grgurić et al., 2003), lo que en tal caso coincide con nuestros resultados. Este hallazgo es novedoso y suma a la discusión sobre las posibles relaciones endocrinas con el consumo de alcohol.
Nuestra expectativa era que fluoxetina disminuyera el consumo de alcohol en los animales deprimidos. Esta expectativa no se cumplió. Este resultado va en contra de otros hallazgos en humanos con adolescentes deprimidos, los cuales describieron efectos terapéuticos de este antidepresivo sobre la depresión y el consumo de alcohol comórbido (Cornelius et al., 2001, 2005; Raymond, Schacht y Book, 2014). Existen al menos dos posibilidades por las que no hayamos visto el efecto de la fluoxetina. Es posible que las dosis administradas, o las repeticiones realizadas, no fueran las efectivas terapéuticamente a estas edades. Es también posible que el tiempo entre el tratamiento y la evaluación de sus efectos no haya sido suficiente. Usualmente esta medicación exhibe una latencia de efecto de varias semanas (Dulawa et al., 2004).
Los resultados obtenidos son útiles para profundizar en los factores de vulnerabilidad biológica asociados al consumo de alcohol. Existen varios elementos biológicos que promueven el desarrollo del alcoholismo, como los niveles de respuesta inicial al etanol, alteraciones en la expresión o funcionamiento de receptores de dopamina o genes asociados, entre otros (Bowirrat y Oscar-Berman, 2005; Pautassi, Camarini, Quadros, Miczek y Israel, 2010; Schuckit, 1987). En este sentido, los niveles de dopamina insular reportados suman a la teoría que los bajos niveles de este neurotransmisor son un factor de vulnerabilidad para el consumo de alcohol. Queda como un aporte a seguir profundizando si los niveles de hormonas tiroideas se suman a la lista de factores de vulnerabilidad biológica.
Una limitación de este trabajo es que los perfiles de consumo de alcohol variaron entre el experimento1 y el2. Si bien ambos experimentos muestran que los animales deprimidos aumentan la preferencia por el alcohol, la dinámica temporal de este efecto varió entre experimentos. Este hecho puede ser explicado por numerosas variables; por ejemplo, las diferencias en los pesos de los animales, particularmente de los que recibieron reserpina, observadas entre los experimentos. Otra limitación es que las pruebas que empleamos para determinar el estado depresivo en modelos animales no son las más comunes en la literatura. Es importante mencionar que numerosos trabajos emplearon el campo abierto para confirmar estados depresivos (e.g., Angrini et al., 1998) y otros tantos trabajos emplearon pruebas que miden ansiedad para confirmar estados ansiosos-depresivos, particularmente debido a que estas patologías exhiben comorbilidad (Ben-Hamo, Tal, Paz-Cohen, Kronfeld-Schor y Einat, 2016; Scheinert, Haeri, Lehmann y Herkenham, 2016; Tucker, Burke, Fu y McCabe, 2016). También puede pensarse que los resultados observados se deban a alteraciones en el desarrollo, inducidas por la reserpina. Entendemos que esto es poco probable, particularmente debido a la poca extensión del tratamiento. Asimismo, estudios preliminares de nuestro laboratorio indican similar rendimiento motor en el test de la barra (Deacon, 2013) en ratas adolescentes tratadas o no con reserpina, con las dosis empleadas en el presente estudio.
Otra limitación del presente trabajo es la falta de una comparación ontogenética (e.g., adultos vs. adolescentes) en los efectos facilitadores de la reserpina sobre el consumo de alcohol. Ciertamente es una limitación importante; aun así, son muchos los trabajos que —como el que nos ocupa— indagan sobre factores moduladores del consumo de alcohol en adolescentes sin evaluar si dicho factor ejerce iguales o diferentes efectos en adultos (Acevedo et al., 2016; Miranda-Morales et al., 2016; Pautassi, Godoy y Molina, 2015). La adolescencia es la etapa del desarrollo donde usualmente comienza y escala el consumo de alcohol, y el conocer factores que ayuden (o mitiguen) esta progresión es, de por sí, valioso.
Más allá de estas limitaciones, este trabajo aporta nueva información para entender los mecanismos que promueven el consumo de alcohol, particularmente en ratas deprimidas durante la adolescencia, época en la que se inician y probablemente determinan los patrones de consumo de alcohol en la vida adulta.
FinanciaciónLa investigación que da origen a los resultados presentados en esta publicación recibió fondos de la Agencia Nacional de Investigación e Innovación (ANII-Uruguay) bajo el código POS_EXT_2014_1_105 877, de la Comisión Sectorial de Investigación Científica de la Universidad de la República (CSIC-UdelaR) (PR), del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) (RMP) y de la Agencia Nacional de Promoción Científica y Tecnológica (ANPyCT) (RMP).