Notas preliminares
El tratamiento quirúrgico de las fracturas conminutas intraarticulares del húmero distal es difícil; los problemas habituales incluyen lograr una reducción estable, la reconstrucción anatómica de la anchura y la angulación de la tróclea y del capitelum, y la pérdida de movilidad como consecuencia de la cirugía misma. Incluso cuando se logra una fijación anatómica estable mediante una reducción abierta con fijación interna (RAFI), la rigidez o la inestabilidad del codo, las lesiones nerviosas, y la formación de osificaciones heterotópicas pueden estropear el resultado.
La prótesis total de codo (PTC) no ha sido considerada una opción para el tratamiento de las fracturas muy conminutas del húmero distal, porque los cirujanos creen que el resultado no es predecible. En base a una búsqueda bibliográfica en Medline de este tema (tabla 1), y en los resultados ya documentados gracias a la mejoría en el diseño de los implante, en la técnica quirúrgica y en la selección de los pacientes, afirmamos que la PTC tiene un papel claro en el tratamiento de algunas fracturas del húmero distal. Siempre que sea posible, realizamos una RAFI de las fracturas del húmero distal.
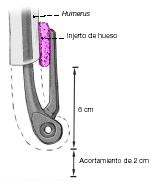
La prótesis cementada semiconstreñida Coonrad-Morrey (fig. 1), que tiene una laxitud de 7º en el plano varo/valgo, y una pestaña anterior, proporciona estabilidad incluso en ausencia de los cóndilos. La fijación extramedular mediante una pestaña anterior resiste las cargas torsionales y el desplazamiento posterior. El implante reproduce el eje de rotación; si se resecan los cóndilos, el eje se mantiene en su localización anatómica (fig. 2). Aún así, es preferible conservar los epicóndilos y sus inserciones musculares y ligamentosas para equilibrar las partes blandas. No es necesario reconstruir unos cóndilos multifragmentados y no se recomienda.
Se ha apuntado que la resección de los cóndilos tiene un efecto negativo sobre la fuerza, partiendo de la idea de que en la mayoría de los casos se pierden las inserciones óseas de la musculatura extensora y flexora-pronadora. McKee et al6 investigaron este tema, utilizando pruebas estandarizadas y objetivas, comparando la fuerza muscular tras colocar la prótesis de codo de Coonrad-Morrey con y sin resección de los cóndilos. No había diferencias significativas entre los dos grupos con respecto a la fuerza de pronación (100% en el lado normal en el grupo con cóndilos intactos comparados con el 89% en el grupo con la resección de los cóndilos; p = 0,40), supinación (68% comparado con 89%; p = 0,49), flexión de muñeca (66% comparado con 56%; p = 0,46), extensión de muñeca (75% comparado con 65%; p = 0,40), o fuerza de puño (83% comparado con 72%; p = 0,40). Tampoco había diferencia en la evaluación de los dos grupos siguiendo la Escala de Función de Codo de la Clínica Mayo (79 puntos en el grupo con cóndilos intactos comparados con 77 puntos en el grupo con resección de los cóndilos; p = 0,67).
Frankle et al2 compararon la RAFI con la PTC en fracturas intraarticulares de húmero distal en mujeres > 65 años. Las pacientes eran 24 mujeres con fracturas del húmero distal subsidiarias de tratamiento quirúrgico, con un seguimiento clínico mínimo de 2 años. Los resultados según la Escala de Función de Codo de la Clínica Mayo, en los doce pacientes tratados mediante RAFI fueron los siguientes: cuatro excelentes, cuatro buenos, uno regular, y tres malos (casos que precisaron convertir a PTC). Los resultados de los doce pacientes tratados con PTC fueron los siguientes: once excelentes y uno bueno. No había resultados regulares y malos en el grupo de la PTC. El tiempo medio quirúrgico en el grupo de prótesis fue de 78 minutos y en la RAFI de 146 minutos.
La PTC en la fractura del húmero distal no es sinónimo de la incapacidad del cirujano para realizar una RAFI. Los factores del paciente, tales como una calidad ósea mala o una conminución extensa de la fractura, imponen en ocasiones el mejor tratamiento para los pacientes ancianos, con el objetivo de recuperar la función, acortar el periodo postoperatorio y evitar el ingreso en un centro de rehabilitación.
Figura 1
Sistema protésico: prótesis de codo semiconstreñida Coonrad-Morrey tipo III (Zimmer Company, Warsaw, IN, EE.UU., www.zimmer.com) fabricada en aleación de Titanium® Ti-6al-4v. La prótesis tiene una articulación abisagrada con un pin de cierre hueco de cromo-cobalto que pasa a través de un cojinete de polietileno de alto peso molecular para capturar el componente cubital. Se coloca un injerto óseo (aproximadamente de 2 x 2 cm y 2-4 mm de grosor) tomado del hueso resecado detrás de la pestaña anterior y que previene las fuerzas nocivas rotacionales y de desplazamiento posterior.
Figura 2
Modelo del húmero distal que muestra el eje normal de rotación que proporciona estabilidad incluso en ausencia de los cóndilos. El eje de rotación está reproducido por el implante modificado de la Mayo de Coonrad-Morrey con los cóndilos intactos. Si se resecan los cóndilos, el eje queda mantenido en su localización anatómica. Se prefiere la conservación de los epicóndilos y de sus inserciones musculares con el fin de lograr el equilibrio
de las partes blandas.
Ventajas
Intervención
* Tiempo quirúrgico breve en comparación con las osteosíntesis complejas dado que no se realiza la reconstrucción de los cóndilos humerales multifracturados.
* Abordaje relativamente poco agresivo que deja casi toda la inserción tricipital intacta.
* Estabilidad postoperatoria inmediata.
Prótesis de codo Coonrad-Morrey (fig. 1)
* Incluso en ausencia de cóndilos humerales, el implante semiconstreñido ("articulación abisagrada flexible") con laxitud varo/valgo de 7º proporciona estabilidad, y el acoplamiento entre los componentes protésicos cubital y humeral es sencillo.
* El acceso al canal medular humeral es fácil tras la resección de los cóndilos.
* Prótesis semiconstreñida que permite una movilidad postoperatoria inmediata del codo no dolorosa y libre; no es de esperar que se produzca rigidez de codo.
Inconvenientes
* Desgaste de los cojinetes de polietileno.
* Aflojamiento de los vástagos protésicos.
* La distribución asimétrica de las cargas sobre la prótesis tras la resección de los cóndilos y de los componentes ligamentosos puede producir un aumento del desgaste.
* Los pacientes no reumáticos tienen más demandas funcionales que pacientes reumatoides de edad similar. Los pacientes no reumáticos esperan un rango de movimiento y actividad similar al que tenían preoperatoriamente. En estos pacientes es previsible que los resultados funcionales y las tasas de supervivencia postoperatoria de la prótesis sean peores a causa de las mayores demandas que supone una actividad mayor.
* En comparación al número de prótesis totales de cadera y de hombro en lesiones traumáticas agudas, la PTC es un procedimiento poco frecuente; los cirujanos traumatólogos que deban realizar este procedimiento deben aprender la técnica quirúrgica visitando otro centro.
Indicaciones
* Hueso osteoporótico de mala calidad en el que la osteosíntesis estable parece imposible.
* Fracturas distales de húmero cerradas con conminución intraarticular grave y con fragmentos múltiples pequeños de cartílago/hueso, sobre todo las fracturas tipo C de la clasificación AO7.
* En pacientes con artropatía degenerativa previa y fracturas tipo A y B.
* Paciente muy colaborador: no se permite sostener objetos de > 5 kg ni levantar de forma repetida objetos de > 1 kg.
* Paciente biológicamente mayor (> 65 años).
* Factores que facilitan la indicación de una PTC: artritis reumatoide, artropatía degenerativa dolorosa previa.
* Déficit de reserva ósea significativa con pérdida de uno o de los dos cóndilos no cambia ni complica la colocación del componente humeral. La prótesis sólo precisa fijarse en la diáfisis humeral para lograr una fijación segura.
Contraindicaciones
* Fracturas abiertas de los tipos II y III de Gustilo-Anderson (lavado primario y desbridamiento, en lesiones abiertas con una pérdida significativa de fragmentos articulares se puede realizar la PTC en un segundo tiempo).
* Infección previa, heridas abiertas.
* Pacientes jóvenes, muy demandantes o poco colaboradores.
* Parálisis del músculo bíceps.
Información para el paciente
* Riesgos quirúrgicos habituales, incluyendo alergias.
* La indicación no se basa solo en las radiografías preoperatorias, sino también en el tamaño y la viabilidad de los fragmentos y el estado del cartílago durante la cirugía.
* Fallo del implante: aflojamiento/desgaste, fractura de los componentes protésicos, cirugía de revisión.
* Métodos alternativos, por ejemplo, tratamiento conservador, osteosíntesis, fijador externo, artrodesis, artroplastia de interposición a posteriori.
* Alivio del dolor (que es con frecuencia un problema a largo plazo tras la osteosíntesis de las fracturas intraarticulares debido a artrosis postraumática) que es el objetivo principal de la PTC incluso en los casos de fractura, no así la función.
* Déficit de extensión probable.
* Estilo de vida y utilización de la extremidad postoperatorios.
Planificación preoperatoria
* Radiografías anteroposterior (AP) y lateral del codo y del húmero.
* Evaluación de la piel y de las partes blandas.
* Exploración neurovascular.
Instrumental quirúrgico e implantes
* Instrumental para hueso.
* Motor de alta velocidad.
* Suturas irreabsorbibles (n.º 5) con aguja recta.
* Prótesis de codo semiconstreñida tipo Coonrad-Morrey III (fig. 1, Zimmer Company, Warsaw, IN, EE.UU., www.zimmer.com) fabricada con aleación de Titanio#R Ti-6A1-4V. La prótesis tiene una articulación abisagrada que consta de un pin de cierre hueco de cromo-cobalto que pasa a través de unos cojinetes de polietileno de peso molecular ultraalto para capturar el componente cubital. Un segundo pin de cierre sólido se coloca desde el lado contrario para bloquear la articulación (debe oírse un ruido de conexión cuando los pins de cierre se han bloqueado). Los componentes cubitales proximales tienen habitualmente una capa de recubrimiento spray en plasma de titanio. El componente humeral está disponible en tres longitudes 10,15, y 20 cm y en tres diámetros regular, pequeño, y extrapequeño. En casos de fracturas agudas se suelen utilizar vástagos de 15 cm para alcanzar el húmero a un nivel más proximal.
* Manguito de isquemia.
Anestesia y colocación
* Decúbito supino, un saquito bajo la cadera y la escápulas ipsilaterales (fig. 3).
* También se puede colocar al paciente en decúbito supino (requiere más tiempo).
* Se viste el campo quirúrgico con la extremidad libre y se cruza la misma por encima del pecho.
* Anestesia general.
Técnica quirúrgica
Figuras 3 a 18
Figura 3
Se realiza una incisión cutánea posterior recta, no se curva,
entre el epicóndilo medial y la punta del olécranon.
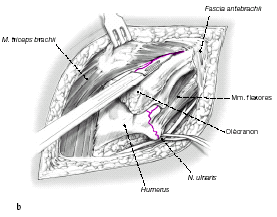
Figuras 4a y b
Se levanta un colgajo medial de grosor total,
liberando el tejido celular subcutáneo del lado
medial del tríceps en continuidad con el periostio cubital y la aponeurosis antebraquial, así se expone el borde medial del tríceps con el nervio cubital; identificación y traslación anterior del nervio
cubital.
Se diseca en sentido distal hasta el retináculo
del túnel cubital, el cual es abierto, y se avanza
distalmente hasta la primera rama motora
del flexor carpi ulnaris (a).
Se localiza y se libera el septo transmuscular.
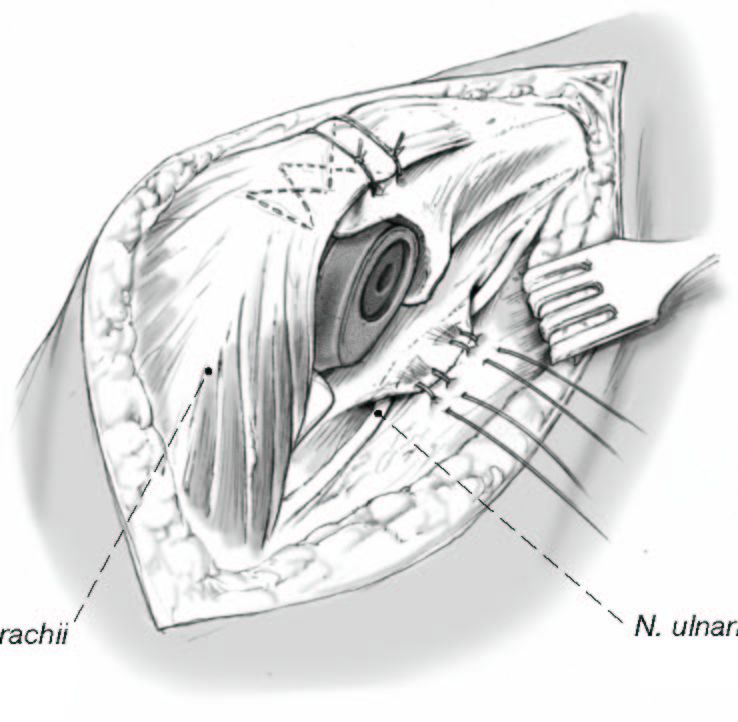
Entonces se levanta la parte medial del tríceps
desde la cara posterior del húmero y de la cápsula, reflejando el tríceps en continuidad con el periostio cubital y la aponeurosis antebraquial. Se libera
el ancóneo y se mantiene en continuidad
con el aparato extensor (b).
Figura 5
Posible resección de múltiples fragmentos de hueso
osteoporótico del húmero distal dejando las inserciones del tríceps prácticamente intactas, se traslada
el segmento humeral distal hasta el borde lateral
del tríceps con lo que se proporciona un acceso fácil
al canal medular en pronación máxima del antebrazo.
Figura 6
Se liberación de los tejidos blandos es necesaria para exponer adecuadamente la articulación, pudiendo incluir la sección
y posterior sutura de los ligamentos colaterales en caso
de que estén intactos.
Figura 7
El húmero distal se traslada lateralmente quedando fácilmente accesible para la preparación. En caso de que queden partes
de la porción medial de la tróclea, deben ser resecadas con una gubia. En caso de que el techo humeral del olécranon no se haya visto afectado por la fractura, se penetra con una gubia o con una fresa y se ensancha para recibir una raspa que sirve como guía de alineación para entrar en el canal humeral. Se ensancha lateralmente la porción metafisaria del canal excavando
el hueso cortical humeral con una pequeña fresa desde ambos rebordes supracondilares medial y lateral con el fin de
acomodar las partes distales del implante, a continuación se raspa el canal humeral hasta el tamaño adecuado. Los bloques de guía de corte sólo se usan cuando han quedado indemnes partes importantes del húmero distal.
Figura 8
Se raspa el canal medular hasta el tamaño apropiado utilizando con cuidado el martillo.
Figura 9
Resección de la punta del olécranon, identificación del canal
medular del cúbito con una fresa de alta velocidad, utilizando un punzón iniciador y una raspa piloto.
Figura 10
Se ensancha el canal medular del cúbito con una raspa piloto. Orientación de la raspa: perpendicular a la cresta del cúbito
para crear una entrada acodada del canal medular (la raspa de inicio pude ser la raspa final).
Figura 11
El centro de rotación del componente cubital se sitúa en la línea media de la coronoides (*) reproduciendo el contorno articular normal, en el cual el centro del componente cubital debería estar alineado con el mismo.
Cementación y acoplamiento de los componentes
Consideraciones generales
Es recomendable colocar los componentes humeral y cubital y hacer una reducción de prueba para asegurar que no hay contractura residual en flexión, identificar un conflicto por pinzamiento ("impingement"), y para comprobar que el componente humeral se puede articular fácilmente con el componente cubital.
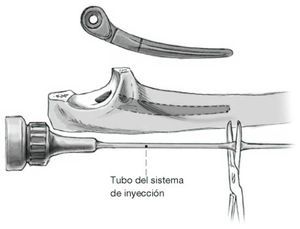
Para cementar, colocar el componente humeral cuando ya se haya endurecido el cemento del cúbito. Se puede usar cemento Refobacin®-Palacos® R tras sacarlo de la nevera (fabricante: Merck) o Sulcem® 3 Gentamicina Plus (fabricante: Zimmer; ventaja: baja viscosidad) en caso de canal estrecho del húmero y del cúbito. Se coloca un tapón de cemento o Spongostan® (esponja reabsorbible de Gelantin 7 x 5 x 1; fabricante: Johnson & Johnson) envuelto en Tabotamp® (hemostático reabsorbible de 5 x 35 cm; fabricante: Ethicon) a modo de tope para el cemento. Como alternativa, se puede colocar un tapón medular al final del tubo de inyección y se libera en el húmero con la pistola inyectora.
Figura 12
Reducción de prueba cuidadosa para determinar la altura de implantación del vástago. Comprobación del arco de movilidad. Si se ha resecado la parte final del húmero, el acoplamiento de los componentes protésicos humeral y cubital se realiza sin dificultad.
Figura 13
Técnica de cementación del componente cubital (y humeral); la longitud del sistema inyector depende de la longitud del componente cubital (y humeral).
Figura 14
Preparación del injerto de hueso (de aproximadamente 2 x 2 cm y un grosor de 2-4 mm) con dos suturas reabsorbibles, utilizando el hueso resecado, cresta iliaca o banco de hueso: se coloca el hueso detrás de la pestaña anterior cuando se introduce el componente humeral dentro del cemento.
Figura 15
El injerto debe quedar: una mitad, por delante de la cortical anterior del húmero distal, y la otra mitad debe quedar visible a través de la tróclea resecada. Entonces se introduce el componente humeral en el canal hasta alcanzar el punto en que se puede articular con el cúbito. Se articulan los componentes. Se debe comprobar que ambos pins están completamente encajados; se debe oír un clic cuando los dos pins quedan conectados. Después de que la prótesis se haya acoplado, se utiliza el impactador humeral para impactar el componente humeral dentro del canal humeral. El injerto óseo previamente colocado encaja la pestaña en el momento del acoplamiento de los implantes. El injerto de hueso se integra bien y previene las fuerzas rotacionales y el desplazamiento posterior nocivos. Esto proporciona una fijación duradera a pesar de la resección de los cóndilos.
Flexionar y extender el codo para identificar posible zonas de "impingement" (apófisis coronoides, cabeza radial), y con una gubia se reseca cualquier hueso que provoque pinzamiento.
Figura 16
El componente humeral largo permite recuperar defectos del húmero distal de hasta 8 cm, 6 cm gracias a la pestaña anterior y 2 cm gracias al acortamiento del húmero.
Cierre
Figuras 17a-c
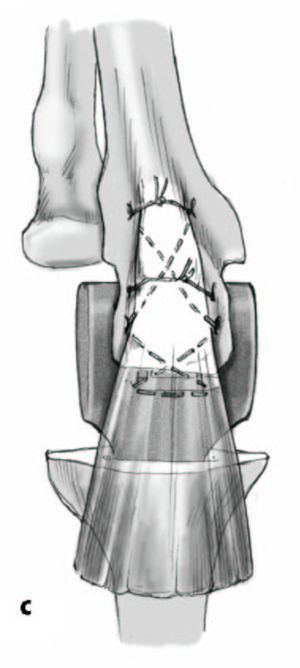
Reinserción del tríceps: se colocan suturas cruzadas no reabsorbibles (n.º 5) a través del hueso y se añade una segunda sutura transversa, atada con el codo a 90º de flexión, evitando anudar en el borde subcutáneo del cúbito.
Reinserción de los orígenes comunes de la musculatura flexora y extensora a los lados medial y lateral del tríceps.
Figura 18
Se coloca el nervio cubital en una bolsa de tejido celular subcutáneo para protegerlo. Finalmente, se coloca un vendaje compresivo con el codo en extensión completa.
Manejo postoperatorio
* Vendaje del brazo en extensión completa.
* Elevación de la extremidad durante 24 h.
* Se permite al paciente que mueva el brazo según tolere tras la retirada de los drenajes.
* No hay sesiones de fisioterapia regladas.
* Estancia media hospitalaria de 3 días.
* Se aconseja evitar la elevación única de objetos de > 5 kg así como el levantamiento repetido de cualquier objeto que pese > 1 kg (restricción permanente).
* Se desaconseja practicar deportes de raqueta y de lanzamiento o deportes similares.
Errores, riesgos y complicaciones
* PTC aflojada y dolorosa, fractura periprotésica con implantes aflojados o PTC aflojada no dolorosa, en caso de ser progresiva, predisponiendo a sufrir una fractura del hueso: retirada de los componentes aflojados, reprótesis dependiendo del defecto óseo, en algunos casos se realiza aporte de injerto óseo esponjoso o estructural.
* Infección articular aguda o crónica: retirada de los implantes, si el germen es muy virulento, se coloca un espaciador, y reprótesis en segundo tiempo; desbridamiento para las infecciones agudas para los microorganismos menos virulentos.
* Fractura periprotésica con implantes estables: osteosíntesis, cerclaje con alambres o placas; si la fractura no está desplazada: se puede tratar con un yeso.
* Fractura del vástago: se pueden aplicar las técnicas utilizadas para prótesis femorales aflojadas de reimplantar el componente en el antiguo cemento.
* Desgaste de los cojinetes con fracaso de la articulación: recambio de los cojinetes; no suele ser técnicamente difícil, porque los elementos permanecen estables y se dejan intactos. Limpieza completa de la articulación de las partículas de desgaste.
* Inestabilidad grave de la articulación: recambio de componente.
* Neuropatía cubital progresiva: revisión nerviosa, posible neurólisis/transposición.
* Insuficiencia y/o desinserción del tríceps: reinserción con suturas no reabsorbibles fuertes Nº 5; se utiliza un colgajo rotacional del ancóneo, si la fijación del tríceps es deficiente.
* Conflicto entre el componente humeral de la PTC y el de una prótesis de hombro (prótesis "en espejo" o "kissing prostheses"): radiografías preoperatorias de la articulación del hombro.
* El componente humeral no se puede colocar por la curvatura anterior de la diáfisis humeral; radiografías preoperatorias del húmero AP y lateral, se dobla el componente humeral con un doblador de placas.
* Técnica de cementación inadecuada: utilizar un sistema de inyección con un introductor que se adapta al cúbito y al húmero.
Consideraciones generales para cualquier cirugía de revisión en el codo
* La localización del nervio cubital es el primer paso de la cirugía.
* Abordar el componente diafisario en la zona de déficit óseo o de lesión nerviosa potencial: si se trata del húmero será necesario exponer el nervio radial; si se trata del cúbito se requiere el abordaje hasta la punta del implante, hasta la fractura o hasta la zona problemática de que se trate.
* Insistir en la liberación adecuada de las partes blandas mediante la reducción de prueba y asegurarse de que la articulación puede acoplarse sin dificultad.
* Liberación del manguito de isquemia al final de la cirugía, especialmente si se ha realizado una disección extensa.
* Inmovilizar el codo tras estabilizar la fractura; más tarde se podrán utilizar férulas de flexión-extensión, en caso de ser necesario.
* En los casos no planificables, se ha de cerciorar de manera absoluta de que dispone de un surtido adecuado de implantes y opciones.
Resultados (figs. 19 y 20)
Figura 19
Radiografía preoperatoria: paciente mujer reumatoidea de 67 años de edad con una fractura tipo B del húmero distal. Radiografía a los 5 años de la cirugía: tiene una buena función tras haberle colocado una prótesis de Coonrad-Morrey.
Figura 20
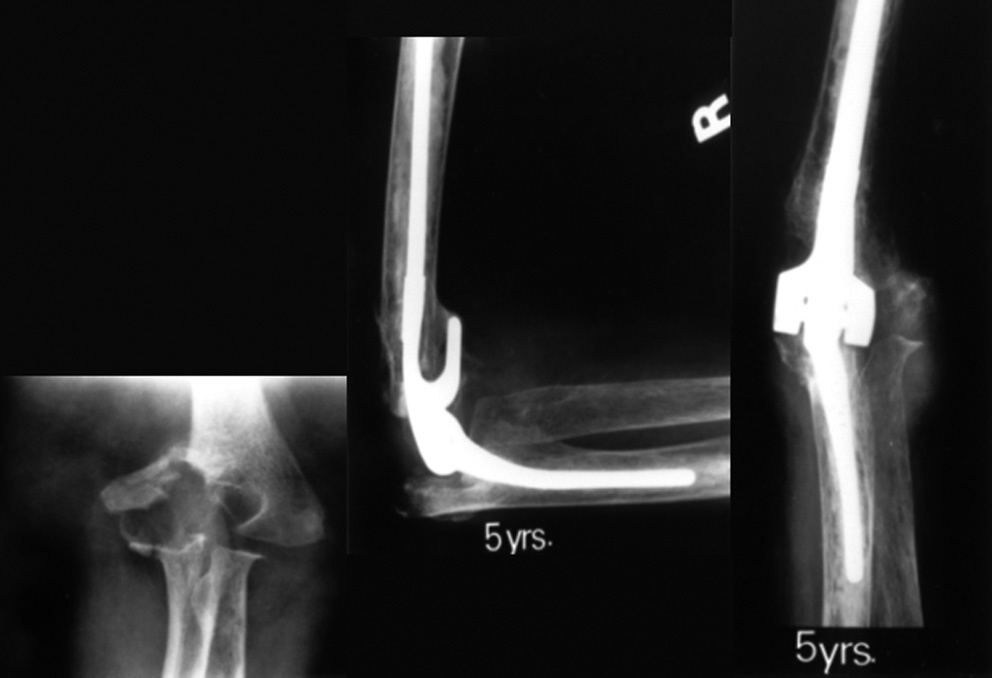
Radiografía preoperatoria: paciente mujer de 79 años de edad con una fractura conminuta tipo C del húmero distal. Radiografía postoperatoria: no se han reconstruido los cóndilos, la paciente está asintomática con una función básicamente normal a los 3 años de la prótesis de Coonrad-Morrey.
La tabla 1 muestra una resumen global de los cinco artículos de revisión publicados con los resultados de la PTC como tratamiento primario de las fracturas distales de húmero (n = 80 prótesis). Un estudio utilizaba el instrumento Souter-Strachclyde5: el tiempo medio entre la lesión y la PTC incluyendo la osteosíntesis en este estudio era de 0-48 meses. Los otros cuatro estudios tenían una demora entre la fractura y la PTC de 6,6-11,4 días1,3,4,8. El seguimiento era de 17,8 a 48 meses. Los resultados funcionales mostraron un arco de movilidad medio en todos los estudios > 100º, y una puntuación media en la Escala de Mayo > 90 (Ikävalko & Lehto5 no publicaron la escala de la Mayo). La "tasa de satisfacción positiva" subjetiva era de 100 a 72%, sólo García et al4 investigaron la escala DASH que era de 23 en 16 pacientes no reumatoides. La complicación precoz más frecuente (tabla 2) fue la infección superficial de la herida (n = 3), líneas radiolucentes no progresivas en el intersticio cemento-hueso (n = 8), neuroapraxias (n = 4), y la distrofia simpaticorrefleja (n = 2). Las osificaciones heterotópicas severas sólo se reportaron en dos casos con pérdida de movilidad. Se publicó un caso de ruptura del tendón del tríceps.
Revisamos retrospectivamente 49 fracturas agudas distales de húmero en 48 pacientes que fueron operados colocando una prótesis de codo como tratamiento inicial. Seis fracturas en cinco pacientes tenían < 2 años de seguimiento y no fueron incluidas en el análisis de resultados. Cuarenta y tres fracturas tenían un seguimiento mínimo de 2 años; la duración media del seguimiento fue de 7 años. Siguiendo la clasificación AO7, cinco fracturas eran tipo A, cinco tipo B, y 33 tipo C. La edad media de los 43 pacientes era 69 años. 14 pacientes fallecieron durante el periodo de seguimiento.
El mecanismo lesional fue una caída de baja energía sobre el codo o con el brazo extendido en 40 pacientes, las otras tres fracturas se debieron a traumatismos de alta energía. Dos fracturas asociaban heridas abiertas del tipo I de Gustilo, que fueron extensamente desbridadas inmediatamente antes de la artroplastia.
Treinta pacientes presentaban patología de base. Diecinueve pacientes sufrían artritis reumatoide y dos de ellos recibían tratamiento con corticoides. Otros tres pacientes tomaban corticoides para tratarse otras afecciones, en tres pacientes existía una osteoporosis diagnosticada en densitometría esquelética. Otras comorbilidades incluían diabetes, demencia, asma, enfermedad respiratoria obstructiva, cardiomiopatías y depresión.
El retraso medio desde la fractura al tratamiento con prótesis total de codo fue de 5,9 días (rango: 1-25 días).
En lo que respecta a los criterios de inclusión, las fracturas con menos conminución de los tipos A y B se consideraron buenos candidatos para la artroplastia, cuando la superficie articular estaba destruida por una patología de base como la artritis reumatoide. La decisión de tratar las fracturas con PTC fue, en la mayoría de los casos, definida preoperatoriamente con el uso de radiografías, en los codos que no resultaban evidentemente irreconstruibles, se utilizó la tomografía. En seis de los codos la decisión de proceder con una artroplastia fue intraoperatoria, cuando la conminución, la calidad ósea y la personalidad de la fractura se hicieron más evidentes de lo que se había apreciado en el preoperatorio.
La función clínica postoperatoria se evaluó mediante la Escala de Función del Codo de la Mayo, se valoraron radiografías AP y lateral en el control de seguimiento.
En las exploraciones del último control de seguimiento, el arco de flexión medio fue de 24º (rango: 0-75º) hasta 131º (rango: 100-150º) y la puntuación en la Escala de la Mayo obtuvo una media de 93 puntos de los 100 posibles. La variable más predecible tras el tratamiento agudo de estas fracturas con PTC fue la función indolora tal y como muestra una puntuación de dolor media de 42 sobre un total posible de 45 puntos en la Escala de Función de la Mayo, con ocho pacientes con dolor moderado y 35 libres de dolor. El dolor moderado se desencadenaba con la actividad en 5 pacientes, y estaba asociado a disestesias del dedo meñique en un paciente. Sólo 2 pacientes lograron la extensión completa en la última revisión, y el resto tenían cierto grado de contractura en flexión. 35 pacientes (79%) alcanzaron una prono-supinación >= 100º.
Nueve codos presentaban líneas radiolucentes en el momento del último control fueron considerados estables, ya que las mismas líneas se habían visto en el postoperatorio y no habían progresado durante el seguimiento. Tres codos tenían líneas radiolucentes que no estaban en el postoperatorio; dos de ellos eran radiolucencias del tipo 2 (cubitales) y uno de tipo 1 (humeral). Dos de estos pacientes presentaban con radiolucencias cubitales presentaba dolor moderado con la actividad. Cuatro pacientes presentaban evidencias de desgaste de los cojinetes. Otros rasgos radiográficos sin consecuencias aparentes eran la reabsorción de hueso de detrás de la pestaña humeral en dos codos. Había osificaciones heterotópicas de algún grado en siete codos.
Los datos de las complicaciones se obtuvieron de los registros de todos los 49 pacientes que fueron sometidos a artroplastia incluyendo los seis que habían sido controlados < 2 años. 32 (65%) de los 49 codos no habían presentado ninguna complicación ni habían sido intervenidos de nuevo desde el momento de la artroplastia inicial hasta la última visita de seguimiento. 14 codos (29%) tuvieron una única complicación, y tres (6%) tuvieron dos complicaciones; la mayoría no precisaron ninguna cirugía al respecto.
Las complicaciones perioperatorias incluyeron un infarto del lóbulo frontal y un infarto de miocardio cada uno en un paciente. Un tercer paciente presentó una fibrilación auricular postoperatoria y un tromboembolismo pulmonar. Un paciente presentó disestesias en el dedo meñique, y otro una neuroapraxia que se manifestó por debilidad de la musculatura intrínseca en el postoperatorio inmediato. Ambos se resolvieron a los 3 meses. Un paciente presentó una distrofia simpaticorrefleja. Un paciente se cayó y sufrió una fractura periprotésica de la diáfisis cubital un año tras la artroplastia, y se trató con éxito con inmovilización en yeso. Nueve codos precisaron un total de diez cirugías complementarias; cinco en relación a las partes blandas y cinco sobre el implante o el hueso.
Tres pacientes precisaron desbridamiento de un hematoma persistente, y dos un cierre secundario para tratar una dehiscencia de herida. Un paciente precisó la retirada de una aguja de Kirschner que protruía en el olécranon a los dos meses de la intervención. Un caso de infección superficial de la herida evolucionó a una infección profunda articular a los 21 días de la intervención. El componente humeral se aflojó, por lo que tuvo que ser retirado, se realizaron tres desbridamientos y se colocaron espaciadores con antibióticos, y se colocó un nuevo componente humeral.
Cinco pacientes precisaron artroplastia de revisión durante el periodo de seguimiento, incluido el mencionado paciente del aflojamiento séptico. Tres pacientes sufrieron una lesión por caída que precisó revisión del implante. Uno sufrió una fractura de la diáfisis humeral y del implante a los 4 años de la cirugía; uno tuvo una fractura del componente cubital a los 20 meses de la artroplastia; y uno fue sometido en dos ocasiones a revisión del componente cubital, la primera por una caída, y la segunda por un aflojamiento aséptico tres años después. El quinto paciente precisó una artroplastia de revisión a los 9 años de la artroplastia inicial por un aflojamiento aséptico del componente cubital.
En conclusión, ante una fractura compleja del húmero distal deberá considerarse en primer lugar la posibilidad de reconstrucción mediante osteosíntesis. Cuando la osteosíntesis no se considera viable, especialmente en pacientes de edad biológica avanzada y con bajas demandas sobre la extremidad, debe valorarse la PTC. Esta revisión retrospectiva apoya la recomendación de la prótesis total de codo para el tratamiento agudo de las fracturas del húmero distal, siempre y cuando se respeten estrictamente los criterios de inclusión.