Notas preliminares
Por "trasplante muscular funcional" se conoce el trasplante de un músculo para recuperar un movimiento ausente, en el sentido de un colgajo local en isla con pedículo neurovascular (transposición muscular) o un trasplante muscular libre funcional con sutura vascular microquirúrgica y coaptación nerviosa próxima al músculo en la zona receptora23,28. En este artículo se describe el trasplante muscular libre con sutura vascular microquirúrgica y coaptación nerviosa próxima al músculo.
Una función muscular insuficiente o ausente puede ser debida a una insuficiencia muscular aislada, una insuficiencia nerviosa aislada o una insuficiencia combinada neuromuscular. La insuficiencia muscular aislada (miógena) aparece en la hipoplasia o aplasia muscular congénita o tras un defecto muscular adquirido, p. ej. traumatismo, tumor o infección25. La lesión de un nervio periférico (insuficiencia neurógena), del tipo axonotmesis de Seddon32 o lesión de grado III-IV de Sunderland36 y neurotmesis o lesión de grado V, provoca una alteración característica en el "órgano efector" músculo. Además de la atrofia muscular apreciable clínicamente, se reduce el número de placas motoras finales. Cuando la denervación es antigua, aparecen procesos degenerativos irreversibles (p. ej. fibrosis) que no permiten la reinervación exitosa si ésta se realiza transcurridos más de 12-18 meses26-28. Una vez localizada la lesión nerviosa, se debe distinguir entre lesiones nerviosas periféricas (lesiones tronculares con atrofia muscular completa) y lesiones nerviosas que afectan al plexo braquial o lumbosacro1,6,18,24,35 (lesiones radiculares con atrofia muscular parcial). En la lesión neuromuscular combinada, además de una lesión nerviosa periférica también existe una lesión muscular directa o indirecta. Los principales representantes de este grupo son los estados provocados por una contractura de Volkmann, lesiones debidas a descargas eléctricas de alto voltaje o amputaciones24.
Dependiendo del nervio donante y/o de la situación vascular, cabe distinguir entre un trasplante muscular libre en un tiempo o en varios tiempos. En el trasplante muscular libre en un tiempo existe un nervio donante y una situación vascular adecuada para realizar una anastomosis microquirúrgica. El procedimiento en varios tiempos supone que antes del trasplante muscular se deben realizar una o varias intervenciones quirúrgicas para conseguir una situación neurovascular inicial adecuada. Para mejorar la situación vascular se puede realizar un injerto de vena safena magna como fístula arteriovenosa central. El trasplante muscular libre no debe practicarse antes de 3 semanas. Si no se dispone de nervio donante, existen varias posibilidades: si está presente el nervio donante pero su muñón terminal es insuficiente —por ejemplo a causa de un síndrome compartimental—, se recomienda disecar y extirpar hasta llegar al tejido sano. Es posible que para suplir una pérdida de sustancia sea necesario un trasplante nervioso como en el procedimiento en varios tiempos. Si no existe un nervio donante adecuado —por ejemplo por una lesión del plexo braquial—, está indicada una neurotización extraplexual utilizando un nervio donante que tenga otra función primaria. Siempre que sea posible, debe intentarse conseguir una coaptación directa en un solo tiempo. Los donantes de axones pueden ser el nervio accesorio (XI par) en la zona del hombro, el frénico o los intercostales 3-6 de las caras flexora y extensora del brazo, y el nervio cubital en la cara flexora del brazo (transferencia de Oberlin) y antebrazo. Si hay pérdida de sustancia, será necesaria una intervención en varios tiempos. Para mejorar la situación nerviosa inicial, en la primera operación se colocan los injertos nerviosos. Como donantes de axones se usan nervios extraplexuales, como el nervio accesorio, el frénico o los intercostales, o la parte dorsal de la raíz C7 con fascículos para los músculos pectorales y el músculo dorsal ancho de la raíz C7 contralateral. Transcurridos 12-18 meses tras la primera operación, se realiza una biopsia del extremo distal del nervio trasplantado para comprobar histológicamente la calidad de la regeneración nerviosa. La calidad motora y sensorial de los axones se comprueba con la reacción de la acetilcolinesterasa22. La cantidad de axones > 6 µm y < 18 µm se determina morfométricamente sobre los cortes de tejido nervioso13 (tinción con toluidina). Si la calidad y la cantidad son suficientes, puede hacerse un trasplante muscular libre.
La duración de la operación puede reducirse significativamente si se dispone de dos equipos quirúrgicos, uno para preparar la zona donante y otro para la zona receptora. Además de los requisitos generales imprescindibles para el restablecimiento de una función muscular insuficiente o ausente, también deben tenerse en cuenta otras condiciones complementarias y detalles de la técnica quirúrgica2,3,11,16,18,19,30.
El trasplante muscular libre funcional solamente puede tener éxito cuando se dan las condiciones adecuadas para una conexión neurovascular en la zona receptora. El éxito de las microanastomosis arteriales y venosas es decisivo para la supervivencia o la pérdida del tejido; la calidad de la coaptación nerviosa es determinante para la función. La coaptación del nervio se lleva a cabo mediante la técnica término-terminal con puntos sueltos y/o adhesivo de fibrina. La técnica de coaptación término-lateral —que en los últimos años se está publicando de nuevo de forma creciente— solamente debe aplicarse cuando no sea posible una coaptación término-terminal. La musculatura puede adaptarse al esfuerzo modificando su metabolismo, algo que puede conseguirse con entrenamiento si se conserva la inervación.
En el trasplante muscular libre, la elección del nervio donante es importante, porque determina la función del injerto muscular.
Antes de la intervención deben comprobarse en la medida de lo posible las condiciones de los tendones de origen y de inserción. Además, hay que establecer el punto más favorable de fijación, la longitud del injerto muscular y la relación topográfica entre el pedículo neurovascular y el posible punto de conexión de la región receptora. Para que un músculo sea adecuado para un trasplante muscular libre, debe cumplir varios criterios. En primer lugar, el músculo debe poseer un pedículo neurovascular constante, dominante y, a ser posible, largo. Además de una amplitud de movimientos suficiente, la intervención de sustitución secundaria deberá permitir recuperar una fuerza suficiente (diámetro muscular). El músculo debe tener además una forma y características adecuadas y, en la zona donante, debe producirse un defecto estético y/o funcional apenas apreciable. También debe ser fácil de abordar y de disecar. Para sustituir los flexores del codo (los músculos bíceps braquial y braquial), en la bibliografía se describe con mayor frecuencia el recto interno así como el dorsal ancho y el recto femoral31. El recto abdominal ya no se utiliza por el gran defecto que provoca en la zona donante y por su inervación segmental mediante varios nervios. El recto interno suele escogerse como primera opción, sobre todo en niños, por su forma casi idéntica al bíceps11,12,23,25,30 (cabeza larga). Algunos autores prefieren el dorsal ancho —sobre todo en adultos— por su mayor diámetro y, consiguientemente, su mayor fuerza7,38.
Independientemente de la elección del músculo, para el trasplante muscular libre deben tenerse en cuenta especialmente los siguientes factores:
Puesto que el éxito del trasplante muscular depende de que exista una rama motora con un número suficientemente elevado de axones bien mielinizados, siempre debe descubrirse primero la rama nerviosa antes de levantar el músculo que va a trasplantarse. El tramo proximal del nervio debe disecarse hasta llegar al tejido sano, y la estructura fascicular debe estar bien delimitada20,26.
La interrupción del riego sanguíneo debe ser lo más breve posible para evitar una merma funcional transitoria o permanente. El riego sanguíneo del músculo sólo se podrá interrumpir cuando los vasos de la zona receptora ya estén preparados para una anastomosis microvascular. Tras interrumpir el riego, el injerto muscular debe refrigerarse en frío seco para reducir el metabolismo celular. Está descrito que el límite máximo de interrupción del riego sanguíneo para no provocar lesiones (clínicas) es de 3 horas de anoxia fría.
La sutura del injerto muscular libre comienza con el control adecuado de la posición del pedículo neurovascular con respecto a los vasos y nervio receptores. Es importante proteger el paratendón a fin de conservar la capacidad de deslizamiento del trasplante. Si se lesiona, pueden surgir adherencias y limitaciones funcionales. Para evitar una pérdida innecesaria de fuerza, es importante elegir un recorrido lo más recto posible. Si es necesario algún cambio de dirección, debe haber alguna estructura que lo guíe8 (poleas).
Una coaptación próxima al músculo ayuda a reducir considerablemente el período de reinervación. Si después de la coaptación nerviosa todavía quedan fascículos para reinervar, pueden aprovecharse para implantarse en el músculo. De ese modo, se consigue una reinervación neuromuscular directa en el área motora del músculo, lo que mejora el resultado de la inervación20.
Anatomía quirúrgicamente pertinente
El músculo recto interno es delgado y plano, de unos 4-6 cm de ancho y más de 40 cm de longitud (fracción muscular > 30 cm, fracción tendinosa > 10 cm). Está situado entre las caras dorsales del aductor largo y del semimembranoso, justo debajo de la fascia profunda, en la cara medial del muslo. El recto interno se origina en la rama inferior del pubis y el isquion, y se inserta en la cara medial de la meseta tibial mediante un tendón largo, que es la porción media de la pata de ganso. Tiene función de aductor de la cadera y flexor de la rodilla. El defecto funcional que se produce es irrelevante.
Según la clasificación de Mathes y Nahai29, el recto interno es un músculo del tipo II (un pedículo vascular dominante y varios pedículos secundarios) que se nutre del ramo ascendente de la arteria circunfleja femoral. El pedículo vascular dominante penetra en el recto interno desde abajo (unos 8-10 cm distal a su origen) y va acompañado del ramo anterior del n. obturador, que es puramente motor.
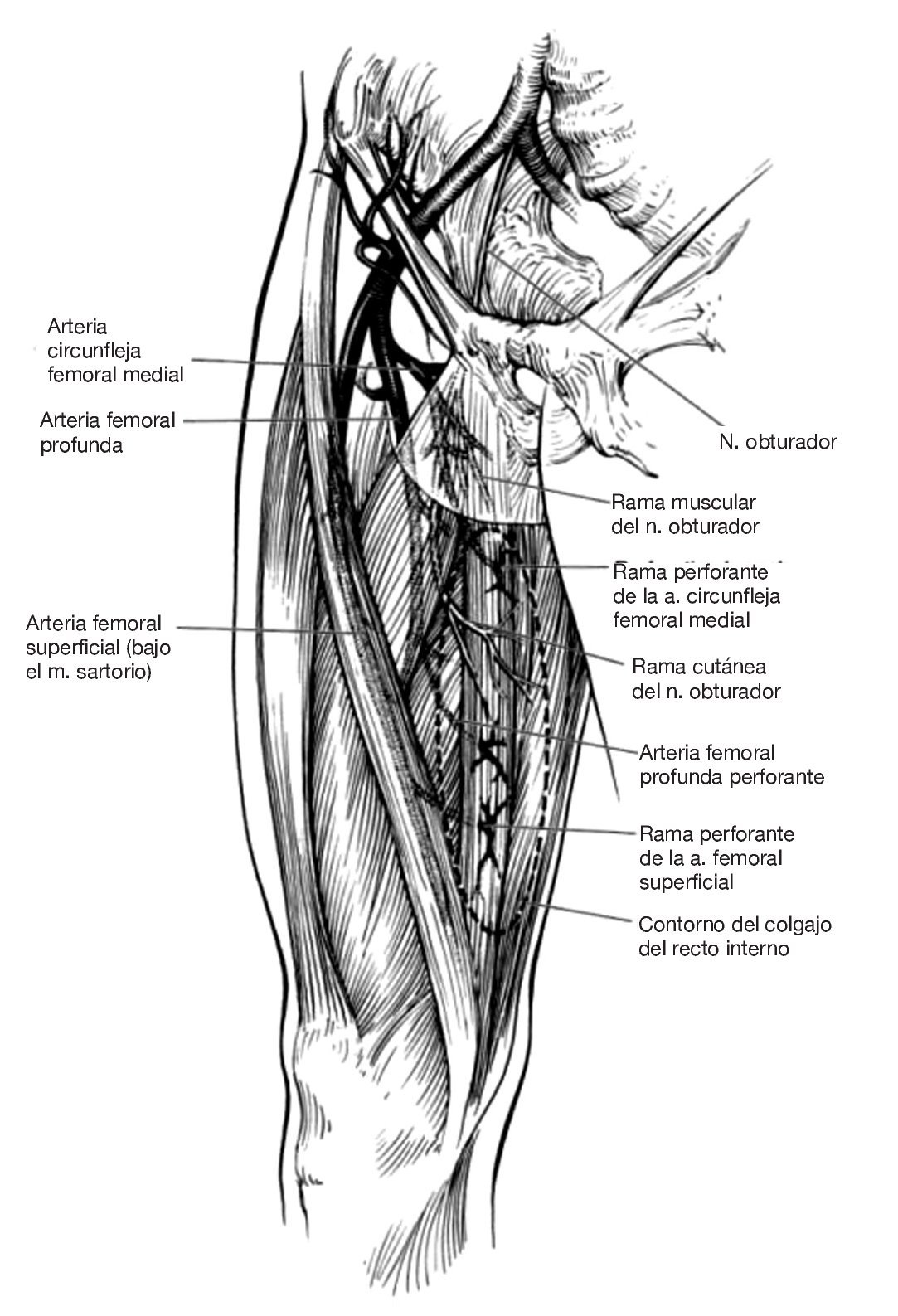
Las arterias van acompañadas de dos venas concomitantes con un diámetro exterior de 3-4 mm. El ramo anterior del nervio obturador discurre entre los músculos aductor largo y corto y se divide aquí en sus porciones sensorial y motora. La porción motora se dirige hacia el recto interno y se une al pedículo vascular dominante. Cuando entra en el recto interno, el nervio motor se divide en dos o tres partes que inervan el músculo por separado. A menudo, esta separación se produce antes de entrar en el músculo, por lo que no es extraño encontrar un nervio motor accesorio del recto interno. La rama sensible del ramo anterior del obturador cruza el recto interno por su tramo medio e inerva la piel de esta zona1,5,12,23 (fig. 1).
Figura 1 Vascularización del recto interno y de la piel suprayacente34.
Principios quirúrgicos y objetivos
Restablecimiento de una flexión activa del codo mediante un trasplante muscular libre del recto interno y coaptación microquirúrgica del muñón nervioso con el correspondiente nervio de la zona donante. Cuando los flexores del codo (bíceps braquial, coracobraquial y braquial) pierden su función (traumatismo directo, tumor, denervación durante más de 18 meses), la mayoría de los pacientes ya no puede flexionar el codo, aunque algunos conservan la flexión activa incluso tras el fallo de los músculos citados gracias a un braquiorradial fuerte1,4,10. El trasplante del recto interno proporciona una nueva unidad contráctil a la cara anterior del brazo: la coaptación microquirúrgica del nervio del colgajo con el correspondiente nervio de la zona receptora restablece la flexión activa del codo.
Ventajas1,7,11,12,15-19,23-26,35
Riego vascular e inervación constantes del recto interno.
Tipo de vascularización adecuado —de la clase IV según Mathes y Nahai29— para la plastia de colgajo muscular pediculado.
Pedículo vascular largo y gran diámetro de vasos.
Gran fiabilidad de la plastia de recto interno.
Facilidad de preparación del colgajo de recto interno.
Defecto funcional y estético pequeño en la zona donante, en la cara interna del muslo.
Plastia en colgajo idónea para un trasplante muscular funcional gracias a la existencia de estructuras tendinosas proximales y distales para la fijación, vasos suficientemente grandes y nervios motores suficientes, gran diámetro muscular para un buen desarrollo de fuerza y excursión suficiente para una amplitud de movimiento adecuada.
No es necesario mover al paciente durante la operación.
Desventajas1,7,11,12,15-19,23-26,35
Riego inseguro de la isla cutánea en el tercio distal del colgajo miocutáneo del recto interno.
La flexión del codo no puede restituirse íntegramente. Como máximo pueden levantarse 4 kg sujetos a la muñeca.
Si falta el nervio musculocutáneo y se necesita una neurotización extraplexual, se produce un defecto añadido en la zona donante. Si se usan partes del nervio cubital (transferencia de Oberlin), no se produce ninguna merma funcional. Si se usan las fracciones inferiores del nervio accesorio, se desarrolla una paresia de la fracción inferior del trapecio. Si se usan tres nervios intercostales, se reduce la capacidad inspiratoria pulmonar y queda una gran cicatriz en el pliegue submamario. Si se usa el nervio frénico, se produce una elevación pasajera del diafragma con reducción de la capacidad inspiratoria pulmonar.
Indicaciones
Insuficiencia miógena aislada de la flexión del codo: intervención precoz siempre y cuando se cumplan las condiciones necesarias para intervenciones de sustitución secundarias.
Insuficiencia neurógena aislada: 2-3 años después de un tratamiento quirúrgico total o parcialmente infructuoso de la lesión nerviosa periférica, como parte del enfoque terapéutico integral.
Lesiones neuromusculares combinadas: tras los procesos de regeneración pertinentes.
Ausencia de musculatura funcional (insuficiencia de órgano final) sin posibilidad de transposición de músculos o tendones.
Defecto en la zona donante demasiado grande en transposiciones de músculo/tendón, por ejemplo transposición del pectoral mayor en una mujer joven.
Resultado previsiblemente insatisfactorio de una transposición de músculo/tendón, por ejemplo para restablecer la función del codo mediante una transferencia de Steindler cuando existe una extensión inadecuada del codo y/o falta de extensión de la muñeca y los dedos.
Para mejorar el resultado funcional de la reconstrucción de un defecto de tejidos blandos con una función motora aún suficiente. Si se fijan el músculo trasplantado y la conexión nerviosa, puede conseguirse una mejora de la función motora (tabla 1).
Contraindicaciones
Lesiones vasculares concomitantes.
Posibilidad de neurotización insuficiente.
Movilidad articular pasiva insuficiente.
Falta de predisposición del paciente para colaborar en la prolongada fisioterapia (12-18 meses).
Falta de sensibilidad en el antebrazo y la mano (contraindicación relativa).
Información para el paciente
Riesgos normales asociados a una intervención quirúrgica.
Resultado estético en la zona donante: una cicatriz larga y delgada en la cara interna del muslo.
Necrosis cutáneas en la zona receptora (muy raramente).
Obstrucción vascular tras una anastomosis microquirúrgica. En el 2-8% de los casos de trasplante tisular libre microquirúrgico surge una complicación vascular que requiere una revisión quirúrgica inmediata. Un período de isquemia caliente superior a 3 horas provoca daños estructurales en el trasplante muscular que afectan a su función de contracción. En el caso de una trombosis postquirúrgica, se ha comprobado que los trasplantes revisados son los que peores resultados arrojan en todas las series. Por eso, algunos autores prefieren la explantación primaria y la realización de una nueva plastia muscular libre funcional. El riesgo de pérdida del trasplante es del 2-5%.
Desarrollo insuficiente de fuerza tras la operación. En el 25-40% de los casos, sobre todo cuando la insuficiencia muscular es total (M0), la fuerza recuperada tras la intervención es insuficiente (< M4).
Preparación de la intervención
Para que el tratamiento tenga éxito es imprescindible que el diagnóstico y la planificación preoperatorios sean exactos.
Determinación de las funciones musculares perdidas. Si hay funciones residuales, han de valorarse las posibilidades de una mejoría espontánea y descartarse un proceso de reinervación en curso de la musculatura dañada a través de varios electromiogramas.
Comprobación de la destreza manual, las posibles enfermedades crónicas debidas al tabaquismo y, sobre todo, las necesidades profesionales e individuales del paciente.
Comprobación clínica de las condiciones necesarias para el restablecimiento de la función muscular insuficiente o ausente (tabla 2).
Radiografías de la articulación del tramo afectado en dos planos para documentar el estado de las articulaciones y diferenciar las posibles lesiones articulares irreversibles de las anquilosis que podrían tratarse con fisioterapia.
Objetivación electroneurográfica de las funciones musculares. En algunos casos, esto permite detectar procesos de reinervación y tomar decisiones acerca de un tratamiento quirúrgico o uno inicial más conservador.
Resonancia magnética para comprobar la magnitud de las lesiones musculares.
Angiografía en caso de cuadros patológicos, resultados extraños de pruebas funcionales (test de Adson, Doppler) o lesiones vasculares conocidas.
Instrumental
Para realizar un trasplante muscular libre microvascular se necesita instrumental microquirúrgico básico, instrumental especial y un microscopio quirúrgico o unas gafas de aumento (4´-6´).
Instrumental básico
Bisturí (hoja 15, 10, 24).
Tijera de disección fina (atraumática).
Tijera de disección media (p. ej. tijera de Metzenbaum).
Tijera para suturas.
Pinza quirúrgica fina (de Adson).
Pinza anatómica fina (de Adson).
Dos separadores para heridas superficiales (gancho de Gilles-Einzinker).
Dos separadores Volkmann.
Dos separadores de Langenbeck.
Clips vasculares pequeños, medianos, grandes (opcionales, simplifican y acortan la operación).
Coagulación bipolar (pinza fina).
Coagulación monopolar.
Portaagujas.
Anclaje óseo (opcional para fijar el extremo proximal del músculo a la apófisis coracoides).
Material de sutura:
- Sutura 0 no absorbible para fijar el músculo.
- Sutura 2/0 no absorbible para suturas de sujeción y de fijación.
- Sutura absorbible 0, 2/0, 3/0 (sutura subcutánea y de la dermis profunda).
- Sutura cutánea (p. ej. Monocryl®/Ethicon 3/0) o grapas (para piel de mala calidad).
Dos drenajes Redon (10 o 12) para la zona donante.
Dos drenajes Redon (10 o 12) para la zona receptora.
Un drenaje Easy-flow para la zona receptora (drenaje de la zona de sutura vascular sin succión).
Instrumental especial de microcirugía
Dos pinzas de microcirugía.
Una tijera vascular de microcirugía.
Una tijera neurológica de microcirugía.
Un portaagujas de microcirugía.
Una cánula de lavado fina (p. ej. Apocath 26G).
Sutura de microcirugía: 8/0, 9/0, 10/0.
Adhesivo de fibrina (Tissucol®).
Fondo de plástico azul para aumentar el contraste y mejor visión de los hilos de microcirugía con aumentos.
Anestesia y posición del paciente
Anestesia de intubación y decúbito supino.
Extensión lateral del brazo afectado sobre una mesa de mano (fig. 2a).
Es preferible que la zona donante sea la ipsolateral, dado que esto facilita el trabajo con dos equipos quirúrgicos. El campo quirúrgico de la zona receptora abarca el cuello, todo el hemitórax y la extremidad superior. El campo quirúrgico de la zona donante abarca toda la extremidad inferior (fig. 2b).
Figuras 2a y 2b Posición del paciente. Ver explicación en el texto.
Técnica quirúrgica
Figuras 3 a 5
Figuras 3a a 3c En la zona donante la operación comienza con la planificación de la incisión cutánea. Si sólo es preciso obtener un colgajo muscular, la incisión cutánea se hace en la cara medial del muslo, 2-3 cm dorsal a una línea que va desde la sínfisis hasta el cóndilo medial (a). Si la atrofia de los flexores del codo es antigua, suele haber un defecto cutáneo relativo, por lo que a menudo está indicado un colgajo miocutáneo de recto interno. La isla cutánea estándar se dibuja en la zona del tercio proximal del músculo (unos 15 cm de longitud y 8 cm de anchura). La localización exacta de la isla cutánea tiene una importancia fundamental para evitar necrosis parciales o incluso completas. Conviene empezar por un abordaje posteromedial de la rodilla para acceder a la pata de ganso, localizar el tendón distal del recto interno y pasar una lazada por debajo de él. Al tirar del tendón del recto interno se visualiza el curso exacto del músculo bajo la piel, lo que permite dibujar exactamente la isla cutánea sobre el vientre del músculo. A continuación, se talla la isla cutánea y se cose al recto interno con sutura absorbible para evitar que se desgarren los perforantes musculocutáneos14. La vena safena magna discurre ventral al músculo y no debe dañarse. Tras identificar el recto interno, entre el vasto medial ventral y el aductor mayor dorsal, se diseca el pedículo vascular hasta el nacimiento de la arteria y la vena circunflejas femorales mediales (b). Seguidamente, se libera el tendón distal y se continúa la disección en dirección proximal. En el tercio distal medial del muslo debe protegerse el nervio safeno. Durante el recorrido siguiente se deben ir ligando cuidadosamente todos los pedículos secundarios. En el tercio proximal se visualiza el pedículo vascular principal, que siempre discurre con el nervio, y se realiza su disección microquirúrgica. De su recorrido por debajo del vasto medial parten múltiples ramas musculares pequeñas que también se tienen que ligar cuidadosamente, preferiblemente con clips vasculares. La disección del pedículo vascular hasta su nacimiento en la arteria o vena circunflejas femorales mediales permite obtener un pedículo de 8-14 cm de longitud. El diámetro vascular de la arteria es de 2-3 mm; el de las dos venas comitantes de 3-4 mm (c). Siempre que sea posible se debe intentar una coaptación nerviosa primaria. Por eso, durante la disección del músculo recto interno se debe seguir al máximo posible el recorrido de su nervio en dirección proximal a fin de conseguir un nervio de 10-14 cm de longitud21. Para reducir al mínimo el tiempo de isquemia, el injerto se deja unido a la zona donante a través de su pedículo neurovascular hasta que todas las estructuras de la zona receptora se hayan preparado de manera segura.
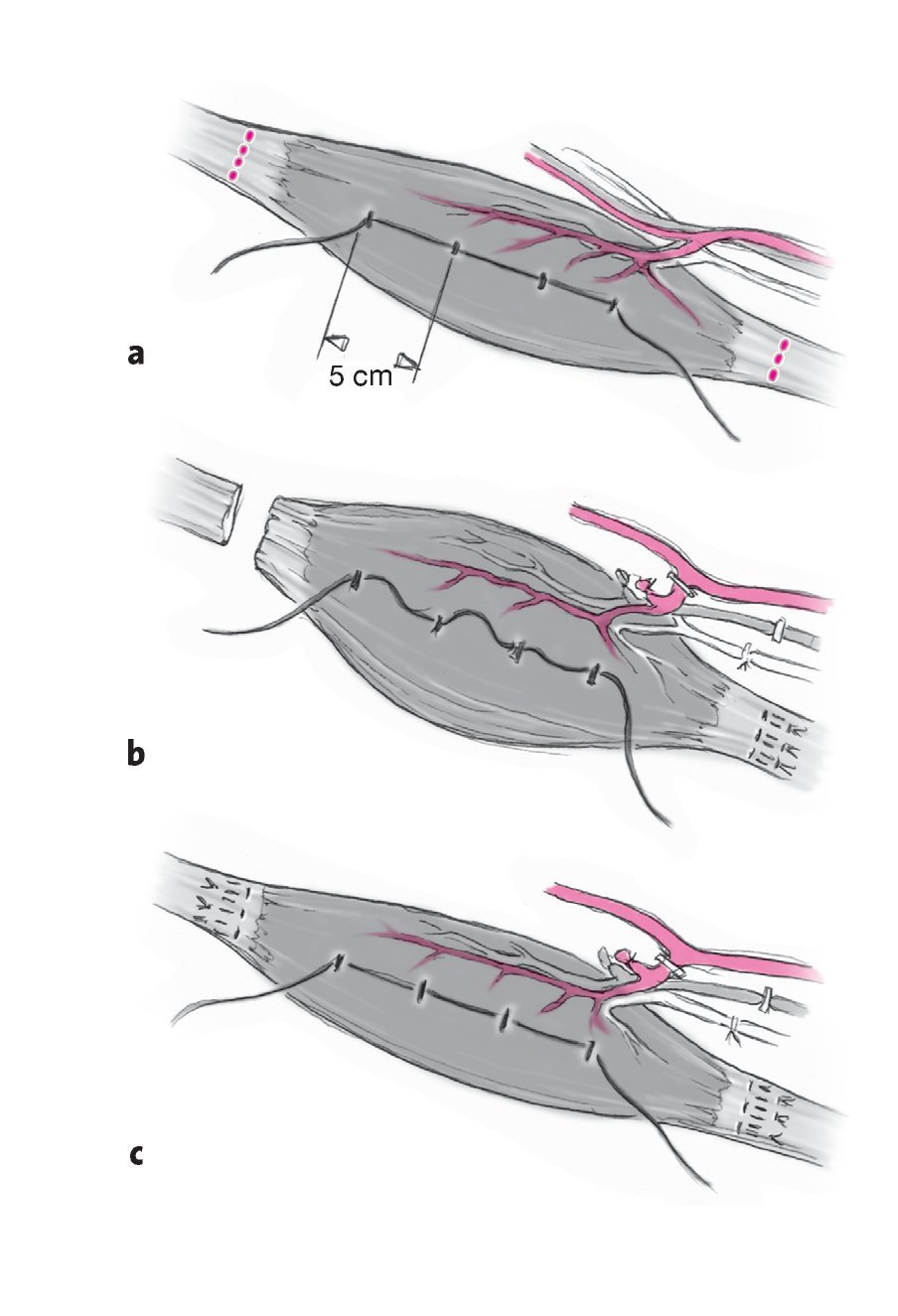
Figuras 4a a 4c La tensión adecuada del trasplante musculotendinoso tiene un papel fundamental de cara a la correcta función9. Para recuperar la tensión en reposo original del músculo una vez trasplantado a la zona receptora, se recomienda fijar un hilo de sutura tenso sobre la superficie del músculo antes de seccionar su origen y su inserción (a). Al seccionar el origen y la inserción del recto interno, el músculo se relaja y las marcas de sutura se aproximan entre sí (b). Tras colocar el trasplante muscular en la zona receptora, el músculo se tensa hasta que la sutura también quede tensa (c). A continuación, puede retirarse la sutura. Es importante comprobar que la posición de las articulaciones de las zonas donante y receptora sea similar20,23.
Figuras 5a a 5c Para descubrir las estructuras de la zona receptora se hace una incisión en la zona del surco deltopectoral unos 2 cm por encima de la clavícula y paralelo a ésta. En la zona del codo, puede descubrirse el tendón distal del bíceps y la tuberosidad del radio mediante una incisión sinuosa. En el tercio medio del brazo, se practica un túnel subcutáneo. Si se realiza una plastia de recto interno miocutánea, ambas incisiones se comunican entre sí a través de una incisión ventral recta (a). Se disecan los vasos de la zona del surco deltopectoral (arteria y vena toracoacromiales) o de la zona infraclavicular (arteria y vena braquiales). Para la coaptación nerviosa puede recurrirse a la porción distal del nervio accesorio (XI), el nervio frénico o los nervios intercostales 3 a 6. Se localiza el recorrido del tronco principal del nervio accesorio en el borde superior del músculo trapecio y se diseca en dirección distal, unos 3-4 cm por detrás de la bifurcación de la rama craneal. Se secciona la porción distal del nervio, y las arterias y venas vecinas se coagulan cuidadosamente. El muñón distal se transpone en dirección ventral y, si el nervio del colgajo de recto interno es largo, puede coaptarse directamente. Si se opta por una transferencia de los nervios intercostales, se disecan los nervios intercostales 3-6 del surco costal a través de un abordaje anterolateral que va desde la línea paraesternal ventral en dirección lateral hasta la línea axilar anterior. Es importante no dañar la pleura parietal (neumotórax) y ligar cuidadosamente los vasos acompañantes. Los tres nervios intercostales se unen en la línea axilar anterior en un muñón nervioso mediante adhesivo de fibrina y, si son lo bastante largos, se coaptan directamente con el trasplante de recto interno. Si se neurotiza con el nervio frénico, éste se descubre mediante otra incisión supraclavicular por el borde anterior del músculo escaleno anterior y se diseca lo máximo posible en dirección distal. El nervio frénico se corta por completo teniendo en cuenta que a menudo va acompañado de una arteria, que debe ligarse. El nervio frénico se transpone en dirección lateral y, si el nervio del colgajo de recto interno es largo, puede conectarse directamente. Una vez comprobada la posición del pedículo, debe fijarse el recto interno por su porción tendinosa proximal a la apófisis coracoides y a la clavícula lateral con sutura fuerte no absorbible. El tendón distal del recto interno se sutura al tendón distal del bíceps a modo de sutura entrelazada, con técnica de Pulvertaft, respetando la tensión de reposo (b). Para ajustar la tensión adecuada se debe comprobar que las articulaciones de la extremidad superior estén en la posición correcta: hombro en abducción de 70-90º, codo en flexión de 110-130º (c). Tras colocar un drenaje Redon, la herida se cierra por planos. Después de la operación, se coloca una férula de escayola en el brazo que incluya la muñeca y cubra el hombro (desplazamiento biarticular).
Tratamiento postoperatorio
La fisioterapia, tanto preoperatoria como postoperatoria, tiene una importancia capital para el éxito del trasplante muscular libre funcional.
Inmovilización postoperatoria: férula de antebrazo que incluya el codo con una flexión a 90º y supinación para reducir la tensión de las suturas distales, y vendaje de hombro que impida la abducción durante 6 semanas.
Colocar la férula con el paciente anestesiado, ya que durante la extubación se pueden producir movimientos incontrolados que desgarren el trasplante. La férula se lleva como protección del trasplante libre muscular hasta que el músculo haya alcanzado una función autónoma suficiente (M4) (alrededor de 12-18 meses). Durante el reposo postoperatorio en cama se coloca un cojín bajo el codo.
Tromboprofilaxis postoperatoria habitual.
Retirada del drenaje de la zona donante a las 24-48 h.
Inicio de la fisioterapia no antes de 10 días, para proteger las anastomosis microvasculares y la coaptación nerviosa.
Movilización: durante las primeras 6 semanas sólo ejercicios de flexión y pronación pasivas. El objetivo es mantener la movilidad pasiva de las articulaciones y las vainas tendinosas. La fisioterapia pasiva precoz permite reducir la incidencia de adherencias tendinosas con las consiguientes tenólisis. Tras la reaparición de la función muscular activa a los 3-6 meses, los ejercicios pasivos se convertirán en "ejercicios activos guiados". Cuando se inicia la contracción muscular después de 6-9 meses, debe comenzarse con el entrenamiento en autorregulación biológica (biofeedback). Restablecimiento progresivo del movimiento pasivo ("Practicar desde la férula") hasta conseguir una contracción muscular suficiente (M4). Una vez alcanzado un movimiento activo suficiente, la atención debe centrarse en potenciar el movimiento y el control de la nueva función muscular. En este estadio se ha demostrado la utilidad de la ergoterapia; la utilidad de la electroestimulación es controvertida. Continuación de la fisioterapia durante 12-18 meses.
Tratamiento postoperatorio habitual del colgajo y de las cicatrices: transcurrida una semana, tratamiento con crema hidratante para la piel. Una vez cerrada la herida por completo, la presoterapia con silicona, utilizada ampliamente en el tratamiento de quemaduras, es el tratamiento de elección para las cicatrices. Dependiendo del tamaño del defecto, pueden utilizarse apósitos de silicona comerciales (Cica-Care®, Smith and Nephew) o almohadillas de silicona cortadas a medida. Tras el aumento progresivo del tiempo de uso2,4,6,8,10,12,14,17,19,20,22, deberá prolongarse la presoterapia combinada con apósitos de silicona durante 6-12 meses hasta que se aprecie un cambio de color de la zona de la cicatriz y del trasplante cutáneo, de rojo a blanco37.
Errores, riesgos y complicaciones
Compresión del pedículo neurovascular: después de trasplantar el colgajo de recto interno al brazo, se comprueba la situación del pedículo neurovascular libre de impedimentos. Debe corregirse cualquier compresión del pedículo neurovascular causada por un músculo, una fascia y/o una cicatriz tensa. Antes de cerrar la herida debe comprobarse el riego del músculo.
Pedículo neurovascular demasiado corto: después de trasplantar el colgajo de recto interno al brazo, se comprueba que el pedículo neurovascular esté libre de tensiones. Si no es así, el problema se puede resolver inmediatamente colocando tramos intermedios de injertos neurovasculares. Los injertos vasculares intermedios aumentan la morbilidad en la zona donante (vena safena magna) y el riesgo de trombosis en la zona receptora. La interposición de un trasplante nervioso da lugar a una inervación significativamente peor del trasplante muscular libre y, por lo tanto, a una función peor, especialmente de la fuerza.
Tensión excesiva del músculo: la tensión excesiva del músculo tras el trasplante provoca una limitación significativa de la función. En ausencia de signos de riego sanguíneo suficiente, se debe comprobar la tensión del músculo y, en caso necesario, reducirse por flexión adicional del codo.
Tensión demasiado escasa del músculo: se debe aumentar la tensión por vía quirúrgica.
Falta de protección del trasplante muscular en proceso de regeneración por no llevar la férula el tiempo suficiente: la férula dorsal del brazo con flexión del codo a 90º debe llevarse hasta que el trasplante alcance una función autónoma suficiente (M4). Si se retira la férula demasiado pronto, el músculo no regenerado por completo puede sufrir lesiones, con la consiguiente formación de cicatrices y reducción de la función hasta la pérdida total. En este caso se requiere un nuevo trasplante muscular libre.
Necrosis cutánea de la zona receptora, sobre todo por el tunelado de la plastia: puesto que la necrosis cutánea se desarrolla por encima del músculo bien vascularizado, no se producen limitaciones funcionales. Es posible que se necesite un injerto cutáneo secundario de espesor parcial.
Resultados
Para valorar los resultados es importante registrar la amplitud, la fuerza (clasificación del Medical Research Council), la resistencia y el control del movimiento recuperado. Para valorar la flexión del codo se utiliza universalmente la clasificación de Segal et al33 o de Doi et al15-19 (tabla 3).
Nuestra serie comprende 29 pacientes con una lesión del plexo braquial y un trasplante muscular libre. El período de seguimiento fue de 3 años como mínimo. En cuatro pacientes se practicó un trasplante muscular libre de recto interno para recuperar la flexión del codo. Todos ellos presentaban una función residual insuficiente de flexión del codo ("indicación de aumento") y los cuatro consiguieron recuperar una flexión funcional del mismo (> 90º, codo a 90º con 1,5 kg en la muñeca) (tabla 4).
El análisis de la bibliografía refleja que sólo se dispone de series pequeñas y no homogéneas en cuanto a etiologías (lesiones del plexo, pérdida muscular traumática directa), situaciones iniciales (pérdida total de la flexión del codo/M0, pérdida parcial de la flexión del codo/M1, M2), coaptaciones nerviosas (nervio musculocutáneo, dos/tres nervios intercostales, nervio accesorio [XI], nervio frénico, transferencia parcial contralateral del C7) y operaciones adicionales (artrodesis de hombro).
Para valorar los resultados es importante tener en cuenta la situación inicial antes del trasplante muscular libre23.
Según la magnitud de la fuerza muscular residual, cabe distinguir entre una "insuficiencia de órgano final" (cuando la fuerza residual de la función muscular es < M3) y un "fallo de órgano final" (cuando no existe función muscular alguna [M0]). Si todavía queda una función residual del tipo "insuficiencia del órgano final", un trasplante muscular libre (con la indicación "trasplante de aumento") permite alcanzar un resultado funcional mucho mejor que cuando la función falta por completo. Esto se debe probablemente a un mejor control sensomotor de la función articular gracias a la musculatura autóctona regenerada.
El trasplante muscular libre precoz para los casos de insuficiencia muscular aislada (miógena) suele ofrecer los mejores resultados porque aporta un riego sanguíneo e inervación autóctonos y adecuados y porque casi nunca aparecen trastornos secundarios, como rigidez articular o fibrosis. La tasa de éxito del trasplante muscular libre debe ser > 75% (figs. 6a a 6g).
Figuras 6a a 6g Trasplante muscular libre de recto interno para restablecer la flexión de la muñeca y de los dedos en un paciente de 25 años con lesiones de macroamputación a dos niveles (brazo y antebrazo) de la extremidad superior derecha. a) Imágenes radiográficas al ingreso. b) Resultado clínico tras reimplante. c) Imagen radiográfica tras reimplante. d) Función 1 año después del trasplante: extensión del codo. e) Función 1 año después del trasplante: flexión del codo. f) Función 1 año después del trasplante: extensión de los dedos. g) Función 1 año después del trasplante: cierre del puño.
En las lesiones completas del plexo braquial (insuficiencia neurógena) y en los cuadros resultantes de un síndrome compartimental (insuficiencia mixta neuromuscular), los resultados funcionales del trasplante muscular libre son muy variados. El éxito de la recuperación de la flexión del codo tras una lesión completa del plexo braquial es del orden del 60-75%.
En la zona donante del recto interno, el defecto funcional es despreciable. Debe evitarse lesionar el nervio safeno en el tramo distal del muslo. El defecto estético también es despreciable. La cicatriz, casi siempre delgada y poco visible, es similar a la de una operación de estiramiento de piel de los muslos. Por otro lado, se ha comentado ya con anterioridad la pérdida funcional que supone utilizar la rama descendente del nervio accesorio, de todo el nervio frénico o de los tres nervios intercostales para una neurotización extraplexual de la plastia en colgajo del recto interno.
Correspondencia
Univ.-Prof. Dr. Robert Hierner
Cirugía plástica, reparadora, estética y de la mano,
Centro de cirugía reparadora interdisciplinar, reimplantación, microcirugía, moldeado, tratamiento de cicatrices y quemaduras
Clínica universitaria de Essen
Universidad de Duisburg-Essen
Hufelandstrasse 55
D-45147 Essen (Alemania)
Tel.: (+49/201) 723-1303; fax: -5629
Correo electrónico: robert.hierner@uk.essen.de