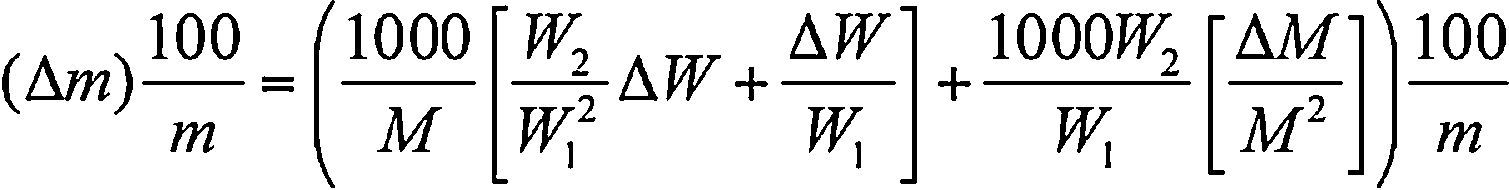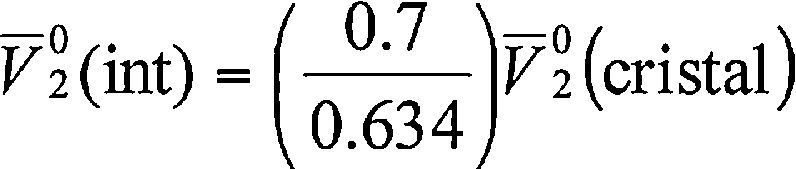Se determinaron las densidades de la DL-valina (Ácido 2-amino-3-metilbutanoico) en soluciones acuosas de nitrato de sodio en el intervalo de temperaturas desde 283.15K hasta 318.15K usando un densímetro de tubo vibratorio Anton Paar DMA 5000. Se calcularon: los volúmenes molares aparentes, los volúmenes molares aparentes a dilución infinita, la segunda derivada de los volúmenes molares parciales a dilución infinita con respecto a la temperatura, así como los volúmenes molares parciales de transferencia y los números de hidratación. Los resultados obtenidos se discutieron en términos de las interacciones predominantes en solución, encontrándose que la DL-valina tiene un efecto disruptor de la estructura del solvente y que a dilución infinita predominan las interacciones soluto-solvente entre el grupo isopropil del aminoácido y los iones sodio y nitrato.
Densities of DL-valine (2-amino-3-methylbutanoic acid) in aqueous solutions of sodium nitrate were determined at temperatures ranging from 283.15 to 318.15K using an Anton Paar DMA 5000 vibrating tube densitometer. The apparent molar volume, infinite dilution apparent molar volume, second derivative of the infinite dilution partial molar volume with respect to temperature, partial molar volume of transfer at infinite dilution and the number of hydration were calculated. The results obtained were discussed in terms of the dominant interactions in solution, it was found that the DL-valine has a disruptor effect in the structure of the solvent and that at infinite dilution solute-solvent interactions are dominant between isopropyl group the amino acid and sodium and nitrate ions.
Es bien conocido que el comportamiento y las propiedades moleculares de las proteínas en las mezclas acuosas es gobernado por muchos factores, como: estructura química, propiedades del disolvente, pH, electrolitos presentes en solución, entre otras1. La fuerte interacción entre electrolitos y proteínas es la causa de la desviación del comportamiento ideal. Por tanto, este hecho es quizás una de las razones por la que debe estudiarse la influencia de los electrolitos sobre el comportamiento fisicoquímico de las proteínas.
No obstante, ya que este estudio resulta inviable por no decir imposible, debido a la compleja organización estructural de estas macromoléculas biológicas, se recurre al estudio de las interacciones de los bloques de construcción de las proteínas (aminoácidos) en soluciones acuosas de electrolitos, con el fin de entender los finos detalles asociados al comportamiento volumétrico2. Por esta razón, es evidente que un estudio directo de las proteínas resulta difícil3 y debido a ello en los últimos años se han usado diversos aminoácidos y péptidos de bajo peso molecular como compuestos modelos en soluciones salinas, con el fin de simular estos complejos ambientes biológicos4–7. De hecho, existen extensos estudios de propiedades volumétricas y termoquímicas sobre esta área de investigación8–11.
Además de los argumentos expuestos, otra razón no menos importante está asociada al hecho de que los aminoácidos y péptidos son las unidades estructurales fundamentales de las proteínas, péptidos, ciertos tipos de hormonas, antibióticos y muchos otros compuestos de relevancia biológica. Generalmente, se reconoce que en ausencia de datos termodinámicos experimentales para estas macromoléculas, los aminoácidos y péptidos pueden servir como modelos útiles para la estimación de sus propiedades12–15.
En virtud a lo anterior y dada la trascendencia del tema, en este trabajo se estudian algunas propiedades volumétricas de soluciones de DL-valina en mezclas acuosas de nitrato de sodio a diferentes concentraciones y a las temperaturas de 283.15, 288.15, 293.15, 298.15, 303.15, 308.15, 313.15 y 318.15K, con el fin de predecir el efecto que causa la adición de una sal sobre el comportamiento de los aminoácidos. Los resultados obtenidos se discuten en términos de las interacciones predominantes en solución.
MATERIALES Y MÉTODOSReactivosSe empleó DL-valina (Alfa Aesar) y nitrato de sodio (Sigma-Aldrich) ambos con una pureza del 99%. Antes de su uso la DL-valina fue recristalizada dos veces en soluciones acuosas de etanol y secada al vacío a 348K durante 6h, después se almacenó en un desecador sobre P2O5. El agua utilizada fue desgasificada y doblemente destilada en medio alcalino con KMnO4 para eliminar la materia orgánica16, obteniéndose con una conductividad inferior a 2μS cm-1.
Preparación de las solucionesEn este trabajo, se prepararon cinco solventes acuosos de nitrato de sodio a concentraciones de (0.0000, 0.0106, 0.0413, 0.1009, 0.4013 y 0.9014) mol kg-1 que fueron mezclados con cantidades específicas de DL-valina hasta obtener concentraciones en el intervalo de 0.0000mol kg-1 hasta 0.4000mol kg-1. Las incertidumbres relativas (expresadas en porcentaje) para las concentraciones molales se encontraron en el intervalo de 0.02% a 0.28%, usando la ecuación (1):
Donde M es la masa molar de la DL-valina, W2 y W1 es la masa de soluto y solvente respectivamente, ΔM es la incertidumbre asociada a la masa molar de la DL-valina y ΔW es la incertidumbre de la balanza analítica utilizada marca Precisa (±1×10-5 g).
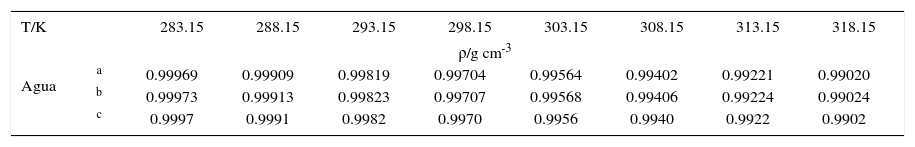
Determinación de la densidadLas densidades de las soluciones fueron determinadas en un densímetro de tubo vibratorio Anton Paar DMA 5000, con una incertidumbre de ±1×10-5 g cm-3 y un control de temperatura de ±0.001K desde 283.15K hasta 318.15K a intervalos de 5K. Se verificó el buen funcionamiento del equipo, determinando la densidad del agua bidestilada a diferentes temperaturas, y los datos obtenidos resultaron en buen acuerdo con los reportados en literatura17–18 como se observa en la Tabla I.
RESULTADOS Y DISCUSIÓNLas densidades obtenidas para la DL-valina en mezclas acuosas de NaNO3 aumentan conforme incrementan las concentraciones del aminoácido y del nitrato de sodio, pero disminuyen con el incremento de la temperatura como se observa en las Figuras 1 y 2 respectivamente.
Los valores de los volúmenes molares aparentes Vϕ para la DL-valina en estas mezclas acuosas de NaNO3, fueron calculados a partir de los datos de densidad utilizando la ecuación (2)19.
Donde M es la masa molar de la DL-valina, m es la molalidad del aminoácido en las mezclas acuosas de NaNO3, ρ y ρ0 son la densidad de la solución (DL-valina en mezclas acuosas de NaNO3) y la densidad del solvente (mezclas acuosas de NaNO3) respectivamente. Las incertidumbres relativas (expresadas en porcentaje) para los volúmenes molares se encontraron en el intervalo de 0.1% a 2.0%, usando la ecuación (3):
Donde Δρ es la incertidumbre del densímetro y Δm es la incertidumbre asociada a la concentración de las soluciones. El término de mayor incertidumbre resulta ser el tercero dentro del paréntesis al lado derecho de la ecuación (3).
Los resultados para las densidades y los volúmenes molares aparentes obtenidos son reportados en la Tabla II. La variación de Vϕ con respecto a la concentración molal se correlacionó adecuadamente por medio de la ecuación de Masson a las temperaturas de trabajo20, a fin de evaluar los volúmenes molares aparentes a dilución infinita Vϕ0 utilizando la ecuación (4). Para ello se toma la región de mayor concentración donde la tendencia de Vϕ en función de m1/2 es lineal; este procedimiento para el cálculo de Vϕ0ha sido previamente utilizado por Frank y Smith21, y es comúnmente aceptado debido a que la incertidumbre experimental de Vϕ aumenta a medida que la concentración disminuye.
Densidades ρ y volúmenes molares aparentes Vϕ para la DL-valina en mezclas acuosas de NaNO3 a las temperaturas de 283.15 hasta 318.15K
| m valina | ρ | Vϕ | ρ | Vϕ | ρ | Vϕ | ρ | Vϕ |
|---|---|---|---|---|---|---|---|---|
| mol kg-1 | g cm-3 | cm3 mol-1 | g cm-3 | cm3 mol-1 | g cm-3 | cm3 mol-1 | g cm-3 | cm3 mol-1 |
| mNaNO3=0.00000mol kg-1 | ||||||||
| 283.15 K | 288.15 K | 293.15 K | 298.15 K | |||||
| 0.00000 | 0.99969 | 0.99909 | 0.99819 | 0.99704 | ||||
| 0.01050 | 0.99989 | 98.77 | 0.99928 | 99.11 | 0.99838 | 99.37 | 0.99722 | 99.66 |
| 0.02000 | 1.00017 | 93.13 | 0.99956 | 93.52 | 0.99866 | 93.83 | 0.99750 | 94.17 |
| 0.03080 | 1.00049 | 91.38 | 0.99987 | 91.85 | 0.99896 | 92.34 | 0.99779 | 92.74 |
| 0.05090 | 1.00103 | 90.87 | 1.00040 | 91.29 | 0.99948 | 91.83 | 0.99832 | 92.09 |
| 0.07980 | 1.00180 | 90.58 | 1.00117 | 90.91 | 1.00025 | 91.30 | 0.99907 | 91.66 |
| 0.09930 | 1.00233 | 90.35 | 1.00170 | 90.74 | 1.00077 | 91.08 | 0.99959 | 91.43 |
| 0.15230 | 1.00376 | 90.10 | 1.00310 | 90.49 | 1.00216 | 90.84 | 1.00096 | 91.19 |
| 0.20990 | 1.00533 | 89.83 | 1.00464 | 90.26 | 1.00368 | 90.62 | 1.00247 | 90.98 |
| 0.24980 | 1.00641 | 89.67 | 1.00571 | 90.13 | 1.00474 | 90.47 | 1.00351 | 90.84 |
| 0.30210 | 1.00783 | 89.50 | 1.00711 | 89.93 | 1.00612 | 90.32 | 1.00488 | 90.68 |
| 303.15 K | 308.15 K | 313.15 K | 318.15 K | |||||
| 0.00000 | 0.99564 | 0.99402 | 0.99221 | 0.99020 | ||||
| 0.01050 | 0.99582 | 99.87 | 0.99421 | 99.91 | 0.99239 | 100.06 | 0.99039 | 100.13 |
| 0.02000 | 0.99610 | 94.37 | 0.99448 | 94.63 | 0.99266 | 94.92 | 0.99066 | 95.17 |
| 0.03080 | 0.99639 | 92.98 | 0.99477 | 93.36 | 0.99295 | 93.64 | 0.99094 | 93.92 |
| 0.05090 | 0.99691 | 92.44 | 0.99528 | 92.74 | 0.99346 | 93.03 | 0.99145 | 93.27 |
| 0.07980 | 0.99765 | 92.00 | 0.99603 | 92.26 | 0.99419 | 92.65 | 0.99218 | 92.89 |
| 0.09930 | 0.99816 | 91.77 | 0.99653 | 92.09 | 0.99469 | 92.40 | 0.99267 | 92.71 |
| 0.15230 | 0.99953 | 91.54 | 0.99788 | 91.85 | 0.99604 | 92.16 | 0.99401 | 92.45 |
| 0.20990 | 1.00102 | 91.30 | 0.99936 | 91.61 | 0.99750 | 91.95 | 0.99547 | 92.20 |
| 0.24980 | 1.00205 | 91.18 | 1.00039 | 91.49 | 0.99853 | 91.79 | 0.99649 | 92.05 |
| 0.30210 | 1.00340 | 91.04 | 1.00173 | 91.32 | 0.99986 | 91.62 | 0.99783 | 91.86 |
| mNaNO3=0.01064mol kg-1 | ||||||||
| 283.15 K | 288.15 K | 293.15 K | 298.15 K | |||||
| 0.00000 | 1.00056 | 0.99995 | 0.99905 | 0.99788 | ||||
| 0.05097 | 1.00192 | 90.44 | 1.00128 | 90.90 | 1.00035 | 91.39 | 0.99917 | 91.76 |
| 0.08072 | 1.00272 | 90.27 | 1.00207 | 90.72 | 1.00113 | 91.19 | 0.99994 | 91.59 |
| 0.09956 | 1.00322 | 90.20 | 1.00257 | 90.64 | 1.00162 | 91.11 | 1.00042 | 91.51 |
| 0.20069 | 1.00592 | 89.95 | 1.00523 | 90.37 | 1.00424 | 90.86 | 1.00301 | 91.25 |
| 0.25061 | 1.00724 | 89.87 | 1.00653 | 90.29 | 1.00553 | 90.76 | 1.00428 | 91.15 |
| 0.30022 | 1.00856 | 89.76 | 1.00783 | 90.18 | 1.00680 | 90.67 | 1.00554 | 91.06 |
| 0.35005 | 1.00987 | 89.70 | 1.00913 | 90.11 | 1.00807 | 90.60 | 1.00680 | 90.98 |
| 0.39684 | 1.01110 | 89.62 | 1.01034 | 90.05 | 1.00927 | 90.53 | 1.00798 | 90.92 |
| 303.15 K | 308.15 K | 313.15 K | 318.15 K | |||||
| 0.00000 | 0.99648 | 0.99486 | 0.99304 | 0.99103 | ||||
| 0.05097 | 0.99776 | 92.12 | 0.99612 | 92.51 | 0.99429 | 92.86 | 0.99227 | 93.28 |
| 0.08072 | 0.99851 | 91.94 | 0.99687 | 92.35 | 0.99503 | 92.70 | 0.99300 | 93.10 |
| 0.09956 | 0.99899 | 91.87 | 0.99734 | 92.26 | 0.99550 | 92.63 | 0.99347 | 93.03 |
| 0.20069 | 1.00155 | 91.62 | 0.99988 | 91.98 | 0.99801 | 92.36 | 0.99596 | 92.74 |
| 0.25061 | 1.00281 | 91.54 | 1.00114 | 91.86 | 0.99925 | 92.25 | 0.99718 | 92.64 |
| 0.30022 | 1.00406 | 91.44 | 1.00237 | 91.78 | 1.00047 | 92.16 | 0.99839 | 92.56 |
| 0.35005 | 1.00530 | 91.36 | 1.00361 | 91.69 | 1.00170 | 92.07 | 0.99960 | 92.47 |
| 0.39684 | 1.00647 | 91.28 | 1.00476 | 91.64 | 1.00284 | 92.02 | 1.00073 | 92.40 |
| mNaNO3=0.04132mol kg-1 | ||||||||
| 283.15 K | 288.15 K | 293.15 K | 298.15 K | |||||
| 0.00000 | 1.00231 | 1.00166 | 1.00073 | 0.99954 | ||||
| 0.05038 | 1.00365 | 90.44 | 1.00298 | 90.81 | 1.00202 | 91.26 | 1.00082 | 91.64 |
| 0.07998 | 1.00443 | 90.30 | 1.00376 | 90.70 | 1.00279 | 91.14 | 1.00157 | 91.52 |
| 0.09896 | 1.00494 | 90.24 | 1.00425 | 90.63 | 1.00328 | 91.07 | 1.00206 | 91.46 |
| 0.20069 | 1.00763 | 90.02 | 1.00691 | 90.43 | 1.00590 | 90.88 | 1.00464 | 91.27 |
| 0.25093 | 1.00895 | 89.95 | 1.00821 | 90.37 | 1.00718 | 90.81 | 1.00591 | 91.20 |
| 0.29985 | 1.01023 | 89.89 | 1.00947 | 90.31 | 1.00843 | 90.73 | 1.00714 | 91.13 |
| 0.34962 | 1.01152 | 89.83 | 1.01075 | 90.24 | 1.00968 | 90.68 | 1.00838 | 91.08 |
| 0.40049 | 1.01284 | 89.76 | 1.01205 | 90.17 | 1.01096 | 90.62 | 1.00964 | 91.03 |
| 303.15 K | 308.15 K | 313.15 K | 318.15 K | |||||
| 0.00000 | 0.99811 | 0.99647 | 0.99463 | 0.99261 | ||||
| 0.05038 | 0.99937 | 92.07 | 0.99773 | 92.36 | 0.99588 | 92.76 | 0.99384 | 93.09 |
| 0.07998 | 1.00012 | 91.93 | 0.99847 | 92.24 | 0.99661 | 92.65 | 0.99457 | 92.94 |
| 0.09896 | 1.00060 | 91.85 | 0.99894 | 92.17 | 0.99708 | 92.58 | 0.99504 | 92.86 |
| 0.20069 | 1.00317 | 91.63 | 1.00148 | 91.96 | 0.99958 | 92.39 | 0.99753 | 92.69 |
| 0.25093 | 1.00442 | 91.54 | 1.00273 | 91.89 | 1.00081 | 92.33 | 0.99875 | 92.63 |
| 0.29985 | 1.00564 | 91.47 | 1.00393 | 91.82 | 1.00200 | 92.27 | 0.99993 | 92.57 |
| 0.34962 | 1.00687 | 91.42 | 1.00515 | 91.76 | 1.00320 | 92.22 | 1.00113 | 92.51 |
| 0.40049 | 1.00813 | 91.35 | 1.00639 | 91.72 | 1.00443 | 92.16 | 1.00235 | 92.45 |
| mNaNO3=0.10086mol kg-1 | ||||||||
| 283.15 K | 288.15 K | 293.15 K | 298.15 K | |||||
| 0.00000 | 1.00580 | 1.00509 | 1.00409 | 1.00285 | ||||
| 0.05034 | 1.00714 | 90.02 | 1.00641 | 90.39 | 1.00540 | 90.79 | 1.00414 | 91.21 |
| 0.08080 | 1.00795 | 89.91 | 1.00721 | 90.30 | 1.00619 | 90.69 | 1.00492 | 91.10 |
| 0.10084 | 1.00849 | 89.87 | 1.00774 | 90.27 | 1.00671 | 90.64 | 1.00544 | 91.06 |
| 0.20070 | 1.01113 | 89.72 | 1.01034 | 90.14 | 1.00929 | 90.50 | 1.00799 | 90.90 |
| 0.25102 | 1.01245 | 89.67 | 1.01165 | 90.10 | 1.01058 | 90.45 | 1.00926 | 90.85 |
| 0.29998 | 1.01374 | 89.62 | 1.01290 | 90.05 | 1.01183 | 90.40 | 1.01049 | 90.79 |
| 0.34969 | 1.01502 | 89.58 | 1.01418 | 90.01 | 1.01309 | 90.35 | 1.01173 | 90.76 |
| 0.39866 | 1.01629 | 89.52 | 1.01542 | 89.96 | 1.01432 | 90.31 | 1.01295 | 90.70 |
| 303.15 K | 308.15 K | 313.15 K | 318.15 K | |||||
| 0.00000 | 1.00138 | 0.99970 | 0.99782 | 0.99560 | ||||
| 0.05034 | 1.00266 | 91.56 | 1.00096 | 91.98 | 0.99907 | 92.30 | 0.99684 | 92.64 |
| 0.08080 | 1.00343 | 91.47 | 1.00173 | 91.87 | 0.99984 | 92.18 | 0.99760 | 92.52 |
| 0.10084 | 1.00394 | 91.42 | 1.00223 | 91.83 | 1.00034 | 92.13 | 0.99810 | 92.47 |
| 0.20070 | 1.00646 | 91.29 | 1.00473 | 91.67 | 1.00281 | 91.98 | 1.00056 | 92.27 |
| 0.25102 | 1.00772 | 91.23 | 1.00597 | 91.62 | 1.00405 | 91.92 | 1.00179 | 92.21 |
| 0.29998 | 1.00894 | 91.18 | 1.00718 | 91.57 | 1.00524 | 91.88 | 1.00298 | 92.16 |
| 0.34969 | 1.01016 | 91.14 | 1.00839 | 91.52 | 1.00645 | 91.82 | 1.00419 | 92.10 |
| 0.39866 | 1.01136 | 91.11 | 1.00958 | 91.48 | 1.00764 | 91.78 | 1.00536 | 92.05 |
| m NaNO3=0.40131mol kg-1 | ||||||||
| 283.15 K | 288.15 K | 293.15 K | 298.15 K | |||||
| 0.00000 | 1.02287 | 1.02185 | 1.02059 | 1.01912 | ||||
| 0.05034 | 1.02419 | 89.33 | 1.02315 | 89.72 | 1.02189 | 90.00 | 1.02040 | 90.32 |
| 0.08028 | 1.02498 | 89.26 | 1.02393 | 89.66 | 1.02265 | 89.94 | 1.02116 | 90.26 |
| 0.10084 | 1.02551 | 89.24 | 1.02446 | 89.62 | 1.02318 | 89.91 | 1.02168 | 90.23 |
| 0.20044 | 1.02809 | 89.16 | 1.02701 | 89.54 | 1.02571 | 89.84 | 1.02419 | 90.14 |
| 0.25074 | 1.02939 | 89.12 | 1.02828 | 89.51 | 1.02697 | 89.81 | 1.02544 | 90.10 |
| 0.29995 | 1.03064 | 89.09 | 1.02952 | 89.48 | 1.02820 | 89.78 | 1.02666 | 90.07 |
| 0.35005 | 1.03191 | 89.06 | 1.03077 | 89.46 | 1.02944 | 89.75 | 1.02789 | 90.04 |
| 0.39786 | 1.03311 | 89.04 | 1.03196 | 89.43 | 1.03061 | 89.73 | 1.02906 | 90.01 |
| 303.15 K | 308.15 K | 313.15 K | 318.15 K | |||||
| 0.00000 | 1.01744 | 1.01558 | 1.01354 | 1.01130 | ||||
| 0.05034 | 1.01871 | 90.71 | 1.01684 | 91.03 | 1.01479 | 91.35 | 1.01254 | 91.64 |
| 0.08028 | 1.01946 | 90.64 | 1.01758 | 90.97 | 1.01553 | 91.27 | 1.01328 | 91.54 |
| 0.10084 | 1.01998 | 90.60 | 1.01810 | 90.93 | 1.01604 | 91.23 | 1.01379 | 91.50 |
| 0.20044 | 1.02246 | 90.50 | 1.02056 | 90.81 | 1.01850 | 91.08 | 1.01623 | 91.33 |
| 0.25074 | 1.02370 | 90.45 | 1.02179 | 90.78 | 1.01972 | 91.04 | 1.01745 | 91.29 |
| 0.29995 | 1.02491 | 90.42 | 1.02299 | 90.74 | 1.02091 | 91.01 | 1.01864 | 91.26 |
| 0.35005 | 1.02613 | 90.39 | 1.02420 | 90.71 | 1.02212 | 90.97 | 1.01984 | 91.22 |
| 0.39786 | 1.02728 | 90.37 | 1.02534 | 90.69 | 1.02325 | 90.95 | 1.02098 | 91.19 |
| mNaNO3=0.90145mol kg-1 | ||||||||
| 283.15 K | 288.15 K | 293.15 K | 298.15 K | |||||
| 0.00000 | 1.05001 | 1.04857 | 1.04694 | 1.04513 | ||||
| 0.05002 | 1.05132 | 87.87 | 1.04986 | 88.24 | 1.04821 | 88.64 | 1.04639 | 88.97 |
| 0.08010 | 1.05209 | 87.84 | 1.05063 | 88.20 | 1.04897 | 88.60 | 1.04714 | 88.93 |
| 0.09997 | 1.05261 | 87.82 | 1.05114 | 88.18 | 1.04947 | 88.58 | 1.04764 | 88.91 |
| 0.20072 | 1.05518 | 87.78 | 1.05369 | 88.12 | 1.05199 | 88.54 | 1.05013 | 88.86 |
| 0.25066 | 1.05645 | 87.76 | 1.05494 | 88.10 | 1.05322 | 88.52 | 1.05135 | 88.84 |
| 0.30012 | 1.05769 | 87.74 | 1.05616 | 88.08 | 1.05443 | 88.50 | 1.05255 | 88.82 |
| 0.35005 | 1.05893 | 87.73 | 1.05739 | 88.07 | 1.05564 | 88.49 | 1.05375 | 88.80 |
| 0.40188 | 1.06021 | 87.71 | 1.05866 | 88.05 | 1.05689 | 88.47 | 1.05499 | 88.79 |
| 303.15 K | 308.15 K | 313.15 K | 318.15 K | |||||
| 0.00000 | 1.04315 | 1.04102 | 1.03862 | 1.03587 | ||||
| 0.05002 | 1.04440 | 89.32 | 1.04225 | 89.62 | 1.03985 | 89.95 | 1.03709 | 90.25 |
| 0.08010 | 1.04514 | 89.29 | 1.04299 | 89.59 | 1.04059 | 89.91 | 1.03782 | 90.23 |
| 0.09997 | 1.04563 | 89.27 | 1.04348 | 89.58 | 1.04107 | 89.90 | 1.03831 | 90.21 |
| 0.20072 | 1.04810 | 89.22 | 1.04593 | 89.53 | 1.04350 | 89.83 | 1.04072 | 90.16 |
| 0.25066 | 1.04931 | 89.20 | 1.04713 | 89.51 | 1.04469 | 89.81 | 1.04190 | 90.15 |
| 0.30012 | 1.05049 | 89.19 | 1.04831 | 89.49 | 1.04587 | 89.79 | 1.04307 | 90.13 |
| 0.35005 | 1.05168 | 89.17 | 1.04949 | 89.47 | 1.04704 | 89.78 | 1.04423 | 90.11 |
| 0.40188 | 1.05291 | 89.15 | 1.05070 | 89.46 | 1.04825 | 89.76 | 1.04543 | 90.10 |
Donde SV es la pendiente límite experimental22.
En la región de dilución infinita, el volumen molar aparente es igual al volumen molar parcial de la DL-valina Vϕ0=V¯2023, y los resultados obtenidos para Vϕ0 se presentan en la Tabla III, observándose que ellos disminuyen con el incremento de la concentración del cosolvente NaNO3, lo cual puede ser interpretado como una contracción del volumen a dilución infinita debido al incremento de las interacciones soluto-cosolvente. Así mismo, los valores de Vϕ0 aumentan con el aumento de la temperatura, lo que podría ser atribuido a un debilitamiento de las interacciones que resultan del incremento de la energía cinética de las partículas.
Volúmenes molares aparentes a dilución infinita Vϕ0 para la DL-valina en mezclas acuosas de NaNO3 a las temperaturas de 283.15, 288.15, 293.15, 298.15, 303.15, 308.15, 313.15 y 318.15K
| m NaNO3/mol kg-1 | Vϕ0/cm3 mol-1 | SV /cm3 mol-2 kg | R2 |
|---|---|---|---|
| 283.15 K | |||
| 0.00000 | 91.53 | -3.69 | 0.9992 |
| 0.01064 | 90.77 | -1.83 | 0.9949 |
| 0.04132 | 90.65 | -1.39 | 0.9970 |
| 0.10086 | 90.20 | -1.06 | 0.9960 |
| 0.40131 | 89.45 | -0.65 | 0.9963 |
| 0.90135 | 87.94 | -0.36 | 0.9983 |
| 288.15 K | |||
| 0.00000 | 91.82 | -3.42 | 0.9989 |
| 0.01064 | 91.19 | -1.82 | 0.9965 |
| 0.04132 | 91.06 | -1.39 | 0.9949 |
| 0.10086 | 90.60 | -1.01 | 0.9963 |
| 0.40131 | 89.81 | -0.61 | 0.9968 |
| 0.90135 | 88.29 | -0.38 | 0.9984 |
| 293.15 K | |||
| 0.00000 | 92.10 | -3.24 | 0.9996 |
| 0.01064 | 91.66 | -1.80 | 0.9994 |
| 0.04132 | 91.49 | -1.37 | 0.9979 |
| 0.10086 | 90.97 | -1.04 | 0.9985 |
| 0.40131 | 90.12 | -0.62 | 0.9962 |
| 0.90135 | 88.69 | -0.35 | 0.9985 |
| 298.15 K | |||
| 0.00000 | 92.44 | -3.20 | 0.9999 |
| 0.01064 | 92.07 | -1.84 | 0.9981 |
| 0.04132 | 91.86 | -1.32 | 0.9987 |
| 0.10086 | 91.38 | -1.07 | 0.9932 |
| 0.40131 | 90.45 | -0.69 | 0.9990 |
| 0.90135 | 89.04 | -0.40 | 0.9982 |
| 303.15 K | |||
| 0.00000 | 92.77 | -3.17 | 0.9987 |
| 0.01064 | 92.46 | -1.87 | 0.9969 |
| 0.04132 | 92.28 | -1.46 | 0.9981 |
| 0.10086 | 91.74 | -1.01 | 0.9981 |
| 0.40131 | 90.81 | -0.71 | 0.9928 |
| 0.90135 | 89.39 | -0.37 | 0.9966 |
| 308.15 K | |||
| 0.00000 | 93.11 | -3.26 | 0.9998 |
| 0.01064 | 92.81 | -1.88 | 0.9994 |
| 0.04132 | 92.55 | -1.32 | 0.9952 |
| 0.10086 | 92.16 | -1.08 | 0.9996 |
| 0.40131 | 91.12 | -0.69 | 0.9998 |
| 0.90135 | 89.69 | -0.37 | 0.9977 |
| 313.15 K | |||
| 0.00000 | 93.45 | -3.32 | 0.9992 |
| 0.01064 | 93.20 | -1.90 | 0.9957 |
| 0.04132 | 92.95 | -1.25 | 0.9980 |
| 0.10086 | 92.48 | -1.10 | 0.9982 |
| 0.40131 | 91.41 | -0.72 | 0.9970 |
| 0.90135 | 90.01 | -0.39 | 0.9988 |
| 318.15 K | |||
| 0.00000 | 93.85 | -3.74 | 0.9996 |
| 0.01064 | 93.58 | -1.87 | 0.9990 |
| 0.04132 | 93.29 | -1.32 | 0.9974 |
| 0.10086 | 92.80 | -1.18 | 0.9992 |
| 0.40131 | 91.66 | -0.75 | 0.9984 |
| 0.90135 | 90.32 | -0.34 | 0.9993 |
También se analizó el efecto de la temperatura sobre el comportamiento del volumen molar aparente a dilución infinita Vϕ0 y éste se discute en términos de las interacciones hidrofóbicas e hidrofílicas y efecto del soluto sobre la estructura del solvente14. Para lo cual, los valores experimentales de Vϕ0 fueron correlacionados con la temperatura usando la ecuación (5).
Donde A, B y C son parámetros ajustables y T es la temperatura absoluta. En particular para estos sistemas los valores de ∂2Vϕ0/∂T2 resultaron positivos para la mezcla binaria DL-valina + agua y negativos para la DL-valina + mezclas acuosas de NaNO3, como se observa en la Tabla IV. Lo cual indica, según Hepler que en el primer sistema la DL-valina tiene un efecto formador de la estructura del agua; mientras que en los demás sistemas, la DL-valina tiene un efecto disruptor de la estructura del solvente mixto (mezclas acuosas de NaNO3)24
Para examinar las interacciones moleculares predominantes en solución se determinaron los volúmenes molares parciales de transferencia a dilución infinita △Vϕ0 que fueron obtenidos con la ecuación (6) y los resultados se presentan en la Tabla V.
Volúmenes molares parciales de transferencia a dilución infinita ΔVϕ0 para la DL-valina en agua hasta las mezclas acuosas de NaNO3
| m NaNO3/mol kg-1 | 0.01064 | 0.04132 | 0.10086 | 0.40131 | 0.90135 |
|---|---|---|---|---|---|
| T/K | ΔVϕ0 /cm3 mol-1 | ||||
| 283.15 | -0.75 | -0.88 | -1.33 | -2.08 | -3.59 |
| 288.15 | -0.63 | -0.76 | -1.22 | -2.01 | -3.53 |
| 293.15 | -0.44 | -0.61 | -1.13 | -1.98 | -3.41 |
| 298.15 | -0.37 | -0.58 | -1.06 | -2.00 | -3.40 |
| 303.15 | -0.31 | -0.49 | -1.03 | -1.96 | -3.38 |
| 308.15 | -0.31 | -0.56 | -0.95 | -2.00 | -3.42 |
| 313.15 | -0.25 | -0.50 | -0.98 | -2.05 | -3.44 |
| 318.15 | -0.27 | -0.57 | -1.05 | -2.19 | -3.54 |
Los valores negativos obtenidos para ΔVϕ0 de la DL-valina en las mezclas acuosas de NaNO3 podrían explicarse con ayuda del modelo de superposición de coesferas hidratadas25 y del concepto de que en el estado de dilución infinita las interacciones soluto-soluto están ausentes26-27. Además, de acuerdo con Mishra y Ahluwalia, los valores negativos de los volúmenes de transferencia obtenidos en este trabajo son el resultado del predominio en solución de la interacción soluto-cosolvente: ion-hidrofóbica, que ocurre entre el grupo isopropil –CH(CH3)2 del aminoácido DL-valina y los iones Na+ y NO3− del cosolvente8. Mientras que los valores negativos para ΔVϕ0son el resultado del efecto que pudiera tener el nitrato de sodio sobre las moléculas de agua en las coesferas de hidratación y sobre la molécula de soluto28.
Consecuentemente, el predomino de dichas interacciones produce un aumento en el número de moléculas de agua liberada desde la esfera de solvatación hacia la fase voluminosa, produciéndose así una disrupción local en la estructura del solvente29-30, este resultado es consistente con el criterio de la segunda derivada del volumen molar a dilución infinita con respecto a la temperatura, como lo sugiere el análisis de ∂2V20/∂T2.
Por otra parte, los valores negativos obtenidos para ΔVϕ0pueden ser también explicados con ayuda de la ecuación (7) propuesta por Shahidi y colaboradores31.
En esta construcción, los volúmenes molares parciales a dilución infinita son consecuencia de las siguientes contribuciones: ΔVVW que es el volumen de van der Waals, ΔVV es el volumen asociado a los espacios vacíos en solución y ΔVS es el volumen de contracción debido al efecto de electrostricción. Asumiendo que ΔVVW y ΔVV tienen la misma magnitud en agua que en soluciones acuosas, es decir son nulos, se deduce que cualquier variación de los volúmenes de transferencia es sólo consecuencia del efecto de electrostricción VS29. El signo negativo para ΔVϕ0 indica una disminución en el volumen a causa del efecto de electrostricción.
Esta situación nos advierte, que la presencia del nitrato de sodio en el sistema (DL-valina + mezclas acuosas de NaNO3) aumenta el efecto de electrostricción alrededor de la DL-valina, como lo reflejan los números de hidratación, que se obtienen a continuación:
Los números de hidratación NH para la DL-valina a cada temperatura y concentración de NaNO3 se calcularon con ayuda del modelo propuesto por Millero32, a partir del volumen molar parcial del aminoácido, mediante la ecuación (8).
Donde V¯20 es el volumen molar parcial a dilución infinita de la DL-valina obtenido experimentalmente, V¯20(int) es el volumen molar parcial intrínseco de la DL-valina, que se puede expresar como la adición del volumen de van der Waals y el volumen debido al efecto de empaquetamiento33, V¯20(elect) es el volumen molar parcial de electrostricción debido a la hidratación del aminoácido. Los valores de V¯20(int) pueden ser obtenidos del volumen molar de un cristal de la DL-valina utilizando la ecuación (9).
Donde V¯20(cristal) es el volumen molar de los cristales del aminoácido, y se obtiene dividiendo la masa molecular de la DL-valina entre su densidad en estado puro34. Esta ecuación fue originalmente usada por Millero, para evaluar el comportamiento de aminoácidos en agua; sin embargo, también ha sido usada por otros investigadores en solventes acuosos mixtos35-40. Una vez conocido el volumen de electrostricción es posible determinar la cantidad relativa de moléculas de agua alrededor del aminoácido hidratado utilizando la siguiente ecuación:
En este modelo se asume que por cada molécula de agua que pase desde la fase voluminosa hasta la región cercana al aminoácido el volumen decrece en (V¯E0–V¯B0). En este trabajo, para evaluar el término (V¯E0–V¯B0) fueron usados los valores de: −2.9, −3.3, −4.0cm3 mol-1 a 288.15, 298.15 y 308.15K reportados por Yan y colaboradores4, en adición a los extrapolados por Páez y colaboradores36 de: −2.7, −3.1, −3.6, −4.6 y −5.5cm3 mol−1 para las temperaturas de 283.15, 293.15, 303.15, 313.15 y 318.15K. Finalmente los números de hidratación pueden ser obtenidos como una aproximación utilizando la ecuación (10) y los resultados se muestran en la Tabla VI.
Números de hidratación NH para la DL-valina en mezclas acuosas de NaNO3 a diferentes temperaturas
| m NaNO3/mol kg-1 | 0.01064 | 0.04132 | 0.10086 | 0.40131 | 0.90135 | 0.01064 |
|---|---|---|---|---|---|---|
| T/K | NH | |||||
| 283.15 | 2.50 | 2.78 | 2.83 | 3.00 | 3.27 | 3.83 |
| 288.15 | 2.23 | 2.45 | 2.49 | 2.65 | 2.92 | 3.45 |
| 293.15 | 2.00 | 2.14 | 2.19 | 2.36 | 2.63 | 3.10 |
| 298.15 | 1.77 | 1.88 | 1.95 | 2.09 | 2.38 | 2.80 |
| 303.15 | 1.53 | 1.62 | 1.67 | 1.82 | 2.08 | 2.47 |
| 308.15 | 1.29 | 1.37 | 1.43 | 1.53 | 1.79 | 2.15 |
| 313.15 | 1.05 | 1.10 | 1.16 | 1.26 | 1.50 | 1.80 |
| 318.15 | 0.81 | 0.86 | 0.92 | 1.01 | 1.22 | 1.46 |
Es evidente que los números de hidratación NH de la DL-valina en las mezclas acuosas de NaNO3 aumentan conforme aumenta la concentración del cosolvente y disminuyen con el aumento de la temperatura. Este hecho sugiere que el aumento de las interacciones entre la DL-valina y los iones Na+ y NO3− del cosolvente generan un aumento en el efecto de electrostricción sobre las moléculas de agua, mientras que el aumento de la temperatura provoca una deshidratación de las especies solvatadas41.
CONCLUSIONESEn este trabajo se obtuvieron valores de densidad no reportados para el sistema de DL-valina en mezclas acuosas de NaNO3 a las temperaturas desde 283.15K hasta 318.15K a intervalos de 5K. A partir de los datos experimentales de densidad obtenidos se calcularon propiedades volumétricas encontrándose que los volúmenes molares aparentes a dilución infinita Vϕ0resultaron positivos y disminuyen con el aumento de la concentración del NaNO3 e incrementan con el aumento de la temperatura. La segunda derivada de Vϕ0con respecto a la temperatura muestra que la DL-valina se comporta como un soluto disruptor de la estructura del solvente mixto (mezclas acuosas de NaNO3). Los volúmenes molares parciales de transferencia a dilución infinita ΔVϕ0indican que las interacciones dominantes se establecen entre los iones Na+ y NO3− del cosolvente y la parte hidrofóbica del aminoácido, generando un aumento en la contracción del volumen a causa del efecto de electrostricción. Finalmente, los resultados de los números de hidratación NH utilizando el método de Millero, muestran un efecto de deshidratación a medida que se incrementan los valores de temperatura; sin embargo, este parámetro no mostró sensibilidad a los cambios en los valores de la concentración del NaNO3 en las mezclas.
Los autores agradecen a la Universidad de Córdoba por el apoyo brindado para la realización de este trabajo.