Se desarrolló y optimizó un método por Microextracción en Fase Sólida seguido de Cromatografía de Gases-Espectrometría de Masas (MEFS-CG-EM) para la determinación de ibuprofeno, naproxeno, clorofeno, triclosán y bisfenol A catalogados dentro de los contaminantes emergentes o productos farmacéuticos de cuidado personal (PPCP's, por sus siglas en inglés) en aguas residuales. La extracción de los analitos se realizó por MEFS utilizando una fibra de polietilenglicol (PEG), agitación a 1,200rpm y 30min de extracción a temperatura ambiente, 50% NaCl y pH=3, seguida de la derivatización en fibra con N-metil-N-t-butildimetilsililtrifluoroacetamida (MTBSTFA). La identificación de cada compuesto se realizó por la comparación del tiempo de retención y de su espectro de masas con los de su correspondiente estándar derivatizado. La cuantificación se efectuó por monitoreo selectivo de iones (SIM). El método desarrollado presentó aceptable linealidad en el intervalo de concentración de 1.0-118.90 pg/mL para el ibuprofeno, 48.0-1488 pg/mL para el naproxeno, 4.40-140.8 pg/mL para el triclosán, 1.0-58.32 pg/mL para el clorofeno y 1.0-59.16 pg/mL para el bisfenol A, con coeficientes de correlación (r) mayores a 0.99. Se analizaron muestras de influentes y efluentes de tres plantas de tratamiento de agua residual del sur de la ciudad: Ciudad Universitaria, Coyoacán y Cerro de la Estrella, pertenecientes al Sistema de Aguas de la Zona metropolitana de la Ciudad de México. Se demostró en este trabajo que la MEFS es una técnica de preparación de muestra simple, reproducible, sensible y rápida, ya que reduce etapas al extraer y concentrar simultáneamente, sin el uso de disolventes orgánicos, de fácil manejo y con un montaje experimental sencillo.
A methodology by SPME-GC-MS was developed and optimized for the simultaneous determination of pharmaceutical and personal care products (PPCP's) in wastewater: ibuprofen, naproxen, chlorofen, triclosan and bisphenol A. The extraction of analytes was performed by SPME using a fiber of PEG (Polietylenglycol), stirring of 1,200rpm, 30min extraction time at ambient temperature, 50% NaCl, pH=3 and derivatization on fiber with MTBSTFA (N-methyl-N-tert-butyl-dimethylsilil-trifluoroacetamide). The identification of the analytes was done by comparison of the retention times and the mass spectrum of standards. The quantification was done by selective ion monitoring (SIM) mode. The developed method shown acceptable linearity in the range of 1.0-118.90 pg/mL for ibuprofen, 48.0-1488 pg/mL for naproxen, 4.40-140.8 pg/mL for triclosan, 1.0-58.32 pg/mL for chlorofen, and 1.0-59.16 pg/mL for bisphenol A, all of them with correlation coefficients > 0.99. Several water samples from influents and effluents were analyzed from three wastewater treatment plants in the south of the Mexico City: “University”, “Coyoacan” and “Cerro de la Estrella” all of them belong to the water system of Mexico City. It was shown in this work that SPME is a sample preparation technique that is simple, reproducible, sensitive and fast because it reduces the steps by extracting and simultaneously concentrating the analytes without the use of organic solvents.
Cuando se habla de contaminantes emergentes o productos farmacéuticos de cuidado personal se refiere a cualquier producto utilizado por las personas para el cuidado de la salud, por motivos cosméticos o aquellos productos utilizados para aumentar el crecimiento o la salud de los animales. Diversos estudios han demostrado que los contaminantes emergentes se encuentran en cuerpos de agua; aguas residuales, ríos, arroyos, aguas subterráneas y entornos marinos1. Existe la necesidad de estudiar el efecto que producen estos compuestos en el ambiente, pues se piensa que pueden causar daños a la salud y ecológicos.
Los contaminantes emergentes probablemente han estado presentes en el agua y el medio ambiente durante el tiempo que los seres humanos los han utilizado. Los medicamentos que tomamos no son totalmente absorbidos por nuestro cuerpo, se excretan y pasan a aguas residuales y aguas superficiales. Con los avances en las técnicas para detectar y cuantificar productos químicos a nivel de trazas, ahora pueden ser identificados y cuantificados estos analitos en bajas concentraciones, con el propósito de estudiar los efectos que estos productos químicos tienen sobre el medio ambiente y la salud humana. Las aguas residuales son aguas con materiales derivados de residuos domésticos o de procesos industriales, los cuales por razones de salud pública, no pueden desecharse sin tratamiento. El tratamiento de las aguas residuales da como resultado la eliminación de microorganismos patógenos, evitando así que estos microorganismos lleguen a ríos o a otras fuentes de abastecimiento. Específicamente el tratamiento biológico de las aguas residuales es considerado un tratamiento secundario, ya que éste está ligado íntimamente a dos procesos microbiológicos, que pueden ser aerobios y anaerobios. Sin embargo, los contaminantes emergentes no son eliminados en estas plantas de tratamiento de agua y los influentes y efluentes contienen estos contaminantes.
Se han publicado diversos estudios, para determinar contaminantes emergentes en diferentes cuerpos de agua, métodos para la cuantificación de productos farmacéuticos, cosméticos, disruptores endocrinos, fármacos antiinflamatorios2, triclosán3, bisfenol,4,5 etc. utilizando MEFS o extracción en fase sólida seguido de Cromatografía de Líquidos o Cromatografía de Gases con acoplamiento a Espectrometría de Masas. Así como estudios para grupos específicos de contaminantes emergentes pero hasta ahora no hay un estudio en el que se determinen, fármacos antiinflamatorios, antisépticos/desinfectantes y disruptores endocrinos de manera simultánea por MEFS seguida de CG-EM.
Este estudio busca aportar información acerca de la presencia de compuestos como el triclosán, clorofeno (desinfectantes), naproxeno, ibuprofeno (fármacos antiinflamatorios), y bisfenol A (disruptor endocrino), desarrollando y optimizando una metodología por MEFS-CG-EM para identificación y cuantificación de estos compuestos presentes en el agua residual de la zona sur-oriente de la Ciudad de México.
Materiales y métodosMaterialesBarra magnética de 10mm x 3mm.
Jeringas Hamilton de vidrio de10, 20, 50, 100, 250 y 500μL.
Fibras: Polidimetilsiloxano/Divinilbenceno (PDMS/DVB, 65μm), Poliacrilato (PA, 85μm), Carboxen/Polidimetilsiloxano (CAR/PDMS, 75μm), Carbowax/Divinilbenceno (CW/DVB, 65μm), Carbowax/Divinilbenceno StableFlex (CW/DVB, 70μm), Polietilenglicol (PEG, 60μm). Las fibras fueron acondicionadas de acuerdo a las indicaciones del proveedor. Soporte de la fibra para inyección manual (Supelco, Bellafonte, P.A., USA).
Material de vidrio Pyrex: matraces aforados, pipetas volumétricas, vasos de precipitado, embudo de filtración de tallo corto. Matraz Kitazato de 250mL. Viales de vidrio (12mL de capacidad) con tapón horadado de polipropileno y septa de teflón (politetrafluoretileno).
Pipeta Pasteur de vidrio. Botellas de vidrio ámbar con capacidad de 1 L.
Limpieza del materialPara evitar interferencia en los análisis de las muestras, así como en la preparación de las curvas de calibración, se llevó a cabo un cuidadoso procedimiento de lavado del material utilizado. El material se colocó en un baño con jabón líquido, se lavó y se enjuagó con abundante agua, posteriormente con agua destilada, secando lo que era de vidrio (no volumétrico) a 100°C, para su posterior almacenamiento en un lugar libre de polvo. Antes de usar los viales en los que se llevó a cabo la MEFS, el material se enjuagó con metanol y acetona para eliminar posibles restos de materia orgánica.
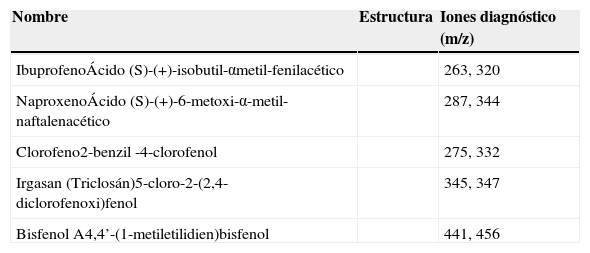
ReactivosAlcohol metílico absoluto anhidro (99.9% de pureza), J.T. Baker, México, agua nanopure sometida a filtración en un sistema purificador y desionizador de agua nanopure (Barnstead Thermolyne, modelo 04747). Ácido clorhídrico 0.1N (solución volumétrica valorada), HYCEL, México. Estándares: ibuprofeno (99% de pureza), naproxeno (98% de pureza), clorofeno (95% de pureza), bisfenol A (99% de pureza), Sigma-Aldrich, EUA e Irgasan (>97% de pureza) Fluka, Italia. La estructura de los contaminantes emergentes se presenta en la Tabla I.
Estándares utilizados en el desarrollo experimental
| Nombre | Estructura | Iones diagnóstico (m/z) |
|---|---|---|
| IbuprofenoÁcido (S)-(+)-isobutil-αmetil-fenilacético | 263, 320 | |
| NaproxenoÁcido (S)-(+)-6-metoxi-α-metil-naftalenacético | 287, 344 | |
| Clorofeno2-benzil -4-clorofenol | 275, 332 | |
| Irgasan (Triclosán)5-cloro-2-(2,4-diclorofenoxi)fenol | 345, 347 | |
| Bisfenol A4,4’-(1-metiletilidien)bisfenol | 441, 456 |
Se prepararon por separado disoluciones estándar de cada compuesto de las siguientes concentraciones: ibuprofeno 22μg/mL, naproxeno 24μg/mL, triclosán 44μg/mL, clorofeno 54μg/mL y bisfenol A 34μg/mL en metanol. Se almacenaron a 4°C, en viales color ámbar de vidrio con tapón y septa sellados con teflón para su posterior uso.
MuestrasSe analizaron 20 muestras (12 influentes y 8 efluentes) provenientes de tres plantas de tratamiento de aguas residuales (PTAR) de la Zona Metropolitana del Valle de México: Ciudad Universitaria (CU), Coyoacán y Cerro de la Estrella.
PTAR de Ciudad Universitaria: se analizaron 4 muestras, debido a problemas de operación la planta no estaba en funciones y sólo se tomaron muestras del influente.
PTAR Coyoacán: se analizaron 8 muestras, 4 de influentes y 4 de efluentes. Durante el muestreo en esta planta se incrementó el flujo de entrada, por tanto, dos muestras fueron tomadas con una diferencia de cuatro días (tiempo total del proceso) y dos con una diferencia de dos días (tiempo total del proceso).
PTAR Cerro de la Estrella: se analizaron 8 muestras; 4 de influentes y 4 de efluentes, con una diferencia de doce horas (tiempo total del proceso).
Toma de muestraEn cada punto del muestreo se tomaron muestras simples por duplicado. Los muestreos de los influentes se realizaron por la mañana, para obtener muestras que representaran las condiciones reales del agua, pues al transcurrir el día el agua se ve afectada por las actividades humanas. El volumen de cada muestra fue de un litro, aun cuando se trabajó con volúmenes menores en el laboratorio, para tener datos representativos.
El procedimiento de muestreo se realizó de acuerdo al método 525.2 de la USEPA (1995)1, con la diferencia de que no se agregó el conservador (para evitar posibles alteraciones de los resultados). El análisis se realizó el mismo día en que se tomó la muestra, salvo en el caso del efluente de la Planta de Cerro de la Estrella, pues la muestra se tomaba por la tarde noche. Todas las muestras se mantuvieron en refrigeración (4°C) hasta su análisis.
Cromatografía de Gases-Espectrometría de Masas (CG-EM)Se utilizó un Cromatógrafo de Gases Agilent 6890N equipado con un inyector split/splitless y una columna capilar ZB-5 (30 m X 0.25mm ID X 0.25μm FT). Temperatura del inyector: 250°C en modo splitless (1min). Programa de temperatura utilizado: 70°C iniciales durante 2min, incrementando la temperatura a 10°C/min hasta 300°C y manteniéndola constante durante 5min. El gas acarreador fue He con flujo de 1mL/min. El cromatógrafo está acoplado con un detector selectivo de Masas Agilent 5973. Temperatura de la línea de transferencia 280°C, fuente de ionización 230°C, analizador (cuadrupolar) 150°C y detector 75°C. Los análisis se realizaron por impacto electrónico (70eV). Se utilizó el modo de barrido total del espectro (SCAN) de 50 a 550 m/z a 1.5 scan.s-1 para la identificación y el selectivo de iones (SIM) para la cuantificación, utilizándose los grupos de iones diagnóstico mencionados en la Tabla I.
Identificación de contaminantes emergentesPara la identificación de los analitos en estudio, se obtuvieron los tiempos de retención de los estándares derivatizados y su respectivo espectro de masas. Debido a que los derivados de los analitos no estaban reportados en la base de datos de la Biblioteca de Espectros de Masas del NIST (The NIST Mass Spectral Search Program for the NIST/EPA/NIH Mass Spectra Library versión 2.0 build 19 de noviembre de 2000), fue necesario llevar a cabo la identificación de éstos mediante la inyección en solución de los estándares previamente sometidos al siguiente proceso de derivatización: se tomaron 2mL de la disolución estándar del analito, se evaporó a sequedad en flujo de nitrógeno, se adicionaron 100μL de MTBSTFA, se colocó en la estufa a 60°C durante 30min, posteriormente se inyectó en el CG-EM, obteniendo el cromatograma y el espectro de masas correspondiente, se realizó el mismo procedimiento para cada analito por separado y posteriormente en una mezcla estándar de los contaminantes emergentes en estudio.
Microextracción en Fase Sólida (MEFS)Para iniciar el desarrollo del método analítico primero se realizó la optimización de la MEFS de los PPCP's en agua, para lo cual se empleó una mezcla de estándares de los analitos en estudio. Para el análisis por CG-EM se llevó a cabo la derivatización en la fibra de MEFS al ser expuesta al agente derivatizante en modo Head-Space.
Optimización de los parámetros para la MEFSLa cantidad de analitos que pueden extraerse por MEFS, es determinada por la constante de equilibrio del analito entre la fase acuosa y la fase polimérica de la fibra. Para optimizar la extracción de los analitos sobre la fibra, es necesario considerar diversos factores que influyen en estos equilibrios. Estos factores son; el tipo de fibra, el pH, la fuerza iónica de la disolución, la temperatura de extracción, la agitación y el tiempo de extracción.
Selección de fibra. Se evaluaron 5 fibras de diferente polaridad: Carboxen/Polidimetilsiloxano (CAR/PDMS), Polidimetilsiloxano-Divinilbenceno (PDMS/DVB), Poliacrilato (PA) y Carbowax/Divinilbenceno (CW/DVB) y Carbowax/Polietilenglicol (PEG). Previo a cada extracción se realizó un blanco de fibra, exponiendo la fibra en el inyector durante 10min.
La extracción se realizó transfiriendo al vial la mezcla de los analitos, con agitación a 1,200rpm durante 5min para mantener un estado de equilibrio. Posteriormente se colocó la fibra en inmersión en la disolución junto al vórtice que se forma en la disolución durante 30min. Inmediatamente después se retiró la fibra y se realizó la silanización, colocando la fibra en el Head-Space de un vial de 4mL, que contenía 100μL de MTBSTFA. Posteriormente se retiró la fibra y se desorbió en el inyector del cromatógrafo de gases durante 1min. Después de la desorción se realizó un segundo análisis cromatográfico para evaluar la cantidad de analito no desorbido. Se estableció que se mantendría la fibra 10min en el inyector para tenerla lista para un siguiente análisis.
Perfil de tiempo de extracción. De acuerdo a los resultados de selección de la fibra, se determinó el perfil de tiempo de extracción utilizando la fibra CW/DVB, se realizó la extracción a temperatura ambiente durante 10, 20, 30, 40, 50 y 60min.
Temperatura de extracción. De acuerdo a los resultados obtenidos en el punto anterior, se trabajó con la fibra CW/DVB, con un tiempo de extracción de 30 minutos, evaluando la extracción a 25, 30, 40 y 50°C.
Tiempo de silanización. Se determinó el tiempo de silanización utilizando la fibra CW/DVB con extracción a temperatura ambiente por 30min. Se evaluaron tiempos de silanización de: 5, 10, 15, 30 y 60min.
Fuerza iónica. Para estudiar el efecto que tiene la adición de sal en la eficiencia de la extracción al disminuir la solubilidad de los analitos en la disolución y favorecer el paso de éstos hacia la fibra, se empleó cloruro de sodio (NaCl). Se utilizó la fibra CW/DVB con extracción a temperatura ambiente por 30min y tiempo de silanización de 30min. Se realizaron extracciones con la adición de 0.08g 0.44g, 0.9g, 1.34g y 1.786g de NaCl equivalente a 5%, 25%, 50%, 75% y saturación de sal respectivamente.
pH. Para evaluar la influencia del pH de la disolución en la extracción, se utilizó la fibra CW/DVB con extracción a temperatura ambiente por 30min, adición de 50% de NaCl y tiempo de silanización de 30min. Los pH estudiados fueron: 2.0, 3.0, 4.0, 5.5, 7.0, 8.0 y 9.0.
Procedimiento seleccionado para la MEFSUna vez optimizada la metodología de extracción fue necesario realizar una nueva elección de la fibra, debido a que la fibra de CW/DVB que se había evaluado fue descontinuada. Se comparó la extracción con cuatro fibras de polaridad similar; Poliacrilato (PA) Carbowax/ Divinilbenceno (CW/DVB), Carbowax/ Divinilbenceno (CW/DVB) StableFlex y Carbowax/Polietilenglicol (PEG). De acuerdo con los resultados, se eligió llevar a cabo la extracción con la fibra PEG.
El procedimiento seleccionado para realizar la MEFS fue: fibra PEG, disolución a pH 3, adición de 50% de NaCl, agitación a 1,200rpm, extracción a 25°C, durante 30min y 30min de silanización (Head-Space).
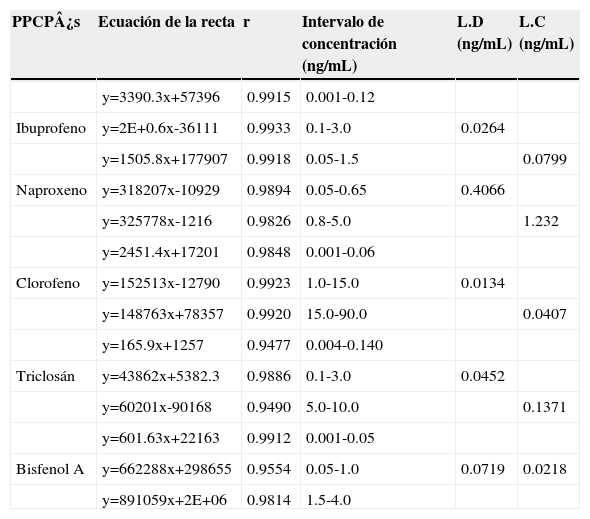
LinealidadUna vez optimizada la técnica de MEFS, se prepararon curvas de calibración absolutas de cada analito en buffer pH=3, en el intervalo de concentraciones indicadas en la Tabla II. Se determinaron los límites de detección (LD = 3 DE) y cuantificación (LQ = 10 DE).6
Linealidad y límites de detección y cuantificación del método (n=7)
| PPCP¿s | Ecuación de la recta | r | Intervalo de concentración (ng/mL) | L.D (ng/mL) | L.C (ng/mL) |
|---|---|---|---|---|---|
| y=3390.3x+57396 | 0.9915 | 0.001-0.12 | |||
| Ibuprofeno | y=2E+0.6x-36111 | 0.9933 | 0.1-3.0 | 0.0264 | |
| y=1505.8x+177907 | 0.9918 | 0.05-1.5 | 0.0799 | ||
| Naproxeno | y=318207x-10929 | 0.9894 | 0.05-0.65 | 0.4066 | |
| y=325778x-1216 | 0.9826 | 0.8-5.0 | 1.232 | ||
| y=2451.4x+17201 | 0.9848 | 0.001-0.06 | |||
| Clorofeno | y=152513x-12790 | 0.9923 | 1.0-15.0 | 0.0134 | |
| y=148763x+78357 | 0.9920 | 15.0-90.0 | 0.0407 | ||
| y=165.9x+1257 | 0.9477 | 0.004-0.140 | |||
| Triclosán | y=43862x+5382.3 | 0.9886 | 0.1-3.0 | 0.0452 | |
| y=60201x-90168 | 0.9490 | 5.0-10.0 | 0.1371 | ||
| y=601.63x+22163 | 0.9912 | 0.001-0.05 | |||
| Bisfenol A | y=662288x+298655 | 0.9554 | 0.05-1.0 | 0.0719 | 0.0218 |
| y=891059x+2E+06 | 0.9814 | 1.5-4.0 |
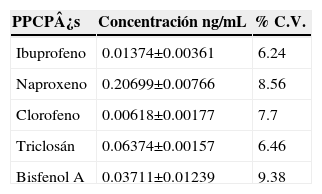
Para calcular la precisión se utilizó una mezcla de estándares de ibuprofeno (0.01374 ng/mL), naproxeno (0.20699 ng/mL), clorofeno (0.00618 ng/mL), triclosán (0.06374 ng/mL) y bisfenol A (0.03711 ng/mL); de esta disolución se realizaron 3 análisis independientes por el método propuesto por MEFS-CG-EM. Con los resultados obtenidos se calculó la desviación estándar (DE) y el coeficiente de variación (CV)6.
Cuantificación de contaminantes emergentesEl análisis cuantitativo, se realizó utilizando el modo selectivo de iones (SIM) con los grupos de iones diagnósticos mostrados en la Tabla I. La cuantificación se realizó utilizando la curva de calibración absoluta de cada compuesto (Tabla II).
Análisis de contaminantes emergentes en muestras de agua residualLas muestras recolectadas de los influentes y los efluentes, se filtraron al vacío en un embudo Büchner, con papel filtro Whatman No. 1. Se les ajustó el pH=3, adicionando HCl 0.1N. Posteriormente se tomaron 5mL de muestra, se colocó el agitador magnético (10mm x 3mm), se adicionó 50% de NaCl y el sistema se selló con teflón, se colocó en la parrilla de agitación manteniendo la muestra a 25°C y agitación de 1,200rpm. La extracción se realizó con una fibra PEG durante 30min por inmersión y posteriormente se derivatizó en la fibra (Head-Space) durante 30min. La fibra se desorbió en el inyector del CG-EM durante 10 minutos. El análisis de las muestras se realizó por triplicado.
Resultados y discusiónOptimización de la MEFSPara llevar a cabo una extracción eficiente por MEFS, fue necesario realizar la optimización de los parámetros para posteriormente proceder con el análisis de las muestras.
La optimización del método de extracción se efectuó utilizando una disolución estándar de PPCP's como se indicó en la parte experimental.
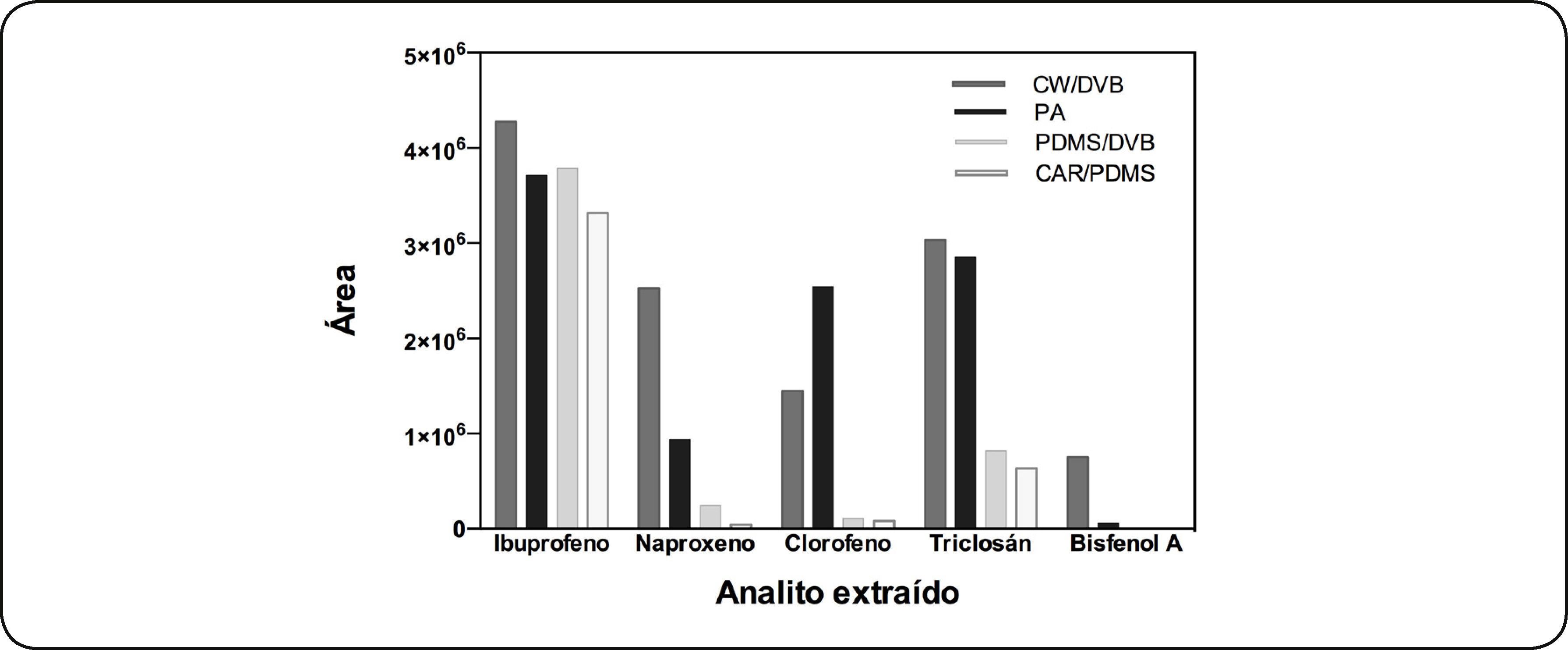
Selección de FibraInicialmente se evaluaron cuatro fibras de diferente polaridad; CAR/PDMS PDMS/DVB, PA y CW/DVB para comparar la capacidad de extracción de los analitos en cada una de ellas. La Fig. 1 ilustra la extracción de ibuprofeno, clorofeno, naproxeno, triclosán y bisfenol A con cada una de las fibras estudiadas. En esta gráfica se observa, que los analitos estudiados al presentar una tendencia polar, son extraídos con las fibras de tendencia polar como son CW/DVB, PA y de polaridad media PDMS/DVB. Al comparar la extracción de los analitos se ve que la fibra de CW/DVB extrajo mayor cantidad de éstos a excepción del clorofeno probablemente debido a la polaridad de la fibra y a los grupos funcionales polares que posee, tanto el anillo aromático, como los OH. Es importante hacer notar que las fibras duales como la CW/DVB y la PDMS/DVB incrementan la capacidad de extracción de los analitos sobre la fibra debido al efecto sinérgico de adsorción y distribución dentro de la fase estacionaria, obteniendo mayor sensibilidad. No se eligieron las fibras PDMS/DVB, CAR/PDMS, por la baja extracción de los analitos mostrada y porque el bisfenol A, no es extraído con estas fibras. La fibra CAR/PDMS por ser una fibra de baja polaridad, presentó una menor extracción para todos los casos. La fibra PDMS/DVB extrajo en menor cantidad al clorofeno, naproxeno y triclosán. En el caso del ibuprofeno la extracción fue mayor con PDMS/DVB que con PA. La fibra de PA extrajo a los cinco analitos, inclusive, extrajo mejor al clorofeno que las otras tres fibras, pero el bisfenol A, se extrajo en muy poca cantidad. Por lo tanto se eligió trabajar con la fibra CW/DVB que extrajo mejor a los PPCP's.
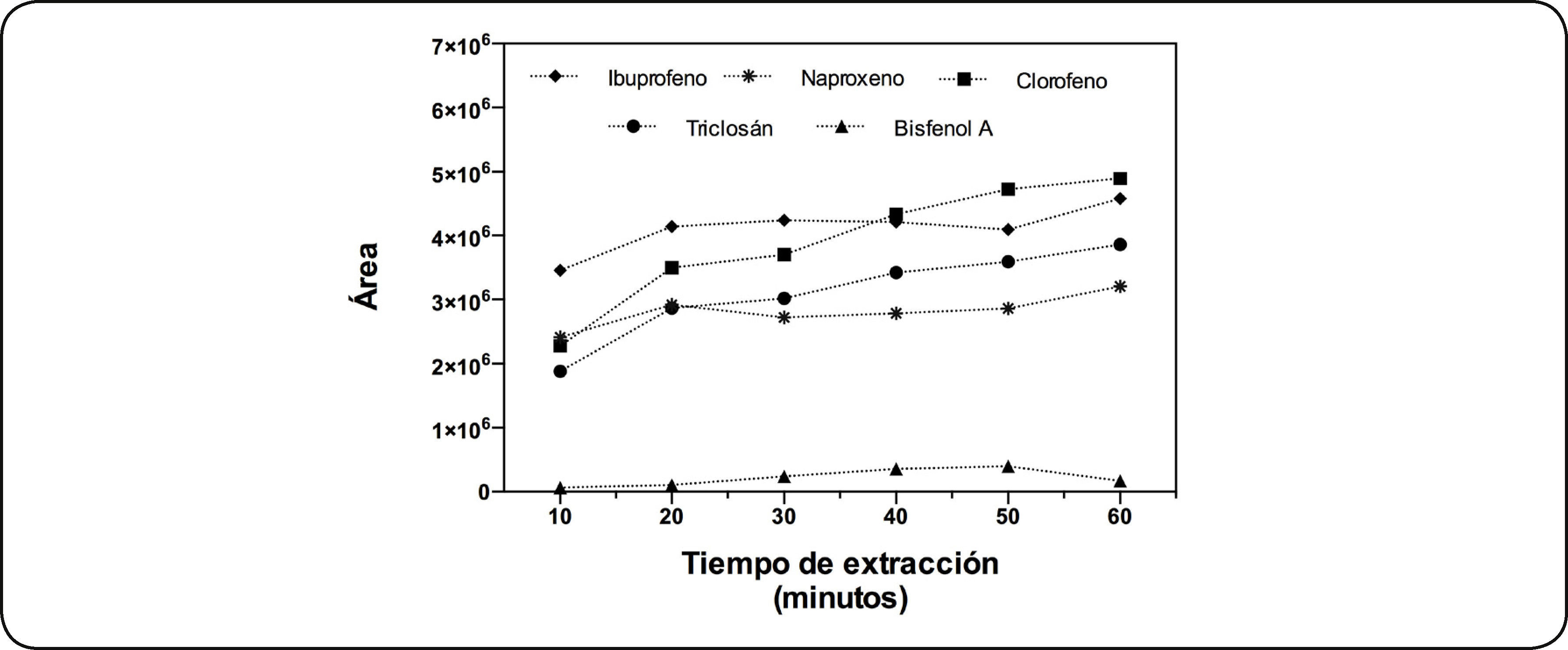
Perfil de tiempo de extracciónSe evaluó el perfil de tiempo de extracción con la fibra CW/DVB a 25°C. La Fig. 2 muestra la extracción de los PPCP's en diferentes tiempos de extracción. En general se observó que al incrementar el tiempo de extracción se incrementó la concentración de PPCP's extraídos. El ibuprofeno presentó un incremento en la extracción a los 20min, después ligeramente disminuyó (a los 50min), incrementándose nuevamente a los 60min. Se incrementó la extracción de naproxeno entre los 10 y 20min, manteniéndose constante entre los 20 y 50min, hasta que alcanzó un máximo a los 60min. El bisfenol A mostró su máximo de extracción entre los 40 y 50min, posteriormente disminuyó la cantidad de analito extraído. En el caso del clorofeno se observó que al aumentar el tiempo de extracción se incrementó la cantidad de analito extraído. Cuando se tienen analitos tan diferentes es difícil que se encuentre un solo tiempo de equilibrio, ya que no es posible establecer un tiempo único en el que todos lleguen al equilibrio. Al llegar la extracción al máximo (tiempo de equilibrio) ya no se extrae más analito, pero no es necesario trabajar con tiempos muy largos siendo posible trabajar en condiciones de no equilibrio, en cuyo caso se debe controlar rigurosamente el tiempo de extracción, dado que pequeñas variaciones en el mismo pueden provocar variaciones importantes en el porcentaje de analito extraído. Por lo anterior se eligió trabajar con un tiempo de extracción de 30min.
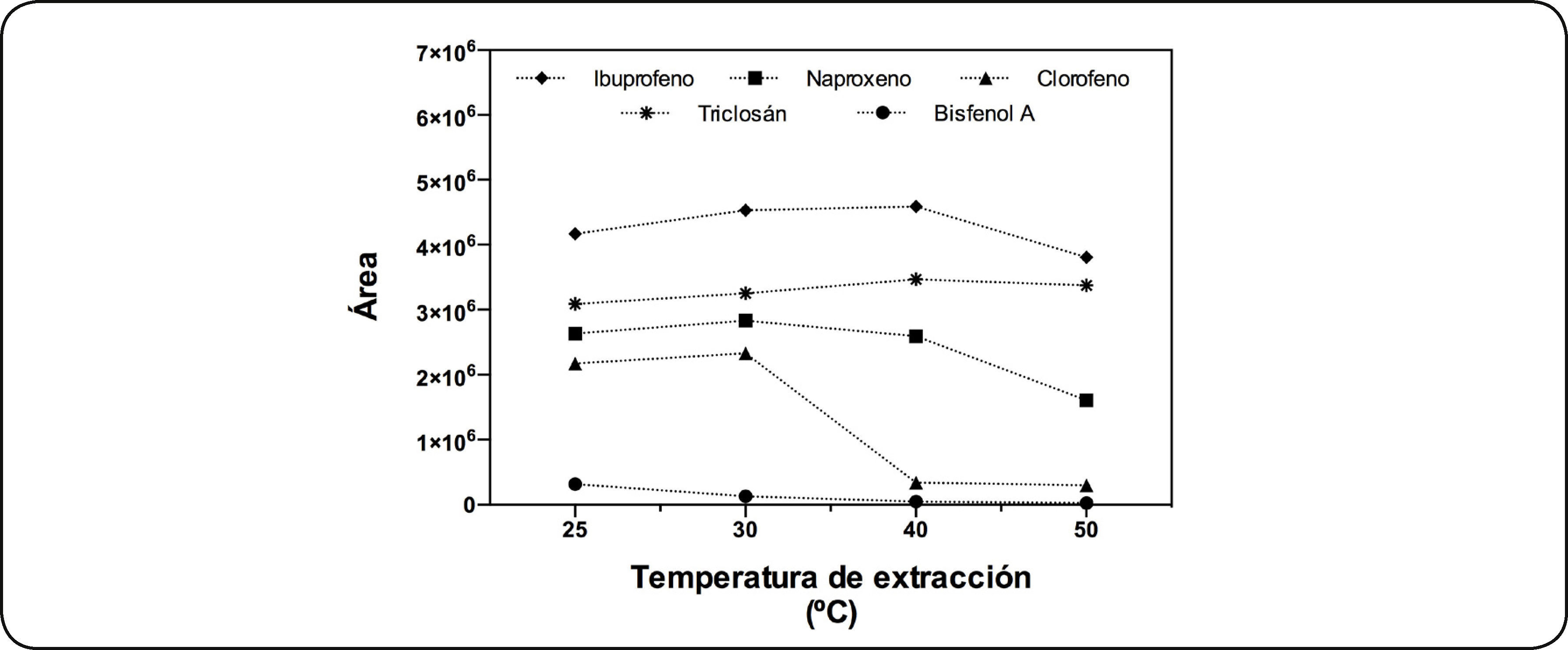
Temperatura de extracciónDe acuerdo a los resultados obtenidos del tiempo de extracción, se eligió trabajar con la fibra de CW/DVB, con un tiempo de extracción de 30 minutos. La Fig. 3 muestra el perfil de extracción de ibuprofeno, clorofeno, bisfenol A, naproxeno y triclosán en función de la temperatura. En la figura se observa que al incrementar la temperatura se incrementó la extracción del ibuprofeno, clorofeno, naproxeno y triclosán, no así para el caso del bisfenol A y del clorofeno. Para el ibuprofeno y triclosán conforme se incrementó la temperatura aumentó la extracción y ambos alcanzan su máximo de extracción a 40°C. En el caso del clorofeno se presentó la máxima extracción entre los 25 y 30°C, después de esta temperatura disminuyó abruptamente la cantidad extraída (diez órdenes de magnitud). Para el naproxeno a los 30°C alcanzó su máximo de extracción, después de esa temperatura disminuyó la extracción. El bisfenol A, disminuye su extracción al incrementar la temperatura. Con base en estos resultados se eligió realizar la extracción a temperatura ambiente (≈ 25°C).
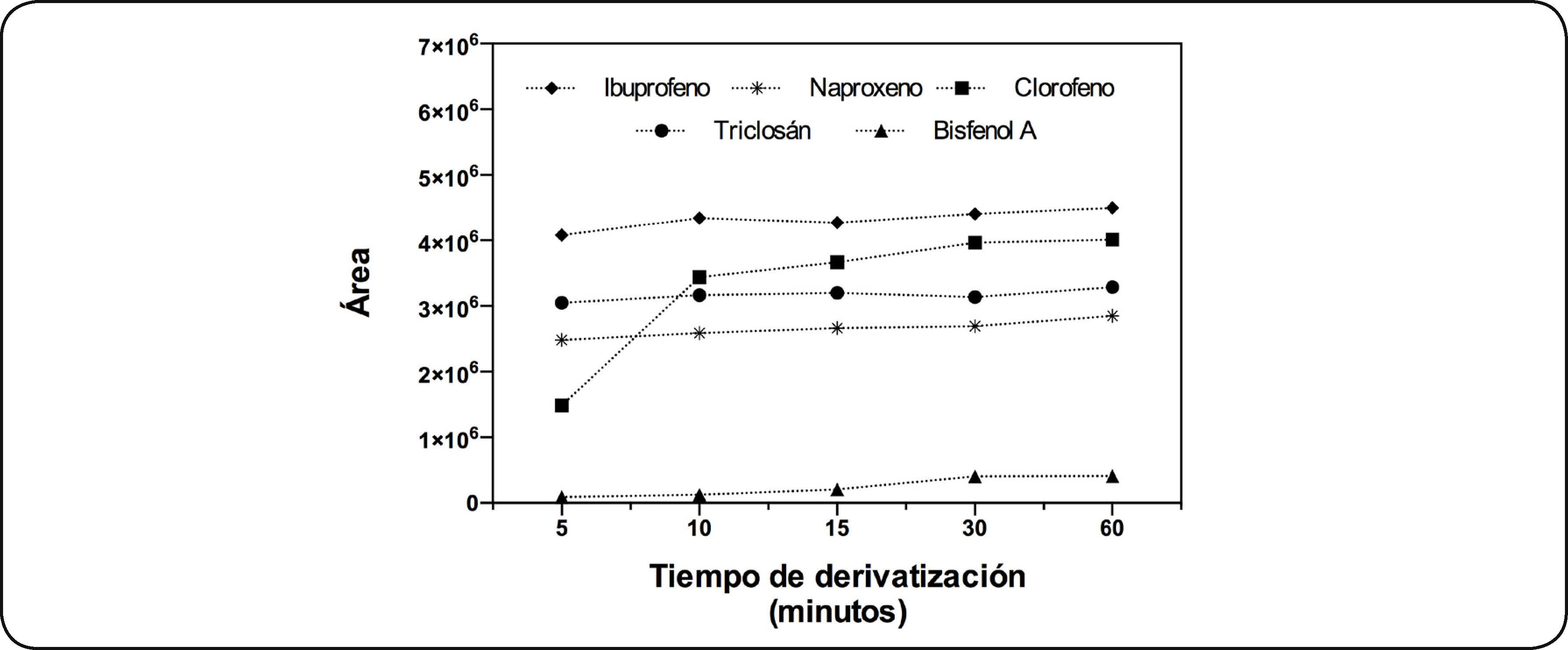
Tiempo de silanizaciónLa Fig. 4 muestra la extracción de PPCP's en diferentes tiempos de derivatización. En esta figura se observa que al incrementar el tiempo de exposición de la fibra al agente derivatizante se incrementó la cantidad de analito derivatizado y por tanto se tiene una mayor respuesta. Se obtiene una derivatización casi completa a partir de los 30min para todos los compuestos en estudio, por lo que se seleccionó el tiempo de derivatización de 30min.
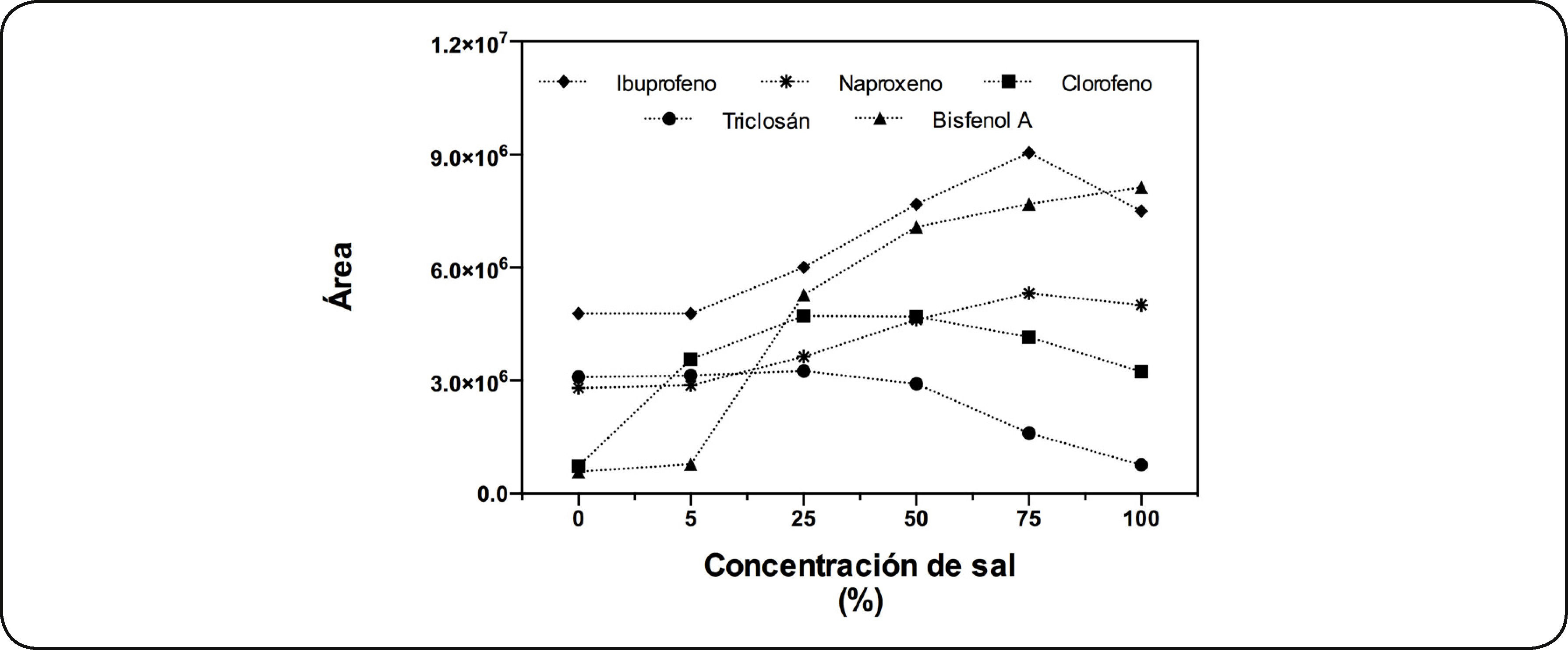
Efecto de la fuerza iónicaPara determinar el efecto de la adición de sal en la extracción se utilizó la fibra CW/DVB con extracción a temperatura ambiente por 30min y tiempo de derivatización de 30min. La Fig. 5 muestra la extracción de los PPCP's con diferente % de adición de sal. Se observa una diferencia significativa en la extracción con 50% de NaCl (necesaria para alcanzar la saturación de la solución). La extracción de ibuprofeno y naproxeno, alcanzó su máximo con 75% NaCl, mientras que el clorofeno y triclosán con 25% de NaCl, para ambos compuestos no disminuyó significativamente la eficiencia de la extracción con 50% de NaCl. En el caso del bisfenol A al incrementar el % de NaCl, se incrementó la extracción, alcanzando su máximo con la solución saturada de NaCl. En general al adicionar NaCl a la solución, se incrementa la fuerza iónica lo que provoca la disminución en la solubilidad de los analitos en disolución, favoreciendo el paso de los analitos hacia la fibra. Debido a que no es posible establecer un % de sal óptimo para que todos los analitos presenten un máximo en su extracción, se seleccionó utilizar 50% de NaCl, que presentó un medio en el que no se extrae el máximo de todos pero se consideró un punto intermedio.
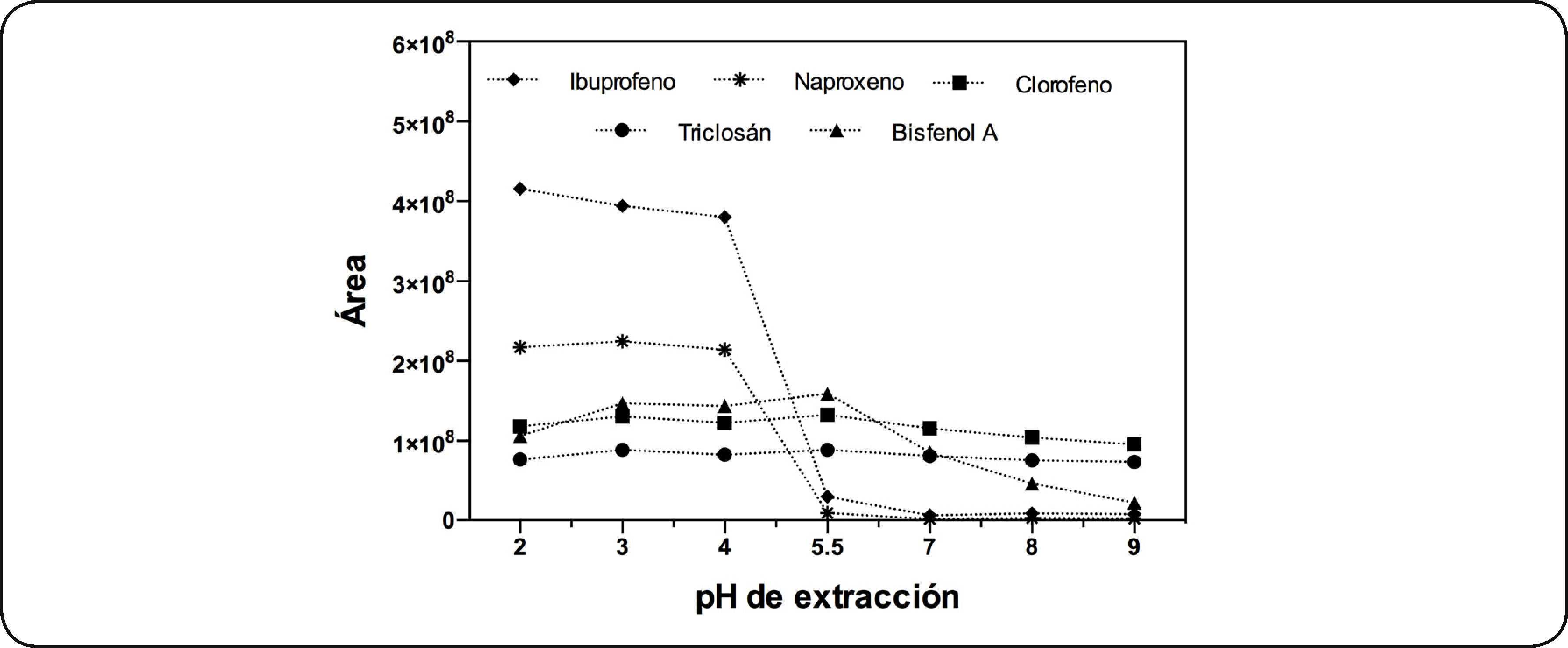
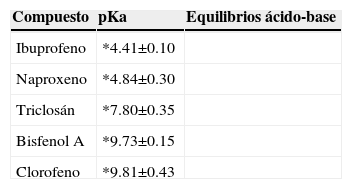
Efecto del pHDe acuerdo a los resultados obtenidos, para evaluar el efecto del pH de la disolución en la eficiencia de la extracción, se utilizó la fibra de CW/DVB con adición de 50% de NaCl, a temperatura ambiente, extracción durante 30min con un tiempo de derivatización de 30min. La Fig. 6 muestra el perfil de extracción de los PPCP's en función del pH de la disolución. Se observa que la mayor extracción se realizó a pH ácido, los PPCP's que se analizaron presentan un grupo hidroxilo y para poder ser extraídos de manera adecuada, deben estar en su forma neutra para que tengan una mayor afinidad por el recubrimiento de la fibra. Para explicar adecuadamente la extracción en función del pH se debe tener en cuenta que los compuestos presentan propiedades ácido-base. Con base en su pKa, el cambio en el pH modifica la estructura, teniendo a la especie protonada o desprotonada del grupo hidroxilo (Tabla III). De acuerdo al intervalo de pH evaluado, a pH menores de 4.31 los cinco compuestos están en su forma protonada, a pH=7 el triclosán, bisfenol A y clorofeno están en su forma ácida, mientras que el ibuprofeno y el naproxeno están en su forma desprotonada. A pH mayor de 10.24 las especies predominantes son las que presentan desprotonación del fenol. Por tanto si se trabaja a pH=3 se tienen todas las especies en su forma molecular, de esta manera tendrán una mayor afinidad por la fibra, lo cual explica que a este pH se tenga la máxima cantidad de analitos extraídos (Fig. 6). Para asegurar que una especie ácida esté totalmente protonada, es necesario trabajar a pH dos unidades menor a su pKa, por ello se observa en la figura anterior que el ibuprofeno alcanza su mayor extracción a pH=2.
Los equilibrios ácido-base establecidos en la Tabla III, de acuerdo a los valores de pKa y a los pH evaluados explican el perfil de extracción de los PPCP's, en el cual se observa que a pH<4 se tiene la máxima cantidad de analito extraído.
En el estudio que reportan Chia-Min, C. y colaboradores4, para la extracción del bisfenol A en función del pH, menciona que en el intervalo de pH que evaluaron de 3 a 11, la extracción no se ve afectada por el incremento del pH. Sin embargo, en este estudio, la extracción del bisfenol A sí se ve afectado por la variación del pH. En la Fig. 6 se observa que a pH mayores de 5.5 la extracción de bisfenol A disminuye, esta disminución se puede explicar con base en el valor de pKa (Tabla III), pues para valores de pH menores en dos unidades de su pKa se tendrá a la especie protonada en 99% respecto a la desprotonada, es decir a pH menor a 7.6 predomina el bisfenol A, pero conforme se incrementa el valor de pH y se acerca al valor de su pKa se tiene a la especie desprotonada, quien es menos afín a la fibra, teniendo así una disminución del analito en la extracción. Por lo tanto, al efectuarse la mayor extracción a pH ácido se seleccionó trabajar a pH=3, para no trabajar en el límite de pH y así evitar el deterioro de la fibra.
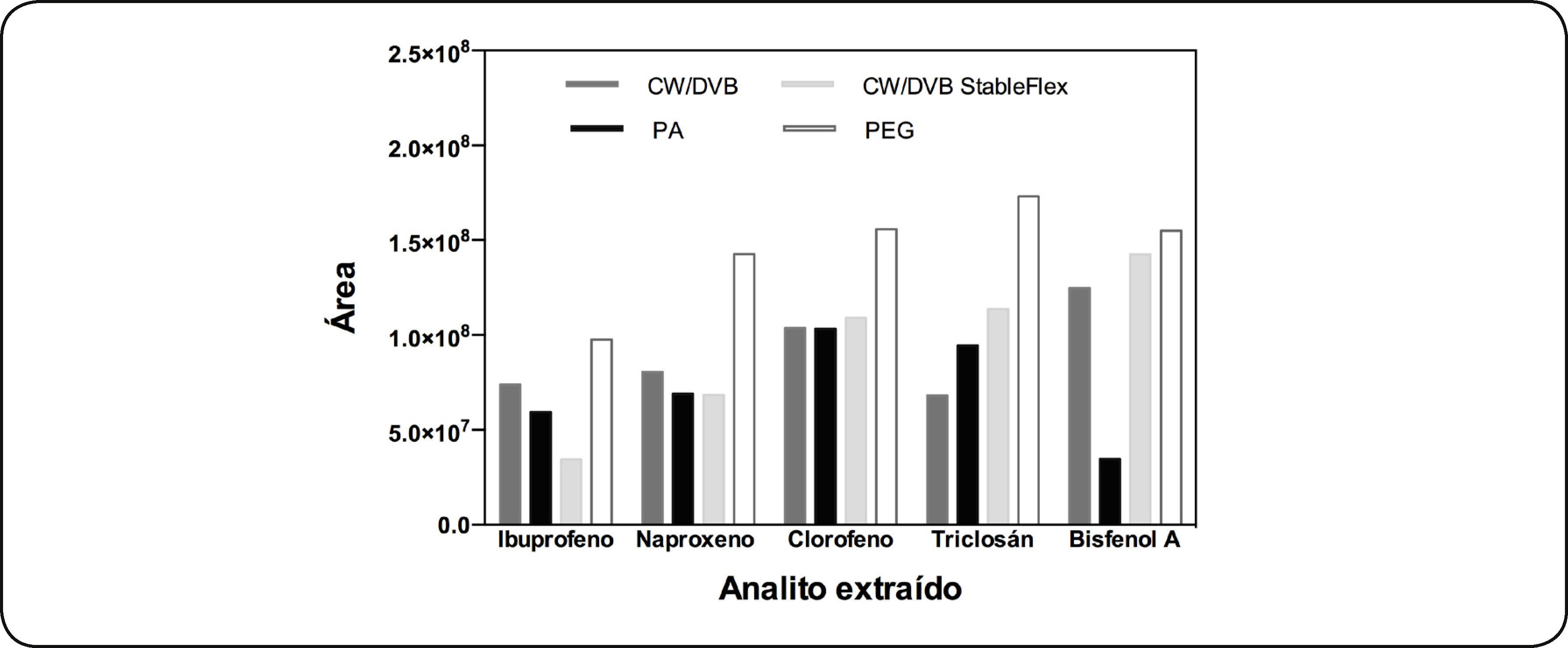
Fibra de Polietilenglicol (PEG)Durante el desarrollo de la optimización de la MEFS, se utilizó la fibra de CW/DVB, pero ésta fue descontinuada, debido a lo cual se comparó la extracción de tres fibras similares a la CW/DVB. Estas fibras fueron: CW/DVB StableFlex, que no está soportada sobre sílice fundida lo que le da flexibidad, con espesor de película de 70μm, PA que ya se había probado y PEG que sustituyó a la fibra CW/DVB. En la Fig. 7 se observa la extracción de los analitos en las condiciones ya establecidas con la fibra CW/DVB. Al comparar la extracción de los analitos en estudio con las fibras CW/DVB y CW/DVB StableFlex se observó que aunque esta última tiene un mayor espesor de película la extracción no fue mayor que con CW/DVB. La extracción con la fibra de PA fue menor que con las otras tres fibras. La fibra PEG es una fibra más polar que la CW-DVB, por lo que la extracción fue mejor para todos los analitos. De acuerdo a estos resultados todos los análisis siguientes se realizaron con la fibra PEG bajo las condiciones ya establecidas.
LinealidadUna vez optimizada la MEFS se llevó a cabo la linealidad del método y se calcularon los límites de detección (LD) y cuantificación (LC). El ibuprofeno, naproxeno y bisfenol A tienen un coeficiente de correlación (r) > 0.99, mientras que para clorofeno y triclosán los coeficientes de correlación son mayores a > 0.94 (Tabla II). Con lo cual se establece que el método desarrollado es lineal en el intervalo de concentraciones estudiado.
PrecisiónSe calculó la precisión del método como coeficiente de variación (C.V.). Los PPCP's presentan los coeficientes de variación < 10% con n=3. Estos valores son aceptables en un análisis por MEFS (Tabla IV).
Análisis de PPCP's por MEFS-CG-EM en muestras de aguas residualesAnálisis cualitativoSe realizó el análisis por MEFS-CG-EM de una disolución estándar de ibuprofeno 9.8 ng/mL, clorofeno 22.8 ng/mL, naproxeno 40 ng/mL, triclosán 42 ng/mL bisfenol A 84 ng/mL, observándose que todos los picos presentaron buena resolución y eficiencia. Por lo que se aplicó esta metodología a una muestra de agua residual tomada de la PTAR de Ciudad Universitaria el 5 de agosto del 2008, observándose picos cromatográficos enormes de ácidos grasos, mientras que los picos correspondientes a los PPCP's eran casi inapreciables, sin embargo, su resolución era buena, por lo que se decidió realizar la detección en modo SIM, con lo cual se incrementa la selectividad y la sensibilidad. Es lógico que los compuestos mayoritarios en la muestra sean ácidos grasos debido al alto contenido de materia orgánica que tienen las aguas residuales. Entre los compuestos mayoritarios presentes en el agua residual se identificaron (base de datos de la Biblioteca del NIST) los ésteres de ácidos: butanoico, octanoico, nonanoico, decanoico, dodecanoico, tetradecanoico, hexadecanoico y octadecanoico.
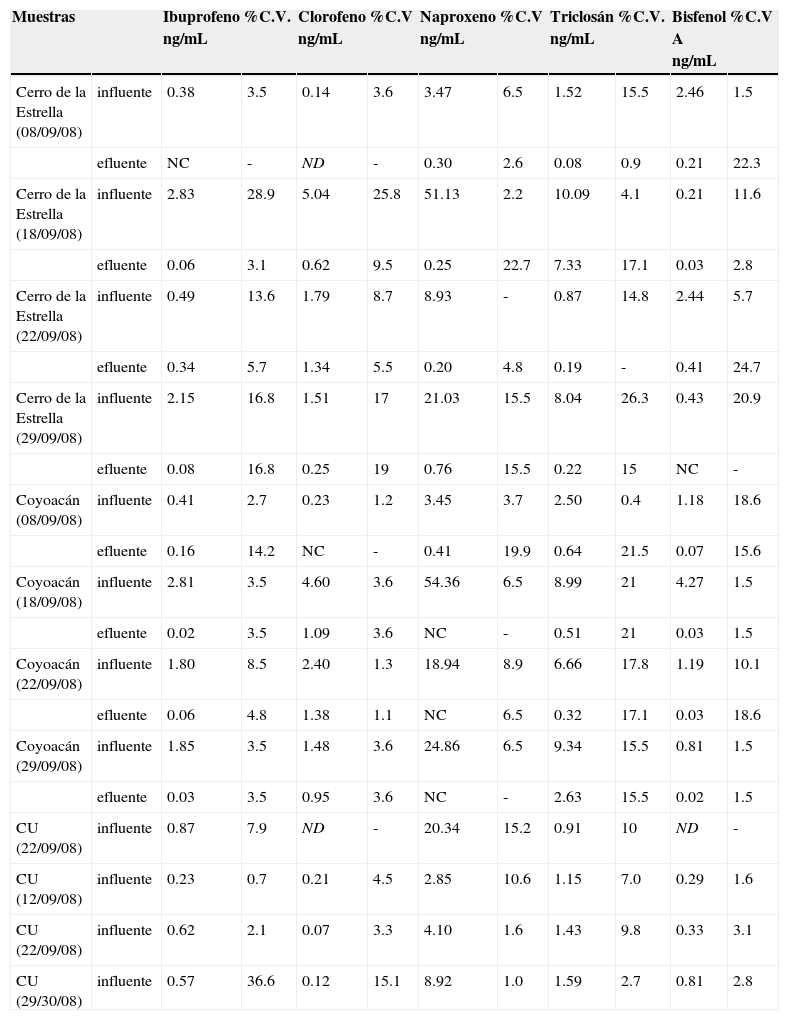
En las muestras analizadas se identificaron todos los analitos en estudio, en influentes y en efluentes. Sin embargo, en la muestra del influente de la PTAR de CU del 22 de septiembre del 2008 no se identificó el clorofeno y bisfenol A (Tabla V). Se identificó el naproxeno en mayor concentración en todas las muestras, este analito es un antiinflamatorio no esteroideo, el cual es utilizado para aliviar el dolor, la fiebre y la inflamación, el 95% de la dosis consumida de este medicamento es excretada en la orina como naproxeno o alguno de sus metabolitos7,8. Para el caso de los efluentes las concentraciones de los analitos disminuyeron considerablemente (Tabla V).
Cuantificación de PPCP's en influentes y efluentes
| Muestras | Ibuprofeno ng/mL | %C.V. | Clorofeno ng/mL | %C.V | Naproxeno ng/mL | %C.V | Triclosán ng/mL | %C.V. | Bisfenol A ng/mL | %C.V | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Cerro de la Estrella (08/09/08) | influente | 0.38 | 3.5 | 0.14 | 3.6 | 3.47 | 6.5 | 1.52 | 15.5 | 2.46 | 1.5 |
| efluente | NC | - | ND | - | 0.30 | 2.6 | 0.08 | 0.9 | 0.21 | 22.3 | |
| Cerro de la Estrella (18/09/08) | influente | 2.83 | 28.9 | 5.04 | 25.8 | 51.13 | 2.2 | 10.09 | 4.1 | 0.21 | 11.6 |
| efluente | 0.06 | 3.1 | 0.62 | 9.5 | 0.25 | 22.7 | 7.33 | 17.1 | 0.03 | 2.8 | |
| Cerro de la Estrella (22/09/08) | influente | 0.49 | 13.6 | 1.79 | 8.7 | 8.93 | - | 0.87 | 14.8 | 2.44 | 5.7 |
| efluente | 0.34 | 5.7 | 1.34 | 5.5 | 0.20 | 4.8 | 0.19 | - | 0.41 | 24.7 | |
| Cerro de la Estrella (29/09/08) | influente | 2.15 | 16.8 | 1.51 | 17 | 21.03 | 15.5 | 8.04 | 26.3 | 0.43 | 20.9 |
| efluente | 0.08 | 16.8 | 0.25 | 19 | 0.76 | 15.5 | 0.22 | 15 | NC | - | |
| Coyoacán (08/09/08) | influente | 0.41 | 2.7 | 0.23 | 1.2 | 3.45 | 3.7 | 2.50 | 0.4 | 1.18 | 18.6 |
| efluente | 0.16 | 14.2 | NC | - | 0.41 | 19.9 | 0.64 | 21.5 | 0.07 | 15.6 | |
| Coyoacán (18/09/08) | influente | 2.81 | 3.5 | 4.60 | 3.6 | 54.36 | 6.5 | 8.99 | 21 | 4.27 | 1.5 |
| efluente | 0.02 | 3.5 | 1.09 | 3.6 | NC | - | 0.51 | 21 | 0.03 | 1.5 | |
| Coyoacán (22/09/08) | influente | 1.80 | 8.5 | 2.40 | 1.3 | 18.94 | 8.9 | 6.66 | 17.8 | 1.19 | 10.1 |
| efluente | 0.06 | 4.8 | 1.38 | 1.1 | NC | 6.5 | 0.32 | 17.1 | 0.03 | 18.6 | |
| Coyoacán (29/09/08) | influente | 1.85 | 3.5 | 1.48 | 3.6 | 24.86 | 6.5 | 9.34 | 15.5 | 0.81 | 1.5 |
| efluente | 0.03 | 3.5 | 0.95 | 3.6 | NC | - | 2.63 | 15.5 | 0.02 | 1.5 | |
| CU (22/09/08) | influente | 0.87 | 7.9 | ND | - | 20.34 | 15.2 | 0.91 | 10 | ND | - |
| CU (12/09/08) | influente | 0.23 | 0.7 | 0.21 | 4.5 | 2.85 | 10.6 | 1.15 | 7.0 | 0.29 | 1.6 |
| CU (22/09/08) | influente | 0.62 | 2.1 | 0.07 | 3.3 | 4.10 | 1.6 | 1.43 | 9.8 | 0.33 | 3.1 |
| CU (29/30/08) | influente | 0.57 | 36.6 | 0.12 | 15.1 | 8.92 | 1.0 | 1.59 | 2.7 | 0.81 | 2.8 |
ND - no detectado
NC - no cuantificado
Los resultados del análisis de los influentes (Tabla V) muestran que el intervalo de concentración de PPCP's es muy amplio, debido a que el agua tratada contiene diferente cantidad de materia orgánica, por ejemplo para el ibuprofeno su concentración en los influentes varía desde 0.2 a 2.8 ng/mL, presentando mayor concentración de ibuprofeno en las muestras de la tercera semana del mes de septiembre (18 de septiembre del 2008) en la planta del Cerro de la Estrella, estas aguas son aguas municipales de la parte sur-oriente de la Ciudad de México. El caso del clorofeno, es similar pues la mayor concentración se presenta en la misma muestra, su concentración varía de 0.07 a 5 ng/mL. El naproxeno es el analito que se cuantificó en mayor concentración en las 3 plantas de tratamiento, en los influentes su concentración varía entre 2.8 a 54 ng/mL.
En el caso del triclosán se esperaba que este analito estuviese presente en mayor concentración, ya que se encuentra en una amplia gama de productos para el cuidado personal, como pastas dentales, talcos, jabones, desodorantes, etc. Sin embargo, hay que considerar que el triclosán puede ser degradado por microorganismos o reaccionar con la luz solar dando lugar a compuestos entre los cuales se encuentran clorofenoles y dioxinas. En los influentes su concentración está entre 0.87 a 10 ng/mL.
Canosa, P. y colaboradores3 determinan la concentración de triclosán y algunos de sus posibles metabolitos por MEFS-CG-EM en una planta de tratamiento de agua en España, reportando el triclosán en el influente en concentraciones entre 242 a 966 ng/L, mientras que para el efluente entre 209 a 321 ng/L.3 Comparando los correspondientes influentes y efluentes determinan una remoción del triclosán en 95%. Hablar de que la remoción de este compuesto en las plantas de tratamiento se da únicamente dentro del sistema de digestión por los microorganismos no sería del todo válido.
Para el bisfenol A, la mayor concentración se presenta en las muestras analizadas en la tercera semana del mes de septiembre (18 de septiembre del 2008) en la planta de Coyoacán, la concentración varía entre 0.20 a 4 ng/mL.
La concentración de PPCP's de los efluentes de las muestras analizadas (Tabla V) en general disminuyeron probablemente debido a que el agua es sometida a tratamiento biológico. Para ibuprofeno la concentración varía de 0.06 a 0.34 ng/mL, clorofeno de 0.2 a 1.4 ng/mL, triclosán de 0.08 a 0.3 ng/mL, bisfenol A de 0.02 a 0.4 ng/mL y naproxeno disminuyó de manera significativa variando de 0.10 hasta 0.80 ng/mL.
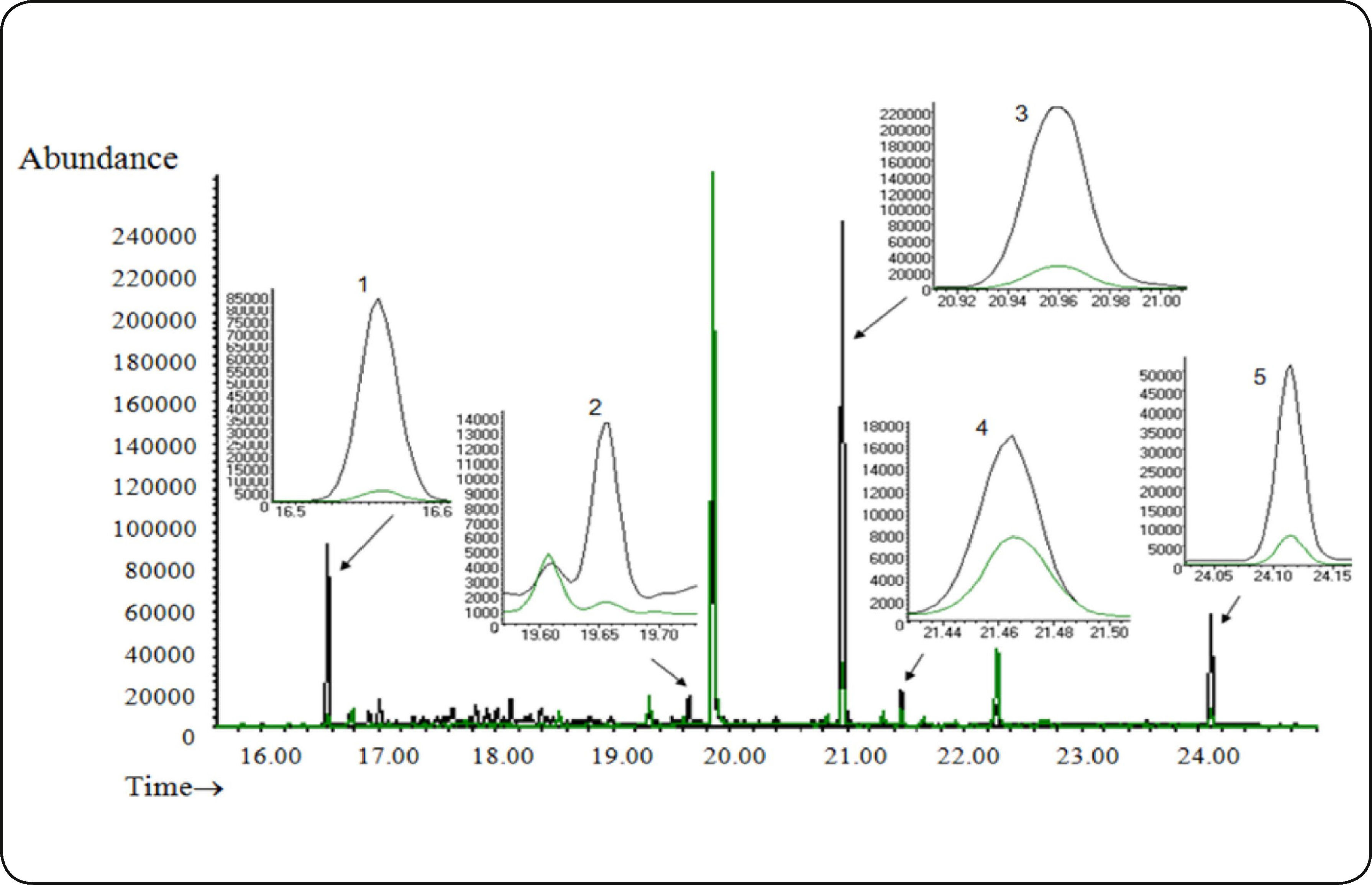
La Fig. 8 muestra el cromatograma del análisis de los PPCP's en influentes (negro) y efluentes (verde) de una muestra de agua residual de la planta de tratamiento Cerro de la Estrella (18 de septiembre del 2008). La concentración calculada de cada analito se muestra en la Tabla V. El nivel de ibuprofeno presente en el agua residual, puede corresponder a que el ibuprofeno es utilizado como un analgésico y antiinflamatorio no esteroideo para el dolor y algunos experimentos indican que después de 2 horas de haber ingerido 200mg que es la dosis recomendada para dolor de cabeza, se excretan por orina 80 ng/mL.8 Rodríguez, I. y colaboradores2 han reportado la presencia de ibuprofeno y naproxeno en una planta de tratamiento de agua en España, obteniendo concentraciones para el ibuprofeno en influentes de 2.74 ng/mL y en efluentes de 0.55 ng/mL, mientras que el naproxeno en influentes se encontró en 2.39 ng/mL y en efluentes en 0.21 ng/mL. Por otro lado Moeder, M. y colaboradores9 encontraron la presencia de ibuprofeno en el río cercano a Leipzig, Alemania en concentraciones entre 200 a 400 ng/L. Al igual que en el trabajo de Rodríguez, I2., en el presente trabajo, se cuantifican los fármacos antiinflamatorios en concentraciones de ppb en las tres plantas de tratamiento de la Ciudad de México estudiadas.
Análisis por MEFS-CG-EM en modo SIM de una muestra del influente y del efluente de la Planta de Tratamiento de Aguas Residuales Cerro de la Estrella (1) ibuprofeno t-BDMS derivado, (2) clorofeno t-BDMS derivado, (3) naproxeno t-BDMS derivado, (4) triclosán t-BDMS derivado, (5) bisfenol A bist-BDMS derivado.
Se desarrolló un método por MEFS-CG-EM, para la identificación y cuantificación simultánea de cinco PPCP's; triclosán, clorofeno, bisfenol A, naproxeno e ibuprofeno en agua residual. El método es libre de disolventes, sencillo, rápido y aplicable para el análisis de PPCP's en muestras de aguas residuales utilizando la fibra PEG y controlando los parámetros de pH, fuerza iónica, tiempo y temperatura de extracción, así como el tiempo de silanización.
El método presentó buena linealidad con coeficientes de correlación mayores a 0.99 para ibuprofeno, naproxeno y bisfenol A y con r > 0.94 para clorofeno y triclosán. La precisión del método fue aceptable obteniéndose coeficientes de variación en el rango de 6.2% a 9.4% para los cinco PPCP's. Los límites de cuantificación del método desarrollado se encuentran en niveles de ng/L.
El método se aplicó al análisis de las muestras para identificar y cuantificar ibuprofeno, clorofeno, naproxeno, triclosán y bisfenol A en aguas residuales proveniente de 3 plantas de tratamiento de aguas residuales de la Ciudad de México: Ciudad Universitaria, Coyoacán y Cerro de la Estrella. Los PPCP's se identificaron en todos los influentes analizados encontrándose en niveles de μg/L, mientras que en los efluentes las concentraciones de los PPCP's disminuyen considerablemente al grado de no poder ser cuantificados en algunas muestras.
Se agradece el apoyo otorgado para el desarrollo del proyecto DGAPA/PAPIIT Claves: IN219010 e IN216114-2.