Un grupo de proteínas de almacenamiento muy abundantes en la semilla de cereales son las prolaminas que se caracterizan por contener muchos residuos de prolina en su secuencia. En cebada, las prolaminas son denominadas hordeínas. El propósito de este estudio fue obtener los patrones proteicos de bandeo mediante la técnica de electroforesis en gel de poliacrilamida bajo condiciones desnaturalizantes para, hordeínas de semilla seca de cinco variedades mexicanas de cebada. Asimismo, se obtuvieron los patrones de hordeínas en malta procesada a partir de cuatro variedades mexicanas y una variedad canadiense (Metcalfe). A continuación, algunas de las bandas diferenciales fueron identificadas mediante espectrometría de masas (EM) utilizando distintos protocolos de digestión. En los patrones de semilla seca se encontraron diferencias entre las variedades mexicanas para las bandas correspondientes a un peso molecular de 100 kDa, 65 kDa y algunas de 37-45 kDa. En el caso de la malta, los patrones de las variedades mexicanas fueron muy contrastantes entre sí, así como con el observado en Metcalfe, lo que sugiere que el procesamiento de hordeínas durante la germinación y el secado de la malta depende de cada variedad. Finalmente, en la identificación por EM se demostró que el uso de digestión con tripsina es adecuado para distinguir hordeínas B y γ en malta, mientras que el uso de digestión secuencial con quimotripsina y tripsina favorece la identificación de hordeínas C en semilla seca.
A group of storage proteins highly abundant in cereal seeds are the prolamins, characterized by the frequent presence of proline in their sequence. The barley prolamins are known as hordeins. The aim of this study was to obtain the hordein banding patterns for five different Mexican barley cultivars in mature seeds. In addition, the hordein patterns in processed malt of four mexican and a canadian (Metcalfe) barley cultivars were obtained. Mass Spectrometry (MS), using distinct digestion protocols, identified differential bands in the patterns. Major differences in the seed patterns between cultivars consisted in discrete bands at 100 kDa, 65 kDa and in the range of 37 to 45 kDa. In malt, the patterns were highly contrasting among Mexican cultivars as well as in Metcalfe, suggesting that hordein processing during germination and malt processing is particular to each cultivar. Finally, the MS identification demonstrated that trypsin digestion is appropriate to distinguish B and γ hordeins in malt, whereas sequential digestion with chymotrypsin and trypsin allows the identification of C hordeins in seed.
La cebada (Hordeum vulgare) es una planta de la familia de los pastos que se encuentra en quinto lugar en la producción mundial de granos. Tiene dos usos principales: como alimento y para la producción de malta y cerveza1. La malta es el grano de cebada germinado y posteriormente secado en condiciones controladas. La composición del grano de cebada maduro y de la malta son determinantes para la calidad de la cerveza. Entre los componentes relevantes se encuentran las proteínas y entre ellas un grupo especial que son las prolaminas, proteínas de almacenaje, que en cebada son llamadas hordeínas. Las hordeínas presentan un alto grado de polimorfismo, y su acumulación y estabilidad en el grano se han relacionado frecuentemente con la calidad de la malta y cerveza2,3. Es por ello que la caracterización de sus patrones en diversas variedades es parte crucial para el mejoramiento genético de la cebada.
Variedades de cebada en MéxicoLa cebada es una planta anual con distintas variedades, entre las que destacan aquéllas cuyas espigas presentan un ordenamiento de los granos en dos o seis hileras4. Cada variedad de cebada tiene diferencias en la composición de su semilla (entre otras características que en este trabajo no se abordan), y es de acuerdo a esto, que cada una tiene distinta calidad para su propósito final. Por ejemplo, la cebada sin cáscara requiere poco o casi ningún esfuerzo para su remoción durante el procesamiento del grano y por lo tanto, estas variedades son las más adecuadas para el consumo humano en forma de alimento. En contraste, la cebada con cáscara es preferida para la producción de cerveza debido a que este tejido contribuye al sabor y ayuda en las filtraciones respectivas. No obstante, es difícil distinguir el grano de cebada adecuado para cada uso, ya que existen pocos criterios que permiten diferenciar entre variedades1.
Algunas variedades tienen un alto rendimiento en grano y producen semillas ricas en proteínas. Contrariamente, otras variedades tienen poca producción de granos, pero sus cualidades se adaptan bien a los procesos de malteo. Entre estas últimas, destaca la variedad Metcalfe de dos hileras (denominada HV2008-08, o simplemente 08 en este trabajo) por su desempeño durante el malteo, siendo una de las variedades preferidas para este fin5. En este estudio se utilizaron cinco variedades de cebada de seis hileras cultivadas en México: HV2005-04, HV2005-19, HV2007-23, HV2007-18, HV2008-11, denominadas en adelante como 04, 19, 23, 18 y 11, respectivamente. Las variedades 19, 23 y 18 se cultivan en la región del Bajío (Guanajuato, Querétaro, Michoacán y Jalisco) en condiciones de riego y las variedades 04 y 11 en el Altiplano (Hidalgo, Puebla Tlaxcala y Estado de México) en condiciones de temporal6. Estas variedades tienen diferentes propiedades, entre ellas su composición de proteínas.
Las hordeínasExiste una gran familia de proteínas de almacenamiento en semillas de cereales llamadas prolaminas que constituyen una reserva de aminoácidos presentes en la semilla para ser utilizados durante el desarrollo embrionario de la planta. En el caso de las semillas de cebada, las prolaminas se denominan hordeínas, las cuales son almacenadas en forma de cuerpos proteicos en el endospermo y presentan polimorfismos entre los genotipos de la especie. La alta variabilidad se debe a que las prolaminas surgen de familias multigénicas y en algunos casos, por el procesamiento proteolítico y glicosilación2. Las hordeínas tienen un tamaño que va desde 30 hasta 100 kDa aproximadamente y se clasifican en tres grupos: 1) ricas en azufre (hordeínas B y γ), 2) pobres en azufre (hordeínas C) y 3) de alto peso molecular (hordeínas D). Una característica común a los tres grupos es su solubilidad en mezclas de alcohol/agua, pero varían considerablemente en otras propiedades como el peso molecular, punto isoeléctrico y composición de aminoácidos7. Por su gran variación genotípica han sido utilizadas como marcadores genéticos2.
Las hordeínas D tienen un tamaño aproximado de 100 kDa y representan menos del 10% del contenido total de la semilla. Las hordeínas C tienen un tamaño de 55-70 kDa, no contienen residuos de cisteína, por lo que no tienden a formar complejos con otras proteínas y su abundancia es del 10-20%. Las hordeínas B tienen un tamaño de 36-44 kDa, son ricas en residuos de cisteína, por lo tanto pueden formar puentes disulfuro intra o intercatenarios y son las más abundantes (75-80%)7. Las hordeínas γ son de tamaño similar a las B y contienen residuos de cisteína pero son menos abundantes que éstas. Las hordeínas γ1 y γ2 pueden formar puentes disulfuro intra o intercatenarios y se asocian con las B en los cuerpos proteicos. La hordeína γ3 solamente forma puentes disulfuro intracatenarios y es requerida para el transporte de las demás hordeínas a la vacuola8.
Las variedades mexicanas de cebada maltera presentan diferentes características para la producción y calidad de la malta. Aunque existen datos agronómicos y fenotípicos a nivel de planta y semilla para estas variedades, no hay datos sobre los polimorfismos a nivel de hordeínas. En este trabajo se propuso investigar la composición de hordeínas y su posible utilización como marcadores moleculares en semillas y malta de cebada de diferentes variedades mexicanas.
Materiales y MétodosMaterial vegetalPara la comparación de patrones de hordeínas en semilla seca se utilizaron cinco variedades mexicanas de cebada maltera. Para la comparación de patrones de hordeínas en malta, se utilizaron cuatro de las cinco variedades mexicanas y la variedad canadiense Metcalfe cuya malta es utilizada ampliamente en la obtención de cerveza a nivel mundial.
Extracción de hordeínasLas hordeínas fueron extraídas utilizando un protocolo disponible para prolaminas de maíz con ciertas modificaciones9. En el protocolo modificado, las muestras de semillas o malta fueron molidas con nitrógeno líquido en un mortero. Se pesaron 50mg de la harina obtenida a partir de esta molienda en una balanza analítica y se colocaron en un tubo de plástico (Eppendorf) con capacidad de 2.0mL. Posteriormente se agregó a cada muestra 1.6mL de amortiguador de extracción, el cual contenía 12.5mM de borato de sodio, 1% de dodecil sulfato de sodio y 2% de β-mercaptoetanol a pH 10, y se incubaron los tubos con agitación a 120rpm a temperatura ambiente (TA) durante 5 horas. Transcurrido este tiempo, las muestras fueron centrifugadas a 11,000rpm durante 15 minutos. Se tomó el sobrenadante y se agregó etanol de la siguiente forma: por cada 500μL de sobrenadante, se adicionaron 1.2mL de etanol absoluto para alcanzar una concentración final de etanol equivalente al 70%. Las muestras se incubaron con agitación durante 1 hora a TA y se centrifugaron a 11,000rpm por 15 minutos. Finalmente el sobrenadante que contenía las hordeínas se almacenó a -20°C para su posterior análisis.
Preparación de la muestra para electroforesis y análisis de patrones de hordeínas por SDS-PAGESe tomó una alícuota de 300μL de la fracción con hordeínas y se secó mediante evaporación utilizando un concentrador al vacío (Centrivap Concentrator de Labconco Corporation®, Kansas USA). Posteriormente el botón se resuspendió en 50μL de amortiguador de carga para electroforesis desnaturalizante SDS-PAGE, 1X.
Se prepararon por triplicado los geles de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE) al 12.5%, para obtener los patrones de hordeínas correspondientes a la semilla seca o malta10. Los geles se tiñeron con Coomassie Coloidal G-250 al 0.02%11.
Para cada uno de los triplicados de semilla seca, las bandas seleccionadas de hordeínas D, C y B o γ se cuantificaron por densitometría en un equipo Chemidoc MP System con el software Image Lab (Bio-Rad, México, D.F.). Se obtuvieron los valores de intensidad total de cada carril y de las bandas seleccionadas en unidades arbitrarias. La intensidad de cada banda fue normalizada por la intensidad total del carril correspondiente para calcular las veces de cambio respecto al valor de la variedad 04 (asignándose un valor igual a uno en este caso). Con estos datos se realizó un Análisis de Varianza (ANOVA) y t de Student para determinar si las diferencias entre variedades son significativas.
Identificación por espectrometría de masasSe seleccionaron algunas bandas diferenciales entre variedades para su identificación por espectrometría de masas. El tratamiento de muestra previo a la identificación fue realizado acorde al protocolo desarrollado en la Unidad de Servicios de Apoyo a la Investigación y la Industria (USAII) de la Facultad de Química en la UNAM. Brevemente, las bandas de gel fueron cortadas en fragmentos pequeños y se destiñeron con 50% de metanol (v/v), 5% de ácido acético (v/v) por 12 horas. Posteriormente se lavaron con agua destilada y se incubaron por 15 minutos dos veces en 100mM de bicarbonato de amonio. Se redujeron en 50mM DTT durante 45 minutos y se alquilaron con iodoacetamida 30mM durante 2 horas. Posteriormente se lavaron 3 veces con 100mM de bicarbonato de amonio. Se deshidrataron completamente con 100% de acetonitrilo y se llevaron a sequedad total. La digestión en gel fue llevada a cabo con 30μL de tripsina de porcino modificada (Sigma-Aldrich Química S. de R.L. de C.V., Toluca, México) de una solución que contenía 20 ng/μL y se incubaron por 18 horas a 37°C. En los protocolos modificados, se utilizó la mezcla Trypsin-LysC de Promega (Promega Corporation, USA) siguiendo el mismo procedimiento, mientras que la digestión secuencial con quimotripsina y tripsina se realizó acorde a Colgrave y colaboradores3.
Los péptidos se extrajeron con 50% de acetonitrilo (v/v) y 5% de ácido fórmico (v/v) en sonicación y se llevaron a sequedad total. Posteriormente, se resuspendieron en 20μL de ácido fórmico al 1% (v/v), se desalaron en columnas Ziptip C18 y se eluyeron en 12μL de fase móvil (97% agua, 3% acetonitrilo y 0.1% de ácido fórmico).
El análisis de péptidos por espectrometría de masas se llevó a cabo utilizando un sistema nano-LC-ESI-MS/MS integrado SYNAPT G2 de alta definición (Waters Corporation, UK) equipado con una fuente de iones NanoLockSpray y acoplado en línea a un cromatógrafo líquido nanoACQUITY Ultra Performance (UPLC; Waters Corporation). El sistema de disolventes binario fue acetonitrilo 2% en agua MilliQ con ácido fórmico al 0.1% (fase móvil A) y 98% de acetonitrilo en agua MilliQ con ácido fórmico al 0.1% (fase móvil B). La muestra se inyectó en una columna de trampa C18 UPLC de 5μm, 180μmx, 20mm (Waters Corporation) y se lavó con 100% de fase móvil A, a una velocidad de flujo de 15μL/min. Los péptidos se separaron en una columna BEH, C18 UPLC de 1.7μm, 75μmx y 100mm (Waters Corporation) utilizando un gradiente lineal hasta el 40% de fase móvil B con una velocidad de flujo de 0.3μL/min.
Se realizaron búsquedas en la base de datos UNIPROT utilizando tripsina como proteasa específica, o en el caso de la digestión secuencial, quimotripsina y tripsina. Los péptidos coincidentes con las puntuaciones de PLGS > 95% de confianza fueron aceptados como correctos. El umbral de puntuación en las condiciones anteriores fue de 52 para p < 0.05.
ResultadosPatrones de hordeínas en semilla secaLas hordeínas se obtuvieron de semillas correspondientes a plantas crecidas en condiciones de campo y colectadas en la misma época del año. Como se describe en Métodos, para el análisis por triplicado en geles se utilizó la misma cantidad de extracto etanólico de hordeínas. Dado que el método de extracción requiere secar totalmente las hordeínas a partir de los extractos etanólicos y resuspender inmediatamente en amortiguador de carga para el gel, no se determinó la cantidad de proteínas previo a la separación por SDS-PAGE. En cambio, los carriles correspondientes a cada variedad fueron registrados en un Fotodocumentador Chemidoc MP System (Bio-Rad, México, D.F.) y analizados con el software Image Lab. La densitometría correspondiente a todo el carril fue utilizada en la normalización por carga.
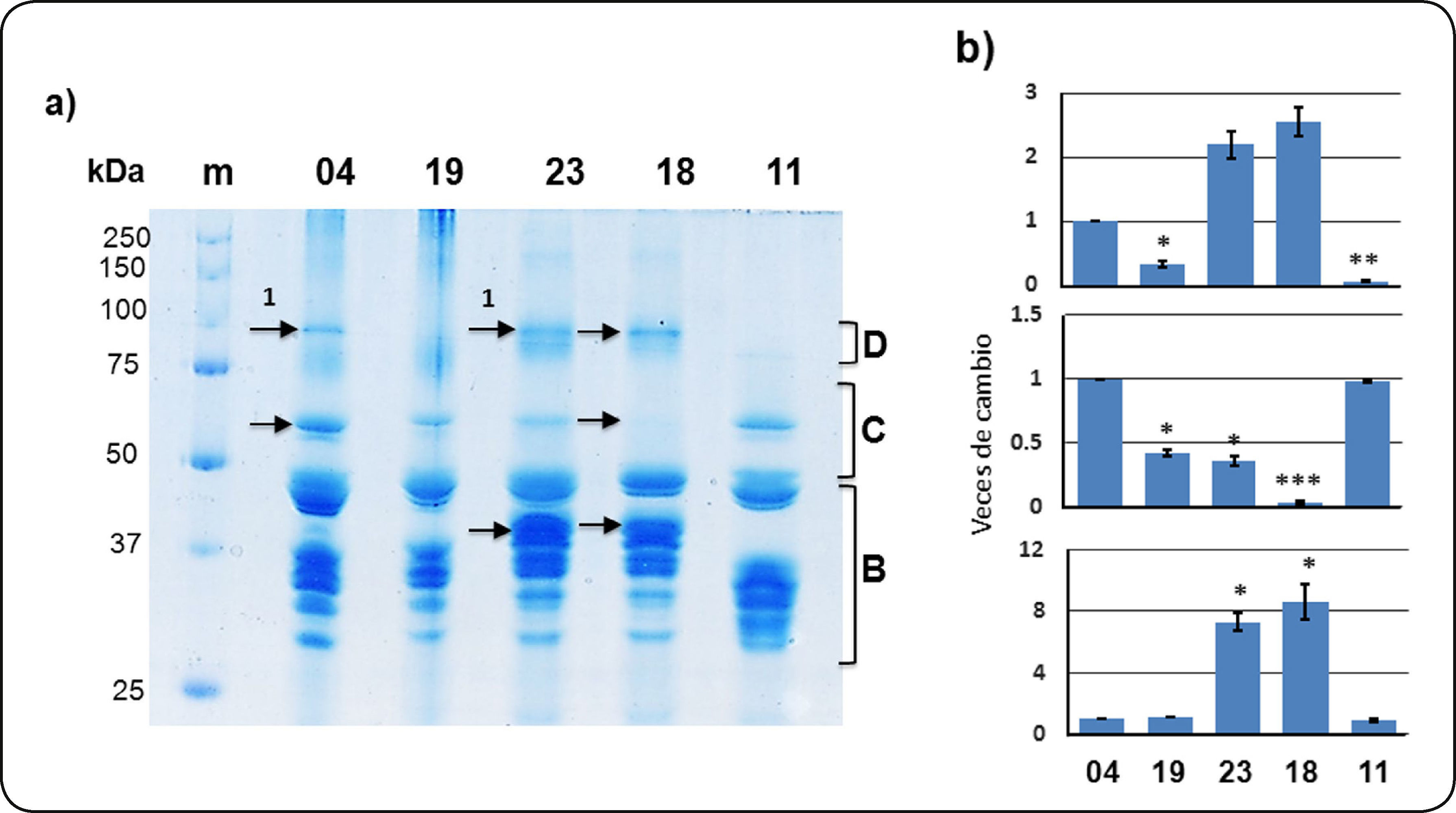
En la Figura 1 se muestran los patrones característicos de semilla seca para las cinco variedades mexicanas de cebada maltera. Las hordeínas se separaron en grupos de distinto peso molecular que son similares a los reportados en la literatura7. Los patrones fueron diferentes entre variedades; algunas de las diferencias estadísticamente significativas se señalan con flechas y se muestra el análisis de densitometría a la derecha. En el intervalo correspondiente a las hordeínas C, se detecta una banda de 65 kDa con niveles mayores en 04 y 11, menores en 19 y 23, y prácticamente ausente para la variedad 18. Las hordeínas del grupo B fueron las más abundantes en todas las variedades y en el intervalo de tamaño de 37-45 kDa se observaron algunas bandas características sólo para las variedades 23 y 18. La presencia de hordeínas D, de mayor peso molecular (100 kDa), fue notoria para las variedades 04, 23 y 18 pero fue significativamente menor en las variedades 19 y 11.
Patrón de hordeínas en semilla seca de cinco variedades mexicanas de cebada maltera (04, 19, 23, 18, 11). a) Separación de proteínas mediante gel desnaturalizante de poliacrilamida al 12%. m: Marcador de peso molecular. Se muestra el intervalo de tamaño de cada grupo de hordeínas, incluyendo a las hordeínas γ dentro del asignado para hordeínas B. Las flechas indican las diferencias más notables y las bandas identificadas por EM se señalan con una clave numérica asignada. La clave de las bandas se compone por el origen de la muestra: S (semilla seca), la variedad y el número sobre la flecha asignada a la banda. b) Análisis densitométrico de las bandas señaladas con flechas para los intervalos de hordeínas D, C, B o γ (en sentido descendente respectivamente). Se grafican las veces de cambio de cada banda respecto a 04. El análisis estadístico de geles por triplicado indica cambios significativos en la intensidad (* P<0.05, ** P<0.01, *** P<0.001) respecto a la variedad 04.
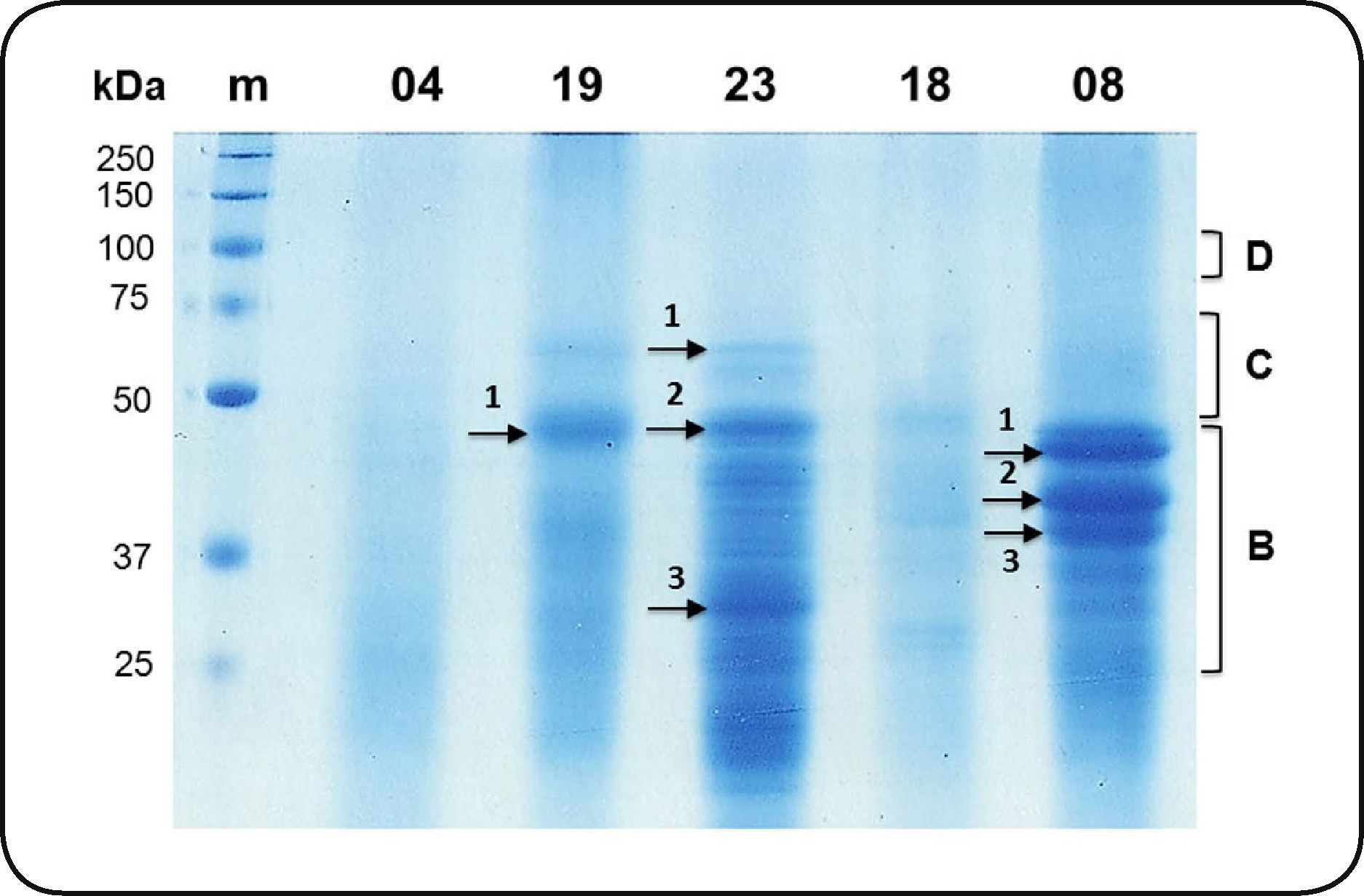
Para el análisis de malta se siguió el mismo protocolo que en semilla seca. Sin embargo, es importante mencionar que mientras que la cantidad de proteína en el extracto etanólico de semilla seca fue similar entre variedades, en el caso de la malta hubo diferencias notables (Figura 2). Por ejemplo, la malta de la variedad 04 prácticamente no tiene prolaminas íntegras, similar a 18, que presenta sólo algunas bandas muy tenues de 50, 40 y 30 kDa. En cambio, la variedad 19 muestra dos bandas mayoritarias de aproximadamente 60 y 50 kDa. De las variedades mexicanas, la 23 es la que presenta un mayor número de bandas implicando que probablemente para esta variedad se mantiene una mayor cantidad de hordeínas después del malteo. Es interesante señalar que el patrón de hordeínas en malta de la variedad canadiense Metcalfe (carril 08) presenta tres bandas intensas en un tamaño de 37-50 kDa que no se observan en los patrones de la malta de cebada mexicana. En ninguna de las maltas se detectaron hordeínas correspondiente al peso molecular del grupo D, y la banda de mayor tamaño fue de aproximadamente 60 kDa. Sin embargo, en la malta es imposible predecir mediante los patrones de gel el grupo de hordeínas al que pertenece cada banda, ya que ha tenido lugar una degradación, al menos parcial, de las proteínas de reserva y además estas proteínas tienden a formar asociaciones en cúmulos que aun en condiciones de electroforesis desnaturalizante son difíciles de deshacer.
Patrón de hordeínas en malta de cuatro variedades mexicanas de cebada maltera (04, 19, 23, 18) y una variedad canadiense (08). Las flechas indican las diferencias más notables y las bandas identificadas por EM se señalan con una clave numérica asignada. m: Marcador de peso molecular. La clave de las bandas se compone por el origen de la muestra: M (malta), la variedad y el número sobre la flecha asignada a la banda. El intervalo de tamaño señalado para cada grupo de hordeínas es el mismo que el mostrado en la Figura 1.
Al comprobar la reproducibilidad de los patrones de hordeínas por lotes analizados, se procedió con la identificación de proteínas en algunas de las bandas señaladas con flecha para semilla y malta (Figuras 1 y 2). Los criterios de selección de las bandas fueron los siguientes:
- 1.
Se seleccionó un mayor número de bandas en malta correspondientes a las variedades 23 y 08, debido a sus patrones contrastantes.
- 2.
En el caso de semilla seca se identificó la banda de aproximadamente 100 kDa en dos variedades para determinar si había diferencias cualitativas en su composición (23 y 04).
- 3.
Asimismo, para la malta de la variedad 19 se eligió la banda de aproximadamente 45 kDa porque por su abundancia parecía ser la única resistente a una degradación en la malta de esta variedad.
Además, las bandas se nombraron con una clave que contiene una letra (M o S, malta o semilla), la variedad y un número para distinguir bandas de una misma variedad que se muestra en cada uno de los patrones (Figuras 1 y 2). Por ejemplo, la muestra M08-2 se refiere a la banda número 2 de la variedad 08 de malta.
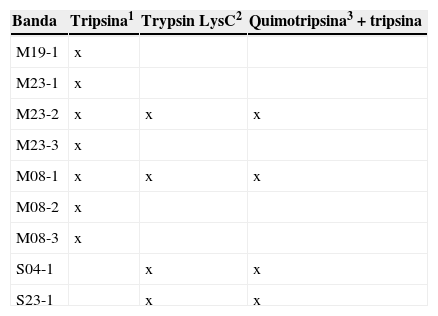
Se ha reportado en diversos estudios que las prolaminas pueden presentar problemas de identificación por la dificultad de ser digeridas por la tripsina, comúnmente utilizada en estudios de proteómica. Con el fin de evaluar con qué enzimas se mejoraba la identificación de las hordeínas por EM, se siguieron dos protocolos distintos además del estándar con tripsina (Tabla I). Uno de éstos fue realizado acorde a Colgrave y colaboradores3 quienes reportaron un protocolo de digestión secuencial utilizando tripsina y quimotripsina, que permitió la identificación por EM de proteínas distintas a las encontradas usando únicamente tripsina. Cabe mencionar que algunas de las muestras correspondientes a las bandas seleccionadas fueron tratadas por los tres protocolos (M23-2 y M08-1), mientras que otras se trataron con uno o dos de estos procedimientos (Tabla I).
Enzimas utilizadas en la preparación de la muestra para Espectrometría de Masas. La clave de las bandas se compone por el origen de la muestra: S (semilla seca); M (malta), la variedad y el número sobre la flecha señalados en las Figuras 1 y 2
| Banda | Tripsina1 | Trypsin LysC2 | Quimotripsina3 + tripsina |
|---|---|---|---|
| M19-1 | x | ||
| M23-1 | x | ||
| M23-2 | x | x | x |
| M23-3 | x | ||
| M08-1 | x | x | x |
| M08-2 | x | ||
| M08-3 | x | ||
| S04-1 | x | x | |
| S23-1 | x | x |
1Genera péptidos con arginina o lisina en C-terminal.
2Mezcla de tripsina y rLys-C, genera péptidos trípticos y es más eficiente el corte en residuos de lisina.
3Hidroliza el extremo C-terminal de aminoácidos aromáticos (Tyr, Phe y Trp) y en menor grado los residuos de Leu y Met.
En la Tabla II se observa que utilizando el protocolo de digestión únicamente con tripsina se identificaron principalmente las hordeínas B3 y γ1. Utilizando la mezcla Trypsin-LysC de Promega grado EM, se incrementó la eficiencia de corte en los sitios de lisina, por lo que se logró identificar además a la hordeína γ3. Finalmente, al realizar la digestión secuencial con quimotripsina y tripsina, se identificaron las hordeínas C aunque solamente en las bandas correspondientes a semilla (Tabla II). La hordeína B3 fue identificada en varias de las bandas analizadas, lo que corresponde a proteínas de diferente tamaño e incluye las bandas M23-1, S04-1 y S23-1 de tamaño mayor al esperado para este grupo de hordeínas (Figura 1). Por otro lado, en la banda M19-1 no se identificaron hordeínas, pero sí otro tipo de proteínas (datos no mostrados) importantes en el proceso de malteo. La diversidad de hordeínas identificadas fue mayor para las muestras de semilla madura (Tabla II).
Hordeínas identificadas con cada protocolo de digestión. La clave de las bandas se compone por el origen de la muestra: S (semilla seca); M (malta), la variedad y el número sobre la flecha señalados en las Figuras 1 y 2
| Muestra | Enzima | Resultado |
|---|---|---|
| M19-1 | Tripsina | ------ |
| M23-1 | Tripsina | Hordeína B3 |
| M23-2 | Tripsina | Hordeína B3 |
| Trypsin-LysC | ------ | |
| Quimotripsina + Tripsina | ------ | |
| M23-3 | Tripsina | Hordeína γ1 |
| M08-1 | Tripsina | Hordeína B3 |
| Trypsin-LysC | ------ | |
| Quimotripsina + Tripsina | ------ | |
| M08-2 | Tripsina | Hordeína B3 |
| Hordeína γ1 | ||
| M08-3 | Tripsina | Hordeína γ1 |
| S04-1 | Trypsin-LysC | Hordeína γ3 |
| Quimotripsina + Tripsina | Hordeína γ1 | |
| Hordeína γ3 | ||
| Hordeína C | ||
| S23-1 | Trypsin-LysC | Hordeína B3 |
| Hordeína γ1 | ||
| Quimotripsina + Tripsina | Hordeína C |
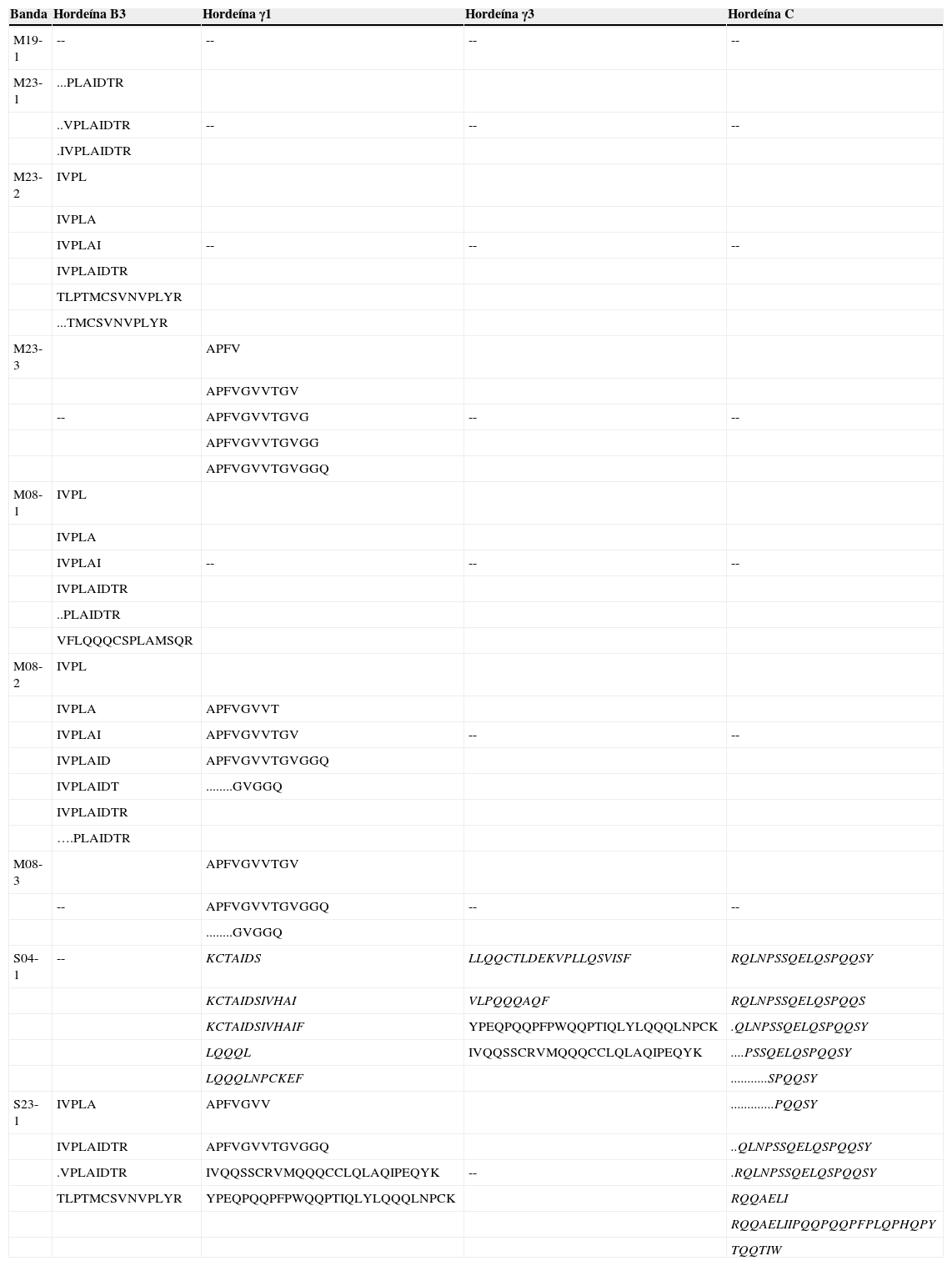
De manera interesante, los péptidos identificados en el análisis por espectrometría de masas indican distinto grado de degradación de las hordeínas en las muestras de malta (Tabla III). Por ejemplo, para la hordeína B3 se observa un gran número y diversidad de péptidos truncados en malta que no contienen lisina o arginina en el extremo C-terminal como cabría esperar de una digestión tríptica. En cambio, la mayoría de péptidos identificados en la semilla para esta hordeína sí contienen los aminoácidos esperados en el C-terminal. Lo mismo se puede observar para la hordeína γ1.
Péptidos identificados para cada hordeína por UPLC-MS. Letra redonda: Identificación con Tripsina. Negrita: Identificación con Trypsin-LysC. Cursiva: Identificación con Quimotripsina y Tripsina. La clave de las bandas se compone por el origen de la muestra: S (semilla seca); M (malta), la variedad y el número sobre la flecha señalados en las Figuras 1 y 2
| Banda | Hordeína B3 | Hordeína γ1 | Hordeína γ3 | Hordeína C |
|---|---|---|---|---|
| M19-1 | -- | -- | -- | -- |
| M23-1 | ...PLAIDTR | |||
| ..VPLAIDTR | -- | -- | -- | |
| .IVPLAIDTR | ||||
| M23-2 | IVPL | |||
| IVPLA | ||||
| IVPLAI | -- | -- | -- | |
| IVPLAIDTR | ||||
| TLPTMCSVNVPLYR | ||||
| ...TMCSVNVPLYR | ||||
| M23-3 | APFV | |||
| APFVGVVTGV | ||||
| -- | APFVGVVTGVG | -- | -- | |
| APFVGVVTGVGG | ||||
| APFVGVVTGVGGQ | ||||
| M08-1 | IVPL | |||
| IVPLA | ||||
| IVPLAI | -- | -- | -- | |
| IVPLAIDTR | ||||
| ..PLAIDTR | ||||
| VFLQQQCSPLAMSQR | ||||
| M08-2 | IVPL | |||
| IVPLA | APFVGVVT | |||
| IVPLAI | APFVGVVTGV | -- | -- | |
| IVPLAID | APFVGVVTGVGGQ | |||
| IVPLAIDT | ........GVGGQ | |||
| IVPLAIDTR | ||||
| ….PLAIDTR | ||||
| M08-3 | APFVGVVTGV | |||
| -- | APFVGVVTGVGGQ | -- | -- | |
| ........GVGGQ | ||||
| S04-1 | -- | KCTAIDS | LLQQCTLDEKVPLLQSVISF | RQLNPSSQELQSPQQSY |
| KCTAIDSIVHAI | VLPQQQAQF | RQLNPSSQELQSPQQS | ||
| KCTAIDSIVHAIF | YPEQPQQPFPWQQPTIQLYLQQQLNPCK | .QLNPSSQELQSPQQSY | ||
| LQQQL | IVQQSSCRVMQQQCCLQLAQIPEQYK | ....PSSQELQSPQQSY | ||
| LQQQLNPCKEF | ...........SPQQSY | |||
| S23-1 | IVPLA | APFVGVV | .............PQQSY | |
| IVPLAIDTR | APFVGVVTGVGGQ | ..QLNPSSQELQSPQQSY | ||
| .VPLAIDTR | IVQQSSCRVMQQQCCLQLAQIPEQYK | -- | .RQLNPSSQELQSPQQSY | |
| TLPTMCSVNVPLYR | YPEQPQQPFPWQQPTIQLYLQQQLNPCK | RQQAELI | ||
| RQQAELIIPQQPQQPFPLQPHQPY | ||||
| TQQTIW |
En este trabajo se realizó un primer acercamiento a la variabilidad en los patrones de hordeínas en variedades mexicanas de cebada maltera. Los patrones fueron obtenidos con un método que permite tener extractos ricos en hordeínas y se basa en las propiedades químicas de éstas: son insolubles en agua, pero altamente solubles en etanol al 70%. De hecho, las prolaminas fueron descubiertas gracias a esta característica7. Los patrones de semilla seca fueron reproduciblemente distintos entre las variedades analizadas, lo que apoya su utilidad como marcadores moleculares para análisis genéticos en la cebada mexicana y ofrece la posibilidad de correlacionar su presencia/ausencia con características de la malta obtenida a partir de las variedades cultivadas. Por ejemplo, las hordeínas cuya migración en el gel corresponde al grupo D se encuentra disminuída significativamente en las variedades 19 y 11, mientras que las hordeínas del grupo C muestran menor contenido en las variedades 19, 23 y 18. Por otra parte, sólo las variedades 23 y 18 presentaron una banda característica en el rango de hordeínas B o γ que se no se detectó en las demás variedades. Si aunado a estos datos se cuenta con conocimiento sobre algunas características fenotípicas deseables en cada una de las variedades es posible seguir a los marcadores propuestos en cruzas genéticas y análisis de características en la descendencia deseables para la semilla y malta obtenida a partir de ésta. En algunos estudios se ha reportado correlación entre bandas particulares de hordeínas en variedades de cebada brasileñas y la calidad de la malta obtenida de estas variedades12. Recientemente, en otro estudio de proteínas asociadas con la calidad de la malta, la hordeína γ3 fue identificada con mayores niveles en micromalteo, para una línea de cebada con mejores características en malta13. En el análisis de hordeínas de semilla seca no se contó con muestra de la variedad canadiense Metcalfe, por lo que en un futuro sería interesante comparar los patrones de las variedades mexicanas con el correspondiente a esta variedad.
Para determinar si la presencia/ausencia de bandas de hordeínas en los patrones de semillas maduras de las variedades de cebada analizadas es debida a polimorfismos genéticos, es necesario obtener los patrones a partir de plantas cultivadas en diferentes condiciones ambientales. Es conocido que los patrones de hordeínas se ven modificados por la disponibilidad de algunos nutrientes en el suelo, como es la fuente de nitrógeno y azufre. En este sentido, Rahman y colaboradores14 demuestran que la falta de azufre en cebada produce una disminución en la acumulación de las hordeínas B (ricas en azufre) con poco o ningún efecto en las hordeínas C (pobres en azufre). Además, Qi y colaboradores15 evaluaron el efecto de la disponibilidad de nitrógeno en la acumulación de los diferentes grupos de hordeínas y encontraron que los grupos B, C y D aumentan su acumulación con altas concentraciones de nitrógeno, siendo las C y D las que se modifican en mayor medida. Finalmente, también se conoce que la temporada de siembra influye en el contenido de proteína total y de hordeínas16.
En el análisis de patrones de hordeínas en malta seca, se observa un cambio importante respecto a los patrones en semilla seca, ya que ha ocurrido el proceso de germinación donde se produce la proteólisis de muchas proteínas almacenadas en la semilla. Además, la semilla germinada ha sido posteriormente secada en condiciones controladas4. En los patrones se advierte el grado de degradación que han sufrido las hordeínas durante la germinación, el cual es notoriamente diferente entre variedades. Estudios sobre la composición de hordeínas en malta y cerveza indican que varias de estas proteínas mantienen su presencia a lo largo de todo el proceso aunque el contenido global disminuye considerablemente3,17. Por ejemplo, se ha reportado que las hordeínas de tipo D y C son las que sufren mayor degradación17; por el contrario, las γ3 y B resisten el proceso y, en conjunto con otras proteínas no-prolaminas, tienen un papel importante en la generación de la turbidez en la cerveza18. Es por esto que las proteínas presentes en la malta (principalmente las hordeínas) tienen una influencia importante en las características de la cerveza, siendo necesaria una cantidad adecuada para estabilizar la espuma pero sin un exceso que podría generar turbidez o hacer más costoso el proceso.
En la malta es imposible predecir mediante los patrones de gel el grupo de hordeínas al que pertenece cada banda. Además, estas proteínas tienden a formar asociaciones en cúmulos, lo cual se favorece en el proceso de malteo por las condiciones de temperatura. Sin embargo, los patrones que se obtuvieron en este estudio permiten distinguir a la variedad 04 como la que presenta mayores niveles de degradación de hordeínas lo que coincide con un comportamiento más favorable de esta malta para el proceso de producción de cerveza.
El patrón de hordeínas en malta de Metcalfe es muy distinto al de las variedades mexicanas y sorpresivamente no se distingue por presentar la mayor degradación de estas proteínas. Considerando que Metcalfe produce una malta que se adapta muy bien a los procesos cerveceros, es posible que las proteínas contenidas en las bandas observadas sean indicativas de cúmulos de hordeínas que no afectan el proceso. De las variedades mexicanas, además de la malta correspondiente a 04, la variedad 18 también presentó un elevado grado de degradación de hordeínas. Esto puede deberse no sólo al tipo de hordeínas, sino también a la abundancia o actividad de proteasas e inhibidores de proteasas que degradan hordeínas19,20.
Dado que la presencia de hordeínas intactas o poco degradadas normalmente se ha correlacionado con problemas en la producción de cerveza, es importante conocer la identidad de las bandas con mayor intensidad en los patrones correspondientes a la malta. Es por ello que algunas fueron seleccionadas para identificar las hordeínas o fragmentos de las mismas que resisten la degradación durante el malteo y su posible influencia sobre las características de procesamiento de la cerveza. La identificación de hordeínas indicó que gran parte de éstas no se encuentran en el tamaño que les corresponde. Esto puede ser debido a que se establecen interacciones de tipo covalentes (puentes disulfuro) o interacciones hidrofóbicas de los fragmentos desnaturalizados de hordeínas y otras proteínas que lleven a la formación de aglomerados que se resuelven en un tamaño distinto al de las proteínas que los forman. Por ejemplo, en la banda M23-1 ubicada entre 55-70 kDa, intervalo que corresponde a las hordeínas C, se identificaron hordeínas B3 cuyo tamaño teórico es alrededor de 46 kDa. A pesar de haber utilizado agentes reductores y desnaturalizantes durante la extracción y electroforesis, es recomendable agregar un paso extra de alquilación de los residuos de cisteína una vez reducidos, para asegurar que no se formen nuevas interacciones entre proteínas. Acorde a los péptidos identificados en malta se comprobó la presencia mayoritaria de hordeínas B3 tanto para la variedad 23 como para Metcalfe. Sin embargo, los fragmentos identificados para cada una de estas hordeínas no fueron siempre los mismos (Tabla III). Es posible notar que en la banda 23-1 se presentaron péptidos de B3 no detectados en ninguna de las bandas de la malta 08 (Metcalfe). Esto apoya el hecho de que las diferencias en los patrones se deben en gran medida a una degradación diferencial del mismo tipo de hordeínas. Por lo anterior, no se puede descartar la presencia de polimorfismos entre variedades para este grupo de hordeínas que también podría contribuir en mayor o menor medida a su susceptibilidad a las proteasas.
Con el uso de diferentes protocolos de digestión fue posible ampliar la identificación de hordeínas. En este caso las hordeínas C sólo se detectaron con el uso de quimotripsina y tripsina, ya que éstas son ricas en fenilalanina y la quimotripsina hidroliza en residuos de aminoácidos aromáticos principalmente, lo que mejoró su digestión y por lo tanto su identificación. Por otra parte fue posible detectar con el uso de tripsina modificada (Trypsin-LysC) varios tipos de hordeínas en semilla seca, pero ninguna en las bandas de malta, donde la mejor identificación se logró con el protocolo estándar de digestión con tripsina. Estos datos permiten a futuro seleccionar el protocolo más apropiado dependiendo del tipo de muestra (semilla seca o malta), así como del grupo de hordeínas que se desea evaluar (C, B o γ). En ninguna de las bandas se identificó a hordeínas del grupo D, aun cuando se seleccionaron bandas en semilla seca correspondientes a su tamaño, por lo que será necesario optimizar los protocolos de identificación para este tipo de proteínas.
Finalmente, la caracterización molecular de las variedades mexicanas de cebada es de gran importancia para encontrar marcadores moleculares que permitan facilitar y acelerar el proceso de obtención de nuevas variedades. Lo anterior con la finalidad de que dichas variedades se adapten mejor a las condiciones ambientales y los requerimientos para la producción de cerveza en México, con lo que se promueve su cultivo y se benefician los agricultores y la industria mexicana.
ConclusionesSe reportaron los patrones de hordeínas en geles SDS-PAGE de una dimensión de semilla seca y malta de variedades mexicanas de cebada. En semilla seca se observaron bandas diferenciales a 100 kDa, 65 kDa y de 37-45 kDa, por lo que se sugiere continuar con su análisis como candidatos a marcadores moleculares en la semilla. En malta destacaron los patrones de la variedad 08 y 23 por su abundancia en hordeínas, así como la 04 y 18 por la degradación de las mismas que muestra cada una. Por otro lado, para la identificación de hordeínas por EM, se determinó que la digestión con tripsina favorece la identificación de péptidos en muestras de malta, mientras que en semilla seca el uso de tripsina modificada puede ser utilizado con éxito en la identificación de hordeínas B y γ y solamente la digestión conjunta de tripsina con quimotripsina favorece la identificación de las hordeínas C.
Este trabajo fue realizado en el marco de la Red de innovación para el mejoramiento genético y desarrollo de tecnologías avanzadas para el mejoramiento agronómico de cebada maltera, dentro del convenio de colaboración entre Impulsora Agrícola S.A. de C.V. y la UNAM con número de registro 36372-2821-14-XI-13 y con apoyo parcial por el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica PAPIIT IN211215 de la UNAM. Agradecemos a la QFB. Margarita Guzmán de la Unidad de Servicios de Apoyo a la Investigación y la Industria de la Facultad de Química de la Universidad Nacional Autónoma de México (UNAM) por su asesoría técnica en la identificación de proteínas por Espectrometría de Masas.