Introducción
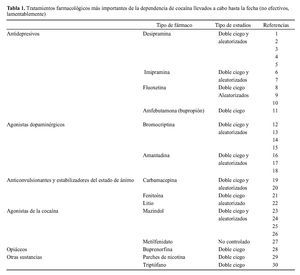
Aunque el abuso de opiáceos y alcohol pueden ser tratados parcialmente con algunos fármacos, no hay lamentablemente tratamientos de este tipo para el abuso de cocaína y otras drogas psicoestimulantes (tabla 1). Además, en el caso de que hubiera tratamientos adecuados nos encontramos con el problema crónico de la recaída en estas drogas. Ello plantea la necesidad de: a) instituir programas de prevención de abuso de drogas que resulten más efectivos y b) conocer mejor los mecanismos de acción de estas sustancias con la esperanza de elaborar fármacos que puedan ayudar a la recuperación de los pacientes.
En la mayoría de las personas el consumo de cocaína se realiza de acuerdo con un patrón compulsivo por el que el usuario se administra la droga cada 10-30 minutos hasta agotar la cantidad disponible31-33. Debido a este patrón compulsivo, la cantidad de droga consumida aumenta conforme se desarrolla la dependencia31,33.
En los consumidores crónicos, después de este tipo de consumo, aparecen los síntomas relacionados con la ausencia de la droga que parecen indicar la existencia de dependencia como son: anhedonia, anergia, disforia, depresión, insomnio, irritabilidad, ansiedad e hiperfagia. Al poco tiempo de la terminación de estos síntomas se vuelve al consumo, debido, en parte, a la influencia de los estímulos ambientales asociados al consumo previo de la droga32. Esta forma de consumo
compulsivo se repite cíclicamente con separaciones de varios días y con una duración de 4 a 200 horas33. Muy probablemente, la cocaína tomada de esta forma genera cambios neuroquímicos que permanecen después de que la droga ha dejado de ser consumida y que influyen en la recaída en el consumo. Se desconocen los mecanismos últimos a través de los cuales la cocaína produce estos efectos, lo que, unido a la complejidad de otros aspectos de la conducta adictiva en sí, hace muy difícil la efectividad de un proceso terapéutico.
En la actualidad, en nuestro país el consumo de esta droga sigue asociado a usuarios de ambientes de clase media y alta con una posición social consolidada, pero también se ha extendido a otros colectivos. Ahora esta droga tiene un amplio grupo de consumidores, muy diversificado en cuanto a sus características pero que, generalmente, están integrados socialmente y son cada vez más jóvenes. Ya no se puede explicar el consumo de esta sustancia con modelos etiológicos que apuntaban a causas relacionadas con desajustes con el medio social en que vivían los jóvenes tales como pobreza, fracaso escolar, precariedad laboral, falta de oportunidades, etc. Por el contrario, el consumo de esta droga está más bien relacionado con la posibilidad de un mayor logro de prestigio y relaciones sociales en ambientes recreativos. La imagen que sigue rodeando a la cocaína es de droga poco peligrosa y que puede consumirse sin problemas bajo control, pero el aumento de la demanda de asistencia por uso de esta sustancia en centros sanitarios es un reflejo de su poder adictivo y de los efectos adversos que su consumo conlleva.
Farmacología de la cocaína
Formas de consumo
La cocaína es un éster alcaloide que se obtiene de las hojas de arbustos de dos especies: Erythroxylum coca Lam y Erythroxylum novogranatense. Las hojas de esta última especie son las que contienen mayor proporción de alcaloides y, por tanto, de cocaína. Esta droga se extrae de las hojas por un proceso de precipitado de los alcaloides básicos que resulta en una pasta de coca, la cual se transforma mediante oxidación con ácido clorhídrico en clorhidrato de cocaína, que es la principal sustancia presente en la cocaína disponible ilegalmente. El clorhidrato se disuelve con facilidad en agua, por lo que es apto para su administración intravenosa. En nuestro país ésta es una de las formas de consumo más utilizada, junto con la administración por vía intranasal (esnifada). En otros países también se consume fumada en forma de base libre del clorhidrato de cocaína (popularmente, crack). La cocaína como base libre tiene la propiedad de fundirse a los 98 ºC y alcanzar un punto de ebullición a los 250 ºC, lo que la hace apta para ser: fumada en cigarrillos pulverizada y mezclada con tabaco o marihuana, o inhalada en recipientes calentados. Estas últimas formas de consumo posibilitan una entrada de la droga muy rápida en el cerebro y que alcance concentraciones elevadas en el tejido nervioso en muy poco tiempo. Por ello, la aparición de la base libre ha supuesto un aumento del riesgo de potencialidad adictiva y efectos tóxicos adversos de la cocaína. Además, al ser fumada es considerada menos susceptible de producir infecciones que la vía intravenosa y este hecho ha favorecido también la extensión de su consumo.
Transcurso temporal de los efectos psicoactivos
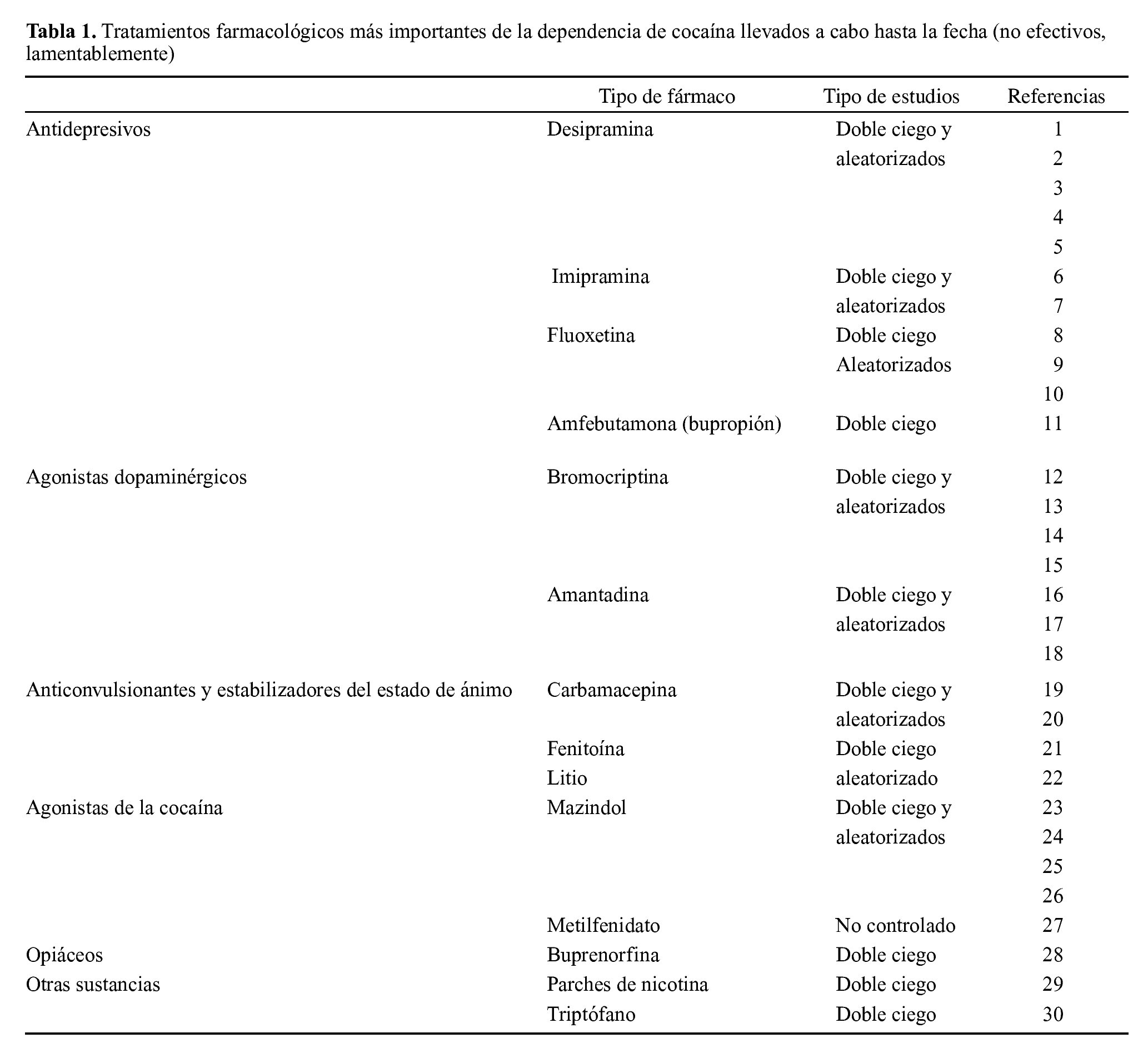
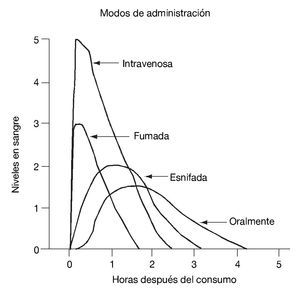
El inicio de los efectos psicoactivos de la cocaína tarda en producirse entre 5 segundos y 30 minutos y permanecen de 5 a 90 minutos, dependiendo de la vía de administración. Como sabemos, la vía de administración determina la velocidad de comienzo de la acción, la concentración en sangre y la duración del efecto euforizante. Está claro que las vías intravenosa y fumada son las de inicio más rápido y de duración menor de los efectos, comparadas con la intranasal y la oral. Ello hace que los consumidores por vías intravenosa y fumada se administren varias dosis para alcanzar una intensa y más duradera euforia. El curso temporal de los niveles en sangre de la cocaína administrada por diversas vías se observa en la figura 1.
Figura 1. Curso temporal de los niveles en sangre de la cocaína administrada por diversas vías.
Farmacocinética
Como la cocaína en su forma básica atraviesa con facilidad la barrera hematoencefálica, cuando se fuma alcanza al cerebro en 5 segundos y en 30 segundos si es por vía intravenosa o por vía nasal. Diversos estudios de tomografía por emisión de positrones (PET) empleando [11C]-cocaína han demostrado una captación rápida de esta droga por el sistema nervioso central y una actividad máxima de la cocaína entre los 4-8 minutos después de la inyección en sujetos humanos, así como una media de 20 minutos para su eliminación después de la inyección. Estas características farmacocinéticas de la cocaína se relacionan estrechamente con el curso temporal de las propiedades euforizantes tras la inyección de la droga34-36.
Administrada por vía intravenosa, la concentración de cocaína en el cerebro es de 10 a 20 veces mayor que en el plasma, su volumen de distribución de 2,7 l/kg, su biodisponibilidad del 100% y su tasa de aclaramiento de 1,83 l/min/total34. Todos estos indicadores señalan que hay una considerable captación de droga por los tejidos.
La tasa de eliminación de la cocaína es independiente de la vía de administración, una vez que la fase de eliminación comienza. Existen dos formas de eliminación de la droga, mediante: a) ruptura metabólica (vía rápida) y b) metabolización y excreción (vía lenta). Por medio de esta última se obtienen dos metabolitos principales, benzoilecgonina (en un 45% aproximadamente) y ecgonina metil éster (en un 40%). Ninguno de estos dos metabolitos tiene actividad biológicamente significativa en seres humanos.
Otros metabolitos menores son ecgonina, norcocaína (2-6%) y cocaetileno. La norcocaína es un metabolito potencialmente activo pero se produce en pequeñas cantidades, lo cual hace que su efecto no sea significativo en seres humanos. El cocaetileno se forma cuando el sujeto consume alcohol junto con cocaína. Dicho consumo conjunto es muy común entre los usuarios, por razones que no se conocen bien. El cocaetileno se produce como consecuencia de la inhibición de la actividad de la metilesterasa, lo cual se traduce en una disminución de la hidrólisis a benzoilecgonina y en la transesterificación por esterasas hepáticas de la cocaína a cocaetileno (o etilcocaína) y en el aumento de la N-metilación a norcocaína. De entre los metabolitos de la cocaína, el cocaetileno es de los más perjudiciales en seres humanos, puesto que tiene actividad tóxica en el corazón y en el hígado, fundamentalmente.
En seres humanos la excreción urinaria representa del 85 al 90% del total de la dosis consumida. De esta cantidad, sólo entre el 1 y el 5% es cocaína sin metabolizar. En ratas la cantidad excretada por la orina es aproximadamente el 50% de la dosis administrada y sólo un 1% de la excretada es cocaína pura37.
Mecanismos de acción de la cocaína
Las acciones de esta droga se realizan a través de varios mecanismos:
1. Bloqueando los canales de Na+ dependientes de voltaje, de donde se derivan las propiedades de la cocaína como anestésico local.
2. Actuando en los terminales monoaminérgicos, inhibiendo la recaptación de dopamina, serotonina y noradrenalina, a través del bloqueo competitivo de sus transportadores. Esta acción sobre los transportadores hace que se incremente la cantidad de neurotransmisores en la sinapsis con la consecuente estimulación sobre los receptores postsinápticos. Las propiedades euforizantes de la cocaína se cree que están relacionadas, sobre todo, con su acción sobre los transportadores de dopamina y serotonina38,39.
3. Actuando también presinápticamente sobre el transportador vesicular de la dopamina, localizado en los terminales nerviosos mesolímbicos y nigroestriales, el cual se encarga de almacenar la dopamina del citoplasma previamente sintetizada y/o de la dopamina recaptada desde el espacio sináptico. Se ha sugerido que la cocaína provoca un descenso en la dopamina recaptada por el transportador40.
4. A través de su afinidad por sitios de unión de receptores tales como receptores serotoninérgicos41, receptores muscarínicos M1 y M242 y receptores sigma43.
La cocaína tiene igualmente propiedades simpaticomiméticas que parecen ser debidas a los efectos de esta droga sobre la noradrenalina en los terminales posganglionares del sistema nervioso autónomo, rama simpática. Ello se traduce en un incremento de la noradrenalina en el espacio extracelular que, a su vez, parece ser la responsable de las complicaciones agudas de la cocaína, esto es, de un aumento de la frecuencia cardíaca, vasoconstricción de arteriolas y venoconstricción de venas a través del músculo liso vascular, intensa midriasis por contracción del músculo radial, incremento de las secreciones salivar, gástrica y pancreática, e intensa sudoración. Además, esta activación noradrenérgica sería la responsable del aumento de la presión arterial y de la vigilancia, debido al efecto sobre el locus coeruleus. Por último, todas las acciones de la cocaína que implican aspectos reforzantes y psicomotores parecen deberse a la acción que ejerce sobre un circuito o un sistema específico: el circuito mesocorticolímbico dopaminérgico, que comentaremos a continuación.
El circuito mesocorticolímbico dopaminérgico
El consumo crónico de cocaína parece alterar este sistema generando modificaciones en la actividad electro-fisiológica de poblaciones neuronales44, en la regulación de receptores de neurotransmisores y en las adaptaciones moleculares en las vías de transducción de señales y en la regulación de la expresión génica45. Estos cambios podrían estar relacionados con el deseo intenso por el consumo de la droga y su búsqueda (craving y drug-seeking, en inglés, respectivamente) y con el desarrollo de fenómenos de tolerancia y sensibilización.
Un hallazgo importante en los estudios de la adicción a la cocaína y a otras drogas ha sido llegar a relacionar las propiedades euforizantes de estas sustancias con mecanismos celulares y moleculares en los que participan estructuras del sistema nervioso central46-49. Históricamente, el origen de esta idea surge como resultado de los primeros trabajos de autoestimulación eléctrica intracraneal50 que llevaron a una primera formulación sobre la existencia de uno o varios centros del placer en el cerebro, que serían responsables del reforzamiento positivo observado en los animales51. El concepto de recompensa estaría relacionado con las consecuencias «subjetivas» producidas por la estimulación del o de los supuestos centros de placer existentes en el sistema nervioso central, experimentadas como positivas y placenteras. A partir de los años sesenta, los estudios de autoadministración demostraron que las drogas podían actuar como reforzadores positivos, lo cual contribuyó a la idea actual de que las drogas actúan sobre un sistema de recompensa neuroanatómico especializado, que sería común para varias clases de reforzadores, incluidos los reforzadores naturales. Entre las estructuras neurales de este sistema destacó desde el principio el núcleo accumbens (NAc) como una región importante en la mediación de las propiedades de los reforzadores positivos52-54.
Los numerosos estudios realizados sobre el sistema mesocorticolímbico dopaminérgico parecen sugerir que este sistema podría sufrir cambios neuroadaptativos como consecuencia del consumo crónico de cocaína, que serían importantes en el mantenimiento de la conducta de autoadministración y en la recaída en el consumo de la droga55,56. El sistema mesocorticolímbico dopaminérgico también parece importante en atribuir capacidad de incentivo a estímulos neutros asociados con el consumo previo de la droga. La posible función de estos estímulos en el desarrollo y recaída en la adicción ha sido resaltada en la teoría de la sensibilización de incentivo condicionada57. De acuerdo con esta teoría, el sistema mesocorticolímbico dopaminérgico actuaría como un circuito motivacional que traduciría los estímulos biológicamente relevantes, incluidos los ambientales y estímulos farmacológicos como la cocaína, en respuestas conductuales58,59.
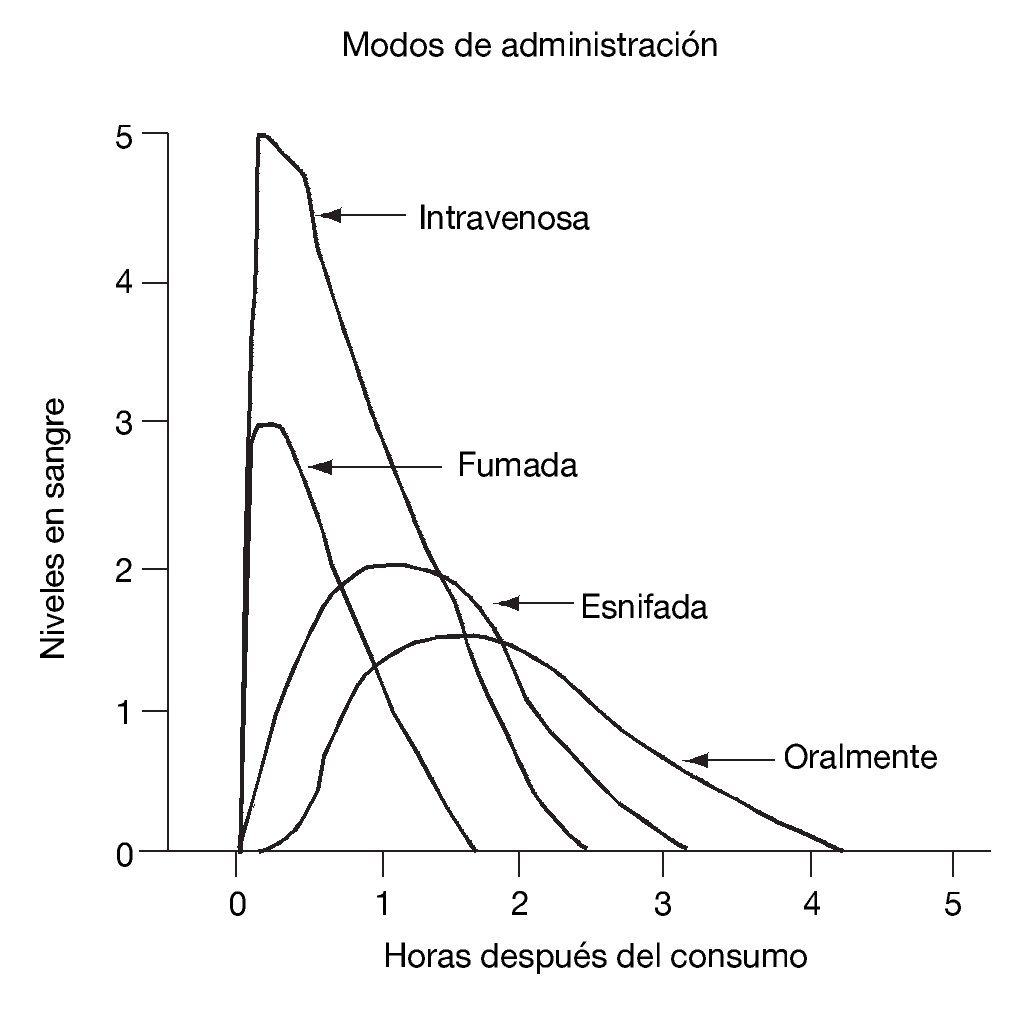
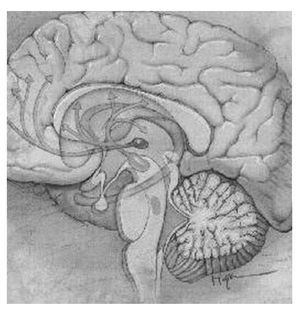
El sistema mesocorticolímbico dopaminérgico, localizado en la parte anterior del cerebro, está formado por una serie de núcleos interconectados entre sí de forma que permite una circulación relativamente fluida de información desde la porción ocupada por los núcleos del circuito córtico-estriado-palidal hacia los sistemas motores piramidal y extrapiramidal60-62. La porción dopaminérgica de este sistema se origina en el tegmento ventral del mesencéfalo o área tegmental ventral (ATV) y forma una primera vía que manda eferentes desde las áreas productoras de dopamina A8, A9 y A10 a la porción periférica o concha (shell, en inglés) y a la porción central o centro (core, en inglés) del NAc, estructura situada en la porción ventral del cuerpo estriado. En la concha, a su vez, se originan eferencias gabaérgicas dirigidas hacia el tegmento ventral (formando así un bucle de control recíproco) y hacia el tálamo dorsomedial y zona dorsal de la corteza prefrontal, vía el pálido ventral. A su vez, desde la corteza dorsal prefrontal se mandan eferencias glutamatérgicas al centro del NAc y la sustancia negra, y desde esta última se envían eferencias dopaminérgicas de salida del sistema hacia los sistemas motores piramidal y extrapiramidal. Una segunda vía de este sistema parte también de la ATV dirigiéndose hacia el centro del NAc y el pálido ventral dorsolateral para confluir en una vía única de carácter gabaérgico que se proyecta a tres estructuras claramente diferenciadas: la sustancia negra, la porción medial del núcleo subtalámico y el núcleo pendúnculo pontino. Esta última estructura converge con las otras dos, vía eferencias acetilcolinérgicas, en los sistemas piramidal y extrapiramidal59. En la figura 2 aparecen las estructuras más importantes y sus conexiones en este sistema.
Figura 2. Estructuras más importantes y conexiones del sistema mesocorticolímbico. En verde la vía mesocortical, que inerva el núcleo accumbens (en amarillo) y las cortezas prefrontal y orbitofrontal. En naranja la vía mesolímbica, que inerva el cuerpo estriado, el tálamo y el hipocampo entre otras estructuras. En azul se destaca el locus coeruleus.
Desde la amígdala parte una de las principales vías de entrada al núcleo del sistema mesocorticolímbico, que es el estriado ventral. El complejo amigdalino está formado por una serie de núcleos (central, lateral y basolateral) profusamente conectados entre sí y con otras divisiones menores, que envían conexiones hacia el interior del sistema formando lo que se ha denominado «amígdala extendida». Se entiende por amígdala extendida una especie de interfaz de límites difusos que pone en relación grandes zonas de corteza y núcleos talámicos (geniculado medial, intralaminar posterior y el suprageniculado) con la zona mesolímbica a través de la ATV, la concha del NAc y la parte medial de los núcleos caudado y putamen63.
Por otra parte, como acabamos de decir, el estriado dorsoventral (núcleos caudado, putamen, NAc y tubérculo olfatorio) constituye la parte esencial del sistema mesocorticolímbico dopaminérgico. Estas estructuras se consideran una interfaz entre la corteza límbica y el sistema motor extrapiramidal y, en conjunto, constituyen una extensa red de comunicaciones nerviosas que conectan con importantes divisiones ventromediales de la corteza, estructuras diencefálicas y núcleos mesencefálicos que sintetizan neurotransmisores monoaminérgicos. Como ya hemos indicado, el NAc ha sido subdividido a su vez en las regiones central y de la concha64. La concha recibe aferentes del subiculum, núcleos del tálamo de la línea media y de la amígdala65-67, y proyecta a la región ventromedial del pálido ventral que, a su vez, inerva la ATV, el hipotálamo lateral y el núcleo pedúnculo pontino68,69. La parte central presenta más similaridades con el estriado dorsal en lo que se refiere a las conexiones aferentes y eferentes, y parece estar más implicada en funciones motoras parecidas a las del sistema estriado dorsal-corteza frontal60,68. El estriado ventral recibe eferencias glutamatérgicas de la corteza entorrinal, la orbitofrontal, la cingulada, áreas subcorticales de la corteza (complejo amigdalino, hipocampo) y del tálamo. El mayor número de aferencias recibidas por el estriado ventral procede del tálamo, principalmente de los núcleos paraventricular, reuniens, de la línea media y dorsomedial. Por su parte, el NAc recibe conexiones del hipocampo procedentes de las regiones CA1, CA2, CA3 y CA4 y del complejo subicular. La concha también recibe proyecciones procedentes del hipotálamo. Todas estas conexiones son glutamatérgicas.
Las conexiones con los núcleos mesencefálicos monoaminérgicos son fundamentales para el desarrollo de las funciones en las que se ha involucrado al estriado ventral en lo que se refiere al reforzamiento y a cambios neuroadaptativos tras la administración crónica de drogas. Estos núcleos son el rafe, el locus coeruleus, la sustancia negra y la ya citada ATV. Las aferencias más importantes son las provenientes de estos dos últimos núcleos, hasta el punto de que el neurotransmisor fundamental en el estriado ventral es la dopamina. Las principales eferencias del estriado ventral son de carácter gabaérgico y se dirigen hacia el pálido ventral, el hipotálamo, el ATV y la sustancia negra. Las conexiones recíprocas entre estas dos últimas estructuras proveen al estriado de un control modulador sobre la producción de dopamina y, como ya se ha comentado, se considera que la vía dopaminérgica que se proyecta desde la ATV al NAc parece fundamental en otorgar valor de recompensa a los estímulos reforzantes relacionados con las conductas operantes y, más concretamente, con la auto-administración de las drogas de abuso.
Los estudios realizados en el NAc han sugerido que esta estructura participa de un modo importante en los efectos reforzantes producidos por la cocaína. Así, las lesiones producidas por la neurotoxina 6-hidroxidopamina (6-OHDA), que causa la destrucción de las terminales presinápticas dopaminérgicas, atenúan la autoadministración de cocaína69,70. El mismo resultado se obtiene tras lesiones con ácido kaínico71. Por otra parte, microinyecciones de antagonistas de receptores de dopamina en el NAc disminuyen la autoadministración de cocaína72-74. Concretamente, se ha demostrado que el SCH23390, antagonista de los receptores D1, al ser inyectado en el NAc o en el núcleo central de la amígdala produce un aumento en la conducta de autoadministración de cocaína74, lo cual se ha interpretado como un intento de compensar la pérdida de la eficacia reforzante de la droga, un efecto similar al observado sobre la frecuencia de respuestas al reducir la dosis de cocaína75.
Evidencias adicionales sobre una contribución de la dopamina en la mediación de los efectos de recompensa de la cocaína indican que los animales son capaces de autoadministrarse agonistas de receptores dopaminérgicos, tales como la apomorfina, bromocriptina76 e incluso la misma dopamina77. Estos datos han planteado la posibilidad de que la conducta de autoadministración de cocaína pudiera estar mediada por cambios relacionados con la regulación de los niveles de dopamina en el NAc, dado que la dopamina77 es autoadministrada en el NAc. Los niveles de dopamina en el NAc parecerían, pues, importantes en esta conducta dado que las disminuciones de dopamina en el NAc78,79 y la administración de antagonistas dopaminérgicos en el NAc atenúa la autoadministración de cocaína80.
Actualmente se cuenta con dos hipótesis para explicar el significado de los cambios en la dopamina del NAc y su relación con la conducta de autoadministración de cocaína:
1. Una primera que asume que las propiedades de la cocaína como reforzador positivo son consecuencia de su capacidad de aumentar la dopamina extracelular79,81,82.
2. Otra que considera que la reducción de dopamina55 o la supresión de la actividad del circuito que media los efectos reforzantes de la cocaína56 pudiera ser el correlato biológico del deseo intenso por el consumo de la cocaína.
Originariamente, esta segunda hipotésis fue propuesta como explicación del fenómeno del deseo intenso de cocaína en los seres humanos que surge en los días posteriores al último consumo compulsivo de la droga. A este respecto, Markou y Koob56 han descrito que la insensibilidad del sistema mesocorticolímbico dopaminérgico como consecuencia de la retirada de la cocaína aparece también en animales, después de que éstos son retirados de la sesión experimental de autoadministración de cocaína. De aquí se deduce que si la reducción de la dopamina es el correlato biológico de la motivación por la cocaína y si este efecto puede ser inferido a partir de la insensibilidad del sistema de recompensa tras la retirada de cocaína, entonces la reducción de la dopamina podría ser un hecho importante que desencadenara la conducta de búsqueda de esta droga entre episodios compulsivos de su consumo y quizá también de su mantenimiento.
En animales, empleando la metodología de microdiálisis por cromatografía líquida de alta presión (HPLC), se ha encontrado que una disminución de los niveles extracelulares de dopamina parece ser una consecuencia de la retirada de cocaína administrada de forma crónica83,84, pero dada la limitación de la resolución temporal de la microdiálisis por HPLC (se requieren 10 minutos hasta obtener suficiente volumen para poder hacer la mediciones), se han descrito discrepancias en los resultados de los estudios realizados con esta técnica. Así, mientras investigadores como Pettit y Justice85,86 han encontrado que la cocaína autoadministrada intravenosamente durante 24-48 horas (aguda) causa un aumento en los niveles de dopamina en el NAc, otros grupos han encontrado que tales aumentos sólo se producían en el grupo de los animales que se habían autoadministrado la cocaína de forma aguda y no en los animales que lo habían hecho de forma crónica (al menos una semana). No obstante, es difícil determinar si los cambios en los niveles de dopamina durante la autoadministración intravenosa de cocaína se relacionan más con una respuesta anticipatoria del reforzador que con la consecuencia reforzante del mismo.
Por otra parte, el significado conductual de los cambios en los niveles de dopamina durante la autoadministración de la cocaína es aún más confuso, ya que los resultados obtenidos en animales con la metodología de la voltametría, que tiene una resolución temporal excelente (de segundos), muestran contradicciones con los obtenidos con microdiálisis por HPLC, que acabamos de comentar. Así, diversos trabajos87 han demostrado que los efectos de la cocaína sobre las señales asociadas a la dopamina en el NAc dependen de la fase de la adquisición de la conducta de autoadministración y de la presencia de estímulos asociados a la ingesta de la cocaína. Con respecto a la fase de autoadministración, los niveles de concentración de dopamina en el NAc alcanzan su máximo valor justo en el momento en el que el animal ejecuta la conducta (cuando se aprieta la palanca), pero luego descienden al recibir la inyección. Este hallazgo puede indicar: a) que la fluctuación de la dopamina en el NAc está inversamente correlacionada con la concentración de droga presente en sangre; b) que la reducción de la dopamina no parece que sea determinante para que el animal se autoadministre cocaína, y c) que la liberación de dopamina puede que no sea fundamental en el refuerzo positivo81,82. Por otra parte, la presencia de un estímulo luminoso asociado a la autoadministración de cocaína produce liberación de dopamina. Este hecho parece indicar que el sistema dopaminérgico estaría más implicado en la anticipación de la recompensa que en la producción de recompensa. La función anticipatoria de recompensa del sistema dopaminérgico ha sido probada también en estudios con comida88 y con estimulantes psicomotores89.
Por otro lado, diversos estudios electrofisiológicos han comprobado que la actividad que muestran las neuronas del NAc es fásica en su cadencia de disparo. La frecuencia de disparo de estas neuronas disminuye al poco de la inyección de cocaína y se recupera progresivamente hasta el momento de la siguiente inyección. Este patrón de actividad se correlaciona con la autoadministración de cocaína, con la concentración de cocaína en sangre y con la cantidad de dopamina extracelular81,82,85,86, y parece indicar que las neuronas dopaminérgicas del NAc emiten respuestas anticipatorias para la obtención de la cocaína. En esta línea se ha comprobado que los antagonistas dopaminérgicos de los receptores D1 (SCH 23390) y D2 (pimozida) son eficaces en bloquear esta respuesta anticipatoria y la respuesta inhibitoria que sigue a la inyección de la cocaína, pero esto solamente ocurre en neuronas que exhiben ambas respuestas89.
A modo de conclusión, de las aportaciones de estos trabajos se desprende que, al menos en animales, los efectos reforzantes positivos producidos por la cocaína no parecen estar relacionados de una manera directa con la liberación de dopamina en el NAc y que, por tanto, es posible que estén implicados otras estructuras y/o sistemas de neurotransmisión.
Neuroadaptaciones inducidas por el consumo y la abstinencia de cocaína
Uno de los aspectos más difíciles del tratamiento de las adicciones a drogas es el problema de las recaídas y en eso la cocaína no es una excepción. El intenso deseo por volver a sentir los efectos de esta droga y el consumo compulsivo de la misma son dos importantes características que acompañan al fenómeno de las recaídas en su adicción. Aunque se desconocen los mecanismos neurobiológicos de las recaídas, se acepta generalmente que los mismos sistemas neurales implicados en los efectos reforzantes de la cocaína están también implicados en su recaída, ya que la conducta de búsqueda de la droga es común a ambos procesos. Existen, sin embargo, dos teorías que son opuestas en sus predicciones sobre las recaídas.
Un grupo de teorías sostiene que la recaída es iniciada a partir de la activación de los sistemas de refuerzo, tal y como ocurre con la administración aguda de la droga. Son teorías que mantienen la existencia de un proceso proponente como explicación de la recaída46,57. Otro grupo de teorías sugiere la existencia de un proceso opuesto (oponente) al ocasionado por la administración aguda de la droga. Este proceso produciría una hipofuncionalidad en los sistemas de refuerzo que se traduciría en estados disfóricos durante la retirada de la droga75. Así, la búsqueda de la droga sería una necesidad para aliviar el estado de malestar producido por la ausencia de la droga. Ambas teorías, de proceso oponente y de proceso proponente, tienen dificultades para explicar fenómenos diversos. La teoría del proceso oponente, por ejemplo, no explica ciertas evidencias que se enumeran a continuación:
1. Los períodos de máxima autoadministración de la droga no coinciden con los de máxima disforia como consecuencia de la abstinencia. Esto es, existe muy baja relación entre los efectos de la retirada en sí misma y la búsqueda de droga para un amplio número de sustancias.
2. Existen numerosos informes médicos y científicos que indican que el alivio de los efectos de la abstinencia es un método poco efectivo en el tratamiento de la adicción. Hay una gran probabilidad de que se produzca la recaída en el consumo de la droga después de haber pasado un largo período sin que haya habido consumo y, verdaderamente, se desconoce si los estímulos condicionados asociados previamente con los efectos de la retirada de la droga son los que en definitiva producen nuevamente el reinicio del consumo. Así, parece que hay una escasa correlación entre el deseo intenso por la droga y los efectos de retirada de la misma57.
3. Se ha comprobado que en los informes subjetivos de cocaína y otras drogas dicho deseo es a menudo más alto después de la administración de la droga, cuando ésta se halla produciendo efectos placenteros subjetivos, que cuando los síntomas de la abstinencia de la droga han sido eliminados o se encuentran muy reducidos.
En conjunto, las evidencias señaladas parecen indicar que las dos características más importantes de la adicción, el deseo intenso por su consumo y la probabilidad de recaída en el mismo, no parecen estar relacionadas exclusivamente con un intento de escapar de las consecuencias aversivas de la abstinencia. Estos dos factores pudieran motivar episódicamente la búsqueda y el consumo de la droga, e incluso aumentar sus efectos reforzantes, pero no serían las únicas causas, ni las causas primarias del deseo intenso por la droga y su consumo compulsivo.
Por su parte, en cuanto a la teoría del proceso proponente, hay datos que no están en la línea de una teoría del reforzamiento positivo. Así:
1. Hay drogas psicoestimulantes como la nicotina que no producen euforia y, sin embargo, tienen un potencial adictivo alto. Además, el inicio en el consumo puede producir más bien estados disfóricos, y a pesar de que el consumo prolongado puede conllevar consecuencias negativas, el deseo intenso y el consumo de la droga se mantienen. Si el consumo de la droga se mantuviese simplemente por el reforzamiento, la autoadministración de la droga se extinguiría, pero usualmente esto no ocurre.
2. El estado placentero que una droga pueda producir cuando es administrada de forma aguda no parece existir cuando el sujeto se expone a estímulos ambientales asociados a su consumo, los cuales sí parecen producir un intenso deseo por volver a consumirla. Estos hechos apoyan una disociación entre los estados placenteros inducidos por la administración aguda de la droga y el deseo de su consumo. Sin embargo, no es descartable una asociación entre el deseo intenso por la droga y algún tipo de «memoria explícita» que guarde experiencias de carácter placentero asociadas con el consumo pasado de la droga.
3. Los seres humanos se autoadministran dosis bajas de drogas, a pesar de que no causan efectos placenteros conscientes. Este hecho se ha observado con cocaína, pero también con opiáceos.
Existen otros datos que encuentran escasa relación entre el reforzamiento producido por la droga y estados subjetivos placenteros. Esto ha llevado a sugerir la existencia de distintos sistemas neurales en la mediación de los efectos subjetivos producidos por la droga y su actuación como reforzador positivo. En conjunto, estos datos dan idea de la dificultad de mantener la existencia de una teoría de proceso proponente u oponente que se base en las consecuencias subjetivas afectivas producidas por la autoadministración o la abstinencia de las drogas57. Pero, por otro lado, ambas teorías mantienen que más que la posible influencia de estados subjetivos en las recaídas, es posible la existencia de neuroadaptaciones a largo plazo inducidas por la droga en los sistemas de recompensa cerebral, lo cual explicaría que la búsqueda de la droga y el deseo siguen persistiendo aun transcurrido un período largo de tiempo.
A este respecto, los recientes estudios de neuroimagen en seres humanos indican que el consumo crónico de cocaína produce una disminución de la transmisión dopaminérgica, que es relativamente duradera en el tiempo, y que está asociada a una reducción de la actividad metabólica en regiones cerebrales del lóbulo frontal90. No hay que olvidar, sin embargo, que otras regiones cerebrales tienen también una función relevante en la dependencia de cocaína, como son las que parecen estar más directamente relacionadas con los procesos de reforzamiento (NAc y núcleo pálido ventral), de memoria (amígdala e hipocampo), de la motivación (cortezas orbitofrontal y subcallosa) y de la planificación general del comportamiento (cortezas prefrontal y cingulada)90. Por otro lado, es posible que, a través de la actuación de la cocaína en esas regiones, se facilite la mayor vulnerabilidad que manifiestan algunos individuos ante los efectos adictivos de la cocaína y otras drogas. Esto es, en aquellas personas en las que, en la fase de las exposiciones iniciales al consumo, la droga produzca un aumento en la función de regiones cerebrales reguladoras de la motivación y del aprendizaje y la memoria, y una disminución en las de recompensa cerebral y toma de decisiones, es más factible una mayor proclividad a la drogodependencia.
En animales, experimentos realizados en nuestro laboratorio en los que hemos combinado la metodología de autoadministración intravenosa de drogas con las de autorradiografía de receptores e hibridación in situ para medir: a) los niveles de receptores de dopamina (D1, D2, D3 y D4) y los de glutamato (NMDA), así como los transportadores de esos dos neurotransmisores, y b) la expresión génica del factor liberador de la corticotropina (CRF, corticotropin releasing factor), proencefalina (PENK) y de la subunidad NMDAR1 del receptor NMDA de glutamato, indican que durante la abstinencia de cocaína en ratas se producen cambios neuroadaptativos en todos esos sistemas de neurotransmisores estudiados. El objetivo esencial de estos estudios fue conocer más acerca de posibles factores de tipo endógeno que pueden participar en las recaídas en la adicción a la cocaína. En esos trabajos empleamos un diseño de tríadas para estimar la influencia de factores cognitivos y farmacológicos en la abstinencia de cocaína. Concretamente, se estudiaron de manera simultánea tres tipos de animales: uno, que se autoadministraba la droga conociendo que podía obtenerla realizando un comportamiento (en nuestro caso apretar una palanca) y que, por tanto, regulaba su comportamiento de ingesta (sujeto contingente); otro, emparejado con el anterior, que recibía la droga de forma pasiva porque el ordenador ponía en marcha automáticamente la bomba de inyección cuando el animal que se autoadministraba lo hacía (sujeto no contingente); y un tercero, emparejado también con el contingente, que recibía suero salino (salino) cuando el contingente se autoadministraba cocaína. Este último sujeto hacía de control de la situación experimental en la que los otros dos se sometían a los efectos de la cocaína. Este diseño nos permitió tener una estimación de la influencia de las expectativas de los animales que podían buscar y conseguir la droga, en contraposición a los que la recibían de forma pasiva y no tenían comportamiento de búsqueda. Así, aunque este estudio esté hecho en animales, es posible que factores cognitivos tales como las expectativas de los sujetos ante la posibilidad de conseguir la droga sean aspectos importantes que pueden contribuir a las neuroadaptaciones producidas por cocaína, puesto que en aquellos animales que tenían posibilidades de hacer alguna conducta para buscar y conseguir la droga (los del grupo contingente), los cambios neuroadaptativos eran más acusados y mostraban claras diferencias respecto a los otros grupos. Además, comparando los hallazgos de los receptores dopaminérgicos y glutamatérgicos, los cambios neuroadaptativos eran más duraderos y mantenidos en el sistema dopaminérgico, lo cual sugiere que en los efectos de la abstinencia de cocaína a medio y largo plazo parecen participar más esos elementos neurales del sistema dopaminérgico que los del glutamatérgico91-95.
En relación con los sustratos neurales que pueden reiniciar la conducta adictiva, un aspecto importante es el relativo a la mayor o menor susceptibilidad de dichos sustratos ante los efectos euforizantes de las drogas. Ciertamente, uno de los correlatos fisiológicos de la mayor facilidad para la adquisición de conductas adictivas parece estar basado en variaciones en la funcionalidad de algunos sistemas de neurotransmisores. Así, datos obtenidos mediante técnicas de neuroimagen sugieren que una mayor presencia de receptores del subtipo D2 de dopamina en el cerebro de las personas puede ser un factor protector ante los efectos euforizantes de la cocaína. Nuestros resultados van en esa línea e incluyen, además, a los sistemas glutamatérgico y opioidérgico entre los neurotransmisores cuya función disminuida puede participar en una mayor susceptibilidad a las recaídas en la dependencia de cocaína. Por último, hay que indicar también que la susceptibilidad individual a las recaídas (así como en la adicción inicial) en el consumo de cocaína puede estar asociada a trastornos psiquiátricos concomitantes. De hecho, son comunes los casos de patología dual en los que están presentes drogadicción y diversos desórdenes psiquiátricos.
Probablemente, como venimos comentando, las neuroadaptaciones que produce el consumo crónico de cocaína hacen a los sujetos aún más vulnerables y proclives a recaer, especialmente si se dan los factores que vamos a describir a continuación.
Factores que favorecen las recaídas en la conducta adictiva
Hay sobre todo tres tipos de factores que reinician la búsqueda de la droga en personas y animales: los estímulos condicionados, el estrés y dosis bajas de la droga que los sujetos se autoadministraban antes de estar abstinentes. Comentando con un poco más de detalle lo que se refiere a cada uno de estos tres factores, diremos que en lo que respecta al efecto de dosis bajas de droga sobre la vuelta al consumo, todos conocemos a personas que después de muchos meses de abstinencia de nicotina, por poner un ejemplo, han recaído en el tabaquismo simplemente por fumar un solo cigarrillo en una reunión social. El efecto de esa única dosis de nicotina es tan reforzante que es capaz de reiniciar por sí sola la conducta adictiva, con consumos muy abultados en los primeros días. Estos efectos son fácilmente reproducibles en animales, después de la extinción de la conducta de autoadministración. A este fenómeno se le llama preparación (priming) y se ha demostrado que ocurre tanto con opiáceos como con psicoestimulantes (cocaína y anfetamina). Se ha visto, además, que existe una preparación cruzada entre estas drogas. Dosis de morfina son capaces de reiniciar el consumo de cocaína, por ejemplo, y viceversa. Se cree que esta capacidad para producir una preparación cruzada refleja la activación de sustratos neurales comunes, posiblemente el sistema mesocorticolímbico dopaminérgico. Ciertamente, hay numerosos datos en la literatura científica que sugieren que las recaídas en animales están mediadas por dicho sistema. Así, microinyecciones de anfetamina directamente en el NAc reinician la conducta de autoadministración de heroína previamente extinguida. De igual modo, microinyecciones de morfina directamente en el ATV reinician la autoadministración de cocaína, pero no tienen este efecto cuando las microinyecciones de morfina se hacen en otras regiones cerebrales ricas en receptores opioides. Además, la idea de una función importante del sistema mesocorticolímbico dopaminérgico en las recaídas está apoyada por el hecho de que agonistas dopaminérgicos inducen el reinicio de la autoadministración de cocaína, mientras que los antagonistas lo bloquean. Todos estos datos indican que posiblemente la liberación de dopamina en el NAc sea un mecanismo necesario y suficiente para las recaídas en la adicción a psicoestimulantes.
En lo que respecta al efecto de los estímulos condicionados, se piensa que los estímulos condicionados reinician el consumo por mecanismos de condicionamiento clásico. Esto es, los estímulos ambientales mediante asociaciones específicas y repetidas con el consumo de la droga adquieren propiedades incentivadoras por sí mismos en ausencia de la droga. Basándose en experimentos realizados con animales, algunos investigadores han sugerido que los estímulos ambientales condicionados también producen liberación de dopamina en el NAc, aunque esta hipótesis no está clara aún. Una región cerebral importante en las recaídas es la amígdala, dado que lesiones de esta estructura disminuyen la capacidad de los estímulos condicionados para producir la recaída. Es interesante recordar a este respecto que hemos dicho que existen proyecciones glutamatérgicas desde la amígdala hacia el ATV donde activan neuronas dopaminérgicas que, probablemente, a su vez producen liberación de dopamina en el NAc. Igualmente, también conocemos que existen proyecciones de tipo glutamatérgico desde la amígdala hacia la corteza prefrontal que mediante la liberación de glutamato en el ATV activan a neuronas dopaminérgicas que luego proyectan sobre el NAc para producir la liberación de dopamina.
Por último, respecto al efecto del estrés en la reanudación del consumo, sabemos que tanto en seres humanos como en animales el estrés desencadena reinicios en la búsqueda de drogas. En animales se ha comprobado que la aplicación de pequeñas corrientes eléctricas tras la extinción de la conducta de autoadministración de cocaína produce un aumento de la frecuencia de la readquisición de esa conducta. Igual que en el caso de los factores anteriores, la influencia del estrés en las recaídas puede estar mediada por la activación del sistema mesocorticolímbico dopaminérgico. También se ha implicado al neuropéptido CRF en la inducción de las recaídas. Se piensa que este péptido es el coordinador de todas las respuestas, ya sean fisiológicas, autonómicas o conductuales frente al estrés.
Efectos farmacológicos de la cocaína que dan lugar a otras patologías
Si bien está claro que la dependencia de cocaína está asociada principalmente a sus particulares acciones sobre el sistema nervioso, es obvio que el consumo de esta droga tiene otras repercusiones en este y otros tejidos corporales. De entre ellos destaca especialmente el sistema cardiovascular, donde las acciones simpatomiméticas de la cocaína producen un cuadro complejo y no muy bien conocido aún. Así, como sabemos esta droga da lugar a un aumento significativo de la actividad noradrenérgica en el músculo cardíaco que se refleja en un incremento de la contractibilidad del mismo y de la actividad cardíaca, pero, debido a sus propiedades anestésicas locales, también reduce estas dos funciones. En conjunto, la sintomatología cardiovascular más común producida por la cocaína conlleva la aparición de palpitaciones, bradicardia (en dosis bajas), taquicardia, arritmias (la más frecuente es la fibrilación auricular, pero también se produce fibrilación ventricular, que es la causa más común de muerte súbita asociada al consumo de cocaína), infartos agudos de miocardio, miocarditis y miocardiopatía, y endocarditis. De todas estas patologías la más frecuente es el infarto agudo de miocardio. En concreto, se ha demostrado que los consumidores de cocaína tienen un riesgo siete veces mayor que los no consumidores de tener un ataque cardíaco no mortal.
El sistema respiratorio se ve afectado también mucho por el consumo de cocaína a través de las vías intranasal y fumada. En el primer caso, las patologías más frecuentes son sinusitis, osteítis y perforación del tabique nasal. En esta última complicación, junto con la inhalación rápida de cristales de cocaína, intervienen la vasoconstricción, hipoxia y anestesia de la mucosa nasal. La cocaína fumada produce patologías como el edema agudo de pulmón, el síndrome de pulmón por cocaína o «pulmón del crack» (caracterizado por un dolor torácico inespecífico y tos), aumento de cuadros asmáticos y aparición de cuadros de neumotórax, neumomediastino y neuropericardio, y hemorragia pulmonar.
En el aparato digestivo los trastornos más comunes son la anorexia (si bien esta complicación se produce por las acciones de la cocaína en el sistema nervioso central), náuseas, vómitos, diarreas y, aunque más raras, también se dan complicaciones de origen isquémico que producen úlceras gastroduodenales con hemorragia y perforación.
La cocaína causa también daño hepático debido probablemente a que, aun en pequeña proporción, esta droga se metaboliza mediante una vía oxidativa microsómica hepática que provoca la aparición de metabolitos que actúan como radicales libres, destacando entre ellos el cocaetileno.
En el sistema visual se produce afectación de los ojos que manifiestan midriasis, así como vasoconstricción conjuntival y nistagmus vertical. En el sistema neuroendocrino también se producen complicaciones debido a que la cocaína disminuye la concentración de dopamina en el sistema tuberoinfundibular, lo cual produce un aumento de la secreción de prolactina (que está normalmente inhibida por la dopamina). Ello conlleva la aparición de galactorrea en varones y mujeres no gestantes. Por otra parte, esta disminución de la concentración de dopamina también afecta al hipotálamo, que se manifiesta con una pérdida de la regulación adecuada de control de la temperatura corporal por parte de esta estructura, con el resultado de hipertermia. Por otro lado, como consecuencia de la afectación de otros sistemas hormonales también se ha descrito en varones ginecomastia, impotencia y pérdida de la libido.
En mujeres embarazadas la cocaína aumenta la probabilidad de abortos espontáneos, así como el incremento de desprendimientos placentarios y la toxicidad cardiovascular. Asimismo, hay un mayor efecto tóxico de la droga en el feto por disminución del flujo sanguíneo que llega al útero, aumento de la resistencia vascular uterina y disminución de la oxigenación del feto.
Por último, hay patologías neurológicas muy frecuentes derivadas de los efectos de la cocaína. De entre ellas destacan las cefaleas, los accidentes vasculares isquémicos y hemorrágicos (ictus), especialmente en personas jóvenes. No se sabe a ciencia cierta la causa de estos ictus, pero se apunta a la influencia de la elevación aguda e intensa de la presión arterial, las arritmias cardíacas y los vasoespasmos a nivel cerebral. Otras complicaciones neurológicas derivadas de la cocaína son las crisis convulsivas. Estas crisis pueden conllevar la muerte de los sujetos, aun en el caso de una intoxicación aguda con dosis pequeñas de cocaína.
Por hacer un rápido resumen, puede verse que la cocaína afecta a múltiples sistemas corporales en los que desarrolla diversas patologías, llegando incluso a producir la muerte del sujeto. Según la vía de administración los efectos adversos pueden variar, siendo, lógicamente, la vía intravenosa la más proclive a introducir enfermedades infecciosas producidas por agujas infectadas o sin asepsia. Además, no hay que olvidar que los cocainómanos son policonsumidores y las otras drogas que acompañan al consumo de cocaína pueden tener efectos sinérgicos con los nocivos producidos por la cocaína.
AgradecimientosEn la elaboración de este trabajo han contribuido las ayudas a la investigación proporcionadas por el Instituto de Salud Carlos III (números de expediente G03/05 y RD06/0001/0029) de la Red de Trastornos Adictivos (RTA) y el Plan Nacional sobre Drogas (PNSD; convocatorias 2001-2003 y 2004-2006).
El autor declara que no existe conflicto de intereses.
Correspondencia:
E. AMBROSIO FLORES
Departamento de Psicobiología.
Facultad de Psicología.
Universidad Nacional de Educación a Distancia (UNED). C/ Juan del Rosal n.º 10.
28040 Madrid, España.
Correo electrónico: eambrosio@psi.uned.es
Recibido: 3-07-2008
Aceptado para su publicación: 10-07-2008