Introducción
La cocaína es un psicoestimulante motor que, además de incrementar el estado de alerta, produce una estimulación conductual con una potente estimulación motora. Cuando la cocaína se administra de manera crónica produce cambios prolongados en el comportamiento, sensibilización conductual y también adicción. Se cree que la cocaína es uno de los mayores reforzadores naturales que existen hoy en día y, por tanto, que la adicción que produce es bastante seria y acarrea trastornos en el comportamiento en un plazo relativamente corto. Estos datos vienen avalados por la experiencia clínica o asistencial que evidencia el corto período de tiempo que transcurre entre el inicio del consumo importante de esta droga y la búsqueda de ayuda médica por el propio individuo. Cómo la exposición a cocaína induce cambios a largo plazo en la conducta y una potente adicción es todavía un problema sin resolver; en este capítulo vamos a resumir algunos de los mecanismos moleculares principales asociados con la plasticidad neural que produce la cocaína.
Acciones de la cocaína
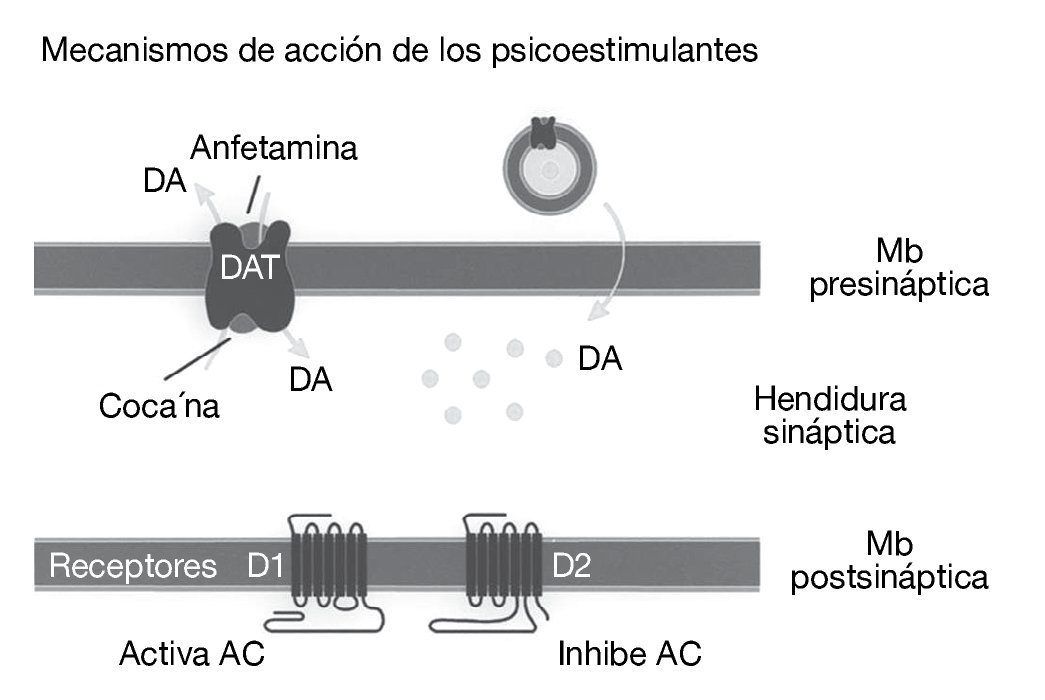
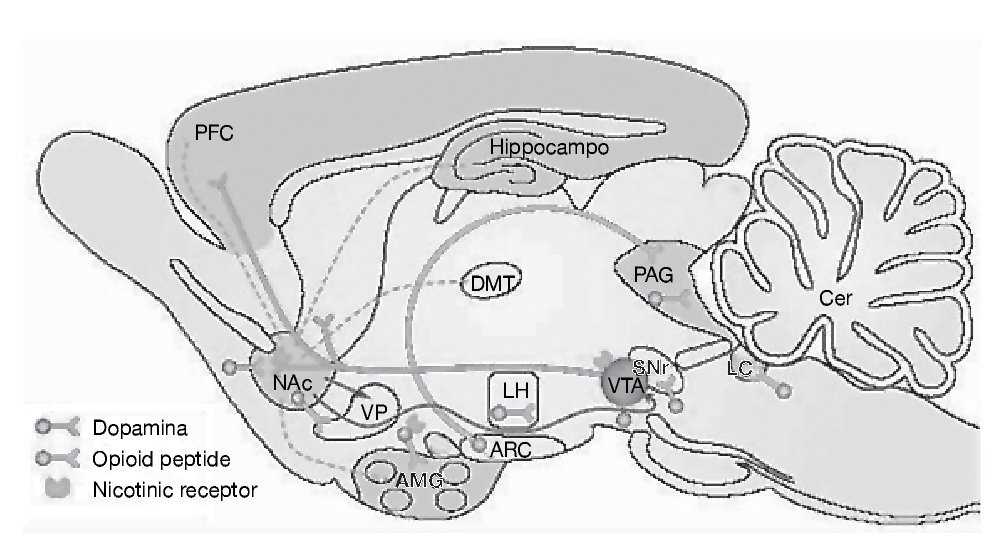
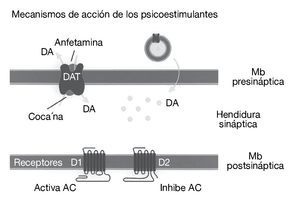
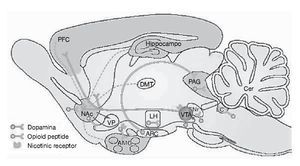
Como ya se ha comentado, la cocaína es un agonista dopaminérgico indirecto. Se une con gran afinidad al transportador de la dopamina bloqueándolo y, en consecuencia, produce un gran aumento en la concentración de dopamina en la hendidura sináptica, próxima a los receptores dopaminérgicos (fig. 1). Es esta estimulación dopaminérgica la responsable de la mayoría de los efectos reforzadores de la cocaína y de los efectos sobre la activación motora. La cocaína también bloquea la recaptación de otras monoaminas como la serotonina y la noradrenalina, pero parece ser que este hecho no interviene en las propiedades reforzadoras de la cocaína. Por tanto, el sistema dopaminérgico es el principal sustrato neuronal de los efectos reforzadores de la conducta adictiva inducida por cocaína, y no sólo por cocaína, sino también por la mayoría de las drogas de abuso. Dentro del sistema dopaminérgico la vía mesocorticolímbica representa el sustrato anatómico de las respuestas motoras y reforzadoras de la cocaína. Esta vía neural está compuesta por las neuronas dopaminérgicas del área tegmental ventral (ATV) que proyectan fundamentalmente al núcleo accumbens, al tubérculo olfatorio y a las cortezas prefrontal y cingular (fig. 2)1.
Figura 1. Representación esquemática del mecanismo de acción de la cocaína. La cocaína bloquea la recaptación de dopamina inactivando el transportador de dopamina (DAT) en la terminal nerviosa de las neuronas dopaminérgicas. AC: adenilato ciclasa; DA: dopamina; Mb: membrana.
Figura 2. Representación esquemática de la vía dopaminérgica mesocorticolímbica implicada en los procesos de drogadicción. Las neuronas dopaminérgicas del área tegmental ventral (VTA) ilustradas en rojo en la figura, mandan sus proyecciones al núcleo accumbens del septo (NAc), estriado dorsal (C-P) y a la corteza prefrontal (PFC). Modificada de Nestler1.
Respuesta conductual a la exposición de cocaína
Conductualmente en roedores la administración aguda de cocaína incrementa de manera consistente la actividad motora, efecto típico de los psicoestimulantes. En dosis bajas los incrementos generales en la actividad consisten en un incremento de la actividad horizontal, alzamientos, acicalamientos (grooming) y actividad exploratoria. En dosis más altas se produce un incremento en la conducta estereotipada (mordisqueos y olisqueos, etc.). También se ha demostrado que la respuesta motora viene mediada principalmente por el sistema mesolímbico, puesto que es inhibida con antagonistas dopaminérgicos administrados intracerebralmente en el núcleo accumbens2-4, mientras que la conducta estereotipada está mediada principalmente por el sistema nigroestriatal, aunque los dos sistemas dopaminérgicos contribuyan en mayor o menor grado en ambas respuestas conductuales.
Con la administración crónica de cocaína se observa un aumento en la respuesta motora que se llama sensibilización conductual. La sensibilización conductual o tolerancia inversa es un aumento progresivo de la respuesta conductual (aumento de la locomoción y la estereotipia) producida por dosis repetidas de cocaína. Estudios conductuales con animales de experimentación demuestran que la sensibilización conductual es un fenómeno persistente, ya que perdura durante meses después de la abstinencia a la administración crónica de cocaína, y sugieren que la sensibilización pudiera estar relacionada con el craving o deseo compulsivo por la droga. También se ha visto que existe una sensibilización conductual cruzada entre los diferentes psicoestimulantes. Este hecho indica que mecanismos neuroquímicos y moleculares similares están sustentando las diferentes formas de sensibilización conductual. Una de las alteraciones más ampliamente observadas asociadas a la sensibilización conductual inducida por cocaína y otros psicoestimulantes es un aumento en la habilidad de éstos para producir una potenciación en la liberación de dopamina en el estriado dorsal y ventral que, a su vez, aumenta la actividad de la adenilato ciclasa y de la proteína kinasa A. Estas observaciones se han llevado a cabo en estudios de microdiálisis y en preparaciones con rodajas cerebrales in vitro5. Además, este aumento en la liberación de dopamina en el núcleo accumbens se correlaciona bastante bien con un incremento en la autoadministración de cocaína en animales previamente sensibilizados. Estos datos corroboran datos clínicos que evidencian un mayor deseo compulsivo en administrarse la droga cuanto mayor es el consumo crónico en el ser humano. Además hay datos clínicos que demuestran que no se produce adicción a la cocaína si previamente el individuo no se ha sensibilizado a ella. Todo ello sugiere que la sensibilización conductual y la adicción a la cocaína pueden tener mecanismos moleculares similares si no idénticos.
Respuesta molecular a la exposición de cocaína: inducción de genes de expresión temprana o factores de transcripción
Desde el punto de vista neurobiológico, la cocaína, al igual que la anfetamina, produce cambios a corto y a largo plazo en el sistema nervioso central (SNC) que están implicados en los procesos de adicción que causan estas drogas. La cocaína, al estimular aunque indirectamente los receptores dopaminérgicos, activa la vía dependiente del adenosín monofosfato cíclico (AMPc) y estimula la proteína kinasa A, que, a su vez, produce la fosforilación de varias proteínas, entre las que cabe destacar CREB (del inglés cAMP responsive element binding protein) y ERK (kinasas reguladas mediante señales extracelulares). Estas proteínas fosforiladas son las que inducen la expresión de diversos factores de trascripción en el núcleo de las neuronas activadas por cocaína. El proceso de fosforilación proteica representa uno de los principales mecanismos o procesos regulatorios mediante el cual un estímulo extracelular influye en todos los procesos neuronales, incluyendo la generación de potenciales sinápticos e incluso el desarrollo y mantenimiento de las características diferenciales de las neuronas. El proceso de fosforilación altera pues las características funcionales de las proteínas presentes y puede también inducir la síntesis de nuevas proteínas a través de la inducción de genes de expresión temprana o genes inmediatos (IEG, del inglés inmediate early genes). Estos genes son proteínas nucleares que se unen al ADN de otros genes, en la parte promotora, para modular su expresión.
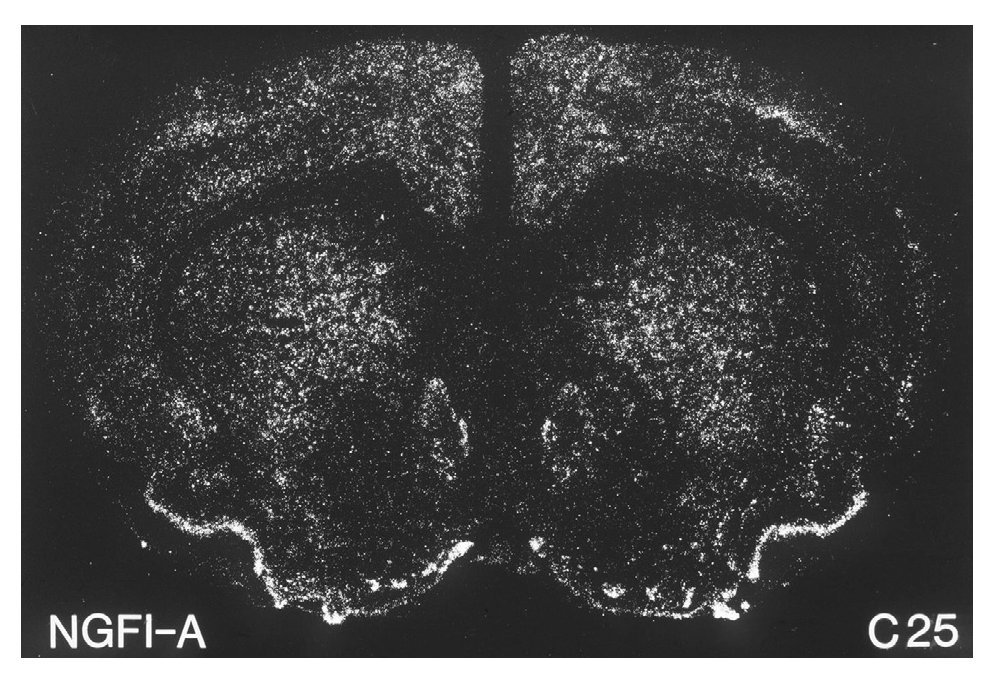
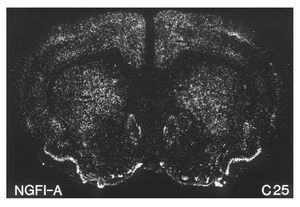
A principios de la década de los noventa, varios investigadores demostraron que la administración aguda de cocaína o anfetamina inducía la expresión estriatal de varios de estos factores de trascripción. Entre éstos cabe destacar6-8 c-Fos, Fos B, Jun B, NGFI-A, etc., por ser los primeros que se estudiaron (fig. 3). Más recientemente se ha demostrado la inducción de otras proteínas como veremos más adelante. El hecho, en concreto, de que la cocaína pueda cambiar el patrón de expresión de estos genes sugiere un mecanismo mediante el cual no sólo la actividad a corto plazo de estas neuronas sino también su funcionamiento a largo plazo pueden ser significativamente modificados por la exposición a la cocaína. El patrón específico de la regulación de factores de trascripción determina qué cascadas de expresión génica neuronal alterada tienen lugar después de la exposición a la droga. En este sentido, la fosforilación de CREB inducida por cocaína produce un aumento rápido, dosis-dependiente, de la expresión de varios de estos genes, entre los que cabe destacar c-Fos, Fos B, Jun B, NGFI-A, NGFI-B, NF-kB, Akt y Cdk5, etc1.
Figura 3. La cocaína induce la expresión del factor de transcripción NGFI-A. Microfotografía que ilustra la expresión del ARN mensajero de NGFI-A en el estriado dorsal y ventral inducida por la administración de 25 mg/kg de cocaína en ratas. Tomada de Moratalla et al8.
El aumento de estos genes de expresión temprana se produce en el núcleo de las neuronas activadas por la cocaína. Estas neuronas están localizadas en la corteza y fundamentalmente en el estriado dorsal (caudoputamen) y en el ventral o núcleo accumbens. Niveles de activación bajos también se observan en otras áreas del cerebro como el hipocampo, la sustancia negra (SN) y el ATV. El producto proteico de estos genes tiene una vida media de alrededor de 2-4 horas, con excepción del Fos B truncado (ΔFosB) cuya vida media es superior a las 24-30 horas. La expresión de estos genes se correlaciona con los efectos conductuales que produce la cocaína9, ya que el bloqueo farmacológico o molecular de su expresión inhibe también la manifestación de la respuesta conductual inducida por cocaína, como la actividad motora, la estereotipia, etc.10,11. De modo que las que alteraciones en la expresión génica sustentan algunos de los cambios comportamentales a largo plazo que induce la cocaína.
La administración crónica de cocaína induce de forma selectiva la expresión del ΔFosB en las neuronas del núcleo accumbens. Los niveles del ΔFosB se acumulan durante el tratamiento crónico y permanecen elevados durante mucho tiempo después debido a la alta estabilidad de la proteína. Por eso se ha propuesto que el ΔFosB es responsable de la mayoría de los cambios a largo plazo en la expresión génica implicados en la adicción. Así, en ratones mutantes que sobreexpresan el ΔFosB en el núcleo accumbens se ha visto que desarrollan una mayor preferencia en el condicionamiento espacial inducido por cocaína, aumentan la conducta de autoadministración y el incentivo emocional por la cocaína12. En definitiva, la expresión prolongada del ΔFosB en el núcleo accumbens incrementa los efectos reforzadores de la cocaína.
Efectos electrofisiológicos de la cocaína
Los efectos electrofisiológicos de la cocaína en las neuronas postsinápticas a las terminales dopaminérgicas y en los cuerpos celulares dopaminérgicos han sido estudiados extensivamente. Las neuronas dopaminérgicas de la SN y del ATV tienen una frecuencia de disparo baja con potenciales de acción elevados. Estas características las diferencian de neuronas vecinas no dopaminérgicas. La dopamina y los agonistas dopaminérgicos, en concentraciones bajas, inhiben estas neuronas debido en la estimulación de receptores D2 presinápticos. La cocaína ejerce un efecto inhibitorio en estas neuronas debido a un bloqueo del transportador de la dopamina en las dendritas y a la subsiguiente estimulación de los receptores D2 presinápticos13,14. Aunque en las regiones de proyección de las neuronas dopaminérgicas mesocorticolímbicas los efectos de la dopamina pueden llegar a ser considerablemente mucho más complicados, debido a la existencia de diversos receptores dopaminérgicos localizados pre- y postsinápticamente, así como a la heterogeneidad de las poblaciones celulares intrínsecas en estas regiones cerebrales, generalmente se acepta que la cocaína ejerce un efecto inhibitorio en la actividad eléctrica de las neuronas que reciben proyecciones monoaminérgicas de los grupos celulares del cerebro medio. Varios estudios han demostrado que la cocaína inhibe la actividad eléctrica de las neuronas dopaminérgicas (SN y ATV), de las neuronas noradrenérgicas (locus coeruleus) y de las neuronas serotonérgicas (núcleo dorsal del rafe). En cambio, el isómero inactivo de la cocaína no tiene ningún efecto sobre la actividad eléctrica de estas neuronas. Sin embargo, un derivado de la cocaína, el 2B-carbometoxy-3B-(4-fluorofenil) tropano (conocido por WIN 35.428 o CFT) es 10 veces más potente que la cocaína en la inhibición de la actividad eléctrica. No obstante, este compuesto es menos selectivo que la cocaína para el sistema dopaminérgico15.
Receptores y neuronas que responden al tratamiento con cocaína
Fenotipo molecular de las neuronas que responden al tratamiento con cocaína
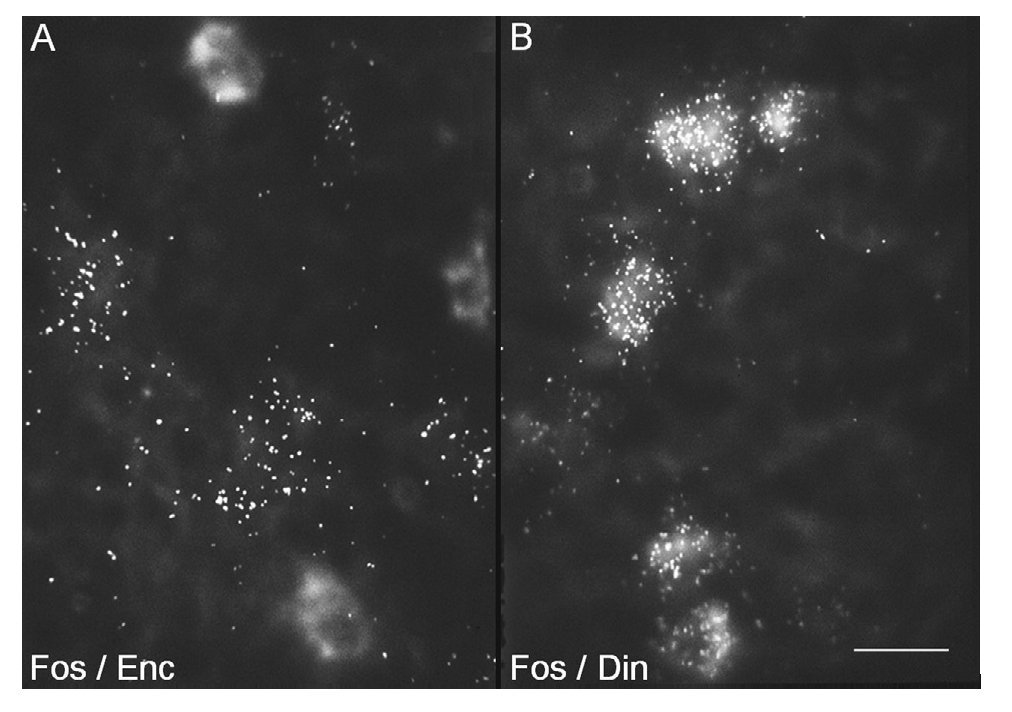
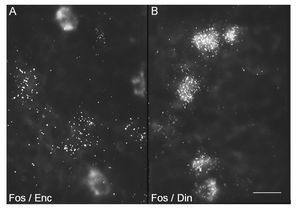
Estos factores de trascripción también se utilizan como marcadores de la actividad celular. Por consiguiente, estudios de doble hibridación in situ y de doble inmunocitoquímica con c-Fos en combinación con cada uno de los marcadores de los distintos tipos de neuronas estriatales, han revelado el fenotipo molecular de las neuronas que responden a la cocaína. Así, sabemos que la cocaína activa fundamentalmente las neuronas estrionigrales, ya que la expresión de c-Fos y de ΔFosB inducida por cocaína tiene lugar en estas neuronas9 (fig. 4), cuyo marcador específico es el neuropéptido dinorfina y el receptor dopaminérgico D1. Estas neuronas son de tamaño mediano, con numerosas espinas en su complejo árbol dendrítico, y proyectan a la SN. Las neuronas estriopalidales (cuyo marcador específico es el neuropéptido encefalina) no expresan estos factores de transcripción inducidos por cocaína (fig. 4). Es de hacer notar que el tratamiento crónico con cocaína, además de inducir c-Fos y ΔFosB en las neuronas estrionigrales también lo hace en las neuronas que expresan somatostatina. Estas neuronas son interneuronas, puesto que no proyectan fuera del estriado y tienen un tamaño algo mayor que las neuronas de proyección. Puesto que están localizadas generalmente en la matriz, cerca de los límites con los estriosomas, se les ha adscrito una función de comunicación entre los dos compartimentos. Habida cuenta de esto, la activación de estas neuronas con el tratamiento crónico con cocaína podría estar mediando el aumento en la activación de los estriosomas y del sistema límbico.
Figura 4. La cocaína induce c-Fos en las neuronas estriatales de proyección de la vía directa. Microfotografías de células estriatales que ilustran la inducción de c-Fos en las neuronas de proyección marcadas mediante hibridación in situ doble con ribosondas específicas para detectar c-Fos y los neuropéptidos encefalina (A) o dinorfina (B). La ribosonda de c-Fos se marcó con digoxigenina, mostrada aquí de manera difusa, mientras que las de proencefalina y prodinorfina se marcaron con 35S y se muestran con puntos, representativos de los granos de plata. La barra indica 15 μm.
Receptores dopaminérgicos implicados en las acciones de la cocaína
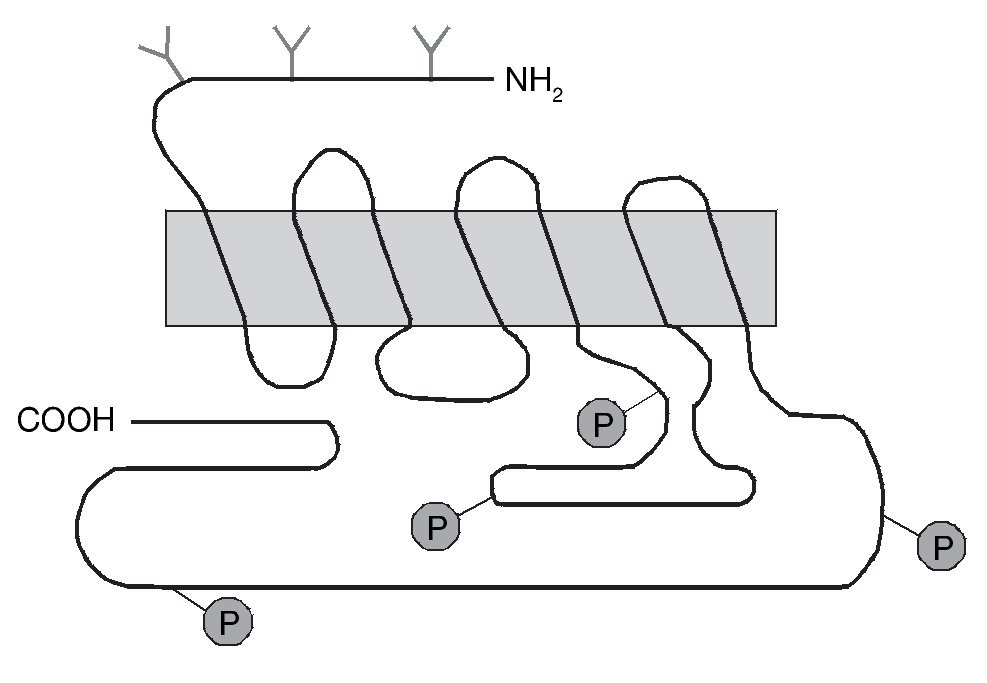
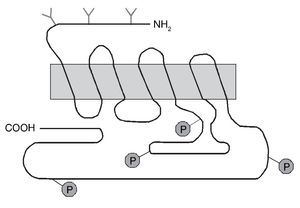
Uno de los receptores dopaminérgicos que más tempranamente se involucró con las acciones de la cocaína es el receptor dopaminérgico D1. Este receptor presenta siete dominios transmembrana (fig. 5), pertenece a la familia de receptores que se acopla a las proteínas G y su activación estimula la enzima adenilato ciclasa. Actualmente poseemos una gran cantidad de información en cuanto a la estructura, mecanismo de activación y función de este y otros receptores gracias a la aplicación de técnicas moleculares de manipulación génica, entre las que cabe destacar, entre otras, aquellas que permiten la generación de ratones knock-out (KO) en los que se han suprimido específicamente algunos de los genes que codifican estos receptores. Con estos ratones KO se puede estudiar el papel específico que desempeña cada uno de los subtipos de receptores en diferentes modelos animales de adicción, de sensibilización dopaminérgica o de enfermedades neurodegenerativas.
Figura 5. Representación esquemática de la estructura del receptor dopaminérgico D1. El receptor dopaminérgico D1 tiene siete dominios transmembranales y pertenece a la familia D1 que estimula la adenilato ciclasa (AC). En el extremo carboxilo se representan los sitios aproximados para la fosforilación (P) del receptor. En el extremo amino se representan también los sitios aproximados de glicosilación (Y). Modificada de Missale et al16.
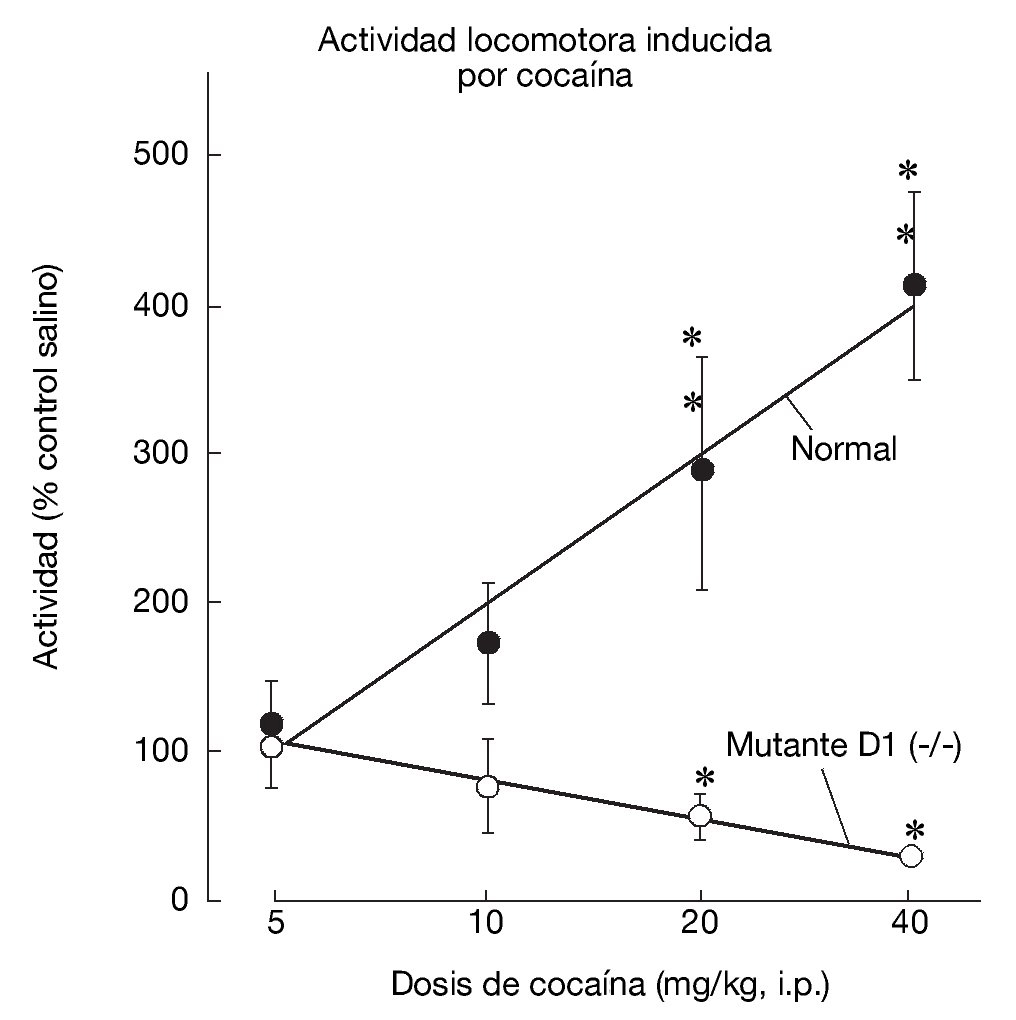
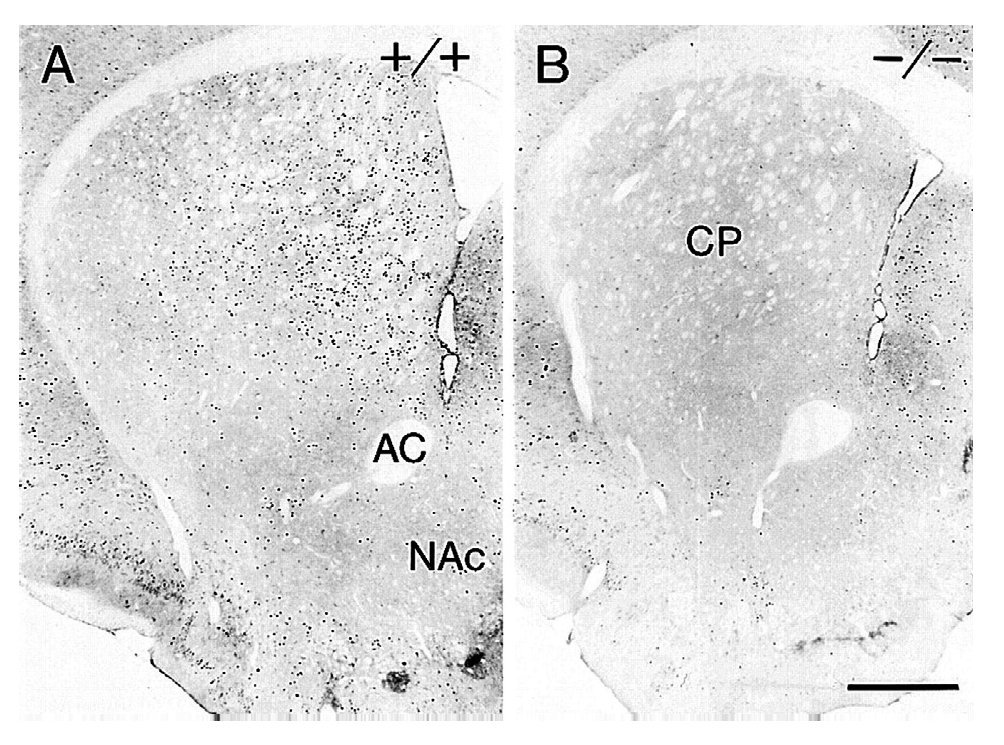
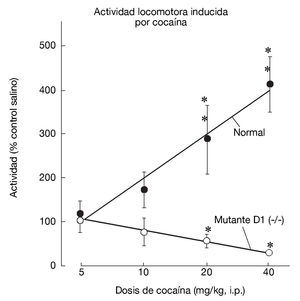
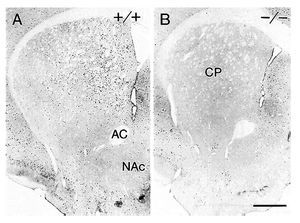
La generación y estudio de ratones genéticamente modificados para suprimir el gen que codifica el receptor D1 (D1-/-) han demostrado el papel primordial de este receptor en las acciones de la cocaína17,18. La inactivación del receptor D1 inhibe la respuesta conductual al tratamiento agudo con cocaína o anfetamina, bloqueando la actividad motora, la conducta estereotipada y la inducción de sensibilización motora tras el tratamiento crónico (fig. 6). Paralelamente a estos resultados conductuales, dicha inactivación bloquea la expresión de los factores de transcripción como c-Fos, ΔFosB y Jun B por psicoestimulantes (fig. 7). También se ha demostrado que la integridad del receptor D1 es necesaria para la expresión basal y la inducida de los neuropéptidos dinorfina y sustancia P, marcadores por otra parte de las neuronas que forman la vía directa de las proyecciones estriatales. Estos resultados concuerdan con la expresión del receptor D1 en estas neuronas.
Figura 6. La inactivación del receptor dopaminérgico D1 en animales genéticamente modificados bloquea la activación motora inducida por cocaína. En animales sanos (WT, del inglés wild-type), la cocaína induce un incremento dosis-dependiente de la actividad locomotora. Este incremento no se produce en los animales mutantes (D1-/-). Tomada de Xu et al17.
Figura 7. La inactivación del receptor dopaminérgico D1 bloquea la expresión de c-Fos inducida por cocaína en el estriado. Microfotografías de secciones coronales de estriado de ratones tratados con 40 mg/kg de cocaína 2 horas antes de la perfusión intracardíaca. Resultados con ratones sanos (+/+) (A) y con ratones mutantes (D1-/-) (B). AC: adenilato ciclasa; CP: caudado putamen; NAc: núcleo accumbens. Tomada de Moratalla et al10.
Consecuencias a largo plazo de la administración de cocaína
Cambios persistentes en la respuesta de las neuronas estriatales
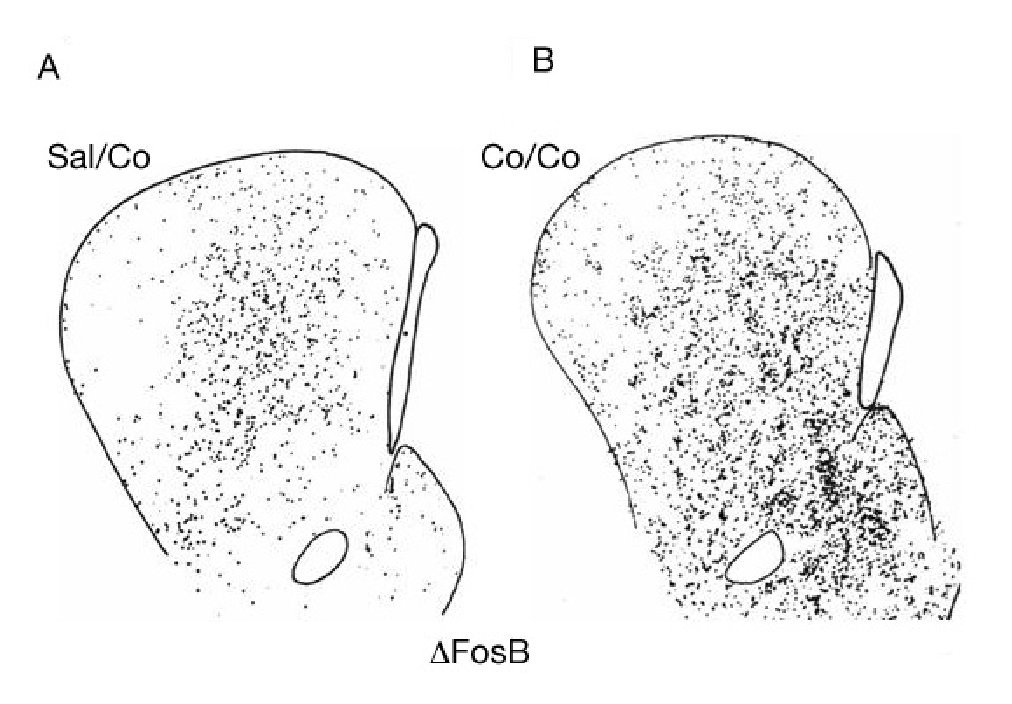
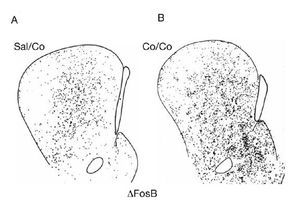
Como se ha mencionado en el apartado anterior, la cocaína induce la expresión de varios IEG en el estriado. Esta expresión es bastante homogénea y se produce con igual intensidad en los dos compartimentos estriatales (estriosomas y matriz). Sin embargo, a los pocos días de la exposición repetida a cocaína se produce un cambio en el patrón de expresión génica. Una dosis más de cocaína ya no produce un patrón homogéneo sino que induce un patrón irregular de expresión génica. En concreto, en la parte rostral del estriado se observa mayor expresión de ΔFosB en los estriosomas que en la matriz (fig. 8). Este cambio permanece inalterado incluso meses después de la abstinencia a cocaína en ratas. Es decir, una dosis de desafío después de una abstinencia a cocaína de uno o dos meses produce un patrón de expresión génica irregular9,19. Además, la autoadministración de cocaína o la administración crónica de cocaína induce la expresión de ΔFosB en la corteza orbitofrontal20, aumenta el número de espinas dendríticas en las neuronas del núcleo accumbens21 y produce acetilación de las histonas en la cromatina de las neuronas del accumbens22. Recientemente se ha demostrado una asociación entre impulsividad y el cambio al uso compulsivo de drogas23, mientras que inyecciones de antagonistas de los receptores NMDA en la amígdala previenen la reconsolidación de memorias asociadas al consumo de drogas24. Efectos similares se han demostrado con el psicoestimulante anfetamina.
Figura 8. Patrón anatómico de la distribución de la expresión de ΔFosB inducida por cocaína. Microfotografías de secciones transversales de cerebro de rata que ilustran la inducción de ΔFosB tras el tratamiento agudo con 25 mg/kg de cocaína (A) o crónico durante 14 días (B). Obsérvese el incremento en la inducción de ΔFosB con el tratamiento crónico y el cambio en el patrón de su distribución. El tratamiento agudo induce ΔFosB de forma homogénea, mientras que el crónico lo hace preferentemente en los estriosomas. La barra indica 1 mm. Tomada de Moratalla et al10.
Estos resultados son muy interesantes, ya que los dos compartimentos estriatales median acciones distintas del estriado en virtud de las conexiones que reciben y mandan las neuronas que los componen. Se considera que la matriz es la parte motora del estriado, mediando la respuesta motora, y los estriosomas la parte límbica, mediando los procesos emocionales. El diferente patrón de expresión génica inducido por los tratamientos agudo y crónico de cocaína refleja su diferente respuesta comportamental, proporcionando el sustrato anatómico de la potenciación de los procesos emocionales inducidos por la exposición crónica y por ende del proceso de adicción.
Agradecimientos
A Oskar Ortiz y Noelia Granado por su valiosa ayuda con el procesador de textos y con las figuras, así como por la lectura crítica del manuscrito. El trabajo de investigación está financiado por el Ministerio de Sanidad y Consumo (PI071073), Plan Nacional Sobre Drogas, y por el Instituto de Salud Carlos III, FIS, mediante la Red de Trastornos Adictivos, RD06/0001/1011 y CIBERNED, CB06/05/0055.
La autora declara que no existe conflicto de intereses.
Correspondencia:
R. MORATALLA
Instituto Cajal.
CSIC.
Avda. Dr. Arce n.º 37.
28002 Madrid. España.
Correo electrónico: moratalla@cajal.csic.es
Recibido: 20-05-2008
Aceptado para su publicación: 28-06-2008