Introducción
El consumo de drogas de abuso por parte de la madre gestante puede ocasionar un variado grupo de alteraciones al feto y al neonato1-5. Teóricamente, estas alteraciones pueden deberse a cuatro mecanismos causales básicos: intoxicación, supresión, modo de uso de la droga y tipo de vida de la madre. Sin embargo, en la práctica clínica las consecuencias de estos cuatro mecanismos son, en la mayoría de las ocasiones, indiferenciables. Sólo por motivos docentes podemos distinguir:
1. Morbilidad por intoxicación: El uso de drogas por la gestante hace que los órganos del embrión/feto se expongan a sustancias posiblemente nocivas para su desarrollo.
2. Morbilidad por supresión: Durante el embarazo, los episodios de abstinencia maternos pueden ocasionar daño al embrión/feto. Además, tras el nacimiento, la separación brusca de niño y madre da lugar al cuadro de abstinencia neonatal aguda.
3. Morbilidad por modo de uso de la droga: Algunas sustancias generan patología por su modo de consumo. Así, la vía intravenosa se asocia a ciertas enfermedades (infecciosas, tóxicas, teratogénicas,...) cuyo origen reside en el consumo con jeringuillas compartidas, la escasa higiene de las punciones, el uso de sustancias que adulteran la heroína,...
4. Y morbilidad por el tipo de vida de la madre: Las madres en consumo de sustancias de abuso están, generalmente, desnutridas, poco cuidadas, con gestaciones mal controladas y viviendo en ambientes muy marginales.
Estos cuatro mecanismos pueden dar lugar a un variado grupo de patología feto-neonatal, que podemos resumir en los siguientes cuadros:
Aborto o mortinato: mayor frecuencia de pérdidas fetales a distintas edades gestacionales.
Crecimiento intrauterino retardado: nacimiento de niños con bajo peso para su edad gestacional.
Prematuridad: nacimiento de niños antes de la 37 semana de edad gestacional.
Teratogénesis: aparición de malformaciones congénitas.
Parto patológico y asfixia perinatal: nacimiento por partos distócicos, con sufrimientos fetales y con necesidad de reanimación neonatal.
Síndrome de abstinencia neonatal agudo: cuadro clínico de abstinencia aguda que puede aparecer en el neonato a las pocas horas de vida, tras la separación brusca de una madre en consumo.
- Síndrome de abstinencia subagudo o crónico: clínica de irritabilidad, alteraciones del comportamiento, problemas con el sueño,... que aparecen en algunos hijos de madre toxicómona durante los primeros meses o años de vida.
Infección congénita: posibles infecciones transmitidas verticalmente desde la madre.
Problema social: situaciones de riesgo socio-familiar que pueden afectar al niño tras su alta hospitalario.
Aunque la frecuencia varía en gran medida de unos centros a otros, en nuestro medio la incidencia de «Hijo de Madre Toxicómana» es de 8 recién nacidos por cada 1.000 recién nacidos vivos6. Esta frecuencia depende, entre otros factores, del hábitat (urbano, industrial, rural,...) y del tipo de hospital (público, privado, nivel de asistencia,...). En estudios prospectivos, con detección de casos por screening de orina y/o heces, las cifras de exposición materna a sustancias de abuso son mucho mayores, llegando a alcanzar prevalencias del 5% de las gestaciones7.
Se ha dicho que la frecuencia tiende a disminuir actualmente en nuestro medio, tras alcanzar un pico de máxima frecuencia a finales de los 80, aunque lo que realmente ha variado, más que la incidencia, es el tipo de droga, y sobre todo, la vía de su utilización.
En este sentido, existen varios aspectos que merecen la pena ser destacados a la hora de valorar a estos niños. El primero es la poca fiabilidad materna a la hora de historiar su consumo. Aunque cada día con mayor frecuencia son las madres las que declaran su toxicomanía, no siempre es así. Por este motivo debe sospecharse esta posibilidad en toda madre que solicite el alta voluntaria a las pocas horas del parto, en madres que soliciten medicación para el dolor frecuentemente, o en todo niño que presente irritabilidad sin causa justificada.
Otro aspecto interesante es la politoxicomanía y los patrones de uso cambiantes. Muchas madres presentan consumo de varias sustancias a la vez, de forma inconstante y desordenada, y por distintas vías (intravenosa, inhalada, esnifada, oral,...), por lo que es difícil determinar que tipo de clínica se debe a una sustancia determinada.
Por último, su modo de vida tampoco ayuda a aclarar los diagnósticos. Suelen ser madres marginales, desnutridas, algunas de ellas dedicadas a la prostitución e infectadas por gérmenes específicos (hepatitis B y C, virus inmunodeficiencia humana, herpes, lues, tuberculosis,...). Todos estos factores hacen difícil saber la patología neonatal que se debe al consumo de tóxicos y lo que se debe al resto de factores.
Sustancias de consumo y efectos sobre el feto
El transporte placentario de sustancias, de la madre al feto y del feto a la madre, se establece alrededor de la quinta semana de vida embrionaria. Sin embargo, antes de formarse la placenta, cualquier sustancia puede actuar directamente sobre las células embrionarias o, por otra vía, sobre los órganos maternos, en este caso alterando su función y afectando de forma indirecta al feto.
Casi todas las sustancias de abuso cruzan fácilmente la placenta durante el embarazo, exponiendo al embrión/feto a concentraciones iguales, o incluso superiores, a las que tiene su madre en sangre8.
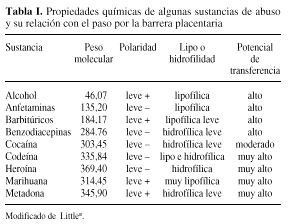
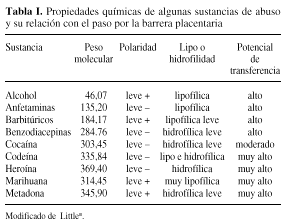
En general, las sustancias que mejor cruzan la placenta son las de bajo peso molecular (menor a 990 D), las sustancias con baja polaridad y las sustancias lipofílicas (Tabla I). Sin embargo, la gran mayoría atraviesan la barrera placentaria e, incluso, algunas se metabolizan en las vellosidades coriales dando lugar a metabolitos tóxicos.
Aunque ya comentamos que es difícil separar los efectos por drogas en los niños debido a la gran cantidad de factores que intervienen, podríamos esquematizar cierta relación causal entre las diferentes drogas y los siguientes efectos:
Narcóticos: Son causa reconocida de abortos, crecimiento intrauterino retardado, prematuridad y partos patológicos. Son las sustancias que definen el llamado síndrome de abstinencia agudo y subagudo por excelencia. Para muchos autores, son causantes de efectos conductuales a largo plazo3,9.
Cocaína: Tanto esnifada como fumada da lugar a efectos deletéreos. Al tener un importante efecto anorexígeno, las madres que la consumen suelen presentar desnutrición que afecta al crecimiento fetal. Además, en los últimos años ha habido varias publicaciones donde se objetiva efectos sobre la circulación materna y fetal (disminución del riego uterino, vasoconstricción periférica fetal,...). Por este motivo se han justificado efectos teratogénicos (defecto reducción extremidades, malformaciones urológicas y digestivas,...), desprendimiento prematuro de placenta, accidentes cerebrovasculares fetales, alteraciones EEG al nacimiento,... Algunos autores hablan de un síndrome de abstinencia a cocaína, aunque otros niegan que exista10,11.
Benzodiacepinas: Tienen un efecto teratogénico reconocido aunque de escasa frecuencia. Pueden producir alteraciones de la línea media como hendidura palatina, labio leporino, alteraciones del cuerpo calloso... y un posible fenotipo característico tipo «alcohol-fetal». También se describe un síndrome de abstinencia similar al de los opiáceos y un cuadro clínico llamado «lactante laxo» («floppy infant»)12.
Cannabis: Aunque no existen estudios que avalen su seguridad, no parece que su consumo se asocie a teratogenicidad, ni a alteraciones como prematuriadad y/o crecimiento intrauterino retardado. Tampoco se han descrito síndromes de abstinencia que precisen tratamiento, si bien se ha publicado asociación con alteraciones del sueño. Es más discutido el posible efecto conductual a largo plazo que mantienen algunos autores13.
Alcohol: El consumo de alcohol por la gestante se asocia a un alto porcentaje de abortos y mortinatos, siendo causa reconocida de dismorfogénesis. El llamado síndrome alcohol-fetal conlleva retraso crecimiento prenatal y postnatal, alteraciones del desarrollo psicomotor, alteraciones de la linea media (cardiacas, cerebrales y esqueléticas) y fenotipo facial característico (microcefalia, hendiduras palpebrales pequeñas, filtrum largo y plano,...). Puede producir, además, un síndrome de abstinencia más o menos agudo14-16.
Tabaco: Es la sustancia de abuso más frecuente en nuestra sociedad. Aunque no se ha demostrado que se asocie a patología neonatal importante, si se asocia a neonatos de bajo peso para su edad gestacional a través de elevar los niveles de carboxihemoglobina materna y fetal y de cierta acción vasoconstrictora secundaria a la nicotina. El tabaco materno se asocia a mayor riesgo de muerte súbita del lactante17.
Otras: Las anfetaminas, barbitúricos, drogas inhaladas y drogas de diseño también se asocian a distintas patologías neonatales18-21.
Clínica del Síndrome de Abstinencia Neonatal
El cese brusco del aporte de algunas sustancias de abuso al recién nacido en el momento del parto, al cortar el cordón umbilical, hace que el niño pueda iniciar, en las horas o días siguientes, un cuadro de deprivación aguda de dichas sustancias1.
Descrito clásicamente para los opiáceos, actualmente también se considera el síndrome de abstinencia neonatal para las benzodiacepinas y para otras drogas. La intensidad de la clínica, su momento de inicio y su duración, depende de la sustancia o sustancias que la madre haya consumido, de su patrón de uso, de la cantidad consumida y de la última dosis recibida. Asimismo, existe cierta variación interpersonal o propia de cada neonato, tanto para la intensidad como para su inicio y duración.
Se puede dividir la clínica del síndrome de abstinencia neonatal agudo en tres grandes grupos (Tabla II):
1. Irritabilidad de SNC: Los recién nacidos presentan temblores, sueño escaso o fragmentado, llanto frecuente y agudo, hipertonía, reflejos hiperactivos, bostezos, estornudos e, incluso, pueden llegar a presentar convulsiones.
2. Disfunción gastrointestinal: Los niños tienen dificultades para su alimentación, con succión incoordinada, vómitos, diarrea, deshidratación, escasa ganancia ponderal y otros problemas relacionados.
3. Signos autonómicos: Pueden presentar taquicardia, taquipnea, cianosis, sudoración profusa, congestión nasal, fiebre, piel moteada o inestabilidad térmica, sin causa aparente.
Por todos estos motivos, en la exploración pueden verse lesiones en la piel por fricción o rascado en la cara, codos, rodillas y otros lugares de roce debidas a la irritabilidad, así como gran enrojecimiento perianal debido a la diarrea acuosa.
El inicio de la clínica depende de la sustancia (realmente, de su vida media), de la dosis de uso y del tiempo desde la última dosis. Para los opiáceos, la clínica suele comenzar a las 48-72 horas del nacimiento, aunque esto es muy variable. El alcohol, por ejemplo, puede dar irritabilidad muy precoz, y, en cambio, los barbitúricos suelen dar deprivación tardía.
Por otro lado, la duración de la clínica cambia mucho de unos casos a otros. Como regla general, la metadona da una abstinencia de inicio más tardío pero más prolongada que otros opiáceos. Para esta sustancia existe el acuerdo de que la madre debería llegar al parto con una dosis menor de 20 mg/día para evitar síndromes de abstinencia neonatal largos e intensos. Sin embargo, es aceptado por todos que es mejor tener a una madre bien controlada con metadona que someterla a una gestación con intoxicaciones y deprivaciones continuas por uso irregular de sustancias de abuso.
Con el fin de valorar la intensidad y duración del síndrome de abstinencia neonatal y poder recomendar un protocolo de manejo clínico se han propuesto múltiples scores o puntuaciones. Las puntuaciones de Khan y Ostrea son escalas subjetivas y dividen al síndrome de abstinencia en leve, moderado y severo. La puntuación de Finnegan22, la más utilizada en nuestro medio, es una escala numérica que valora 31 ítems (algunas modificadas valoran menos ítems) y que es muy útil para valorar el tratamiento de estos niños (Tabla III). Últimamente se ha propuesto una puntuación más simple propuesta por Lipsitz con 11 ítems, puntuados de 0 a 3, y que parece tan útil como la de Finnegan y más sencilla de cumplimentar.
Si se sospecha síndrome de abstinencia neonatal a sustancias de abuso debemos realizar una historia dirigida y pormenorizada para preguntar a la madre por tipo de droga, cantidad, última dosis, modo de empleo,... La determinación de tóxicos en orina y/o meconio pueden ser muy útiles. Esta método diagnóstico ha sido muy discutido desde el punto de vista ético y la mayoría de los autores reconocen que puede realizarse sin permiso de los padres en aquellos niños con sospecha de abstinencia. Como la duración de la eliminación urinaria de estas sustancias es relativamente corta, el test solo tendrá valor en las primeras horas de vida. En cualquier caso, conviene realizar un amplio diagnóstico diferencial con otras patologías neonatales (hipoglucemia, hipocalcemia, infección, hemorragia intracraneal,...) que puedan explicar la clínica.
Tratamiento del Síndrome de Abstinencia Neonatal
El tratamiento del síndrome de abstinencia agudo se divide en dos partes: el tratamiento de soporte no medicamentoso y el tratamiento farmacológico. Ambos son complementarios y no se debe utilizar el segundo sin haber iniciado el primero. Como norma general, la decisión sobre el inicio del tratamiento farmacológico se realizará de forma individual en cada caso1.
Algunos niños hijos de madres con consumo de sustancias de abuso no presentarán clínica de abstinencia aguda o esta será mínima, por lo que no necesitarán tratamiento. Sin embargo, en la mayoría de los casos, los niños presentan distintos grados de abstinencia y precisan, como mínimo, un tratamiento de soporte.
El tratamiento inicial o de soporte consiste en medidas no farmacológicas encaminadas a disminuir la clínica de ansiedad del niño. Entre estas medidas están la disminución de la estimulación sensorial al niño, evitando ruidos y luces intensas, la alimentación con leche hipercalórica a pequeñas y frecuentes tomas, el acunarlo o mecerlo, evitar los cambios de temperatura,...
El tratamiento farmacológico será un escalón terapéutico más, complementario al tratamiento inicial de soporte si con este no pudiéramos aliviar la clínica. La decisión de iniciar este tratamiento debe tomarse de forma individualizada para cada niño y no existen reglas que puedan generalizarse.
Aunque la Food and Drug Administration solo tiene aprobado el uso de las benzodiacepinas para la abstinencia alcohólica y de la metadona para la abstinencia a opiáceos, existen muchas posibilidades terapéuticas a nuestro alcance:
Tintura de opio, paregórico y solución de morfina: son preparados que contienen opiáceos y que se han usado en este tratamiento, aunque actualmente están en desuso por sus efectos secundarios. Sin embargo, por su naturaleza serían el tratamiento más correcto para la abstinencia neonatal a opiáceos. El parergórico al tener otros componentes en su fórmula ya no se usa.
Metadona: aunque son pocos los estudios realizados, parece ser que la metadona podría ser una buena solución para el tratamiento de estos niños1.
Clonidina: actualmente no se usa.
Clorpromazina: actualmente no se usa.
Fenobarbital: a pesar de no ser el mejor tratamiento posible, si es el más utilizado en nuestro medio. Es capaz de disminuir la clínica de irritabilidad del SNC pero no tiene efectos sobre la clínica digestiva. Sin embargo, al menos en nuestro hospital, se usa como primera elección.
Diazepam: en nuestro medio no se utiliza.
Naloxona: está prohibida en estos niños ya que podría inducir a convulsiones y a abstinencia aguda.
El tratamiento médico debe ir modificándose en su dosis a medida que se va normalizando la clínica. Como norma general, nosotros comenzamos con fenobarbital a 5 mg/kg/día, en dos dosis. Desde esta dosis, vamos subiendo o bajando según sea necesario. Para valorar su efectividad, utilizamos el test de Finnegan calculado en cada turno por nuestros ATS.
Ningún niño debería mandarse de alta desde el hospital sin haber superado su síndrome de abstinencia. Se recomienda que el alta se retrase hasta tener el niño asintomático durante 2-3 días sin tratamiento médico.
Otros problemas que pueden presentar estos niños
Infección congénita
Los hijos de madre toxicómana deben ser estudiados para descartar infecciones congénitas: Virus de la Inmunodeficiencia Humana (VIH), Virus de la Hepatitis B (HVB), Virus de la Hepatitis C (HVC), Sífilis, Virus del Herpes, Citomegalovirus (CMV), Toxoplasmosis,...
Los hijos de madre con infección por VIH deben entrar en el protocolo de tratamiento perinatal con Zidovudina (AZT). Este tratamiento es efectivo para disminuir la transmisión vertical desde un 15-20% a un 5-8%. Lo ideal es que la madre inicie el tratamiento durante la gestación (desde la 14 semanas), lo reciba durante el parto y al niño se le comience a las 6 horas de vida y lo reciba durante 6 semanas (a dosis de 2 mg/kg/6 horas por vía oral). Aunque la madre no cumpla los requisitos esenciales de este tratamiento, está indicado ofrecerlo en cualquier momento, incluso una vez que el niño haya nacido23.
Los hijos de madre AgHVBs positivo deben recibir una dosis de gammaglobulina hiperinmune al nacimiento (primeras 12-24 horas de vida) e iniciar vacunación frente a HVB. Con estas medidas se reduce casi completamente el riesgo de transmisión del VHB.
Los hijos de madre HVC deben ser seguidos clínica y analíticamente, con serología y PCR-HVC, ya que presentan un pequeño, pero real, riesgo de infección perinatal (5-10%). La transmisión vertical del virus de la HVC parece estar íntimamente relacionada con la viremia materna durante la gestación y con su estado VIH.
En el caso de madres infectadas por Sífilis, Toxoplasmosis, Herpes, CMV se deben seguir los protocolos de actuación específicos para cada caso.
Muerte súbita del lactante
Estos niños presentan un riesgo mayor que los niños normales de presentar muerte súbita del lactante (3-7 veces el riesgo de niños normales). Algunos autores discuten si es debido a la exposición a drogas intrautero o al medio social posterior en el que viven. De cualquier forma, las medidas encaminadas a disminuir la muerte súbita del lactante deben ser especialmente aconsejadas a sus padres: dormir en decúbito supino, evitar humo del tabaco, mantener una temperatura normal, no dormir con los niños en la cama,...24.
Problema social
Algunos de estos niños vivirán en un medio social marginal. En estos casos es obligada una consulta a la Asistente Social para que valore la capacidad de los padres de atender al niño y sus recursos económicos.
Con cierta frecuencia, estos niños salen del hospital al alta para ir a un centro de acogida de un Organismo Público bajo la tutela del Juez Protector de Menores. La problemática que estas decisiones conlleva podría ser objeto de un debate ético importante.
Síndrome de abstinencia subagudo y problemas conductuales a largo plazo:
Se ha descrito un síndrome de abstinencia subagudo o crónico. No se sabe si es una verdadera abstinencia o es el reflejo del medio socio-familiar en el que crece el lactante. Lo cierto es que muchos de estos niños, una vez que reciben el alta hospitalario, son definidos por sus padres como niños muy inquietos y nerviosos, con problemas de sueño y, posteriormente, de comportamiento (alteraciones del aprendizaje, dificultad para la concentración, patrones de relación alterados,...).
Lactancia
La lactancia materna está contraindicada en madres con consumo activo de sustancia de abuso ya que, la mayoría de ellas, pasan a la leche humana en cantidades apreciables pudiendo ocasionar problemas al niño25,26.
Sin embargo, en el caso de la metadona a dosis bajas (20 mg/día) en tratamientos muy controlados, algunos autores opinan que podría ser útil para el niño tomar la leche de su madre25. Así, el niño evitaría la abstinencia aguda de la retirada brusca de la sustancia y, por otra parte, su madre se beneficiaría mucho de la relación íntima que se produce con su hijo. Sea como fuere, la decisión de la lactancia debe ser sometida a un análisis individual en cada caso sopesando ventajas e inconvenientes.
Si la madre es VIH positiva, la lactancia materna está contraindicada. Si la madre es HVBs Ag positiva y el niño recibe la gammaglobulina y la primera dosis de la vacuna, se puede dar lactancia materna. Por último, si la madre está infectada por el VHC, la decisión debe tomarse por consenso con la madre, explicándole que aunque el virus o partículas virales han sido detectadas en la leche, no se ha podido demostrar ningún caso de transmisión de VHC por la leche materna hasta la actualidad27.