Cambios neuroquímicos inmediatos y a largo plazo
En la rata adulta la administración de la 3,4-metilenodioximetanfetamina (MDMA) produce un efecto neuroquímico característico de tipo bifásico en el que se diferencian efectos agudos, que son reversibles, y efectos a largo plazo, que son persistentes y se consideran neurotóxicos.
Inmediatos
Neuroquímicos
Mediante la técnica de la microdiálisis intracerebral in vivo, se ha observado que la administración de MDMA induce una liberación masiva y rápida de serotonina que se refleja en el hecho de que la concentración hística de serotonina cerebral disminuye significativamente durante las primeras horas siguientes a la administración de la droga. Este efecto es de corta duración y revierte completamente a las 24 horas de la administración. Además, la MDMA inhibe la actividad de la triptófano hidroxilasa, la enzima limitante de la síntesis de serotonina. Este efecto se detecta todavía a las 2 semanas de la administración de una dosis única de MDMA.
El efecto inmediato que produce la MDMA sobre la neurotransmisión serotonérgica no es selectivo, puesto que también se observa un aumento en la liberación de dopamina en el tejido cerebral y de noradrenalina a partir de sinaptosomas cerebrales.
La MDMA inhibe la actividad de la monoaminooxidasa (MAO) con una potencia 10 veces mayor para inhibir la MAO-A que la MAO-B. Este efecto conduce a una reducción del metabolismo de 5-HT y dopamina en el terminal nervioso que podría contribuir también al aumento en la liberación del neurotransmisor.
Neuroendocrinos
La administración de MDMA produce un aumento de las concentraciones plasmáticas de corticosterona y prolactina a los 30 minutos de la administración. Las concentraciones de corticosterona permanecen elevadas durante 4 horas, mientras que el pico de prolactina se observa a los 60 minutos y retorna a valores controles a las 4 horas, aproximadamente. Mientras que el incremento en la concentración de corticosterona fue dosis-dependiente, esta relación no se observó en la respuesta de prolactina.
La secreción de renina y aldosterona también aumenta tras la administración de MDMA, siendo este último efecto probablemente el resultado de la secreción de serotonina.
Efectos cardiovasculares y simpáticos
Los informes clínicos han asociado el uso de MDMA con toxicidad cardiovascular. La MDMA produce taquicardia, arritmias, vasoconstricción y un aumento de la presión arterial que en algunas ocasiones provoca bradicardia refleja por estímulo de los barorreceptores. Se observa también una disminución en la actividad nerviosa simpática renal que se atribuye a una acción sobre los receptores adrenérgicos alfa2 medulares.
Temperatura corporal
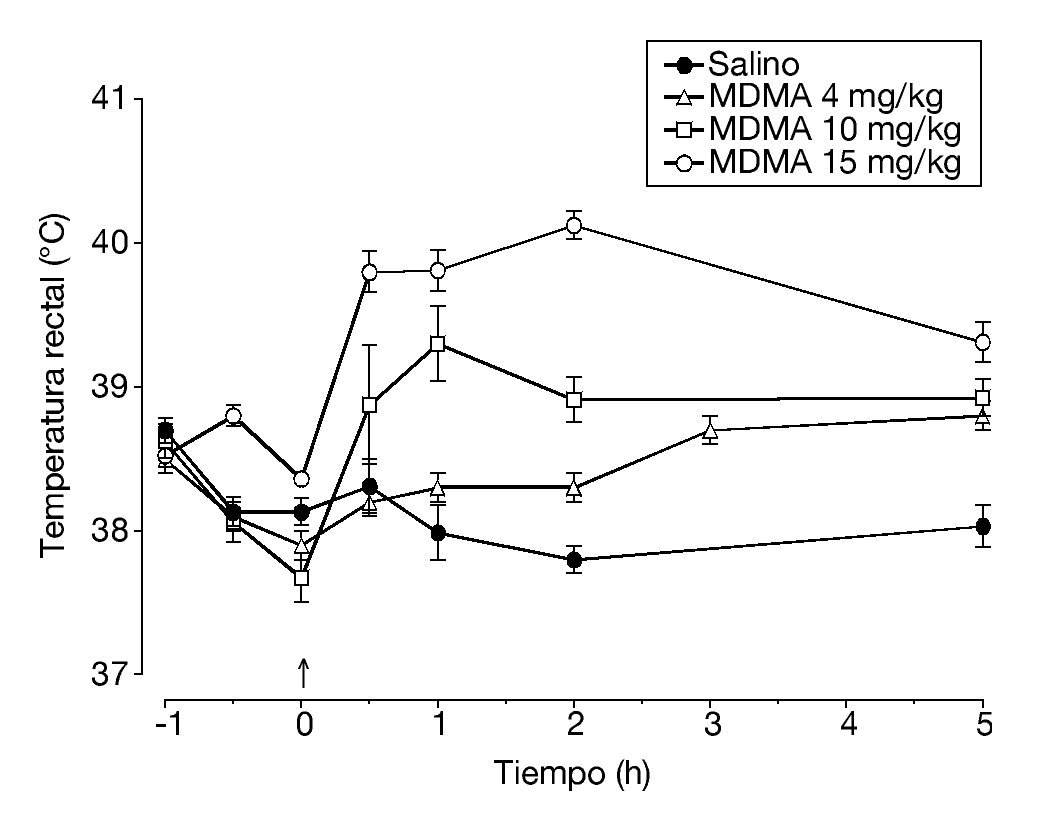
Es conocido que la administración de MDMA provoca un incremento dosis-dependiente de la temperatura rectal de los animales, que oscila entre 1,5-2 ºC y alcanza un pico 1 hora después de la inyección (fig. 1). Esta respuesta hipertérmica se mantiene por lo menos durante 12 horas. El efecto que produce la MDMA sobre la temperatura corporal está estrechamente unido a la temperatura ambiente a la que se administra la droga. A una temperatura ambiente de 20-22 °C la administración de MDMA generalmente produce una marcada respuesta hipertérmica que es dosis-dependiente. Sin embargo, en algunos estudios se ha observado una disminución de la temperatura corporal a 20-22 ºC, ningún cambio a 24-26 °C y una respuesta hipertérmica a 28-30 °C.
Figura 1. Temperatura rectal de ratas Dark Agouti tras la administración intraperitoneal de diferentes dosis de 3,4-metilenodioximetanfetamina (MDMA).
Comportamentales
La MDMA produce un complejo conjunto de síntomas que constituye el síndrome serotonérgico y que se manifiesta por la aparición de hiperactividad, movimientos oscilantes de cabeza, forepaw treading, piloerección, erección del pene, eyaculación, salivación y defecación.
Efectos a largo plazo
El consumo humano de MDMA es preocupante debido a que estudios recientes que proceden de diversos laboratorios han demostrado que la MDMA, al igual que otros derivados anfetamínicos como metanfetamina, fenfluramina o p-cloroanfetamina, es tóxica para el cerebro de diversas especies animales. El primer trabajo aparecido en la literatura en el que se hace referencia a los efectos neurotóxicos de MDMA data de 1986 y fue publicado por el grupo de Schmidt. Desde entonces han sido numerosos los artículos publicados en la literatura científica internacional en los que se demuestra que la MDMA produce daño neuronal a largo plazo que, en algunas especies animales como los primates no humanos, parece ser irreversible.
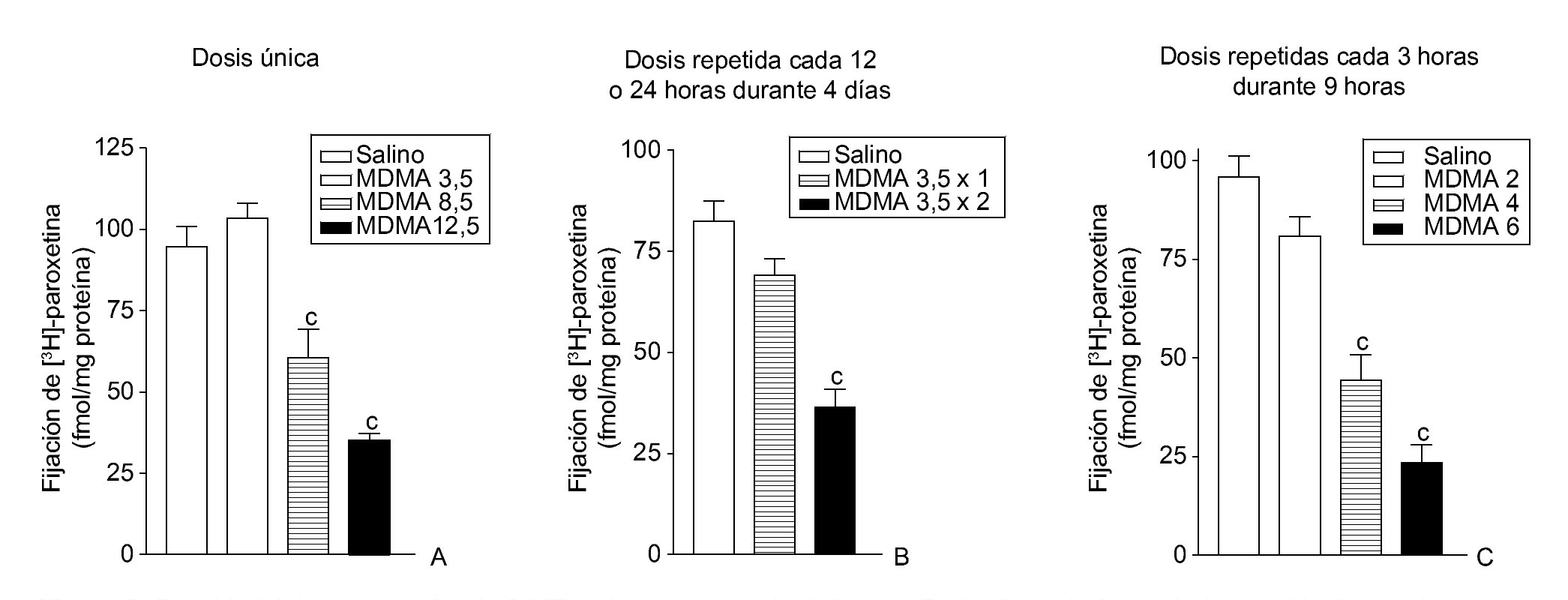
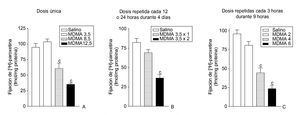
El efecto neurotóxico que produce la MDMA en roedores es específico de la especie, en el sentido de que existen marcadas diferencias entre el daño neuronal que la MDMA produce en la rata y el que se observa en el ratón. Cuando la droga se administra en la rata aparece una degeneración selectiva de terminales nerviosos serotonérgicos en diversas regiones cerebrales (fig. 2). Por el contrario, en el ratón se manifiesta una degeneración de los terminales dopaminérgicos estriatales dejando intactas las neuronas que contienen serotonina. Es interesante señalar que la neurotoxicidad en la rata se manifiesta tras la administración de una dosis única de MDMA, mientras que el efecto tóxico en el ratón requiere la administración repetida de la droga y dosis más altas que las utilizadas en la rata. Los estudios realizados con primates no humanos reflejan la extremada vulnerabilidad de estos animales a los efectos neurotóxicos de la MDMA y demuestran la existencia de una degeneración de neuronas serotonérgicas. El efecto neurotóxico se manifiesta por una disminución de la concentración de serotonina y su metabolito, el ácido 5-hidroxi-indol acético, una reducción en la densidad del sistema transportador de serotonina y una disminución en la densidad de terminales y/o axones serotonérgicos que a veces incluso afecta al cuerpo neuronal. Es probable que estos efectos sean permanentes puesto que se siguen manifestando 7 años después de suprimida la administración de la droga. La existencia de daño neurotóxico en el cerebro de los consumidores habituales de MDMA continúa siendo materia de controversia, no obstante, existen datos bioquímicos y funcionales que sugieren la presencia de daño neuronal en el cerebro de estos individuos.
Figura 2. Densidad del transportador de 5-HT en la corteza cerebral de ratas 7 días después de la administración de una dosis única de 3,4-metilenodioximetanfetamina (MDMA) (3,5, 8,5 y 12,5 mg/kg, i.p.) (A), una dosis repetida de MDMA (3,5 mg/kg, i.p.) una o dos veces diarias durante 4 días consecutivos (B) y varias dosis repetidas de MDMA (2, 4 y 6 mg/kg, i.p.) 3 veces con un intervalo de 3 horas (C).
ap < 0,05; bp < 0,01; cp < 0,001.
Mecanismo de acción
Efectos inmediatos
La liberación de 5-HT inducida por MDMA resulta de una interacción de MDMA con el sistema de transporte serotonérgico de tal manera que fluoxetina bloquea el incremento de 5-HT en el espacio sináptico. Sin embargo, la implicación del sistema de recaptación de dopamina en la liberación de este neurotransmisor es materia de controversia. Algunos estudios han demostrado que el inhibidor del transportador de dopamina, GBR 12909, previene el efecto de la MDMA sobre la liberación del neurotransmisor, sin embargo, otros han observado que GBR 12909 lejos de impedir la liberación de dopamina que induce la MDMA, incrementa la concentración extracelular del neurotransmisor. Estos últimos datos sugieren que la MDMA penetra en el terminal dopaminérgico por difusión, no a través del sistema transportador. En este sentido es importante señalar que mazindol tampoco bloquea la liberación de dopamina que se observa tras la administración de metanfetamina.
La secreción de corticosterona inducida por MDMA está mediada por el sistema serotonérgico, puesto que se atenúa por la administración de ketanserin, mianserina o fluoxetina.
Efectos a largo plazo
Aunque se han propuesto varias teorías, la hipótesis que a nosotros nos parece más plausible es la formación de un metabolito tóxico de MDMA. Esta hipótesis está basada en el hecho de que la administración intra-cerebral directa de MDMA no produce ninguna evidencia de una respuesta neurotóxica, mientras que por el contrario la administración sistémica produce déficits serotonérgicos prolongados asociados con neurodegeneración.
La principal vía metabólica de la MDMA in vitro está catalizada por la enzima debrisoquina hidroxilasa, la cual, por demetilenación, convierte la MDMA en un derivado catecólico reactivo e inestable (3,4-dihidroximetanfetamina) que posteriormente por oxidación se transforma en la correspondiente quinona. La debrisoquina hidroxilasa, presente en el hígado y el cerebro, es un miembro polimórfico de la familia de enzimas citocromo P450 y está ausente en un 5-9% de la población caucasiana como consecuencia de la herencia de mutaciones génicas autosómicas recesivas. Esto explicaría al menos una parte de las diferencias interindividuales en la respuesta al éxtasis, aunque es casi seguro que aún nos queda mucho por averiguar en este sentido.
Se ha mencionado que la MDMA en su metabolismo da lugar a compuestos con estructura de catecol y quinona y es conocido que estos compuestos dan lugar a la formación de radicales libres que inducirían estrés oxidativo y daño celular. En concordancia con estas observaciones, estudios recientes indican que la formación de radicales libres podría ser uno de los determinantes de la neurotoxicidad de la MDMA. Utilizando la técnica de la microdiálisis intracerebral in vivo, se ha demostrado que inmediatamente después de la administración de MDMA se detecta un incremento en la formación de radicales libres en el cerebro de la rata que se refleja por un aumento en la concentración de ácido 2,3-dihidroxibenzoico en el dializado hipocampal. Estas especies reactivas de oxígeno, a su vez, inician un proceso de peroxidación de los fosfolípidos de la membrana neuronal. Además, compuestos atrapadores de radicales libres no solamente previenen la formación de radicales hidroxilo, sino que también protegen frente a la neurotoxicidad de la MDMA.
El papel que desempeña la hipertermia en la neurotoxicidad a largo plazo inducida por MDMA ha sido ampliamente estudiado. La hipertermia desempeña un papel determinante en la expresión de la neurotoxicidad serotonérgica inducida por MDMA de tal manera que las respuestas térmicas son predictivas, en parte, de la severidad de las reducciones en los marcadores bioquímicos serotonérgicos producidos por MDMA. En otras palabras, el grado de daño neuronal producido por MDMA está estrechamente relacionado con la magnitud de la respuesta hipertérmica. Estudios realizados a diferentes temperaturas ambiente han demostrado que el mantenimiento de los animales a una temperatura de 10 ºC antes y/o después del tratamiento con MDMA previene la respuesta hipertérmica y atenúa, o incluso elimina, la neurotoxicidad de la droga. Por el contrario, a elevadas temperaturas ambiente (26-33 ºC) tanto la respuesta hipertérmica como la neurotoxicidad están potenciadas. A pesar de esta estrecha relación entre hipertermia aguda y neurotoxicidad a largo plazo, el papel exacto que desempeña la hipertermia en la respuesta neurotóxica es difícil de definir puesto que es posible observar neurotoxicidad en ausencia de hipertermia. La administración de dosis bajas y repetidas de MDMA (4 mg/kg, cada 12 horas, durante 4 días) produce una marcada disminución de terminales serotonérgicos pero no incrementa la temperatura corporal. De modo que la ausencia de una respuesta hipertérmica pronunciada no parece ofrecer garantía alguna de que el daño cerebral a largo plazo esté siendo evitado. Además, existen compuestos neuroprotectores que previenen el efecto neurodegenerativo de la MDMA y no modifican sensiblemente la hipertermia inducida por la droga. En conjunto, estos datos indican que la hipertermia ejerce un importante papel modulador pero no es un factor esencial en la neurotoxicidad ocasionada por MDMA. Existen otros factores como dosis elevadas o un incremento en la frecuencia de administración que pueden superar la carencia de una respuesta hipertérmica para producir neurotoxicidad.
Neurotoxicidad de otras drogas de diseño: MDEA y MDA
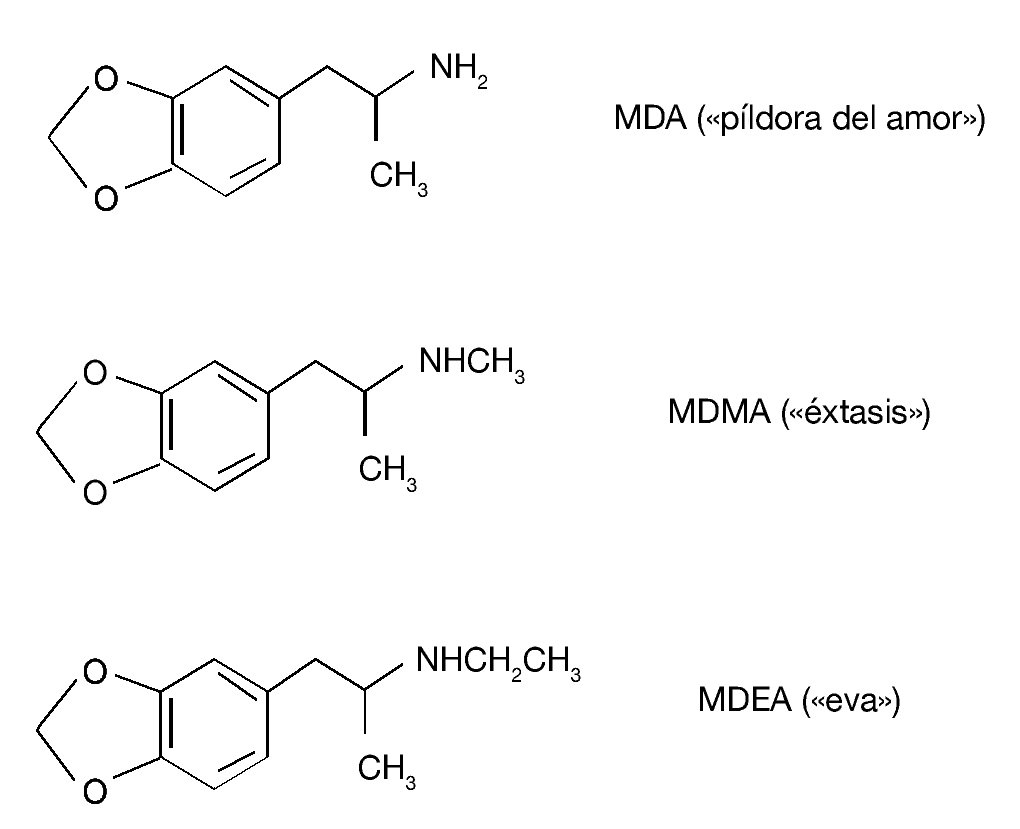
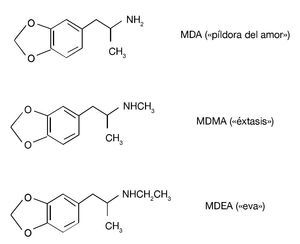
Existen otros derivados anfetamínicos sustituidos en al anillo cuya estructura química está estrechamente relacionada con la de MDMA (fig. 3). Estos compuestos también se utilizan en nuestro entorno social como drogas de abuso, aunque con menor frecuencia que el «éxtasis». La 3,4-metilenodioxianfetamina (MDA, «píldora del amor») se diferencia fundamentalmente de la MDMA por sus propiedades alucinógenas. La 3,4-metilenodioxietilanfetamina (MDEA, «eva») se caracteriza por poseer una actividad psicotrópica similar a la MDMA, si bien sus efectos ocurren más rápidamente que los de MDMA o MDA y son de duración más corta. En cuanto a sus efectos tóxicos, es importante señalar que los 3 compuestos producen neurotoxicidad a largo plazo sobre el sistema serotonérgico del cerebro de la rata, aunque varían en la potencia para producir este efecto, de tal manera que el más potente es la MDA y el menos potente es la MDEA. En lo que se refiere a efectos sobre la temperatura corporal de los animales, ambas drogas, al igual que el «éxtasis», inducen una respuesta hipertérmica. Por ejemplo, la MDEA induce un incremento dosisdependiente de la temperatura rectal de los animales que alcanza un pico de aproximadamente 2 ºC 1 hora después de su administración.
Figura 3. Estructura química de 3,4-metilenodioxianfetamina (MDA), 3,4-metilenodioximetanfetamina (MDMA) y 3,4-metilenodioxietilanfetamina (MDEA).
Estudios realizados con dosis análogas a las del consumo en seres humanos
Los expertos en el reciente fenómeno del consumo masivo de drogas de diseño afirman que una gran mayoría de los consumidores habituales cree que las dosis utilizadas para inducir daño en los animales de experimentación son tan altas que tienen poca relación con aquellas utilizadas por ellos y, por tanto, consideran a la droga, en concreto al «éxtasis», «segura». Esta opinión queda debilitada por el hecho de que una sola dosis de MDMA de 10 mg/kg (dosis que induce neurotoxicidad) produce, en la rata, unos niveles plasmáticos de la droga similares a los detectados en seres humanos que requirieron atención hospitalaria por presentar graves efectos adversos agudos. Los consumidores habituales de «éxtasis» ingieren de forma repetida pastillas que contienen generalmente 75-250 mg de la droga, lo cual equivale a una dosis aproximada de 1-4 mg por kg de peso en individuos de 60-70 kg, dosis que ingieren varias veces durante el fin de semana. En nuestro laboratorio la administración repetida de dosis bajas de MDMA (4 mg/kg, 2 veces diarias, durante 4 días), aunque no modifica la temperatura corporal de los animales, produce en la rata una pronunciada disminución de diversos parámetros serotonérgicos en distintas áreas cerebrales que se manifiesta 7 días después de suprimido el tratamiento.
El efecto producido por dosis similares a las del consumo en seres humanos ha sido estudiado también en monos (concretamente en monos ardilla y rhesus) y se ha observado que las neuronas serotonérgicas cerebrales de estos primates son extremadamente vulnerables a los efectos tóxicos de la MDMA. Una dosis repetida de 2,5 mg/kg produce en los monos una disminución de la densidad de axones serotonérgicos similar a la provocada en la rata por la administración repetida de MDMA en la dosis de 4 mg/kg. Los efectos tóxicos que produce la MDMA en primates son probablemente permanentes: monos ardilla sometidos a la administración repetida de MDMA (5 mg/kg) continúan mostrando una pronunciada disminución de la densidad de terminales serotonérgicos en la corteza frontal, el núcleo caudado y el hipocampo 18 meses e incluso 7 años después de la administración de la droga. Estos últimos resultados sugieren que los axones serotonérgicos de estos primates no se recuperan de las lesiones producidas por la MDMA y son particularmente relevantes, puesto que podrían ser más indicativos de lo que ocurre en los seres humanos.
Agradecimientos
La elaboración de este artículo está financiada por el Instituto de Salud Carlos III, Red de Trastornos Adictivos (RD06/0001/0006).
La autora declara que no existe conflicto de intereses.
Correspondencia:
M.I. COLADO
Departamento de Farmacología. Facultad de Medicina.
Universidad Complutense.
Avda. Complutense s/n.
28040 Madrid. España.
Correo electrónico: colado@med.ucm.es
Recibido: 04-06-2008
Aceptado para su publicación: 28-06-2008
Bibliografía recomendada
Broening HW, Bowyer JF, Slikker Jr W. Age-dependent sensitivity of rats to the long-term effects of the serotonergic neurotoxicant (±)-3,4-methylenedioxymethamphetamine (MDMA) correlates with the magnitude of the MDMA-induced thermal response. J Pharmacol Exp Ther. 1995275:325-33.
Burns N, Olverman HJ, Kelly PA, Williams BC. Effects of ecstasy on aldosterone secretion in the rat in vivo and in vitro. Endocr Res. 199622:601-6.
Camarero J, Sánchez V, O'Shea E, Green AR, Colado MI. Studies, using in vivo microdialysis, on the effect of the dopamine uptake inhibitor GBR 12909 on 3,4-methylenedioxymethamphetamine (MDMA, «ecstasy»)-induced dopamine release and free radical formation in the mouse striatum. J Neurochem. 200281:961-72.
Colado MI, Camarero J, Mechan AO, Sánchez V, Esteban B, Elliott JM, et al. A study of the mechanisms involved in the neurotoxic action of 3,4-methylenedioxymethamphetamine (MDMA, «ecstasy») on dopamine neurones in mouse brain. Br J Pharmacol. 2001134:1711-23.
Colado MI, Esteban B, O'Shea E, Granados R, Green AR. Studies on the neuroprotective effect of pentobarbitone on MDMA-induced neurodegeneration. Psychopharmacology. 1999142:421-5.
Colado MI, Granados R, O'Shea E, Esteban B, Green AR. The acute effect in rats of 3,4-methylenedioxyethamphetamine (MDEA, «eve») on body temperature and long term degeneration of 5-HT neurones in brain: a comparison with MDMA («ecstasy»). Pharmacol Toxicol. 199984:261-6.
Colado MI, Green AR. The spin trap reagent a-phenyl-N-tert-butyl nitrone prevents «ecstasy»-induced neurodegeneration of 5-hydroxytryptamine neurons. Eur J Pharmacol. 1995280:343-6.
Colado MI, Murray TK, Green AR. 5-HT loss in rat brain following 3,4-methylenedioxymethamphetamine (MDMA), p-chloroamphetamine and fenfluramine administration and effects of chlormethiazole and dizocilpine. Br J Pharmacol. 1993108:583-9.
Colado MI, O'Shea E, Esteban B, Granados R, Green AR. In vivo evidence against chlomethiazole being neuroprotective against MDMA («ecstasy»)-induced degeneration of rat brain 5-HT nerve terminals by a free radical scavenging mechanism. Neuropharmacology.199938:307-14.
Colado MI, O'Shea E, Granados R, Esteban B, Martín AB, Green AR. Studies on the role of dopamine in the degeneration of 5-HT nerve endings in the brain of Dark Agouti rats following 3,4-methylenedioxymethamphetamine (MDMA or «ecstasy») administration. Br J Pharmacol. 1999126:911-24.
Colado MI, O'Shea E, Granados R, Misra A, Murray TK, Green AR. A study of the neurotoxic effect of MDMA («ecstasy») on 5-HT neurons in the brains of mothers and neonates following administration of the drug during pregnancy. Br J Pharmacol. 1997121:827-33.
Colado MI, O'Shea E, Granados R, Murray TK, Green AR. In vivo evidence for free radical involvement in 5-HT following administration of MDMA («ecstasy») and p-chloroamphetamine but not the degeneration following fenfluramine. Br J Pharmacol. 1997121:889-900.
Colado MI, Williams JL, Green AR. The hyperthermic and neurotoxic effects of «Ecstasy» (MDMA) and 3,4-methylenedioxyamphetamine (MDA) in the Dark Agouti (DA) rat, a model of the CYP2D6 poor metabolizer phenotype. Br J Pharmacol. 1995115:1281-9.
Escobedo I, O'Shea E, Orio L, Sánchez V, Segura M, de la Torre R, et al. A comparative study on the acute and long-term effects of MDMA and 3,4-dihydroxymethamphetamine (HHMA) on brain monoamine levels after i.p. or striatal administration in mice. Br J Pharmacol. 2005144:231-41.
Esteban B, O'Shea E, Camarero J, Green AR, Colado MI. 3,4-methylenedioxymethamphetamine induces monoamine release, but not toxicity, when administered centrally at a concentration occurring following a peripherally injected neurotoxic dose. Psychopharmacology. 2001154:251-60.
Gordon CJ, Watkinson WP, O'Callaghan JP, Miller DB. Effects of 3,4-methylenedioxymethamphetamine on autonomic thermoregulatory responses of the rat. Pharmacol Biochem Behav. 199138:339-44.
Green AR, Mechan AO, Elliott JM, O'Shea E, Colado MI. The pharmacology and clinical pharmacology of 3,4-methylenedioxymethamphetamine (MDMA, «ecstasy»). Pharmacol Rev. 200355:463-508.
Green AR, O'Shea E, Colado MI. A review of the mechanisms involved in the acute MDMA (ecstasy)-induced hyperthermic response. Eur J Pharmacol. 2004500:3-13.
Hatzidimitriou G, McCann UD, Ricaurte GA. Altered serotonin innervation patterns in the forebrain of monkeys treated with (±)3,4-methylenedioxymethamphetamine seven years previously: factors influencing abnormal recovery. J Neurosci. 199919:5096-107.
Koch S, Galloway MP. MDMA induced dopamine release in vivo: role of endogenous serotonin. J Neural Transm. 1997104:135-46.
Leonardi ET, Azmitia EC. MDMA (ecstasy) inhibition of MAO type A and type B: comparisons with fenfluramine and fluoxetine (Prozac). Neuropsychopharmacology. 199410:231-8.
Marek GJ, Vosmer G, Seiden LS. The effects of monoamine uptake inhibitors and methamphetamine on neostriatal 6-hydroxydopamine (6-OHDA) formation, short-term monoamine depletions and locomotor activity in the rat. Brain Res. 1990516:1-7.
Mechan AO, Esteban B, O'Shea E, Elliott JM, Colado MI, Green AR. The pharmacology of the acute hyperthermic response that follows administration of 3,4-methylenedioxymethamphetamine (MDMA, «ecstasy») to rats. Br J Pharmacol. 2002135:170-80.
Mechan AO, O'Shea E, Elliott JM, Colado MI, Green AR. A neurotoxic dose of 3,4-methylenedioxymethamphetamine (MDMA ecstasy) to rats results in a long term defect in thermoregulation. Psychopharmacology. 2001155:413-8.
Nash JF Jr, Meltzer HY, Gudelsky GA. Elevation of serum prolactin and corticosterone concentrations in the rat after the administration of 3,4-methylenedioxymethamphetamine. J Pharmacol Exp Ther. 1988245:873-9.
O'Cain PA, Hletko SB, Ogden BA, Varner KJ. Cardiovascular and sympathetic responses and reflex changes elicited by MDMA. Physiol Behav. 200070:141-8.
O'Shea E, Esteban B, Camarero J, Green AR, Colado MI. Effect of GBR 12909 and fluoxetine on the acute and long term changes induced by MDMA («ecstasy») on the 5-HT and dopamine concentrations in mouse brain. Neuropharmacology. 200140:65-74.
O'Shea E, Granados R, Esteban B, Colado MI, Green AR. The relationship between the degree of neurodegeneration of rat brain 5-HT nerve terminals and the dose and frequency of administration of MDMA («ecstasy»). Neuropharmacology. 199837:919-26.
Ricaurte GA, DeLanney LE, Irwin I, Langston JW. Toxic effects of MDMA on central serotonergic neurons in the primate: importance of route and frequency of drug administration. Brain Res. 1988446:165-8.
Sánchez V, Camarero J, Esteban B, Peter MJ, Green AR, Colado MI. The mechanisms involved in the long-lasting neuroprotective effect of fluoxetine against MDMA («ecstasy»)-induced degeneration of 5-HT nerve endings in rat brain. Br J Pharmacol. 2001134:46-57.
Schmidt CJ, Wu L, Lovenberg W. Methylenedioxymethamphetamine: a potentially neurotoxic amphetamine analogue. Eur J Pharmacol. 1986124:175-8.
Slikker W Jr, Holson RR, Ali SF, Kolta MG, Paule MG, Scallet AC, et al. Behavioral and neurochemical effects of orally administered MDMA in the rodent and nonhuman primate. Neurotoxicology. 198910:529-42.
Tucker GT, Lennard MS, Ellis SW, Woods HF, Cho AK, Lin LY, et al. The demethylenation of methylenedioxymethamphetamine («ecstasy») by debrisoquine hydroxylase (CYP2D6). Biochem Pharmacol. 1994 47:1151-6.