Paciente de 45 años, fumador de 10 cigarrillos/día. Refiere historia de uso de heroína por vía intravenosa entre los 16 y 37 años, y desde entonces (1996) está en tratamiento con metadona a dosis de 60 mg/día. Asimismo, presenta un cuadro de abuso/dependencia de benzodiacepinas de larga evolución y toma cloracepato a dosis de 100 mg/día. Refiere algún episodio de convulsiones tonicoclónicas en el contexto de deprivación de benzodiacepinas. En una ocasión precisó tratamiento antidepresivo con paroxetina que abandonó a los 2 meses. Presenta infección crónica por los virus de la hepatitis C y B (portador de HBsAg) sin historia de descompensación clínica.
A los 25 años (en 1984) y en un control rutinario se le diagnosticó infección por el virus de la inmunodeficiencia humana (VIH) aunque no realizó controles ni seguimiento hasta los 37 años (1996). Como infecciones asociadas había presentado: leucoplasia oral vellosa, candidiasis oral de repetición, condilomas en el labio superior y un cuadro de diarrea que se diagnosticó de enteritis por Campylobacter jejuni. Como enfermedad definitoria de sida presentó un sarcoma de Kaposi digestivo que fue tratado con doxorrubicina durante 7 meses. Requirió otros ingresos hospitalarios por neumonía neumocócica (1999) y bacteriemia por Streptococcus viridans (2000). Además presentaba plaquetopenia periférica asociada al VIH diagnosticada a los 38 años que había cursado con episodios de gingivorragias, epistaxis y hemorragia digestiva que requirieron transfusiones de plaquetas y hematíes en alguna ocasión; la plaquetopenia se trató con corticoides y gammaglobulinas.
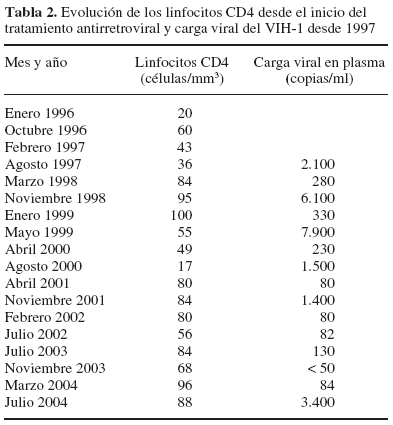
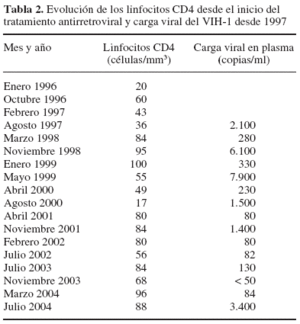
Inició tratamiento antirretroviral a partir de 1996 (37 años) habiendo realizado diferentes combinaciones terapéuticas (tabla 1). Las evolución de las cifras de linfocitos CD4 y de carga viral del VIH se muestran en la tabla 2.
Se discute el caso en la sesión clínica de un servicio de medicina interna con especialistas en virus de la inmunodeficiencia humana (VIH)/sida y adicciones. Los médicos adjuntos (M) preguntan a los residentes (R)
M: ¿Qué datos señalaríais como más relevantes de la historia clínica del paciente?
R: Se trata de un paciente que fue usuario de heroína por vía parenteral durante 21 años hasta que inicia tratamiento con metadona. Presenta infección por VIH de larga evolución (20 años) y se halla en tratamiento antirretroviral desde hace 8 años, coincidiendo con la entrada en metadona. Destacaba una marcada alteración de la inmunidad celular (CD4) al inicio del tratamiento antirretroviral y aunque la historia clínica no lo revela, es probable que el inicio del tratamiento con metadona y los antirretrovirales coincidiera con uno de los ingresos por complicaciones asociadas al VIH o a la drogadicción. Entre 1996 y 2003 ha seguido tratamiento antirretroviral con 4 combinaciones terapéuticas diferentes. Presenta también infección por el virus de la hepatitis C (VHC) y es portador crónico del virus de la hepatitis B (VHB) (HBsAg positivo) aunque no parece que sea el principal problema clínico hasta ese momento.
M: El tratamiento de la infección por VIH en consumidores de drogas por vía intravenosa plantea una serie de situaciones que no están presentes en otras categorías de transmisión del VIH. Un porcentaje elevado de los drogadictos activos son reticentes a contactar con el sistema de salud y muchos de ellos sólo lo hacen cuando tienen una enfermedad aguda intercurrente. En muchas ocasiones, la drogadicción activa impide la evaluación de los múltiples problemas de salud que presentan1.
Los objetivos primordiales del tratamiento del VIH son:
1. Suprimir la carga viral del VIH
2. Recuperar la función inmunológica.
Los marcadores biológicos que se utilizan para establecer el pronóstico y determinar la eficacia del tratamiento antirretroviral son la carga viral del VIH y la cifra de linfocitos CD41. ¿Cómo interpretais la evolución de estos parámetros en el paciente?
R: La determinación de carga viral del VIH se realiza de forma rutinaria desde 1997. El objetivo del tratamiento antirretroviral es que la carga viral del VIH se mantenga por debajo de los valores de detección (50-80 copias/ml, según el método utilizado)1. En este caso no disponemos de carga viral al inicio del tratamiento. La primera determinación se realizó trascurridos 20 meses, es poco elevada y desde febrero de 2002 se mantiene baja (< 100 copias/ml). Los linfocitos CD4 indican el estado de la inmunidad celular y pueden predecir el riesgo de una infección oportunista. Los linfocitos CD4 del caso clínico son muy bajos antes de iniciar el tratamiento antirretroviral y en ningún momento de la evolución posterior han sido superiores a 100 células/mm3, lo que indica que no hay recuperación de la inmunidad celular a pesar de que las cargas virales sean indetectables o muy bajas. En personas bajo tratamiento antirretroviral se considera adecuado un aumento de 100-150 células/mm3 por año1.
M: ¿Existen diferencias en la eficacia del tratamiento antirretroviral en usuarios de drogas por vía parenteral?
R: Si se elimina el uso activo de sustancias y se consigue una adecuada adherencia al tratamiento antirretroviral, la eficacia es similar a la observada en otras categorias de transmisión1.
M: En pacientes drogodependientes el tratamiento de la adicción es fundamental para tratar otras enfermedades asociadas2. La metadona es uno de los tratamientos farmacológicos más utilizados en la adicción a heroína. En España hay 80.000 pacientes tratados con metadona y por ello se hace necesario conocer las características del tratamiento con sustitutivos de la heroína. El mantenimiento con metadona reduce o elimina el uso de heroína, disminuye la mortalidad asociada y disminuye la transmisión de enfermedades parenterales3.
¿Podeis describir las características farmacocinéticas de la metadona?
R: Es un agonista opiáceo derivado de la 3,3 difenilpropilamina, y clínicamente se utiliza como mezcla racémica de 2 esteroisómeros4. La farmacocinética de la metadona presenta una amplia variabilidad interindividual. Tras la administración de la misma dosis se obtienen concentraciones diferentes en cada sujeto; el efecto farmacológico puede ser leve en unos pacientes o intenso y prolongado en otros. Todo ello hace difícil anticipar cuál será la relación entre dosis administrada, concentración plasmática y efecto clínico5,6.
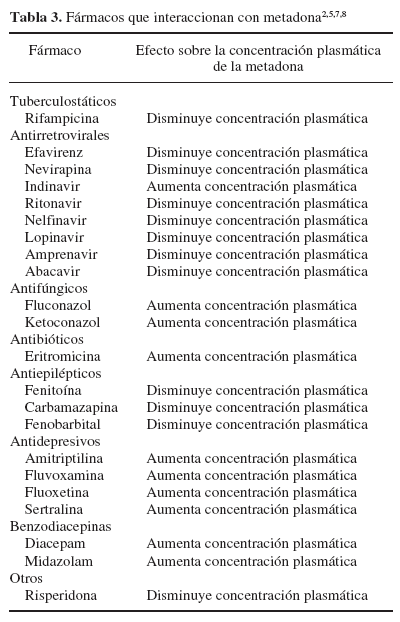
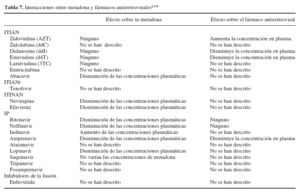
Tras la absorción por vía digestiva, se identifica en plasma a los 30 min5. La concentración plasmática máxima (Cmáx) se alcanza a las 4 h y la vida media es de 24-36 h. Una vez absorbida, de un 60 a un 90% se une a proteínas plasmáticas, especialmente lipoproteínas, gammaglobulinas y a alfa-1-glucoproteínas. Las concentraciones plasmáticas que suelen considerarse adecuadas para la terapia de mantenimiento son de 0,1 µg/ml aunque valores de 0,8 µg/ml (0,02-0,45 mg/dl) pueden resultar letales en algunos casos. La metadona sufre metabolización hepática mediante procesos de N-desmetilación, y se forman 2 metabolitos. En este proceso está implicado el citocromo P450, grupo de enzimas localizadas en la membrana del retículo endoplásmico del hígado e intestino delgado. La isoenzima CYP3A4, la más importante desde el punto de vista clínico, es la que realiza los procesos de biotransformación de la metadona, y también intervienen otras isoenzimas (CYP2D6, CYP2C8, CYP2C18)6. La actividad de la CYP3A4 varía considerablemente entre individuos y es la principal responsable de las diferencias en la biodisponibilidad de la metadona5. La intervención del citocromo P450 en el metabolismo de la metadona, vía utilizada también por numerosos fármacos5, es lo que condiciona sus principales interacciones medicamentosas. En la tabla 3 se describen diversos fármacos que pueden modificar la concentración plasmática de metadona. Se elimina en forma de pirrolidina y pirrolina a través de la bilis y la orina, y en esta última se puede detectar hasta pasados 3 días tras la ingesta (vida media de eliminación entre 15 y 60 h).
M: En el caso clínico que describimos, una vez el paciente se halla estabilizado en metadona a dosis de 60 mg/día se inica el tratamiento antirretroviral. Se trata ahora de revisar las indicaciones de tratamiento antirretroviral y de los fármacos empleados para el tratamiento del VIH. Actualmente se dispone de 20 fármacos con actividad antirretroviral pertenecientes a 5 familias (tabla 4)9.
Los antiretrovirales son un grupo de fármacos que han demostrado su eficacia en el tratamiento del VIH al disminuir la replicación del virus y permitir la recuperación del sistema inmune. En la tabla 5 se exponen las recomendaciones actuales para iniciar el tratamiento en individuos previamente no tratados y en la tabla 6 los regímenes recomendados1.
M: Según se muestra en la tabla 3, un gran número de antirretrovirales presentan interacciones con la metadona. ¿Qué características de los fármacos antirretrovirales pueden explicar estas interacciones?
R: Las interacciones farmacológicas pueden deberse a mecanismos farmacocinéticos (alteraciones en la absorción, transporte, distribución, metabolismo o excreción de sustancias) o a mecanismos farmacodinámicos con respuestas aditivas, sinérgicas o antagonistas10. Al analizar la farmacocinética de los antirretrovirales y de la metadona aparece la glucuronidación y el citocromo P450 como principales mecanismos de biotransformación de estos fármacos. La glucuronidación es la vía utilizada en la mebabolización de los ITIAN y la metadona tiene capacidad inhibitoria sobre ella. Por otra parte, la metadona es sustrato y autoinhibidora de la CYP3A4, isoenzima del citocromo P450, vía que también utilizan algunos antirretrovirales (IP/ITINAN)6.
M: El primer fármaco utilizado en el tratamiento del VIH fue la AZT en monoterapia; entre 1995 y 1996 el tratamiento ya se realizaba con una combinación de 2 ITIAN. En el caso descrito, el tratamiento antirretroviral se inició con zidovudina (AZT) y zalzitabina (ddC). ¿Se han descrito interacciones entre los fármacos de este grupo y la metadona?
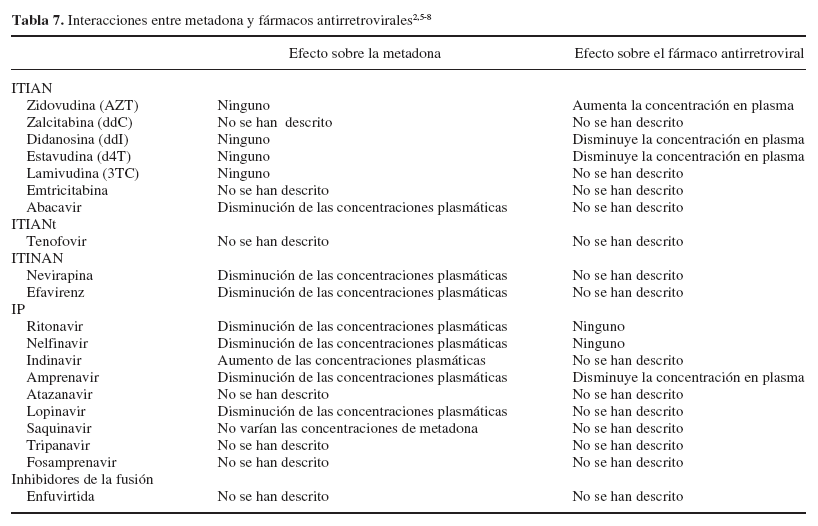
R: Los ITIAN no tienen ningún efecto significativo sobre el metabolismo de la metadona pero las concentraciones plasmáticas de algunos antirretrovirales pueden verse modificadas. ddC, estavudina (d4T), AZT y abacavir se metabolizan principalmente por mecanismos de glucuronidación. Al administrarlos conjuntamente con metadona, que inhibe dicha vía, cabría esperar un aumento de las concentraciones plasmáticas. En la práctica clínica se ha descrito lo siguiente:
-- d4T y didanosina (ddI): no modifican las concentraciones de metadona aunque algunos autores hacen referencia a la disminución de la concentración plasmática y el área bajo la curva de ambos antirretrovirales pudiendo presentar concentraciones plasmáticas poco eficaces; la absorción de ddI en comprimidos tamponados puede verse dificultada por la metadona al reducir ésta la motilidad gastrointestinal; la presentación de ddI en cápsulas entéricas evitaría el problema1,2,7,9.
-- Lamivudina (3TC): no presenta ninguna interacción con metadona. La metadona puede aumentar la concentración plasmática de AZT6,8.
-- Abacavir: aumenta el aclaramiento de metadona en un 22% y puede disminuir las concentraciones plasmáticas de metadona; se ha descrito algún caso de aparición de síndrome de abstinencia a los opiáceos a los 3-4 días de administrar abacavir conjuntamente con metadona11.
-- ddC: no se han descrito interaciones con metadona.
M: La aparición de los inhibidores de la proteasa (IP) en 1996 coincide con un cambio de estrategia en el tratamiento del VIH. A partir de 1997 el paciente fue tratado con una combinación que incluye 2 ITIAN y 1 IP que ha sido cambiado en 2 ocasiones. ¿Podeis describir las interacciones de metadona con los IP?
R: Todos los fármacos de este grupo son metabolizados mayoritariamente por el citocromo P450, isoenzima CYP3A4 y actúan como sustrato e inhibidores de esta isoenzima. Este papel inhibidor hace prever una interacción con la metadona que de como resultado un aumento de las concentraciones plasmáticas de ésta. Sin embargo, en la práctica clínica6 se han descritos las siguientes situaciones:
-- Ritonavir: es el fármaco que tiene mayor potencia inhibitoria de la isoenzima CYP3A4. Disminuye las concentraciones plasmáticas de metadona en un 40% y el AUC en un 36%. Se han descrito casos de síndrome de abstinencia a los 4-10 días de tratamiento que precisan aumento de dosis de alrededor del 20%. No se observan cambios en las concentraciones de ritonavir.
-- Nelfinavir: produce una disminución de la concentración de metadona del 40-50%. Sin embargo, en un estudio de 36 pacientes en tratamiento con dosis estables de metadona antes de iniciar tratamiento con nelfinavir, sólo 1 caso precisó aumento de dosis7. Las concentraciones de nelfinavir no se ven afectadas por la metadona.
-- Amprenavir y lopinavir: no existen datos suficientes para valorar la posible interacción con metadona, sin embargo, in vitro se ha observado que producen una disminución de los valores plasmáticos que pudiera traducirse en la aparición de síndrome de abstinencia a los opiáceos. La metadona disminuye en un 30% las concentraciones de amprenavir.
-- Fosamprenavir: presenta las mismas interacciones con metadona que amprenavir1.
-- Indinavir: hay estudios que sugieren que aumenta la concentración en plasma de metadona aunque sin ningún efecto clínico relevante5,6.
-- Saquinavir: no tiene efectos significativos sobre la concentración de metadona, aunque no existen datos suficientes para descartar interacción entre ambas.
En la tabla 7 se muestran las interacciones entre metadona y fármacos antirretrovirales.
M: En nuestro caso, ¿se presentó alguna interacción entre IP y metadona?
R: Hay que señalar que los cambios en las concentraciones plasmáticas de metadona en pacientes con tratamiento antirretroviral no siempre se acompañan de efectos clínicos significativos2. En el caso que describimos no aparecieron síntomas de abstinencia al introducir en el tratamiento nelfinavir ni tampoco con lopinavir/ritonavir, fármacos que según se ha descrito disminuyen las concentraciones plasmáticas de metadona.
M: ¿Cuál fue la evolución del paciente?
R: A los 4 meses de iniciar el tratamiento con d4T, ddI, lopinavir/ritonavir continuaba con una carga viral indetectable aunque sin recuperación de la inmunidad celular (linfocitos CD4 84 células/mm3). Consultó por síndrome tóxico, tos y expectoración de 3 semanas de evolución. Se le diagnosticó una tuberculosis (TB) pulmonar.
M: La TB sigue siendo en España la enfermedad oportunista más frecuente en los pacientes con sida10. ¿Cuáles son las recomendaciones generales para el tratamiento de la TB en pacientes con infección por el VIH?
R: Son las mismas que para individuos no infectados por el VIH: el tratamiento inicial de la TB se hará con isoniacida (INH), rifampicina y pirazinamida (PZA) durante los 2 primeros meses seguido de INH y rifampicina. En áreas con una resistencia primaria a INH superior al 4% deberá incluirse un cuarto fármaco: etambutol (EMB) o estreptomicina. En pacientes con antecedentes de enfermedad tuberculosa, el retratamiento se determinará según la pauta previa y grado de cumplimiento. La duración del tratamiento para la enfermedad TB deberá prolongarse durante 9 meses a excepción de los casos con buen control virológico e inmunológico del VIH y certeza del cumplimiento terapéutico, que podrían beneficiarse de pautas de 6 meses.
En el tratamiento de la TB en los pacientes infectados por el VIH también se deben tener en cuenta otras consideraciones: en primer lugar, las interacciones entre algunos fármacos antirretrovirales (IP, ITINAN) con las rifamicinas (rifampicina y rifabutina)12. La rifampicina es un inductor enzimático de la isoenzima CYP3A4; este mecanismo hace disminuir las concentraciones séricas de IP e ITINAN.
Se pueden utilizar las siguientes combinaciones de antirretrovirales con rifampicina:
-- Ritonavir + saquinavir con ITIAN e ITIANt (análogos de nucleótidos inhibidores de la transcriptasa inversa).
-- Efavirenz con 2 ITIAN.
Rifabutina es un inductor menos potente del citocromo P450 y se puede utilizar con IP e ITINAN, aunque deben modificarse las dosis de rifabutina13.
A pesar de las interacciones que presentan las rifamicinas, éstas se deben incluir en los regímenes de tratamiento tuberculostático. Debido a la importancia de la adherencia al tratamiento, se recomienda la supervisión estricta de éste o tratamiento directamente observado12.
M: Al abordar el tratamiento tuberculostático y sus interacciones no debemos olvidar que el paciente se halla en un programa de metadona. ¿Es posible que la rifampicina, al ser inductora de la actividad del CYP3A4, pueda presentar alguna interacción con la metadona?
R: Rifampicina disminuye significativamente (36-68%) las concentraciones plasmáticas y el área bajo la curva de metadona7-8 y ello puede traducirse en la aparición de un síndrome de abstinencia a los opiáceos con el riesgo que supone el abandono del tratamiento tuberculostático o la recaída en el consumo de heroína. En series de casos, se describe la aparición de sindrome de abstinencia en 21 pacientes de 30 tratados con metadona y rifampicina8,14. Puede ser necesario incrementar la dosis de metadona hasta el doble de la habitual para tratar los síntomas y signos de abstinencia a los opiáceos5. La rifabutina, al ser un inductor menos potente del citocromo P450 que la rifampicina, no se ha descrito asociada a cambios significativos en la farmacocinética de la metadona15.
M: ¿Fue preciso modificar el tratamiento antirretroviral al instaurar tratamiento tuberculostático?
R: Sí. Se sustituyó lopinavir/ritonavir por efavirenz debido a las interacciones farmacológicas entre rifampicina e IP.
M: Al realizar el cambio de lopinavir/ritonavir por efavirenz, evitamos el riesgo de concentraciones infraterapéuticas del antirretroviral, pero podemos favorecer la aparición de un síndrome de abstinencia a los opiáceos al asociar efavirenz con metadona. Efavirenz es un ITINAN. Las interacciones farmacocinéticas entre los fármacos de este grupo (efavirenz, nevirapina) con metadona son bien conocidas y las más descritas en la práctica clínica. ¿Podrías describirlas?
R: Efavirenz y nevirapina presentan metabolización hepática mediada por el citocromo P450, principalmente por la isoenzima CYP3A4. Efavirenz determina una disminución en la concentración plasmática de metadona de entre un 22 y un 80%5,7. Con nevirapina la disminución en la concentración plasmática es del 46-60%7, que puede manifiestarse clínicamente por la aparición de síndrome de abstinencia a los opiáceos a partir de los 4-7 días de iniciar el tratamiento. Se recomienda valorar un incremento gradual de las dosis de metadona hasta estabilizar la situación clínica. Se ha descrito que con nevirapina es preciso aumentar un 45% la dosis habitual de metadona para resolver el síndrome de abstinencia7.
M: En la práctica clínica, ¿puede ser de utilidad la determinación de concentraciones plasmáticas de metadona para la prevención y tratamiento del síndrome de abstinencia en pacientes VIH+ tratados con varios fármacos?
R: Debido a la variabilidad interindividual del metabolismo de la metadona no puede establecerse una clara relación entre dosis, concentraciones plasmáticas y efecto clínico. Es preferible la observación del paciente y ajustar la dosis de metadona basándonos en los signos clínicos5.
M: ¿Cómo se debe tratar el síndrome de abstinencia que aparece en el curso del tratamiento antirretroviral?
R: El síndrome de abstinencia se trata aumentando la dosis de metadona en 5-10 mg/día o cada 2 días7,16 hasta lograr la desaparición de los síntomas. En el caso que se presenta y al introducir rifampicina y efavirenz fue preciso aumentar considerablemente la dosis de metadona hasta llegar a 130 mg/día.
En el síndrome de abstinencia a opiáceos pueden presentarse los siguientes síntomas y signos:
-- Midriasis.
-- Intranquilidad motora, nerviosismo, irritabilidad.
-- Insomnio.
-- Estornudos, lagrimeo.
-- Sudoración.
-- Vómitos y diarreas.
-- Dolores generalizados.
M: ¿Presentó otros problemas clínicos tras el inicio del tratamiento tuberculostático?
R: A las 3 semanas de inciar el tratamiento tuberculostático y efavirenz presentó insomnio, cambio de carácter, síntomas depresivos y náuseas. El paciente decidió suspender ambos tratamientos.
M: ¿Cuál fue la indicación terapéutica cuando consultó al facultativo?
R: Se le indicó reiniciar el tratamiento tuberculostático y suspender momentáneamente el tratamiento antirretroviral. No se modificaron las dosis de metadona (130 mg) ni de benzodiacepinas.
M: ¿Qué diagnóstico diferencial se plantea en esta situación?
R: El diagnóstico diferencial se debe realizar entre el síndrome de abstinencia a opiáceos y los efectos secundarios de efavirenz sobre el sistema nervioso central que puede producir insomnio, irritabilidad, pérdida de concentración, alucinaciones y agitación, que son más frecuentes al inicio del tratamiento1,16.
M: ¿Por qué consideras que se suspendió el tratamiento antirretroviral?
R: En un paciente con infección por VIH que debe iniciar tratamiento antirretroviral y tuberculostático no se recomienda el tratamiento simultáneo por el elevado número de fármacos, las interacciones y el riesgo de toxicidad. Debe iniciarse primero el tratamiento tuberculostático, y el inicio de los antirretrovirales se puede retrasar entre 4 y 8 semanas. Si al iniciar un tratamiento tuberculostático el paciente ya está tomando tratamiento antirretroviral debe continuarlo12, pero ante la aparición de efectos secundarios o sospecha de interacciones siempre debe darse prioridad al tratamiento tuberculostático.
M: ¿Cuándo se instauró de nuevo tratamiento antirretroviral y cuál fue el esquema terapéutico?
R: A los 2 meses se instauró de nuevo tratamiento antirretroviral con el siguiente esquema terapéutico: saquinavir + ritonavir, 3TC y tenofovir.
M: Tenofovir es un fármaco antirretroviral que todavía no hemos comentado. ¿Se han descrito interacciones al administrarlo con metadona?
R: Por el momento no se han descrito. Smith et al17 evaluaron 14 pacientes en tratamiento con tenofovir y metadona sin encontrar ningúna interacción entre ambos.
M: ¿Cuál ha sido la evolución del paciente?
R: Completó el tratamiento tuberculostático sin nuevas interrupciones y al retirar la rifampicina fue posible disminuir parcialmente las dosis de metadona. Ha continuado el tratamiento antirretroviral sin necesidad por el momento de nuevos cambios en el régimen terapéutico.