El trasplante renal es el tratamiento de elección para los pacientes con enfermedad renal terminal. El presente estudio describe las características generales de una cohorte de trasplante renal y explora diferencias de supervivencia entre subgrupos.
Materiales y métodosSe revisaron los registros de seguimiento postrasplante renal entre 1986 y 2015. Se definieron características generales y supervivencia global (Kapplan Meier); diferencias por subgrupos en la supervivencia del paciente y del injerto por regresión múltiple por método de Cox, y diferencias en la frecuencia de infecciones por odds ratio. Todos los contrastes estadísticos asumieron una confianza de 95%.
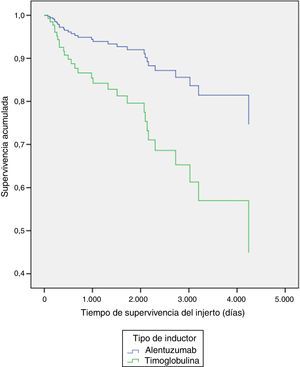
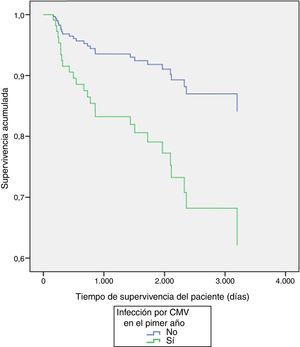
ResultadosSe revisaron 323 registros del programa de seguimiento de trasplante renal. La edad media fue de 43años, el 63,5% fueron hombres; en el primer año, el 19,8% presentaron infección urinaria (IVU) y el 10,53%, infección por citomegalovirus (CMV); el 75,8% recibió alemtuzumab y el resto, timoglobulina. La supervivencia global de los pacientes fue del 90,7%, y la del injerto, del 90,4%, con menor supervivencia en los pacientes con infección por CMV y menor supervivencia del injerto en pacientes tratados con timoglobulina (vs alemtuzumab); el resto de diferencias no fueron significativas.
ConclusionesLa infección en el primer año por CMV se asoció a menor supervivencia de los pacientes. El alemtuzumab se asoció a mayor tiempo de supervivencia del injerto en nuestra serie; se requieren ensayos clínicos aleatorizados doble ciego para establecer asociaciones causales, la estimación del riesgo de pérdida del injerto y muerte en relación a IVU, y criterios homogéneos para la definición de IVU.
Kidney transplant is the treatment of choice for patients with end-stage renal disease. The present study describes the general characteristics of a cohort of renal transplant patients, and examines if there are differences in survival between subgroups.
Materials and methodsThe follow-up records of post-kidney transplant patients between 1986 and 2015 were reviewed. The general characteristics and overall survival (Kapplan Meier) were defined; the subgroup differences were analysed in patients and graft survival by multiple Cox regression. The differences in the frequency of infections were defined by Odds Ratio. All statistical tests assumed 95% confidence limits.
ResultsA total of 323 records from the follow up program for kidney transplant were reviewed. The mean age was 43years, and 63.5% were male. In the first year 19.8% had a urinary tract infection (UTI), and 10.53% cytomegalovirus (CMV), with 75.8% receiving alemtuzumab and the remainder thymoglobulin. The overall patient survival was 90.7%, and the overall graft survival was 90.4%. Survival was lower in patients with CMV infection, and graft survival was lower in patients treated with thymoglobulin (vs alemtuzumab). The remaining differences were not significant.
ConclusionsCMV infection in the first year was associated with decreased patient survival. Alemtuzumab was associated with longer graft survival in our series. Double-blind randomised clinical trials are needed to establish causal associations, and to estimate the risk of graft loss and death in relation to UTI, as well as establishing homogeneous criteria for the definition of UTI.
El tratamiento de elección para los pacientes con enfermedad renal crónica en estado terminal es el trasplante renal1-5.
Antes de la llegada de la inmunosupresión, el trasplante renal estaba limitado a gemelos idénticos con enfermedad renal crónica4. La alta tasa de rechazo al injerto y la falta de medidas apropiadas para el control del rechazo impedían el acceso al trasplante a otros grupos poblacionales. La terapia de inducción juega un rol importante en la supervivencia del injerto, que actualmente excede el 90% de los casos5-8. El inductor más utilizado a nivel mundial es la timoglobulina; sin embargo, no existe consenso en la literatura que describa las indicaciones y/o el inductor ideal que se debe utilizar en cada caso5,9-13. Debido a la administración de inmunosupresores, estos pacientes tienen riesgo de presentar múltiples complicaciones como infecciones14,15, siendo las más frecuentes las infecciones de vías urinarias (IVU)16, que en concurrencia con infección por citomegalovirus (CMV) representan las mayores causas de rechazo al injerto y mortalidad global17.
El objetivo de este estudio es describir las características generales de los individuos a los que se les realizó trasplante renal en la Fundación Clínica Shaio y explorar si existen diferencias en supervivencia del paciente y del injerto por subgrupos.
Materiales y métodosSe realizó un estudio descriptivo retrospectivo. Se extrajeron los registros de las bases de seguimiento y control a pacientes postrasplante renal del periodo febrero de 1986 hasta junio de 2015 de la Fundación Clínica Shaio, y se definieron las características generales de los individuos (edad, género, tipo de inductor utilizado y presencia o no de infección por CMV e IVU). Las variables cualitativas fueron presentadas con frecuencias absolutas y relativas; las variables cuantitativas (dependiendo de su distribución) se presentaron con medias e intervalos de confianza del 95% o medianas y rangos intercuartílicos. Se describió la supervivencia global de los pacientes y la del injerto en curvas de Kapplan Meier, se realizó un modelo de regresión múltiple por método de Cox para definir la contribución de los factores independientes (tipo de donante, tipo de inductor, género, presencia o no de IVU y de infección por CMV) al riesgo conjunto de la pérdida del injerto y muerte del paciente, así como los odds ratio entre el tipo de inductor administrado y el riesgo de desarrollo de IVU o infección por CMV. Todos los contrastes estadísticos asumieron un nivel de confianza del 95%.
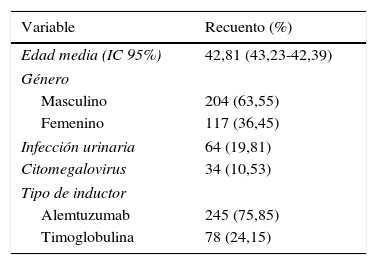
ResultadosSe revisaron 323 registros de pacientes postrasplante renal en el periodo descrito. La edad media fue de 43años, el género masculino aportó el 63,5% de los registros; el 19,8% presentaron IVU y el 10,53%, infección por CMV durante el primer año; el 75,85% de los pacientes recibieron como inductor alemtuzumab y el resto, timoglobulina (24,15%) (tabla 1). La supervivencia global evaluada por método de Kapplan Meier de los pacientes fue del 90,7%, y la del injerto, del 90,4% a 27años (10.000 días) (tabla 2).
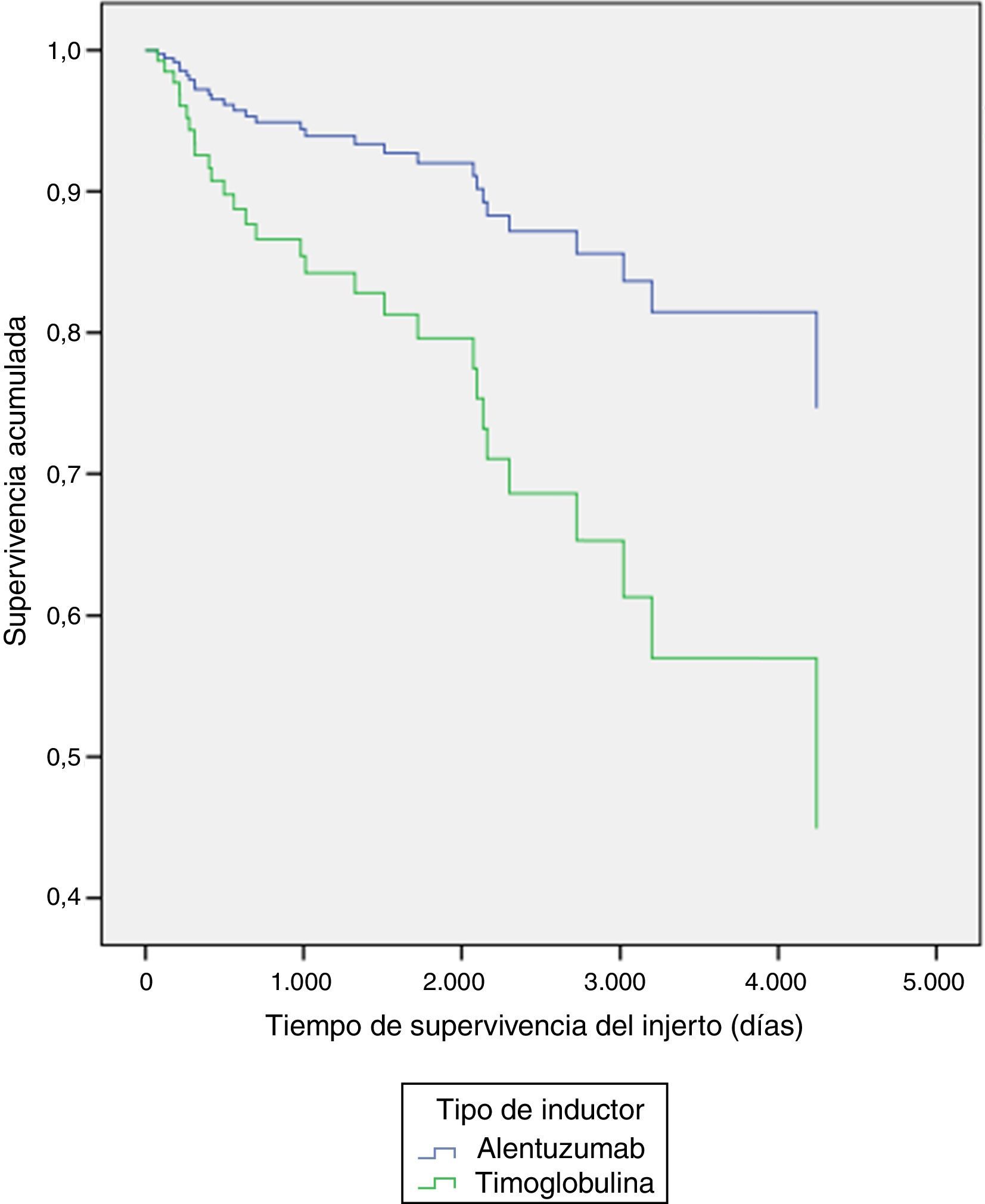
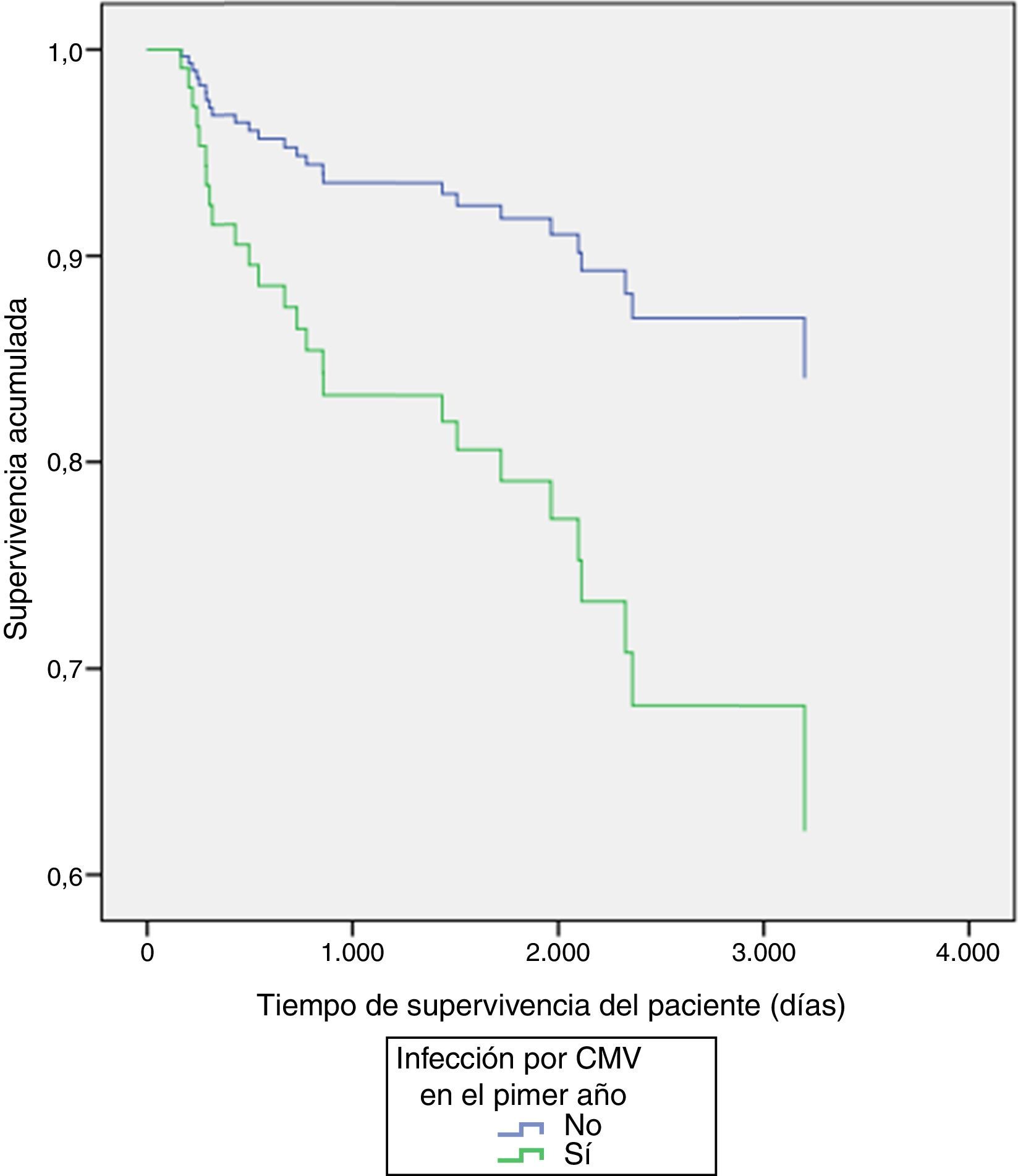
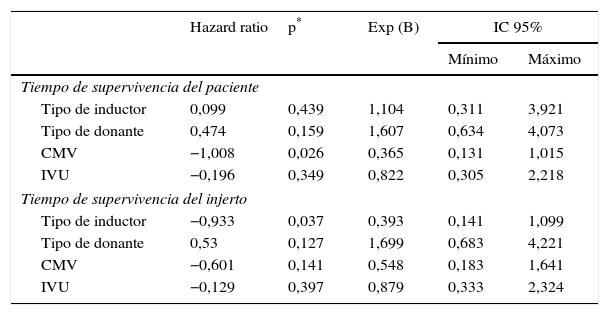
Al explorar diferencias entre subgrupos, por método de regresión múltiple de Cox, se encontraron diferencias significativas en la supervivencia del injerto por tipo de inductor (p=0,03) a favor del alemtuzumab vs timoglobulina (tabla 3 y fig. 1), y en la supervivencia de los pacientes con presencia o ausencia de infección por CMV durante el primer año (p=0,02), siendo la presencia de infección la variable contribuyente a la disminución de la supervivencia de los pacientes (tabla 3 y fig. 2).
Análisis de regresión multivariado tipo Cox
| Hazard ratio | p* | Exp (B) | IC 95% | ||
|---|---|---|---|---|---|
| Mínimo | Máximo | ||||
| Tiempo de supervivencia del paciente | |||||
| Tipo de inductor | 0,099 | 0,439 | 1,104 | 0,311 | 3,921 |
| Tipo de donante | 0,474 | 0,159 | 1,607 | 0,634 | 4,073 |
| CMV | −1,008 | 0,026 | 0,365 | 0,131 | 1,015 |
| IVU | −0,196 | 0,349 | 0,822 | 0,305 | 2,218 |
| Tiempo de supervivencia del injerto | |||||
| Tipo de inductor | −0,933 | 0,037 | 0,393 | 0,141 | 1,099 |
| Tipo de donante | 0,53 | 0,127 | 1,699 | 0,683 | 4,221 |
| CMV | −0,601 | 0,141 | 0,548 | 0,183 | 1,641 |
| IVU | −0,129 | 0,397 | 0,879 | 0,333 | 2,324 |
CMV: citomegalovirus; IVU: infección de vías urinarias.
Al explorar en tablas cruzadas la frecuencia de IVU e infección por CMV según el tipo de inductor utilizado, no se encontraron diferencias significativas (p=0,513 y p=0,085, respectivamente) (tabla 4).
Riesgo de infección urinaria y citomegalovirus según el tipo de inductor: alemtuzumab vs timoglobulina (n=321)
| Desenlace | Inductor | OR (IC 95%) | p |
|---|---|---|---|
| Infección urinaria | Alemtuzumab | 0,988 (0,84-1,15) | 0,513 |
| Timoglobulina | 1,038 (0,63-1,69) | ||
| Infección por citomegalovirus | Alemtuzumab | 1,193 (0,92-1,54) | 0,085 |
| Timoglobulina | 0,647 (0,39-1,06) |
El trasplante renal duplica la expectativa de vida en pacientes adultos con enfermedad renal crónica, y es el tratamiento de elección alrededor del mundo. Sin embargo, debido a que es un procedimiento quirúrgico de alta complejidad, inherente a él existe el riesgo de presentar un sinnúmero de complicaciones, las cuales se pueden dividir en 6 categorías: urológicas (urinomas, cálculos, y obstrucción urinaria), colecciones (hematomas, linfoceles, infecciones, y abscesos), disfunción del injerto (necrosis tubular aguda, rechazo agudo y crónico, toxicidad a los medicamentos y enfermedad terminal), complicaciones vasculares (estenosis de la arteria trasplantada, infarto, fistulas arteriovenosas, pseudoaneurismas y trombosis de la vena renal), neoplasias (carcinoma de células renales, linfomas y trastornos linfoproliferativos postrasplante) y enfermedad renal nativa recurrente2,17.
El 80% de los pacientes receptores de trasplante renal desarrollan algún tipo de infección en el primer año postrasplante, y la IVU y la infección por CMV ocupan los primeros puestos en frecuencia. Un estudio realizado en África encontró una incidencia de IVU del 43% en el primer mes y del 33% en los siguientes 6 meses postrasplante. Sin embargo, la incidencia varía dependiendo del estudio; en Francia se encontró una incidencia del 77% en un grupo de 177 pacientes que fueron sometidos a trasplante renal16. En cuanto a la infección por CMV, ocurre principalmente en el primer mes postrasplante, con una incidencia estimada del 30-78% si no se administra profilaxis18. Se ha encontrado presencia del virus en más de dos tercios de los donantes y receptores antes del trasplante, y la terapia inmunosupresora recibida por los pacientes trasplantados es la causa atribuida al incremento de este riesgo respecto de la población general15.
Se ha demostrado que la IVU y la infección por CMV están asociadas a mayor rechazo del injerto y mayor tasa de mortalidad en pacientes postrasplante renal, tanto así que en un estudio realizado por Charfeddine et al reportaron que la IVU se encontraba en todos los pacientes que hicieron rechazo al injerto y en el 58% de los pacientes sin rechazo16. Según la revisión de la literatura se encontró que los pacientes que recibieron injertos de donante cadavérico presentaron mayor tasas de IVU que los que recibieron injerto de donante vivo (70% vs 28%)16.
Por la alta prevalencia y los efectos deletéreos de presentar IVU e infección por CMV, la literatura recomienda la administración profiláctica de antivirales antes y hasta 3 a 6meses después del trasplante renal18, sumado a vigilancia activa regular de IVU desde el día 3 hasta un año después del trasplante16,19.
Se han descrito múltiples factores de riesgo para el rechazo del injerto, dentro de los cuales se encuentran edad avanzada, raza negra, diabetes, retraso en la funcionalidad del injerto y rechazo en el primer año del trasplante20. Para disminuir el riesgo de rechazo y el retraso de la función del injerto6,17 se utilizan diversos tipos de inductores, y para este estudio se comparó la supervivencia del injerto en pacientes que recibieron timoglobulina vs alemtuzumab. La elección del tipo de inductor es aún controversial, ya que en lo revisado en la literatura no existen consensos establecidos de las indicaciones específicas para cada uno5,9,12,13; sin embargo, se conoce que la timoglobulina es el agente inductor más usado alrededor del mundo; se trata de una inmunoglobulina policlonal purificada, usada para la prevención y el tratamiento del rechazo agudo del trasplante renal17,19,21,22. Por su parte, el alemtuzumab también se ha venido utilizando con frecuencia y es un anticuerpo monoclonal anti-CD526,9; su administración resulta en una rápida depleción de linfocitosT y B, monocitos y natural killers. En el año 2005, en Estados Unidos, en el 39% de los receptores de trasplante renal se administró timoglobulina, mientras que solo al 9% se administró alemtuzumab22.
La infección aguda en el postrasplante por CMV, acorde con lo reportado en la literatura internacional y los hallazgos del estudio, afecta la supervivencia del paciente, por lo que se recomienda la profilaxis extendida para prevenir la infección por CMV y así disminuir la mortalidad.
Dentro de las limitaciones del presente estudio se encuentran las inherentes al carácter retrospectivo. Los criterios utilizados para el diagnóstico de las IVU han cambiado en el tiempo, y la heterogeneidad de estos podría explicar la falta de diferencias en la tasa de rechazo por subgrupos, constituyendo la fuente de sesgo más importante. El tipo de análisis de registros retrospectivos en poblaciones constituye un riesgo de sesgo que podría influir en las diferencias identificadas entre los subgrupos. Este riesgo fue controlado al realizar un análisis con censura de los registros en el tiempo de seguimiento aportado para el análisis de supervivencia (densidad de riesgo de Kapplan Meier), y es así que la regresión de Cox permitió estratificar el riesgo, la comparación de los subgrupos y de la censura de los datos perdidos en el seguimiento, lo que es apropiado siempre y cuando los subgrupos de comparación sean superiores a 30 pacientes23. Se requieren estudios prospectivos para realizar el diagnóstico de infecciones con el método de elección y así establecer las asociaciones entre subgrupos.
Como fortalezas del estudio se presentaron las descripciones, alcances y limitaciones de los registros de seguimiento a la cohorte postrasplante renal y se lograron establecer diferencias en la supervivencia del injerto por subgrupos; las diferencias en la supervivencia por tipo de inductor podrían ser dadas por azar, dado que no obedecen a un proceso de control y aleatorización.
ConclusionesEn nuestra serie la infección por CMV en el primer año postrasplante se asoció a menor supervivencia de los pacientes. La administración de alemtuzumab como inductor se asoció a mayor tiempo de supervivencia del injerto, y se requieren ensayos clínicos aleatorizados doble ciego para establecer asociaciones causales. No se demostró relación entre IVU y riesgo de pérdida del injerto o muerte de los pacientes. Estudios prospectivos con criterios homogéneos para la definición de IVU podrían aclarar este contexto.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.